Bab I
Diunggah oleh
Riza SeptianaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bab I
Diunggah oleh
Riza SeptianaHak Cipta:
Format Tersedia
BAB I PENDAHULUAN
1.1. Latar Belakang Hukum kekekalan energi menyatakan energi didak dapat dimusnahkan dan dapat diciptakan melainkan hanya dapt diubah dari satu bentuk kebentuk lain.di alam ini bnayak terdapat energi seperti energi listri,energi kalor,energi bunyi,namum energi kalor hanya dapat dirasakan seperti panas matahari Dalam kehidpan sehari-hari kita sering melihat alat-alat pemanas yang menggunakan energi listrik seperti teko pemanas, penanak nasi, kompor listrik ataupun pemanas ruangan. Pada dasarnya alat-alat tersebut memiliki cara kerja yang sama yaitu merubah energi listrik yang mengalir pada kumparan kawat menjadi energi kalor/panas. Sama halnya dengan kalorimeter yaitu alat ayang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan.
1.2. Tujuan
Adapun tujuan utama dari dilaksanakannya praktikum ini adalah mahasiswa dapat memahami sistem kerja kalorimeter dan arti fisis tara panas listrik.
BAB II TINJAUAN PUSTAKA
Kalorimeter
Energi mekanik akibat gerakan partikel materi dan dapat dipindah dari satu tempat ke tempat lain disebut kalor. (Syukri S, 1999). Pengukuran jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dengan eksperimen disebut kalorimetri. Dengan menggunakan hukum Hess, kalor reaksi suatu reaksi kimia dapat ditentukan berdasarkan data perubahan entalpi pembentukan standar, energi ikatan dan secara eksperimen. Proses dalam kalorimeter berlangsung secara adiabatik, yaitu tidak ada energi yang lepas atau masuk dari luar ke dalam kalorimeter. (Petrucci,1987). Kalor yang dibutuhkan untuk menaikan suhu kalorimeter sebesar 1 0C pada air dengan massa 1 gram disebut tetapan kalorimetri (Petrucci,1987). Dalam proses ini berlaku azas Black yaitu: q lepas = q terima q air panas = q air dingin + q kalorimeter m1 c (Tp Tc) = m2 c (Tc Td) + C(Tc Td) keterangan: m1 = massa air panas m2 = massa air dingin c = kalor jenis air C = kapasitas kalorimeter Tp = suhu air panas Tc = suhu air campuran Td = suhu air dingin Sedang hubungan kuantitatif antara kalor dan bentuk lain energi disebut termodinamika. Termodinamika dapat didefinisikan sebagai cabang kimia yang menangani
hubungan kalor, kerja, dan bentuk lain energi dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan (Keenan, 1980). Hukum pertama termodinamika menghubungkan perubahan energi dalam suatu proses termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor yang dipindahkan kesistem (Petrucci, 1987) Hukum kedua termodinamika yaitu membahas tentang reaksi spontan dan tidak spontan. Proses spontan yaitu reaksi yang berlangsung tanpa pengaruh luar. Sedangakan reaksi tidak spontan tidak terjadi tanpa bantuan luar. Hukum ketiga termodinamika menyatakan bahwa entropi dari kristal sempurna murni pada suhu nol mutlak ialah nol. Kristal sempurna murni pada suhu nol mutlak menunjukkan keteraturan tertinggi yang dimungkinkan dalam sistem termodinamika. Jika suhu ditingkatkan sedikit diatas 0 K, entropi meningkat. Entropi mutlak selalu mempunyai nilai positif (Petrucci, 1987) Kalor reaksi dapat diperoleh dari hubungan massa zat (m), kalor jenis zat (c) dan perubahan suhu (T), yang dinyatakan dengan persamaan berikut q = m . c . T (Petrucci, 1987).
Keterangan : q = jumlah kalor (Joule) m = massa zat (gram) t = perubahan suhu takhir - tawal) c = kalor jenis
Kalorimetri
Kalorimetri adalah ilmu dalam pengukuran panas dari reaksi kimia atau perubahan fisik. Kalorimetri termasuk penggunaan calorimeter. Kata kalorimetri berasal dari bahasa Latin yaitu calor, yang berarti panas. Kalorimetri tidak langsung (indirect calorimetry) menghitung panas pada makhluk hidup yang memproduksi karbondioksida dan buangan nitrogen (ammonia, untuk organisme perairan, urea, untuk organisme darat) atau konsumsi oksigen. Lavosier (1780) mengatakan bahwa produksi panas dapat diperkirakan dari konsumsi oksigen dengan menggunakan regresi acak. Hal itu membenarkan teori energi dinamik. Pengeluaran panas oleh makhluk hidup juga dapat dihitung oleh perhitungan kalorimetri langsung (direct calorymetry), dimana makhluk hidup ditempatkan didalam kalorimeter untuk dilakukan pengukuran. Jika benda atau system diisolasi dari alam, maka temperatur harus tetap konstan. Jika energi masuk atau keluar, temperatur akan berubah. Energi akan berpindah dari satu tempat ke tempat lainnya yang disebut dengan panas dan kalorimetri mengukur perubahan suhu tersebut, bersamaan dengan kapasitas panasnya, untuk menghitung perpindahan panas. Kalorimetri adalah pengukuran panas secara kuantitatif yang masuk selama proses kimia. Kalorimeter adalah alat untuk mengukur panas dari reaksi yang dikeluarkan. Berikut adalah gambar calorimeter yang kompleks dan yang sederhana. Kalorimetri adalah pengukuran kuantitas perubahan panas. Sebagai contoh, jika energi dari reaksi kimia eksotermal diserap air, perubahan suhu dalam air akan mengukur jumlah panas yang ditambahkan. Kalorimeter digunakan untuk menghitung energi dari makanan dengan membakar makanan dalam atmosfer dan mengukur jumlah energi yang meningkat dalam suhu kalorimeter. Bahan yang masuk kedalam kalorimetri digambarkan sebagai volume air, sumber panas yang dicirikan sebagai massa air dan wadah atau kalorimeter dengan massanya dan panas spesifik. Keseimbangan panas diasumsikan setelah percobaan perubahan suhu digunakan untuk menghitung energi tercapai.
Kapasitas Panas dan Panas Spesifik Sifat-sifat air yang memberikan definisi asal dari kalori adalah banyaknya perubahan temperatur yang dialami air waktu mengambil atau melepaskan sejumlah panas. Istilah umum untuk sifat ini disebut kapasitas panas yang didefinisikan sebagai jumlah panas yang diperlukan untuk mengubah temperatur suatu benda sebesar 10C. Kapasitas panas bersifat ekstensif yang berarti bahwa jumlahnya tergantung dari besar sampel. Misalnya untuk menaikkan suhu 1 g air sebesar 10C diperlukan 4,18 J (1 kal), tapi untuk menaikkan suhu 100 g air sebesar 10C diperlukan energi 100 kali lebih banyak yaitu 418 J. Sehingga 1 g sampel mempunyai kapasitas panas sebesar 4,18 J/0C sedangkan 100 g sampel 418J/0C. Sifat intensif berhubungan dengan kapasitas panas adalah kalor jenis (panas spesifik) yang didefinisikan sebagai jumlah panas yang diperlukan untuk menaikkan suhu 1 g zat sebesar 10C. Untuk air, panas spesifiknya adalah 4,18 Jg-1C-1. Kebanyakan zat mempunyai panas spesifik yang lebih kecil dari air. Misalnya besi, panas spesifiknya hanya 0,452 J g-1 0C1
. Berarti lebih sedikit panas diperlukan untuk memanaskan besi 1 g sebesar 10C daripada air
atau juga dapat diartikan bahwa jumlah panas yang akan menaikkan suhu 1 g besi lebih besar dari pada menaikkan suhu 1 g air. Besarnya panas spesifik untuk air disebabkan karena adanya sedikit pengaruh dari laut terhadap cuaca. Pada musim dingin air laut lebih lambat menjadi dingin dari daratan sehingga udara yang bergerak dari laut ke darat lebih panas daripada udara dari darat ke laut. Demikian juga dalam musim panas, air laut lebih lambat menjadi panas daripada daratan.
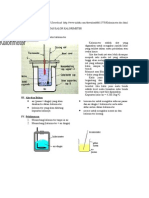
BAB III METODA PRAKTIKUM 2.1.Alat dan Bahan Sebuah kalorimeter dilengkapi dengan kumparan pemanas dan pengaduk.
Termometer Sebuah voltmeter Sebuah amperemeter Sebuah gelas ukur Sebuah Stopwatch 5 kabel penghubung
2.2.Prosedur Praktikum 1. Dengan menggunakan gelas ukur yang tersedia, isilah kalorimeter dengan air suling sebanyak 50 mlL. 2. Timbang massa air suling. 3. Susunlah alat-alat percobaan seperti pada gambar. Sebelum sumber tegangan diaktifkan , periksalah pada asisten. 4. Hubungkan arus dalam waktu yang singkat dan atur arusnya sebesar 0,3 A, kemudian sumber tegangan DC dimatikan lagi. 5. Aduklah air dan catat suhu sebagai suhu awal T1. 6.Alirkan kembali arus listrik (sumber tegangan DC diaktifkan). Catat tegangan yang terukur pada voltmeter. 7. Catatlah suhu pada saat 3 menit, 6 menit, 9 menit, 12 menit dan 15 menit. Isikan sebagai suhu akhir T2. Setelah 15 menit, matikan sumber tegangan DC. 8. Gantilah air didalam kalorimeter dan ulangi percobaan diatas dengan besar arus yang mengalir 0,5 A. Isikan pada data tabel yang tersedia. 9. Hitunglah tara panas listrik untuk mesing-masing percobaan dan hitung rata-ratanya.
10. Hitunglah hambatan dan daya listrik kumparan. 11. Hitung ketelitian percobaan anda dengan literatur (1 kalori=4,2 Joule). 12. Berikanlah kesimpulan berkaitan dengan praktikum ini.
BAB IV HASIL DAN PEMBAHASAN
4.1. Hasil
4.2. Pembahasan
Kalorimeter merupaka suaatu alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Adapun kalor merupakan energi yang berpindah akibat adanya perbedaan suhu. Hukum pertama termodinamika menghubungkan perubahan energi dalam suatu proses termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor yang dipindahkan kesistem. Pada kalorimeter terjadi perubahan energi dari energi listrik menjadi energi sesuai dengan hukum kekekalan energi yang menyatakan energi tidak dapat diciptakan dan energi tidak dapat dimusnahkan. Pada percobaan ini kita tidak membuat energi kalor / panas melainkan kita hanya merubah energi listrik menjadi energi kalor / panas. Prinsip kerja dari kalorimeter adalah mengalirkan arus listrik pada kumparan kawat penghantar yang dimasukan ke dalam air suling. Pada waktu bergerak dalam kawat penghantar (akibat perbedaan potenial) pembawa muatan bertumbukan dengan atom logam
dan kehilangan energi. Akibatnya pembawa muatan bertumbukan dengan kecepatan konstan yang sebanding dengan kuat medan listriknya. Tumbukan oleh pembawa muatan akan menyebabkan logam yang dialiri arus listrik memperoleh energi yaitu energi kalor / panas. Berdasarkan data hasil praktikum diketahui bahwa semakin besar nilai tegangan listrik dan arus listrik pada suatu bahan maka tara panas listrik yang dimiliki oleh bahan itu semakin kecil. Dalam data hasih praktikum seolah terlihat bahwa pengukuran dengan menggunakan arus kecil menghasilkan nilai yang kecil. Hal ini merupakan suatu anggapan yang salah karena dalam pengukuran pertama ini perubahan suhu yang digunakan sangatlah kecil berbeda dengan data yang menggunakan arus besar. Tapi jika perubahan suhu itu sama besarnya maka yang berarus kecil yang mempunyai tara panas listrik yang besar. BAB V PENUTUP 5.1.Kesimpulan Kalorimeter adalah alat yang digunakan untuki mengetahui besar energi yang dibebaskan pada suatu sistem. Pada kalorimeter terdapat energi disipasi. Energi disipasi dapat berarti energi yang hilang dari suatu sistem. Hilang dalam arti berubah menjadi energi lain yang tidak menjadi tujuan suatu sistem (dalam percobaan, energi listrik berubah menjadi energi kalor) . Timbulnya energi disipasi secara alamiah nggak dapat dihindari 5.2.Saran Untuk mendapatkan hasil pengamatan yang akurat, sebaiknya mahasiswa lebih teliti dalam mengamati termometer, amperemeter dan voltmeter . Selian itu juga mahasiswa sebaiknya menggunakan alat penunjang praktikum yang kondisinya masih baik dan menyusunnya dengan benar sesuai modul dan arahan dari asisten.
DAFTAR PUSTAKA
Zaida, Drs., M.Si. Petunjuk Praktikum Fisika. Bandung:Dosen Unpad Keenan, 1980, Kimia untuk Universitas Jilid 1, Erlangga, Jakarta. Petrucci, Ralph. H, 1987, Kimia Dasar Prinsip dan Terapan Modern Jilid 2 Edisi 4, Erlangga, Jakarta. Syukri, S, 1999, Kimia Dasar 1, ITB, Bandung.
Download Laporan Praktikum Kalorimeter.doc
Anda mungkin juga menyukai
- Kalorimeter dan Prinsip KerjanyaDokumen14 halamanKalorimeter dan Prinsip KerjanyaYudha MahyudiBelum ada peringkat
- KALORIMETER LAPORANDokumen17 halamanKALORIMETER LAPORANNiongBelum ada peringkat
- KalorimeterDokumen1 halamanKalorimetermanhalfgod100% (2)
- Laporan Praktikum Termodinamika SiskaDokumen54 halamanLaporan Praktikum Termodinamika SiskaSiskaamayaBelum ada peringkat
- Percobaan I Termo IciDokumen5 halamanPercobaan I Termo IciIdam Sulastri TelaumbanuaBelum ada peringkat
- MengukurKalorDenganKalorimeterDokumen47 halamanMengukurKalorDenganKalorimeterWardah FaizahBelum ada peringkat
- ENTALPI DAN ENTROPIDokumen23 halamanENTALPI DAN ENTROPIWillyBelum ada peringkat
- Panas NetralisasiDokumen14 halamanPanas NetralisasiJuandito YudhatamaBelum ada peringkat
- Laporan Praktikum Kimia FisikaDokumen29 halamanLaporan Praktikum Kimia FisikaL.a. Putu HendrayaniBelum ada peringkat
- Penggunaan Algoritma 2'Dokumen4 halamanPenggunaan Algoritma 2'rifky ariqBelum ada peringkat
- Turunan Fungsi Kelompok 2Dokumen16 halamanTurunan Fungsi Kelompok 2syarfina witriBelum ada peringkat
- SIKLUS CARNOT REFRIGERATORDokumen8 halamanSIKLUS CARNOT REFRIGERATORZonasalsa ArdyantiBelum ada peringkat
- Kelarutan Dan Hasil Kali KelarutanDokumen2 halamanKelarutan Dan Hasil Kali KelarutanFika Atina RizqianaBelum ada peringkat
- OPTIMALKAN UNTUK KALORIMETERDokumen8 halamanOPTIMALKAN UNTUK KALORIMETERazizryan rachmadi0% (1)
- 01 Perkal 01 2016Dokumen36 halaman01 Perkal 01 2016saepisan1Belum ada peringkat
- Niar Susu KedelaiDokumen14 halamanNiar Susu KedelaiRahmaNiar RahmanBelum ada peringkat
- ASETONDokumen13 halamanASETONSyahril RahmanBelum ada peringkat
- Analisa Termal Dapat Didefinisikan Sebagai Pengukuran SifatDokumen3 halamanAnalisa Termal Dapat Didefinisikan Sebagai Pengukuran SifatronaldgultomBelum ada peringkat
- Perubahan Wujud Zat Air, Udara, dan ApiDokumen17 halamanPerubahan Wujud Zat Air, Udara, dan ApiTazkiatunBelum ada peringkat
- MENENTUKAN PERUBAHAN ENTALPI REAKSI ANTAR LARUTAN ASAM DAN BASADokumen1 halamanMENENTUKAN PERUBAHAN ENTALPI REAKSI ANTAR LARUTAN ASAM DAN BASAastri dwi wBelum ada peringkat
- Diagram Fase HeliumDokumen7 halamanDiagram Fase HeliumMia Kristina DamayantiBelum ada peringkat
- KALORIMETERDokumen11 halamanKALORIMETERhalimBelum ada peringkat
- Laporan Praktikum Fisika Dasar - Hukum JouleDokumen15 halamanLaporan Praktikum Fisika Dasar - Hukum JouleYudi_MeidiansyahBelum ada peringkat
- MENGUKUR KAPASITAS KALOR AIRDokumen19 halamanMENGUKUR KAPASITAS KALOR AIRDillah Kangend MaSa LaluBelum ada peringkat
- Sifat Energi Dan Jenis EnergiDokumen3 halamanSifat Energi Dan Jenis EnergiFahma FitraBelum ada peringkat
- Laporan Praktikum Kalorimeter BomDokumen9 halamanLaporan Praktikum Kalorimeter BomKing Bima SaktiBelum ada peringkat
- Laporan D1 D2 Sifat Koligatif LarutanDokumen13 halamanLaporan D1 D2 Sifat Koligatif LarutanNiken Keni Part IIIBelum ada peringkat
- Volume Molal NaClDokumen19 halamanVolume Molal NaClSinar Desi PratiwiBelum ada peringkat
- OPTIMALKAN NERACADokumen26 halamanOPTIMALKAN NERACAYunita Selonika100% (1)
- KALOR PEMBAKARANDokumen12 halamanKALOR PEMBAKARANDevy Aprilia0% (1)
- Laporan Praktikum Fisdas Pegas-Libre PDFDokumen18 halamanLaporan Praktikum Fisdas Pegas-Libre PDFNovianaDewiBelum ada peringkat
- Makalah Kimia Analitik Metode Adsorbsi Sinar XDokumen6 halamanMakalah Kimia Analitik Metode Adsorbsi Sinar XThethemeetGunungBelum ada peringkat
- Menghitung Energi Aktivasi ReaksiDokumen6 halamanMenghitung Energi Aktivasi ReaksiLevina ArastikaBelum ada peringkat
- Reaksi Netralisasi Asam Oleh Basa Atau SebaliknyaDokumen17 halamanReaksi Netralisasi Asam Oleh Basa Atau SebaliknyaSri LeginiBelum ada peringkat
- Laporan Praktikum Teknik Kimia DasarDokumen39 halamanLaporan Praktikum Teknik Kimia DasarHezekiah ReynardBelum ada peringkat
- Laporan Fisika Dasar Percobaan 1Dokumen13 halamanLaporan Fisika Dasar Percobaan 1Sindy SafitriBelum ada peringkat
- Diktat KF GasDokumen13 halamanDiktat KF GasBakry AzizBelum ada peringkat
- Kalorimeter BombDokumen11 halamanKalorimeter BombSaffira Raudhania TrisnahadiBelum ada peringkat
- Kapasitas Panas Dalam Mekanika KuantumDokumen2 halamanKapasitas Panas Dalam Mekanika KuantumrrrrrrrrrrrrrrrrrBelum ada peringkat
- Pembahasan Diagram TernerDokumen3 halamanPembahasan Diagram TernerAdi Sagitarius100% (1)
- Isolasi steroid dari daun Saurauia roxburghiiDokumen9 halamanIsolasi steroid dari daun Saurauia roxburghiiDiani PratiwiBelum ada peringkat
- Koreksi Newton untuk Penentuan Kalor Lebur EsDokumen3 halamanKoreksi Newton untuk Penentuan Kalor Lebur EsDark PostBelum ada peringkat
- Definisi KalorDokumen11 halamanDefinisi KalorfatimahdwirespatiBelum ada peringkat
- Laporan Praktikum Percobaan Iv Perbandingan Sifat Senyawa Ion Dan Senyawa Kovalen (A.n.s) UlmDokumen10 halamanLaporan Praktikum Percobaan Iv Perbandingan Sifat Senyawa Ion Dan Senyawa Kovalen (A.n.s) UlmAnisa NurulBelum ada peringkat
- CARA MEMBUATDokumen4 halamanCARA MEMBUATjihannBelum ada peringkat
- SBP 1Dokumen21 halamanSBP 1Ayu Febriana AntonBelum ada peringkat
- Rumus MolekulDokumen16 halamanRumus MolekulHestyPratiwyLuphALmazBelum ada peringkat
- Titrasi Asam BasaDokumen5 halamanTitrasi Asam BasaNurul Farhah FBelum ada peringkat
- Membaca Diagram Fasa Sistem Dua Komponen CairDokumen22 halamanMembaca Diagram Fasa Sistem Dua Komponen CairFitrya ChiequzaBelum ada peringkat
- 0166 Ba Fmipa 2009 PDFDokumen229 halaman0166 Ba Fmipa 2009 PDFTedi IsmunantoBelum ada peringkat
- EKSTRAKSIDokumen49 halamanEKSTRAKSIsalsabilaBelum ada peringkat
- TermokimiaDokumen22 halamanTermokimiaHikma WRBelum ada peringkat
- Membuat Sabun dari Minyak KelapaDokumen9 halamanMembuat Sabun dari Minyak Kelaparizqi fauzanBelum ada peringkat
- Kelompok 5 - Laporan Percobaan 8 - ELEKTROLISIS UNTUK MENENTUKAN BIALANGAN AVOGADRODokumen9 halamanKelompok 5 - Laporan Percobaan 8 - ELEKTROLISIS UNTUK MENENTUKAN BIALANGAN AVOGADROYahya HengkyBelum ada peringkat
- 3 EkstraksiDokumen62 halaman3 Ekstraksidini septianaBelum ada peringkat
- Konstanta Joule KalorDokumen9 halamanKonstanta Joule KalorDiyana Maharany Sa'eat100% (1)
- Makalah KalorimeterDokumen13 halamanMakalah KalorimeterAnggun PrmewalBelum ada peringkat
- Fisika TeoriDokumen17 halamanFisika TeoriLeo Sandiko SinagaBelum ada peringkat
- Kalorimeter dan Pengukuran PanasDokumen12 halamanKalorimeter dan Pengukuran PanasAldo Jasrico100% (1)
- Surat Permohonan Dana-SuciDokumen2 halamanSurat Permohonan Dana-SuciSuci WinarsihBelum ada peringkat
- (Fix) Serat Optik-Suci Dan SitiDokumen29 halaman(Fix) Serat Optik-Suci Dan SitiSuci WinarsihBelum ada peringkat
- BAB I EditDokumen3 halamanBAB I EditSuci WinarsihBelum ada peringkat
- Proposal Penelitian-Suci WDokumen21 halamanProposal Penelitian-Suci WSuci Winarsih100% (2)
- Soal UAS-Aplikasi Polimer - SUCI WINARSIH 140310100082Dokumen9 halamanSoal UAS-Aplikasi Polimer - SUCI WINARSIH 140310100082Suci WinarsihBelum ada peringkat
- Revisi MBE-Suci WinarsihDokumen19 halamanRevisi MBE-Suci WinarsihSuci WinarsihBelum ada peringkat
- Makalah Medan EM Statis Pada BahanDokumen17 halamanMakalah Medan EM Statis Pada BahanSuci Winarsih100% (1)
- Surat Permohonan Dana-SuciDokumen2 halamanSurat Permohonan Dana-SuciSuci WinarsihBelum ada peringkat
- Silabus Fisika Dasar 2Dokumen2 halamanSilabus Fisika Dasar 2Suci WinarsihBelum ada peringkat
- Lapak Anomali Air - SuciDokumen27 halamanLapak Anomali Air - SuciSuci WinarsihBelum ada peringkat
- NANOTECHNOLOGY FOR DRUG DELIVERYDokumen47 halamanNANOTECHNOLOGY FOR DRUG DELIVERYSuci WinarsihBelum ada peringkat
- Teori Pita Energi Pada PadatanDokumen21 halamanTeori Pita Energi Pada PadatanFitri HandaiyaniBelum ada peringkat
- MAGNET DAN MEDAN MAGNETDokumen20 halamanMAGNET DAN MEDAN MAGNETSuci WinarsihBelum ada peringkat
- Slide Revisi-Suci WinarsihDokumen24 halamanSlide Revisi-Suci WinarsihSuci WinarsihBelum ada peringkat
- Sistem Saraf Pada Manusia1Dokumen30 halamanSistem Saraf Pada Manusia1Heppi FitriBelum ada peringkat
- Gaya Ikat-Sarbel&SuciDokumen18 halamanGaya Ikat-Sarbel&SuciSuci WinarsihBelum ada peringkat
- Aplikasi Polimer - SUCI WINARSIHDokumen41 halamanAplikasi Polimer - SUCI WINARSIHSuci WinarsihBelum ada peringkat
- (Fix) Tegangan Nernst Dan Pulsa Saraf-Suci Dan TresnaDokumen12 halaman(Fix) Tegangan Nernst Dan Pulsa Saraf-Suci Dan TresnaSuci WinarsihBelum ada peringkat
- EDIT Nanoteknologi Bidang Elektronik SUCIDokumen31 halamanEDIT Nanoteknologi Bidang Elektronik SUCISuci WinarsihBelum ada peringkat
- Gelombang ElektromagnetikDokumen34 halamanGelombang ElektromagnetikEkky AndreanBelum ada peringkat
- Spektroskopi Uv Vis-IsopreneDokumen7 halamanSpektroskopi Uv Vis-IsopreneSuci WinarsihBelum ada peringkat
- Struktur MolekulDokumen16 halamanStruktur MolekulFarid EluddinBelum ada peringkat
- Calculus Vektor & Integral Fungsi Vektor (Compatibility Mode)Dokumen77 halamanCalculus Vektor & Integral Fungsi Vektor (Compatibility Mode)Ridhani Aipassa0% (1)
- UNHANDokumen3 halamanUNHANSuci WinarsihBelum ada peringkat
- Lowongan KerjaDokumen6 halamanLowongan KerjaSuci WinarsihBelum ada peringkat
- Lowongan KerjaDokumen6 halamanLowongan KerjaSuci WinarsihBelum ada peringkat
- CmosDokumen9 halamanCmosSuci WinarsihBelum ada peringkat
- LMDokumen3 halamanLMSuci WinarsihBelum ada peringkat
- Ketentuan Tes PresentasiDokumen2 halamanKetentuan Tes PresentasiSuci WinarsihBelum ada peringkat
- OsilasiDokumen8 halamanOsilasiPdl FrglBelum ada peringkat