Laboratorio de Acido Base
Diunggah oleh
Jose Gabriel CaamañoJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Laboratorio de Acido Base
Diunggah oleh
Jose Gabriel CaamañoHak Cipta:
Format Tersedia
.
UNIVERSIDAD DEL ATLNTICO FACULTAD DE INGENIERA INGENIERA QUIMICA REACCIONES CIDO-BASE.
OCTUBRE 16 2012, LABORATORIO DE QUIMICA ANALITICA I. UNIVERSIDAD DEL ATLNTICO. RESUMEN En esta experiencia se busco determinar la concentracin de diferentes tipos de soluciones cidas a travs de una concentracin conocida y un volumen gastado de una base fuerte, el NaOH. Este procedimiento sirvi para conocer e identificar el punto de equivalencia de una titulacin acidobase. Una titulacin acido-base es una neutralizacin en la que se determina la concentracin de una solucin utilizando un patrn de concentracin conocida.
Palabras claves:, pH, indicadores, titulacin. H+(ac)+ Cl-(ac)+Na+(ac)+OH-(ac) Na+(ac)+Cl(ac)+ H2O(l) Por lo tanto, la reaccin se puede representar mediante la ecuacin inica neta: H+(ac) +OH-(ac) H2O(l) Tanto el Na+ espectadores. como el Cl- son iones
INTRODUCCION Una reaccin de neutralizacin es una reaccin entre un acido y una base. Generalmente, en las reacciones acuosas cido-base se forma agua y una sal, que es un compuesto inico formado por un catin distinto del H+ y un anin distinto del OH- u O2-: cido + Base Sal +Agua La sustancia conocida como sal de mesa, NaCl, es producto de la reaccin cido-base HCl(ac)+NaOH(ac) NaCl(ac) + H2O(l) Sin embargo, puesto que tanto el cido como la base son electrolitos fuertes, estn completamente ionizados en la disolucin.
Si en la reaccin anterior se hubiera iniciado con iguales cantidades molares de cido y de la base, al final de la reaccin nicamente se tendra una sal y no habra cido o base remanentes*. Esta es una caracterstica de las reacciones de neutralizacin cido-base.(1) Las titulaciones cido-base consisten en completar una reaccin de neutralizacin entre una base y un cido de Bronsted. El titulante siempre es un cido o una base fuerte y el analito puede ser un cido o una base fuerte o dbil. El punto final se determina a partir de la curva de titulacin o
La ecuacin inica es:
por el cambio de color de un indicador cidobase. La curva de titulacin se construye graficando el pH de la solucin en funcin del volumen de titulante agregado. La forma de la curva de titulacin vara segn cul sea la fuerza del cido.(2) Al comenzar la titulacin tenemos un volumen de cido Vi, y a medida que se agrega un Vt, de la base titulante, tanto el cido como la base se diluyen. En el punto de equivalencia, cuando la neutralizacin es completa, por ejemplo en una titulacin de HCl con NaOH, se tiene una solucin de NaCl cuyo pH es 7, por ser una sal de cido y base fuertes. Si en este punto, se sigue agregando NaOH, la concentracin de OH- aumenta rpidamente de 10-7 M en el punto de equivalencia hasta la correspondiente a una solucin de NaOH que contenga NaCl. En el entorno del punto de equivalencia hay un cambio en varias unidades de pH que puede ser visualizado fcilmente con un indicador cido-base, por ejemplo, la fenolftalena. (2) METODO EXPERIMENTAL 1. En primer lugar para realizar la titulacin acido-base se vertieron 25mL de HCl 0.1 M dentro de un matraz Erlenmeyer y posterior a esto se le adicionaban 2 gotas de fenolftalena. Luego, desde una bureta se fue adicionando NaOH 0.1 M poco a poco hasta que la solucin se tornara a un color rosa plido, que indica el punto de equivalencia.
2. De igual forma, se llevo a cabo nuevamente una titulacin acidobase, pero con un volumen de 10 mL, de vinagre. Luego, se le adicionaron aproximadamente 20mL de agua y 2 gotas de fenolftalena tambin llevndolo a su punto de equilibrio a travs de la adicin de cierto volumen de NaOH. 3. Por ltimo y siguiendo el mismo mtodo, se tomaron 20mL de bebida gaseosa (Sprite) en 20 mL de agua. De igual manera dos gotas de fenolftalena y un pequeo volumen de NaOH.
RESULTADOS Y DISCUSION No siempre es posible el uso del pH metro, se utiliza un indicador, en esta ocasin en el laboratorio se uso fenolftalena, que con un viraje debido a su presencia en la solucin, nos permite hallar el punto de equivalencia cualitativamente. En la experiencia se llevo a cabo una la titulacin acido-base, tomando como sustancias a titular: HCl 0.1 M, vinagre de concentracin desconocida y una bebida gaseosa (Sprite), utilizando como titulante el NaOH 0.1 M. La concentracin del cido clorhdrico se conoce, pero para las otras dos sustancias es desconocida, por ende, se hallaron tales concentraciones y se corrobor las concentraciones que suministraban del cido clorhdrico. Para tal clculo se utiliz la formula: Donde:
1. Titulacin de cido clorhdrico. PREGUNTAS En el HCl 0.1 M obtuvo un volumen gastado aproximado de 24.2 mL de NaOH.
CALCULOS DE pH VALORACION HCl CON NaOH.
=
( )
Punto inicial
Depende de la concentracin inicial del cido: [H+] = 0,0968 pH = 1.014 Despus de la adicin de 10ml de base.
Mediante la titulacin acido-base tenemos como objetivo neutralizar los compuestos y formar una sal y agua como productos, estableciendo un equilibrio acido-base conjugado. 2. Titulacin de vinagre. Para el vinagre hubo un gasto promedio de 27.2 mL de NaOH.
En el proceso de valoracin reacciona una mili mol de base con una mili mol de cido, quedando 4 mili moles de cido sin neutralizar. nH+ = 25ml x 0,0968 mmol/ml = 2.42mmol nOH- = 10 ml x 0,1 mmol/ml = 1mmol
Vt = 35 ml Rx de Neutralizacin:
En esta titulacin se llevo a cabo la siguiente reaccin: CH3COOH + NaOH--- CH3COONa + H2O Que tambin se puede expresar: CH3COOH + OH---- CH3COO- + H2O Debido al exceso de iones OH- formados, en el punto de equivalencia, cuando solo hay iones acetato, el pH ser mayor que 7. 3. Titulacin de Bebida gaseosa. En el caso de la bebida gaseosa se realiz un gasto promedio de base de 9.5ml.
H+ 2.42 -1 1.42
OH1 -1 --
H2O
[H+] = 1.42mmol / 35ml = 0.040mmol/ml PH = 1,39. punto de equivalencia.
Se da cuando se han adicionado 24,2 ml de NaOH (0,1M) ; donde las moles de la base
han neutralizado completamente las moles del cido presente en la solucin, quedando como producto de la reaccin el H2O . Observndose que el pH de la solucin depende de la concentracin de H+ que provienen de la disociacin del H2O. [H+] = [OH-] = 1,0 x 10-7 PH = 7 Despus de la adicin de 40,0 ml de NaOH
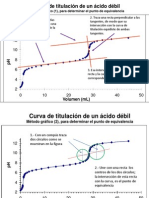
*Grafica 1: curva de valoracin acido fuertebase fuerte.
CALCULOS DE pH VALORACION DE VINAGRE CON NaOH.
Despus del punto de equivalencia predomina la concentracin de iones OH-. nOH- = 40m x0,100mmol/ml = 4 mmol de OHnH+ = 25ml x 0,096800 mmol/ml = 2.42 mmol 4 2.42 = 1,58 mmol en exceso deOHVt = 65 ml de solucin. [OH-] = 1.58 mmol/65 ml = 0.0243mmol/ml pOH = 1.614 por lo tanto PH = 12.386
Cuando se valora un cido dbil con una base fuerte el pH en el punto de equivalencia de la valoracin es bsico, por tanto la concentracin de protones es mas pequea que la de un acido fuerte, la ionizacin del acido esta restringida por el efecto ion comn, sal que se forma como producto de la neutralizacin. En este caso el punto estequiometrico no corresponde a un pH= 7 y la base conjugada reacciona con el agua generando iones oxidrilos. Punto inicial HA = A- + H+ 0.272 0 0 0.272-X X X ( )
la X en el denominador puede ser despreciada debido a que la constante de acidez es muy pequea en relacin ala concentracin de dicho acido.
curva valoracion HCL con NaOH
14 12 10 pH 8 6 4 2 0 0 20 40 60 volumen de valorante
( ( ( ) ) )
( ( )( )
Despues de 10ml de valorante
= 0.073 0.073-X 0 X
+ 0 X
( ( )
Esta X tambin puede ser despreciada. ( )( )
pOH= -log[OH]= 5.196 pH en el punto de equivalencia. Despues de 40ml de valorante
En este punto ambos reactivos se comportaran como reactivo limite y se producir una sal con un valor de moles igual . Dicha sal es el hidrxido de sodio, la cual es un electrolito fuerte que se hidrolisa completamente en sus iones, dando asi el ion , que al provenir de un acido dbi hidroliza con agua para regenerar su par conjugado y al ser un ion pruducira iones hidroxilos.
para este caso el reactivo limite pasa a ser el acido formando una sal con la cantidad de moles que se consumen, y el efecto de ion comn se hace presente en esta reaccin, asi como tambin la hidrolisis del ion acetato proveniente de la hidrolisis de la sal en cuestin. Una cantidad de iones hidroxilo provienen de la base de reaccin inicial (1.28*10-3 mol).
pOH= -log[OH]= 1.59
4.0*10-3 -2.72*10-3 1.28*10-3
2.72*10-3 -2.72*10-3 0
valores dados en moles
valoracion vinagre con NaOH
2.72*10-3
14 12 10 pH 8 6 4 2 0 0 10 20 30 40 50 volumen de valorante
Equlibrio de hidrolisis
*grafica 2: valoracin acido dbil con una base fuerte. Al observar ambas curvas de valoracin podemos notar que sus trazos mantienen una similitud aunque los valores sealados tanto para punto inicial y punto de equivalencia marcan la diferencia, esto e debido a que el las curvas de valoracin acido fuerte base fuerte se da una disociacin completa por tanto los valores de concentracin de protones corresponder a concentracin inicial del acido en estudio, mientras que en la valoracin de un acido dbil este se hidroliza y da una disociacin parcial, por lo cual es necesario la utilizacin de clculos mas extensos por decirlo de alguna manera, ya que es necesario la aplicacin de formulas cuadrticas para conocer la cantidad de acido que se disocia en cada punto o etapa de la valoracin donde se emplean operaciones logartmicas, en la bsqueda tambin del pH
0.544M 0.544-X
0 X
0.0256M 0.0256+X
( (
) )
Se desprecia la X en el denominador y obtenemos los siguiestes resultados:
respectivamente. En la grafica uno se confirma que el pH alcanzado es de 7, mientas que en la grafica dos el pH calculado se encuentra entre 8 y 9, ya que se hbla de la interaccion de un acido dbil con una base fuerte. Clculos de porcentaje p/p y p/v del acido actico en el vinagre. En el punto de equivalencia, las moles de base son iguales a las moles del acido.
( )
0.294%
El uso de cada indicador puede variar dependiendo el tipo de reaccin que se tenga. Por ejemplo, cuando la neutralizacin se produce entre una base fuerte y un cido dbil. El anin del cido sufre una hidrlisis producindose iones hidrxido, por lo que el pH es > 7. Entonces podremos utilizar indicadores como: Azul de timol, azul de bromotimol, verde bromocresol y todos los que tengan un rango viraje menor a pH= 7. Cuando la neutralizacin se produce entre un cido fuerte y una base dbil. El catin de la base sufre una hidrlisis producindose iones hidronio, por lo que el pH es < 7. Es posible usar un rojo neutro o un azul de metileno.
( ) ( ) Para el porcentaje peso peso se toma la densidad del vinagre como 1.01g/ml ( ) ( )
( ( ) 1.613
Cuando la neutralizacin se produce entre una base dbil y un cido dbil. El anin del cido sufre una hidrlisis al igual que el catin de la base, por lo que el pH es < 7 si es ms dbil la base y es >7 si es ms dbil el cido.
Porcentajes p/v de acido carbnico en la bebida gaseosa.
( )
Figura 1. Colores de diferentes indicadores dependiendo el pH En las titulaciones cido-base se tiene el conocido punto de equivalencia que visualmente casi siempre se nota con un cambio de coloracin. Dicho cambio indica cuando han reaccionado los mismos moles de acido y de base de la mezcla que se esta dando. CONCLUSIONES Luego de realizar la experiencia y una posterior investigacin se pudo concluir que: 1. La titulacin por mtodo volumtrico permite evaluar la concentracin desconocida del cido a travs de la concentracin conocida del NaOH. 2. El punto final de la titulacin es llamado punto de equilibrio que se obtiene por medio de los indicadores. BIBLIOGRAFIA
1. CHANG, Raymond. Qumica. Decima edicin. Editorial McGraw Hill. 2010. Pag. 133 y 134. 2. ALBELDE, Sara. Qumica 2. Qumica en accin. Editorial Calihue, Buenos Aires. 2004. Pgs.291 y 292. 3. LANTO, M. Qumica, segunda edicin. McGraw Hill, Bogot Colombia 1991, Pgs. 96, 119. 4. CASTRO, N, Consultor Estudiantil, primera edicin. Prolibos Ltda, Bogot- Colombia. 2000. Pgs. 39 43. 5. Remanente: * Residuo o reserva de una cosa.
3. En una valoracin acido- base se debe saber cundo hay que dejar de aadir reactivo. En otras palabras, saber en qu momento se ha completado la reaccin. El indicador cambiar de color cuando se complete la reaccin. Si el indicador cambia de color antes de este punto, se habr aadido escasa cantidad de reactivo, y la reaccin no habr sido completa. Si cambia de color demasiado tarde, cuando ya se haya pasado el punto de equivalencia, se habr aadido demasiado reactivo.
Anda mungkin juga menyukai
- Tipos de AcueductosDokumen2 halamanTipos de AcueductosNilton Evans Castellanos100% (1)
- Química 5to Año PDFDokumen161 halamanQuímica 5to Año PDFcrisar1083% (18)
- Práctica N°4 - EQUILIBRIO EN SISTEMAS ÁCIDO - BASE Y EN SOLUCIONES REGULADORASDokumen10 halamanPráctica N°4 - EQUILIBRIO EN SISTEMAS ÁCIDO - BASE Y EN SOLUCIONES REGULADORASJORGE LUIS BASTIAS BARRETOBelum ada peringkat
- Volumetría de Oxido - Reducción IDokumen10 halamanVolumetría de Oxido - Reducción IingrossBelum ada peringkat
- Titulacion Acido BaseDokumen6 halamanTitulacion Acido BaseJhoan Alexander LambrañoBelum ada peringkat
- Acidos Polipróticos - 26042010Dokumen9 halamanAcidos Polipróticos - 26042010Tuti Lopez0% (1)
- CorrecióndeprotocoloacidobaseDokumen16 halamanCorrecióndeprotocoloacidobaseDemi EstralarBelum ada peringkat
- Determinación Volumétrica de Haluros Por Formación de PrecipitadosDokumen6 halamanDeterminación Volumétrica de Haluros Por Formación de PrecipitadosJorly Torres100% (1)
- UNIDAD 5 - Qca - Analitica I - IngDokumen17 halamanUNIDAD 5 - Qca - Analitica I - IngJuan Pablo Sará FoncecaBelum ada peringkat
- La Normalidad de Una Solución Es El Peso Equivalente en Gramos de UnDokumen2 halamanLa Normalidad de Una Solución Es El Peso Equivalente en Gramos de UnJEFFERSON DAITON GOMEZ SHUPINGAHUABelum ada peringkat
- Titulación Ácido-Base Usando Un PhmetroDokumen5 halamanTitulación Ácido-Base Usando Un PhmetroPaulaBelum ada peringkat
- INFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDokumen13 halamanINFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDimar MontejoBelum ada peringkat
- Informe BufferDokumen5 halamanInforme BufferNicole AHBelum ada peringkat
- Práctica - Estudio de Equilibrios ÁcidoBaseDokumen4 halamanPráctica - Estudio de Equilibrios ÁcidoBaseMarcolorenzana0% (1)
- Power Point Val. NeutralizaciónDokumen8 halamanPower Point Val. NeutralizaciónJosé Jacobo Brito PadillaBelum ada peringkat
- Lab NDokumen23 halamanLab Nanon_18033708Belum ada peringkat
- 7 PKa de Un Indicador Acido BaseDokumen8 halaman7 PKa de Un Indicador Acido Basedaisuke_123Belum ada peringkat
- Pto de Equivalencia, Determinacion GraficaDokumen3 halamanPto de Equivalencia, Determinacion Graficamanolete4321Belum ada peringkat
- Práctica 4: Valoraciones Ácido-Base.Dokumen18 halamanPráctica 4: Valoraciones Ácido-Base.Enrique DelgadoBelum ada peringkat
- Analisis Cualitativo Cationes PDFDokumen17 halamanAnalisis Cualitativo Cationes PDFaavvilaBelum ada peringkat
- Titulación de Ácidos PolipróticosDokumen14 halamanTitulación de Ácidos PolipróticosRIVERA LOZANO ENRIQUE ULISESBelum ada peringkat
- Informe 13N ConductividadDokumen17 halamanInforme 13N ConductividadNICK MARALLANOBelum ada peringkat
- Marcha Sistematica para Cationes Sin El Empleo de h2sDokumen5 halamanMarcha Sistematica para Cationes Sin El Empleo de h2sKelly N Martinez AlmenteroBelum ada peringkat
- PERMANGANIMETRÍADokumen6 halamanPERMANGANIMETRÍALuis Armando Hernandez MolinaBelum ada peringkat
- Formación de Complejos ColoridosDokumen14 halamanFormación de Complejos ColoridosMartin SanchesBelum ada peringkat
- Informe de Analitica Terminado Titulacion Potenciometrica PDFDokumen11 halamanInforme de Analitica Terminado Titulacion Potenciometrica PDFHabitaciones Para ParejasBelum ada peringkat
- SA-B Karla Estrella 1451Dokumen5 halamanSA-B Karla Estrella 1451Karla EstrellaBelum ada peringkat
- Titulacion Acido Fuerte Base FuerteDokumen24 halamanTitulacion Acido Fuerte Base FuerteRodrigo DalenceBelum ada peringkat
- VOLUMETRÍADokumen8 halamanVOLUMETRÍAKarl BeltranBelum ada peringkat
- ArgentometriaDokumen3 halamanArgentometriaMauricio Camarena100% (1)
- Informe Valoracion ConductimetricaDokumen4 halamanInforme Valoracion ConductimetricaAlex GonzálezBelum ada peringkat
- PRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableDokumen8 halamanPRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableCynthia GonzalesBelum ada peringkat
- Informe Coeficiente de Reparto RealDokumen20 halamanInforme Coeficiente de Reparto RealDaniel MoralesBelum ada peringkat
- Practica 5 BIOQ - Punto Isoelectrico de Las ProteinasDokumen4 halamanPractica 5 BIOQ - Punto Isoelectrico de Las ProteinasGiSsXD0% (1)
- Absorción de GlucosaDokumen8 halamanAbsorción de GlucosaMiguel AngelBelum ada peringkat
- EQUILIBRIO Solucionesacuosas2Dokumen104 halamanEQUILIBRIO Solucionesacuosas2GLORIA CONINBelum ada peringkat
- Informe 5. Lab BioqDokumen8 halamanInforme 5. Lab BioqKELLY JOHANA CORREA SANTABelum ada peringkat
- Determinacion Acidez en VinagreDokumen3 halamanDeterminacion Acidez en VinagreAngie Rozo0% (1)
- ANÁLISIS DE COMPUESTOS ORGÁNICOS Método de Lassaigne MaiDokumen7 halamanANÁLISIS DE COMPUESTOS ORGÁNICOS Método de Lassaigne MaimichaelBelum ada peringkat
- 4° Práctica de LaboratorioDokumen20 halaman4° Práctica de LaboratorioLUIS JAIME RAMOS POMPABelum ada peringkat
- Método QuelatométricoDokumen3 halamanMétodo QuelatométricoSharon Yanireth Castro PaganBelum ada peringkat
- Soluciones AmortiguadorasDokumen2 halamanSoluciones AmortiguadorasIglesia TiempodeDiosBelum ada peringkat
- Informe de Analisis Titulacion.. 2listoDokumen4 halamanInforme de Analisis Titulacion.. 2listoAndrea Peña TorresBelum ada peringkat
- Informe SOLUCIONES REGULADORASDokumen9 halamanInforme SOLUCIONES REGULADORASRoberto Andres Delgado MillanBelum ada peringkat
- Informe de Laboratorio 3Dokumen8 halamanInforme de Laboratorio 3Kinesis lduBelum ada peringkat
- Metodo Molibdato de AmonioDokumen2 halamanMetodo Molibdato de AmonioFelipe Rudloff AlvarezBelum ada peringkat
- Lab NeutralizacionDokumen19 halamanLab Neutralizacionapi-3802357100% (7)
- Soluciones AmortiguadorasDokumen28 halamanSoluciones AmortiguadorasNisha MarroquínBelum ada peringkat
- PH y Soluciones Amortiguadoras. QuimicaDokumen4 halamanPH y Soluciones Amortiguadoras. QuimicaestebanBelum ada peringkat
- Tema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Dokumen17 halamanTema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Alan YañezBelum ada peringkat
- INFORME-Solucion de Tiosulfato de SodioDokumen8 halamanINFORME-Solucion de Tiosulfato de SodioJosé MolinaBelum ada peringkat
- Sesión EXPRESIÓN DE LOS RESULTADOS ANALÍTICOSDokumen26 halamanSesión EXPRESIÓN DE LOS RESULTADOS ANALÍTICOSRosario Valentina Sanchez ZevallosBelum ada peringkat
- Informe #8-Volumetría Con EDTADokumen6 halamanInforme #8-Volumetría Con EDTABrian Esteban Peña RecaldeBelum ada peringkat
- Determinación de La Constante de EquilibrioDokumen2 halamanDeterminación de La Constante de EquilibrioChiran Alexis0% (1)
- Lab7 - Acidimetria y AlcalimetriaDokumen15 halamanLab7 - Acidimetria y AlcalimetriaCarlos Daniel Cuba JaraBelum ada peringkat
- Reacción Ácido - Base IDokumen5 halamanReacción Ácido - Base ISANTIAGO DE JESUS PEREZ FERRERBelum ada peringkat
- Avancequimica BuenoDokumen4 halamanAvancequimica BuenoCARLOS GREGORIO PADILLA PAJOYBelum ada peringkat
- Curva de Valoración y Equilibrio de Formación de ComplejosDokumen12 halamanCurva de Valoración y Equilibrio de Formación de ComplejosyaninaBelum ada peringkat
- Informe de Curvas y VolumetriaDokumen6 halamanInforme de Curvas y Volumetriaguillermo rBelum ada peringkat
- Reacciones Ácido-BaseDokumen2 halamanReacciones Ácido-BaseAngie GarciaBelum ada peringkat
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDari EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadBelum ada peringkat
- Informe - UNTDokumen1 halamanInforme - UNTGesù PastoreBelum ada peringkat
- AntecedentesDokumen6 halamanAntecedentesJuluisa SaavedraBelum ada peringkat
- C.03.01 E.070 de Sencico 20-2-19Dokumen24 halamanC.03.01 E.070 de Sencico 20-2-19alex perccaBelum ada peringkat
- Introducción A La EstadísticaDokumen9 halamanIntroducción A La EstadísticaJosé Eduardo Rojas LeconaBelum ada peringkat
- UntitledDokumen8 halamanUntitledDiego GarcíaBelum ada peringkat
- Práctica 1 Simulación ADSDokumen3 halamanPráctica 1 Simulación ADSJOSE ESTUDILLO ALARCONBelum ada peringkat
- Aportes L'HopitalDokumen3 halamanAportes L'HopitalJeannette Gonzalez GarciaBelum ada peringkat
- Reseña David MametDokumen4 halamanReseña David MametDaniela MartínezBelum ada peringkat
- Crisis y Desarrollo GlobalDokumen7 halamanCrisis y Desarrollo Globalsantilincango96Belum ada peringkat
- ABORTODokumen4 halamanABORTOMimi PerezBelum ada peringkat
- Estudio Cualitativo Psicologia AmbientalDokumen19 halamanEstudio Cualitativo Psicologia AmbientalMichael Barreto100% (1)
- Laboratorio BibliotecaDokumen3 halamanLaboratorio Bibliotecavnc hfzBelum ada peringkat
- EvaluaciónU1 FranciscoLeónDokumen7 halamanEvaluaciónU1 FranciscoLeónFrancisco Javier LeónBelum ada peringkat
- Números CardinalesDokumen3 halamanNúmeros CardinalesJayro MarroBelum ada peringkat
- Metodología de La Investigación I.Cm Quinto KDTE. Guamaní Quishpe Kevin Joel 24/01/2023Dokumen4 halamanMetodología de La Investigación I.Cm Quinto KDTE. Guamaní Quishpe Kevin Joel 24/01/2023Joel GuamaniBelum ada peringkat
- Prueva DiagnoticaDokumen2 halamanPrueva DiagnoticaYenny Rodriguez PeñaBelum ada peringkat
- Marketing de AlpinaDokumen15 halamanMarketing de Alpinaandreacifu100% (1)
- Concepto y Objeto de Estudio de La SociologíaDokumen6 halamanConcepto y Objeto de Estudio de La SociologíaNatalia MelianBelum ada peringkat
- UC2. Fórmulas Químicas y Su FormaciónDokumen33 halamanUC2. Fórmulas Químicas y Su Formaciónct0808847Belum ada peringkat
- Industria de La ConstrucciónDokumen2 halamanIndustria de La ConstrucciónCarlosBelum ada peringkat
- Cloruro de ViniloDokumen22 halamanCloruro de ViniloEdgar Jamanca Antonio100% (1)
- Informe Fisica Aplicada N°2Dokumen13 halamanInforme Fisica Aplicada N°2Alfredo Teran santivanezBelum ada peringkat
- Eón HadeicoDokumen9 halamanEón HadeicoGusmelio NelsonBelum ada peringkat
- Política General de Responsabilidad Social Corporativa BBVA 2020Dokumen11 halamanPolítica General de Responsabilidad Social Corporativa BBVA 2020ComunicarSe-ArchivoBelum ada peringkat
- 09-01-2023 095823 Am PRÁCTICA DE LABORATORIO #03 - MEDICIONES DE MASA VOLUMEN Y DENSIDADDokumen9 halaman09-01-2023 095823 Am PRÁCTICA DE LABORATORIO #03 - MEDICIONES DE MASA VOLUMEN Y DENSIDADjrodriguezmo26Belum ada peringkat
- Y.mayta G.umpiri Tesis Titulo Profesional 2022Dokumen132 halamanY.mayta G.umpiri Tesis Titulo Profesional 2022josecardaldaBelum ada peringkat
- Análisis de Lectura - Leva - ColánDokumen2 halamanAnálisis de Lectura - Leva - Colánliseth levaBelum ada peringkat
- Trabajo Final Gestión ComercialDokumen3 halamanTrabajo Final Gestión ComercialmjchipocoBelum ada peringkat