Jurnal Dok Lum Obgyn
Diunggah oleh
andikaagus13Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jurnal Dok Lum Obgyn
Diunggah oleh
andikaagus13Hak Cipta:
Format Tersedia
Apoptosis: Mekanisme dan Implikasi Klinisnya Ringkasan Keseimbangan antara pertahanan hidup sel dan kematian sel adalah
dibawah control genetic yang ketat. Banyaknya sinyal dari mediator ekstraseluer dan intra seluler yang terlibat telah mempertahankan keseimbangan tersebut. Ketika sel terpapar oleh jejas fisik, biokimia, zat tertentu ataupun biologis sel akan mengaktivasi serial gen yang berhubungan dengan respon terhadap stress. Apabila stress minimal, maka sel akan bisa memperbaiki dirinya dan kembali ke keadaan normal. Namun apabila stress yang diterima cukup besar, maka sel akan mengalami kematian atau apoptosis dan didaur ulang uleh sel-sel di sekitarnya. Apabila stress yang diterima sangat besar, maka banyak sel yang mengalami nekrosis disertai dengan adanya respon inflamasi. Disregulasi dari mekanisme yang mengkontrol kondisi tersebut akan menghasilkan suatu penyakit. Defisiensi apoptosis berhubungan dengan kejadian kanker, penyakit autoimun dan infeksi viral. Apoptosis yang berlebihan berhubungan dengan penyakit jantung iskemik, stroke, penyakit neurodegenerative, sepsis dan sindroma disfungsi organ multiple (MODS). Terdapat banyak sekali pilihan terapi yang tersedia saat ini akibat dari semakin terungkapnya pengetahuan tentang apoptosis dan control dari apoptosis. Proses kematian sel merupakan suatu peristiwa yang terkontrol dengan ketat, terorganisasi dengan seksama, dan dibagi menjadi proses apoptosis dan non apoptosis atau biasa disebut sebagai nekrosis. Apoptosis merupakan peristiwa bunuh diri sel dimana mekanismenya telah dikode dalam kromosom semua sel berinti. Kematian sel secara fisiologis yang menghilangkan sel-sel yangtidak dikehendaki merupakan peristiwa yang sangat penting untuk perkembangan, homeostasis jaringan, dan pertahanan untuk melawan infeksi virus dan mutasi. Apoptosis diatur oleh sinyal molecular yang komplek. Iskemik dan reperfusi jaringan mampu mengaktivasi sistem molekuler tersebut, yang oleh karenanya dapat mewakili sebuah target terapi untuk mempertahankan integritas pada organ-organ vital seperti jantung dan otak. Sel yang mengalami apoptosis akan dipecah menjadi fragmen sel melalui mekanisme enzimatik dependen energy, yang terdiri dari DNA (deoksiribonukleat), lipid, dan makromolekul lain. Kesemua debris sel tersebut disimpan dalam vesikel untuk kemudian difagositosis dan digunakan kembali. Sel yang mati melalui mekanisme ini tidak melukai sel disekitarnya, sebaliknya sel yang mati secara nekrosis akan disertai dengan tanda inflamasi dan kerusakan sel yang luas.
Apoptosis memegang peranan sentral dalam pathogenesis berbagai penyakit pada manusia yakni ketika gen yang mengkode proses apoptosis tersupresi, overekspresi atau tidak berfungsi karena terjadinya mutasi.[3] Gangguan pada proses apoptosis dapat memicu terjadinya berbagai penyakit (table 1). Penelitian mengenai apoptosis telah berkembang pesat dan hal ini memicu munculnya kemungkinan pendekatan terapi berbagai macam penyakit pada manusia. [4] Tujuan dari review ini adalah untuk menyediakan informasi mengenai komponen molekuler yang mengaktivasi apoptosis dan kaitannya dalam menyebabkan berbagai penyakit pada manusia, dan membahas mengenai hal-hal yang borpotensi menjadi terapi pada penyakit tersebut berdasarkan pemahaman mengenai mekanisme apoptosis. Pemahaman mengenai peran jejas sel dan kematian sel pada pastofisiologi disfungsi organ berperan dalam penatalaksanaan jejas iskemik dan reperfusi serta sindoma disfungsi organ multiple (MODS)
Sejarah Pada tahun 1880 Weigert & Cohnheim menggamparkan penampakan mikroskopis kematian sel pada jaringan nekrotik sebagai nekrosis koagulasi. [5] Pada tahun 1885, Flemming menggambarkan proses kromatolisis dimana nucleus dari sel folikel ovarium mamalia terpecah-pecah dan kemudian menghilang pada proses kematian sel. [6-8] Pada awal tahun 1870an, Kerr menggambarkan penampakan mikroskopis electron dari sel liver binatang, [9,10] yang terpapar oleh toksin (heliotrine dan albitocin) dan iskemia (dengan ligasi cabang besar vena porta), set tersebut mengalami shrinkage necrosis (atau nekrosis pengkerutan) [11]. Kematian sel adrenal tikus akibat karsinogen dan sel tumor yang terpapar dengan actinomycin D, mitomycin C, cytosine arabinose dan sikloheksimid juga telah diteliti pada tahun 1971. Wylie menemukan bahwa kematian sel tunggal pada kelenjar adrenal yang terpapar carsinogen dipicu oleh hipofisektomi dan menunjukan jalur kematian sel melalui tegulasi hormonal dan jalur kematian yang berkaitan dengan jejas keganasan. [14,15]. Pada sebuah karya tulis yang diterbitkan pada tahun 1972, Kerr dkk menggambarkan ciri-ciri perubahan struktur sel dari jaringan sehat secara sekuensial yang terjadi selama proses kematian sel. Selain itu juga digambarkan perubahan sekuensial dari perkembangan normal, regresi tumor, atropi dan involusi dari sel. [1] Istilah apoptosis (berasal dari bahasa yunani yang berarti jatuh kebawah, suatu istilah untuk menggambaekan daun yang berguguran
pada saat musim dingin) telah diperkenalkan [1].
Pada tahun 1980an Horvits melaporkan kematian sel spesifik selama perkembangan nematode Caenorhabditis elegans dan mengkloning gen kematian (gen ced) yang bertanggung jawab terhadap peristiwa tersebut. Gen anti-apoptosis pada nematode yakni gen ced-9 memiliki kemiripan dengan gen pro-oncogen pada mamalia yakni gen bcl-2 [17], dan menunjukan kemampuannya untuk meempertahankan limfosit B [18,19]. Pada tahun 1990an, mekanisme biomolekuler yang tetap menjaga proses apoptosis berjalan dengan benar dan peristiwa molekuler yang membuat gangguan pada proses apoptosis masih belum terungkap. Tumor fibroblast tikus yang mengekspresikan gen human c-myc memiliki daya apoptosis yang tinggi [20], mengindikasikan bahwa kanker dapat terjadi ketika mutasi telah mengakibatkan disfungsi dari peristiwa apoptosis. Definisi Apoptosis secara spesifik didefinisikan sebagai proses yang tergantung adanya energy, asinkron, terkontrol secara genetic, dimana sel yang tidak diperlukan atau rusak membunuh diri mereka sendiri ketika gen apoptosis diaktifkan [22,23]. Sel akan mengkerut dan melepaskan diri dari sel-sel disekitarnya dan inti sel menjadi terpecah-pecah. Fragmen inti dan organela menggumpal dan terbungkus oleh membrane yang membentuk vesikel, kemudian dieksositosis atau dicerna oleh sel-sel disekitarnya. Integritas membrane sel intak, sedangkan kematian sel terjadi dalam akhir proses. Tidak adanya tanda inflamasi merupakan hal yang membedakan apoptosis dari nekrosis. Perbedaan antara nekrosis dan apoptosis dirangkum dalam table 2. Kematian sel secara iskemik dan tiba-tiba memiliki ciri terjadinya pembengkakan sel atau oncosis (dari bahasa yunani onkos yang berarti bengkak) akibatnya terjadi pembengkakak inti dan kariolisis (hilangnya afinitas terhadap pewarna basa). Baik onkosis maupun apoptosis sel akan mengalami tahap dimana sel tersebut difagositosis, namun pada onkosis juga disertai tanda-tanda inflamasi. Apoptosis dan onkosis/nekrosis merupakan peristiwa kematian sel yang saling over lap. Sel terpapar oleh stimulus noxious yang berat seperti iskemia atau toksin yang memicu terjadinya onkosis dan nekrosis [27]. Kematian sel yang terprogram (programmed cell death = PCD) didefinisikan sebagai upaya bunuh diri sel yang terjadi selama proses perkembangan embrio dari organism imatur dan maturasi jaringan dan tidak memerlukan ekspresi gen de novo [28,29,30]. Pathofisiologi Ciri Morfologis
Terdapat 3 fase dalam apoptosis [31]. Pada fase pertama, sel melepaskan diri dari jaringan dan sel sekitarnya akibat hilangnya mikrovili dan kompleks juctional yang disebut desmosome [32]. DNA dicerna oleh enonuclease spesifik dan dipecah menjadi fragmenfragmen yang terbungkus oleh vesikel. Perubahan DNA yang terjadi meliputi pemisahan pita DNA (karyohexis) dan kondensasi kromatin inti (pyknosis). Kromatin pyknotik tampak sebagai topi yang berbetuk bulan sabit di bawah mikroskop cahaya. Reticulum endoplasma membengkak dan mengeluarkan semua isinya. Sel menjadi lebih padat dan mengkerut dan mengalami involusi. Pada fase kedua, sel membentuk pseudopodia (budding) yang memiliki organela atau fragmen inti dan semuanya terdapat dalam vesikel. Sel yang tersisa menjadi berbentuk bulat, dan terbungkus oleh membrane yang halus (disebut sebagai badan apoptotic) [3,4, 32]. Pada fase ketiga, membrane tersebut menjadi permeable terhadap pewarnaan, misalnya Triphan blue. Badan apoptotic dan budding kemudian difagositosis oleh makrofag, epitel, endotel dan sel tumor. Kesemua proses terjadi sekitar 15 menit dan oleh karena itu tidak dapat terdeteksi pada irisan jaringan [5,23,33]. Sebaliknya pada proses onkosis terjadi pembengkakan sel dan organela dengan proses fragmentasi inti yang lambat serta dicerna oleh enzim lisosom. Pembengkakakn terjadi karena deficit produksi ATP (adenosisn trifosfat) yang memicu gagalnya pompa Na-K dan meningkatkan permeabilitas membrane. Hal ini akan membuat sel menggembung (seperti balon yang terisi air) yang kemudian terjadi rupture membrane. Terjadi serbuan neutrofil dan makrofag pada jaringan disekitarnya yang memicu terjadinya proses inflamasi. Teknik yang dapat digunakan untuk mengidentifikasi dan menghitung apoptosis meliputi pewarnaan inti sel seperti Hoechst 33258 yang mampu memvisualisasikan inti yang menggumpal atau clumping. Mikroskop modem video mampu memvisualisasikan sekuen temporal yang terjadi selama 15-60 menit sampai 24 jam. [23,34,35] Mikroskop floresen dengan acridine orange mampu membuat kromatin yang clumping dapat dilihat segera setelah proses pewarnaan. Beberapa teknik lain antara lain comet assay yang mampu menunjukan degradasi DNA [2]. Metode yang lebih akurat untuk mengidentifikasi apoptosis adalah metode yang secara spesifik dapat mengetahui terjadinya fragmentasi DNA [36]. Agarose elektroforesis dari DNA yang terfragmentasi menunjukkan pola ladder atau anak tangga yang dapat digunakan sebagai marker dari apoptosis. Degrasi DNA dapat menghasilkan bentuk hexamerik yang disebut sebagai rosette [4]. Metode labeling DNA dengan pengecatan TUNEL (The terminal transferase deoxyuridine nick-end Labeling) dimana melabel residu uridine dapat digunakan untuk mendeteksi terjadinya apoptosis pada
irisan jaringan [37]. Flowsitometri juga dapat digunakan untuk menghitung jumlah sel yang mengalami apoptosis secara lebih akurat [38-40]. Mekanisme kematian sel Setelah stimulus yang adekuat, tahap pertama atau tahap decision phase dari apoptosis adalah aktivasi control genetic dari kematian sel. Kemudian diikuti oleh tahap ke dua yakni tahap eksekusi atau execution phase, dimana bertanggung jawab terhadap perubahan
morfologi sel pada proses apoptosis. Terdapat empat kelompok stimulus apoptosis [4,30,32,34,41-45]. Stimulus fisiologis maupun patologis dapat memulai terjadinya apoptosis seperti yang terangkum dalam table 3. Stimulus kelompok pertama menyebabkan kerusakan DNA termasuk di dalamnya radiasi pengion dan obat anti kanker alkilasi. Kelompok yang kedua menginduksi apoptosis melakui mekanisme reseptor-ligan, termasuk di dalamnya oleh reseptor yang termediasi oleh hormone glukokortikoid (beraksi pada timus) [34], temor necrosis factor-a (TNF-a), atau oleh deficit factor pertumbuhan (nerve growth factor dan interleukin (IL)-3) [41,42]. Kelompok ketiga melibatkan agen biokimia yang merangsang
komponen yang mengaktivasi jalur apoptosis termasuk di dalamnya adalah inhibitor fosfatase dan kinase (misal, calphostin C, stauroporine). Kelompok keempat adalah berkaitan dengan agen yang dapat secara langsung merusak membrane sel, termasuk di dalamnya antara lain agen oksidan (anion superoksida, hydrogen peroksida). Produksi ROS (reactive oxygen species) yang berlebih seperti superoksida, hydrogen peroksida, dan radikal hidroksi, menghasilkan radikal bebas yang dapat merusak membran lipid, protein, asam nukleat, dan matrik ekstraseluler glikoaminoglikan. Stimulus tersebut pada dosis besar dapat menicu nekrosis. Jejas pada membrane sel dapat merangsang terjadinya apoptosis dengan mengaktivasi asam spingomyelin yang menghasilkan second messanger dari membrane lipid yakni ceramid. [43,44] Sinyak tranduksi yang memicu apoptosis merupakan dampak dari ikatan death receptor dengan ligannya atau karena kerusakan genome. Reseptor kematian (death receptor) yang memicu apoptosis antara lain sistem reseptor Fas dan reseptor TNF [41]. Reseptor Fas pada walnya dikenal dengan nama CD95 atau APO-1, merupakan death reseptor yang tersusun dari glikoprotein dan berlokasi di transmembran. Reseptor ini teraktivasi oleh Fas ligan (FasL) yang juga berada di membrane sel, [41]. Molekul intrasel yang disebut FADD (Fasassociated death domain) juga diproduksi. Reseptor Fas terdapat pada sel epitel, tumor, jam jaringan hematopoeitik yang dapat terinduksi oleh sel-sel lain yang memiliki Fas-L.
Jalur Fas memegang peranan penting dalam sistem imun. Limfosit T sitotoksik mampu mengekspresikan Fas-L yang mengaktivasi apoptosis dari sel yang memiliki reseptor Fas. Sistem reseptor TNF memediasi berbagai macam jalur biokimiawi yang berbeda.[41,42] ligan apoptosis yang diinduksi oleh TNF (TRAIL=TNF related apoptosis inducing ligan) telah ditemukan. Sel-sel kanker sangatpeka terhadap apoptosis yang diinduksi oleh TRAIL. Jika TRAIL berikatan dengan reseptornya, maka molekul intrasel yang disebut d eath domain diproduksi. TNF receptor associated death domain (TRADD) juga telah teridentifikasi. TNF dapat mensupresi apoptosis dengan berikatan dengan reseptornya yakni TNFR2 yang mana mengaktivasi suatu protein yang disebut Nucleas Factor kappa B (NF-kB) yang diklassifikasikan sebagai protein inhibitor apoptosis (IAP=inhibitor apoptosis protein) yang menghambat terjadinya fase eksekusi [43]. NF-kB merupakan protein yang meregulasi banyak gen pro inflamasi untuk memproduksi berbagai sitokin dan molekul proinflamasi. Terdapat bukti bahwa peningkatan NF-kB sangat penting dalam pathogenesis SIRS (systemic inflammatory response syndrome), MODS dan sindrom distress respirasi akut [28]. Fase keputusan decision (kontrol genetik) Apoptosis dikendalikan secara genetic oleh 2 macam gen yakni bcl2 dan p53. Bcl2 merupakan family gen yang mengatur apoptosis [46-49], dan dapat ditemukan di membrane mitokondria, dan pada membran reticulum endoplasma gen ini juga berperan untuk mengatur kanal kalsium. Saat ini juga telah ditemukan gen yang satu family dengan bcl2 yang juga mampu mengaktivasi atau menghambat apoptosis [50,51]. Protein seperti bcl2 dan bcl xl dapat mencegah apoptosis, sedangkan bcl2 ini sendiri berhubungan dengan protein x (bax) seperti bax, bad dan bcl xl yang dapat memicu terjadinya apoptosis [30,52,53]. p53 merupakan suatu protein inti dengan berat molekul 23 kDa terikat dengan DNA dan berperan sebagai factor transkripsi serta mengkontrol proliferasi sel danperbaikan DNA [54]. Mutasi pada gen p53 disinyalir berhubungan dengan 50% kejadiang kanker pada manusia (misalnya kanker kolon) dan berhubungan dengan resistensi terhadap suatu terapi. Gen c-myc merupakan suati gen proto-oncogen yang mengkode sequence-specific DNA-binding protein suatu protein yang berperan sebagai factor transkripsi dan memicu apoptosis dengan p53 yang normal. Pada banyak tumor terdapat peningkatan kadar c-myc. Mutasi gen neuronal apoptosis inhibitory protein (NAIP) terjadi pada pasien dengan atropi otot spinal [56]. NAIP dapat melindungi berbagai sel dari apoptosis yang diakibatkan oleh TNF-a, radikal bebas dan defisiensi factor pertumbuhan
Tahap Eksekusi Peristiwa penting dalam apoptosis adalah proteolisis dan inaktivasi mitokondrial. Kerusakan sel merupakan dampak dari aktivasi family sitein protease yang disebut caspase (CASP) [30,32,43,57-59]. Kaspase merupakan proenzim yang telah berhasil diisolasi dari tubuh nomatoda sampai tubuh manusia. Saat ini telah ditemukan 10 jenis caspase (casp 1-10). Studi terdahulu mengenai apoptosis berfokus pada nematode C. elegan dan gen yang dibutuhkan untuk penentuan apoptosis yakni gen ced-3. Terdapat 2 subfamili caspase yakni subfamily ced-3 (diproduksi oleh gen ced-3) dan subfamili ICE (IL-1b coverting exzyme). Caspase 1 yang berkaitan erat dengan ICE sering terlibat dalam proses inflamasi [60,61]. Caspase ced-3 berperan penting sebagai efektor apoptosis. Caspase 8 atau FADD-like interleukin converting enzyme (FLICE) merupakan enzim paling penting dari subfamily ced-3 [61,62]. Aksi dari caspase sangat bervariasi: beberapa berperan sebagai endonuklease yang memotong DNA, beberapa memotong protein sitoskeleton, dan yang lainnya mengakibatkan hilangnya daya adhesi sel. Integritas membrane sel tetap dipertahankan pada awalnya, meskipun budding dari sel membrane dapat terjadi setelahnya. Tidak ada sekresi enzim lisosom yang menyababkan kerusakan sel disekitarnya atau memicu timbulnya respon imun. [63] sel yang mengalami apoptosis mampu mengekspresikan sinyal yang memicu fagositosis [64]. Makrofag dapat mengenali sinyal dari neutrofil yang mengalami apoptosis melalui kompleks protein yang melibatkan reseptor thrombospodin (CD36) dan integrin avb3 [65-67] Relevansi Klinis dari Apoptosis Sistem Saraf Pusat Pada perkembangan organisme terdapat bentuk kematian sel yang disebut apoptosis namun saat ini dikenal sebagai kematian sel yang terprogram (PCD) [30]. Selama perkembangan sistem saraf pusat embrio terdapat surplus sel yang terbentuk. PCD mengeliminasi sel-sel yang berlebih tersebut dimana axon gagal untuk meraih target sel tersebut. PCD tersebut terjadi dengan cara withdrawl atau penarikan kembali subtansi thropic seperti nerve growth factor atau dengan menghilangkan kontak sinaptik atau input afferent. Sitokin (seperti TNFa) dan ROS juga dapat memicu PCD [68]. Stess oksidatif, eksitosisitas glutamate dan influx kalsium juda dapat memicu apoptosis pada sistem saraf pusat matur. Produksi ROS yang berlebih mengakibatkan stress oksidatif, merusak lipid membrane, protein, asam nukleat, dan matriks ekstraseluler glikosaminoglikan. ROS dengan dosis rendah atau berkurangnya
antioksidan (superokside dismutase, katalase, gluthation peroksidase) dapat memicu apoptosis. Sedangkan ROS dosis tinggi akan memicu terjasinya nekrosis [30]. Jejas neuronal yang dimediase oleh reseptor glutamate merupakan penyebab utama terjadinya kematian sel neuronal akibat eksotoksikasi yang diikuti dengan iskemia, trauma, kejang epileptic atau neurodegenerasi [30]. Glutamate mengakibatkan nekrosis dengan merangsang influx dari Na, Cl, dan air sehingga sel menjadi membengkak atau justru menunda kematian sel dan mengarahkan ke proses apoptosis beberapa jam setelah paparan melalui mekanisme influx kalsium akibat aktivasi reseptor glutamate. [69-71] Kalsium merupakan second messanger yang penting, dan merupakan instrument dalam menginduksi apoptosis dengan menstimulasi neurotransmitter, induksi gen dan aktivasi enzim (protease, fosfatase, protein kinase, endonuklease, fosfolipase dan NO sintetase) [72]. Fosfolipase A2 menghasilkan anion superoksida dan NO sintetase menghasilkan NO,
keduanya dapat menyebabkan stress oksidatif yang memicu terjadinya apoptosis. Peningkatan apoptosis akibat berlebihnya ion kalsium intrasel merupakan hal yang terjadi pada iskemia serebri, jejas dan trauma otak. Iskemia serebri berakibat terjadinya nekrosis dan DND (delayed neuronal death). Sel yang mengalami DND akibat stress minimal, terlihat pada bagian perifer dari infark di dalam penumbra. Terdapat berbagai bukti yang menyatakan bahwa apoptosis berperan dalam DND [30]. Transfer gen dengan menggunakan virus yang mengandung vector bcl2 dapat memberikan perlindungan terhadap iskemia [73]. Pada cedera otak, kurang dari 10% neuran yang mati mengalami apoptosis pada 24-48 jam paska jejas. [74] Semakin berat jejas pada suatu jaringan, maka semakin banyak sel yang mengalami nekrosis, sedangkan sel yang mengalami apoptosis semakin kecil. [73]. Peningkatan jumlah sel yang mengalami apoptosis berdampak pada terjadinya beberapa penyakit neurodegenerative. Pada penyakit Alzheimer apoptosis korteks otak terjadi akibat penumpukan b-amyloid peptide pada jaringan otak dan pembuluh darahnya [75] melalui mekanisme NO [76]. Penyakit Parkinson berhubungan dengan hilangnya neuron dopaminergik pada substansia nigra, dan dopamine Nampak
mengakibatkan apoptosis pada neuron yang terpapar. [30] Beberapa bentuk sclerosis familial amyotrophic lateral dapat diakibatkan oleh gen mutan yang mengkode antioksidan superoksid dismutase sehingga terjadi kematian motor neuron via apoptosis. Pendekatan terapi masa depan dapat dilakukan dengan memberikan growth factor atau inhibitor sintesis makromolekul yang merangsang apoptosis [56].
Defek pada apoptosis akibat dari mutasi gen pro apoptosis juga dapat mengakibatkan terjadinya berbagai tumor neuronal. Mutasi pada gen p53 terjadi pada tumor astrosit [77,78] Inhibitor protein kinase C (seperti hipericin dan capholstin) dapat mengakibatkan apoptosis pada kultur sel glioma. Teknik transfer gen juga digunakan untuk memapar bclxl ke dalam sel neuroblastoma dan retrovirus ICE ke dalam sel gliosarkoma yang berda,pak apoptosis sel tumor. [78-79]. Sistem Kardiovaskuler Saat ini telah diketahui bahwa kematian miosit pada penyakit jantung terjadi melaui proses baik apoptosis maupun nekrosis sebagai respon terhadap hipoksia atau iskemia. [45] Apoptosis telah dilaporkan terjadi pada iskemia miorkadium, reperfusi, infark, dan gagal jantung yang dikarenakan kinerja berlebihan ventrikel atau emboli coroner, overload hipertropi, dan penuaan [42]. Hipoksia, malnutrisi dan toksin (misalnya kemiterapi) yang umumnya menyebabkan nekrosis, dapat pula memicu apoptosis pada dosis rendah. [45,52] Area infark memiliki sebuah daerah sentral yang mengalami nekrosis yang dikelilingi dengan daerah dimana selnya mengalami apoptosis pada batas periinfark. [42] Sttudi otopsi dari infark miokardium menyatakan bahwa apoptosis secara acak terjadi pada bagian sentral area nekrotik dan area perifer miokard normal. Ligasi arteri coronaria dapat memicu peningkatan biomarker proto oncpgen (bcl2 dan Fas) pada miosit. Peristwa biomolekuler yang terjadi pada beberapa jam awal iskemia mengarah kepada apoptosis. Karena sel jantung mendapat iskemia yang semakin parah maka gen apoptosis tidak mampu lagi diekspresikan dan terjadilah nekrosis [81]. Studi mengenai reperfusi in vivo pada kelinci menyatakan bahwa apoptosis paling banyak terjadi pada jantung yang mengalami reperfusi, sedangkan nekrosis paling banyak terjadipada area dengan oklusi persisten [82]. Reperfusi meningkatkan produksi radikal bebeas dan kalsium intrasel, yang merupakan agen potensial untuk menginduksi apoptosis, Apoptosis pada otot polos pembuluh darah pada plak atherosclerosis dalam arteri coronaria dapat mengakibatkan ketidakstabilan dan rupture plak [83]. Apoptosis meningkat menjadi 43% pada lesi atheroskerosis dan 93% pada restenosis [84,85]. Hal tersebut mungkin dipicu oleh NO dan berhubungan dengan ekspresi caspase 1 [84]. Aritmia juga mungkin berkaitan dengan defisiensi peristiwa apoptosis pada saat perkembangan jantung. Normalnya paska kelahiran terjadi apoptosis pada pacemaker kecil pada bagian sentral dan bawah dari AV node [85]. Penundaan atau gagalnya apoptosis dari sel pacemaker tersebut dapat berakibat terjadinya aritmia yang mengancam jiwa, namun dapat membaik secara spontan pula.
Sedangkan apoptosis sel pace maker yang berlebihan dapat mengakibatkan bradiaritmia dan kematian mendadak [45]. Pasien dengan sindroma QT memanjang memiliki peningkatan daya apoptosis pada sinus node [85]. Fase akhir dari semua kelainan pada sistem kardiovaskuler tersebut adalah gangguan fungsi jantung dan gagal jantung yang berkaitan dengan kardiomiopati dilatasi [45.46]. Hipertropi miokardium dapat terjadi sebagai respon kompensasi awal terhadap overload pada jantung. Hal ini berhubungan dengan c-myc, c-fos, dan perubahan factor pertumbuhan yang terlibat dalam memulai peristiwa apoptosis. Kardiomiopati dilatasi dapat dipicu oleh paparan kronik TNF-a yang menyebabkan apoptosis [43]. Penurunan fungsi jantung secara progresif pada gagal jantung tahap akhir mungkin dikarenakan apoptosis, hal ini didukung dengan ditemukannya peningkatan bcl2 pada miosit pasien dengan gagal jantung. Meskipun apoptosis sendiri merupakan peristiwa irreversible, namun dengan meminimalisasi factor pertumbuhan dan sitokin mungkin dapat mencegah penurunan progresif dari fungsi ventrikel kiri. [45] Aritmia ventrikel kanan yang dysplasia merupakan kardiomiopati yang berkaitan dengan aritmia ventrikel akibat periwtiwa apoptosis, yang mana ditemukan pada biopsy miokardium pada pasien tersebut [45]. Sistem Imun Disfungsi jalur apoptosis dapat menyebabkan penyakit autoimun, imunodefisiensi dan keganasan limfoid. Selama proses perkembangan, banyak sel precursor dari sumsum tulang bermigrasi ke timus. Mayoritas (90-95%) sel precursor gagal memproduksi TCR (T-cell receptor) dan mati memalui jalur apoptosis [86]. Apoptosis timosit dapat dipicu oleh hormone glukokortikoid dan deficit TCR [87,88]. Kematian klon sel (delesi klonal) karena apoptosis yang berkaitan dengan deficit TCR, juga terjadi pada sel limfosit B yang
menghasilkan antibody terhadap tubuh sendiri, peristiwa ini terjadi di liver janin dan kemudian di sumsum tulang [89,90]. Studi menggunakan binatang mengindikasikan ahwa penyakit autiimun seperti reumathoid arthritis, systemic lupus erimatosus (SLE), inflamatori bowel disease (IBD), dan diabetes dependen insulin, mungkn juga diakibatkan oleh disfungsi apoptosis [91,92]. Terdapat bukti bahwa sel T sitotoksik telah membunuh sel target dengan menginduksi apoptosis sel target [93]. Apoptosis granulosit juga penting untuk resolusi dari respon inflamasi. Agen inflamasi seperti LPS (lopopolisakarida) dan granulocyte colony stimulating factor (G-CSF)
menghambat apoptosis netrofil. Selama apoptosis dipicu oleh TNF-a dan NO, neutrofil kehilangan kemampuannya untuk degranulasi, sehingga membatasi inflamasi. Neutofil yang intak difagosit oleh makrofag dan didegradasi dalam hitungan menit tanpa mengeluarkan mediator pro inflamasi. Ketika granulosit yang nekrosis difagosit, makrofag mengeluarkan mediator pro inflamasi [94]. Penyakit hematologi seperti MDS (myelodisplasia syndrome), anemia aplastik, neutropeni kronis, atau b-thalasemia berat juga berkaitan dengan peningkatan apoptosis pada sumsum tulang [95]. Infeksi Virus Banyak virus mampu menghambat apoptosis sel inang mereka untuk memperlama masa hidup sel inang sehingga mereka dapat bereplikasi. Virus dapat mengkode protein anti apoptosis seperti baculovirus, IAPs, p53 baculovirus dan protein crma dari virus serpin cowpox, dan protein-protein tersebut mampu memicu perkembangan berbagai macam
kanker. [96] Virus DNA juga memiliki gen anti apoptosis. Sebagai contoh, virus papiloma dan adenovirus dapat mengkode inhibitor p53. Virus RNA juga memiliki gen anti apoptosis [97]. Infeksi HIV memiliki ciri penurunan proliferasi sel T awalnya dengan berkurangnya sel T CD4 dan CD8, kemudian disusul dengan sel NK (natural killer) dan neuron. Apoptosis pada sel CD4 pada pasien dengan HIV telah dipicu oleh virus. Produk lain dari virus HIV-1 yakni protein tat, juga diproduksi oleh sel yang terinfeksi dan kemudian diambil oleh sel T yang tidak terinfeksi, mengakibatkan kadar antioksidan intrasel menjadi berkurang dan stess oksidatif menjadi bertambah [99]. Sepsis dan MODS (multiple organ dysfunction syndrome) Sepsis sering disertai dengan MODS dimana diakibatkan oleh apoptosis [100]. Pelepasan sitokin secara sitemik seperti TNF-a dan IL-1b oleh LPS bakteri mengakibatkan peningkatan kalsium intrasel dan peningkatan produksi radikal bebas, hal ini dipercaya mampu memicu apoptosis pada berbagai macam organ [101-104]. TNF-a dapat memicu pelepasan IL-1b [105]. Pada percobaan dengan tikus yang mengalami syok septic, paparan langsung terhadap TNF-a dapat memicu apoptosis hepatosit. Penemuan lainnya menyatakan bahwa defisiensi ICE merupakan parameter dari resistensi terhadap syok septic. [107] Telah dinyakatakan bahwa peristiwa apoptosis pada syok septic sebenarnya menguntungkan bagi penderitanya karena bertujuan untuk meminimalisir respon inflamasi pada target organ. [28] Apoptosis merupakan penyebab utama kematian sel limfosit pada sistem imun (timus, limfonodi, dan
limpa) selama proses infeksi bakteri maupun virus. [101,108-113] selain itu, selama sepsis apoptosis juga terjadi pada sel paru, ileum, colon, dan otot rangka. [109] Apoptosis mungkin merupakan regulator yang penting untuk mencapai keseimbangan antara factor pro dan anti inflamasi, dan keseimbangan ini dicapai melalui kematian sel limfosit yang berujung pada berkurangnya produksi sitokin [114]. Pasien yang mengalami trauma baik dengan atau tanpa sepsis menunjukan penurunan apoptosis neutrofil yang berkaitan dengan peningkatan fosforilasi tirosin yang mana mampu memicu kerusakan jaringan secara luas [115,116]. Pasien dengan SIRS dan paska operasi aorta juga menunjukan penurunan apoptosis neutrofil yang mungkin dikarenakan beredarnya agen pro inflamasi anti-apoptosis seperti LPS, TNF-a, IFN-g, G-CSF dan granulosit monosit colony stimulating factor. [117] Neutofil pada kondisi tersebut berkontribusi terhadap patofisiologi MODS karena neutrofil akan terus mendegranulasikan mediator kimia dan ROS yang memicu kerusagan jaringan. Apoptosis dapat berjalan normal kembali dengan pemberian antibody anti TNF dan IL-10 [118]. Pada sepsis karena polimikroba, terjadi apoptosis makrofag yang berlebih, yang berkaitan dengan aktivasi NO dan caspase yang memicu hilangnya fungsi fagositosis [119] Kanker Terdapat bukti bahwa kegagalan memulai proses apoptosis diikuti dengan kerusakan DNA dapat mengakibatkan kanker. Peningkatan kadar c-myc juga ditemukan pada banyak tumor. [120-122] Pada limfoma folikular, translokasi kromosom 14 dan 18 menyebabkan ekspresi oncogene bcl2. Kadar bcl2 meingkat pada berbagai macam kanker pada manusia, seperti limfoma, leukemia, adenocarcinoma, kanker ginjal dan paru, neuroblastoma, dan melanoma [123-126]. Proses mutasi juga terlibat dalam karsinogenesis. Sebagai contoh, mutasi pada gen supresi tumor p53 yang berfungsi menekan produksi bcl2. Defisiensi gen p53 terjadi pada semua kanker manusia [127-130]. Sebagai contoh pada tumor Wilms dimana terjadi mutasi gen p53 pada area yang anaplastik. Sitem Ginjal Secara embriologis, perkembangan ginjal melibatkan periode apoptosis yang diwakili dengan adanya bcl2 [131]. Kekurangan kadar bcl2 pada tikus dapat mengakibatkan terjadinya penyakit ginjal polikistik [132], namun bcl2 yang berlebih terjadi pada berbagai macam tumor ginjal [133].
Sistem Gastrointestinal Penyakit saluran pencernaan dapat berkaitan dengan apoptosis yang berlebihan maupun yang defisiensi apoptosis. Shigella dysentriae dapat menyebabkan apoptosis yang berlebihan dari makrofag pada lamina propia intestine dengan melepaskan IL-1b. pada tikus yang mengekspresikan N-cadherin mutan nonfungsional pada vilinya, mampu berkembang kea rah Crohn disease dan menunjukan peningkatan apoptosis baik pada vili maupun kripta dan beresiko untuk terjadinya adenoma. Inhibisi progresif terhadapproses apoptosis diduga juga terlibat dalam pathogenesis neoplasma pada saluran pencernaan khususnya kanker kolorektal. [134] gen yang mengatur apoptosis menjadi gen mutan pada kanker gaster dan kolorektal. p53 wild type, ketika dikenalkan kepada kultur sel kanker kolorektal, mampu menghambat pertumbuhan sel dan menginduksi apoptosis [135]. Namun, ekspresi p53 juga berhubungan dengan prognosis yang lebih buruk baik pada kanker gaster maupun kolorektal [4] yang mungkin diakibatkan oleh mutasi atau malfungsi p53 sehingga apoptosis tidak berjalan sebagai mana mestinya. Protein bcl2 juga ditemukan pada berbagai macam kanker pada manusia terutama tertinggi pada adenoma [136].
Sel hepar mengalami apoptosis ketika terinfeksi oleh virus seperti dalam kondisi hepatisis kronis [137]. Aktivasi sel T sitotoksik abdominal mungkin juga terlibat dalam terjadinya hepatitis fulminan pada manusia. [95] Paracetamol mampu merangsang peningkatan kadar kalsium intrasel yang mana akan mengaktivasi nuclease dependen Ca [138]. Apoptosis juga mampu memediasi rejeksi allograf pada transplantasi hati [139]. Sistem Reproduksi Apoptosis secara kontinyu dihambat oleh banyak jaringan sistem reproduksi yang memiliki hormone trophic dari kelenjar hipofisis, gonad dan uterus. Ketika hormone tersebut dihilangkan, jaringan akan mengalami atropi. Folikel ovarium akan mengalami pertumbuhan atau atresia tergantung dari respon terhadap perubahan siklus LH (leutenizing hormone) dan FSH (follicle stimulating hormone); endometrium; payudara dan prostat juga dipengaruhi oleh hormone steroid dan mengalami regresi jika hormone tersebut dihilangkan. [140] Kemungkinan Pendekatan Terapi di Masa Depan Banyaknya keterlibatan komponen-komponen dalam apoptosis mempengaruhi patofisiologi dari penyakit dan juga menyediakan celah untuk intervensi terapeutik penyakit itu sendiri.
Pada penyakit yang diakibatkan oleh banyaknya kematian sel, seperti hepatitis viral dan penyakit neurodegenerative, tujuan terapi adalah meminimalisir apoptosis dengan memodifikasi sinyal tranduksi yang memicu respon apoptosis (influx kalsium , ROS) atau dengan mengganggu efektor apoptosis (caspase dan endonuklease). Namun, hambatan proses apoptosis juga beresiko untuk menimbulkan berbagai tumor karena tidak terjadi eliminasi selsel yang rusak. Pada penyakit yang diakibatkan defisiensi apoptosis seperti kanker, latensi virus, penyakit autoimun, maka dapat digunakan pendekatan terapi dengan metode meningkatkan apoptosis. Agen yang memiliki target reseptor atau molekul regulator dan agen yang memliki target pada proses akhir jalur apoptosis memiliki kemungkinan sebagai agen terapi. Fas yang terlarut dapat menjadi agen yang memicu apoptosis (untuk terapi tumor), sedangkan antibody anti Fas merupakan agen yang dapat menghambat terjadinya apoptosis (misalnya untuk terapi penyakit neurodegenerative). Terdapat laporan mengenai kesuksesan inhibitor TNF-a untuk menngobati beberapa penyakit inflamasi kronis seperti reumathoid arthritis dan colitis ulseratif, namun agen ini tidak mencegah terjadinya sepsis [141]. Sebaliknya penurunan bcl2 pada sel kanker dapat mengembalikan kembali sensitivitas tumor terhadap kemoterapi dan radioterapi. Hal ini terjadi karena terapi dengan single strand DNA sintetis pendek yang disebut antisense
oligonukleotida yang mana mampu mengikat messager spesifik dari sekuen RNA dan mencegah produksi protein tertentu yang hendak dibentuk. [143] Caspase merupakan target terapi dimana mulai dikembangkan berbagai macam inhibitor untuk caspase. Aldehid tetrapeptida merupakan inhibitor potent ICE namun bersifat toksik [4]. Zat tersebut beraksi spesifik dengan berikatan dengan protease dan menghambat pemecahan protein sel target. Inhibitor ICE dapat menghambat apoptosis pada sejumlah besar sistem sel. Zat tersebut memiliki peran terhadap sepsis dan penyakit neurodegenerative [144]. Kanker Kerr dkk [145] menemukan bahwa agen antikanker juga memicu apoptosis pada tumor. Agen kemoterapi yang dilaporkan mampu menginduksi apoptosis antara lain alkilating agen (siklofosfamid, mitomisin C, mustard nitrogen), inhitor topoisomerase II (danorubisin, adriamisin), deksametasone, antimetabolit (methotrexate, 5-fluorouracil, 5-azacytidine), cisplatin, penghancur mikrotubuli (vincristine, vinblastin, taxol), cycloheximide, bleomicin, tamoxifen, dan sitosin arabinose [30,90]. Radiasi dam agen sitotoksik memicu terjadinya
kerusakan DNA sehingga merangsang ekspresi p53 untuk memulai apoptosis. Jika terjadi defek p53, maka terjadi resistensi terhadap kemoterapi [129]. Aktivasi jalur p53 pada sel kanker untuk memulai proses apoptosis merupaka target terapi yang potensial dan kuat untuk terapi tumor. Sehingga muncul pendekatan terapi melalui gen p53. Sebagai contoh terapi kanker dengan menggunakan paparan wild type p53 yang dibawa oleh viral sebagai vector pada karsinoma small cell paru dengan hasil yang cukup memuaskan [146]. Penyakit Inflamasi Kortikosteroid dapat memicu apoptosis sel eosinofil namun menghambat apoptosis neutrofil. Pengobatan pasien astma dengan kortikosteroid dapat menyebabkan kematian eosinofil untuk selanjutnya difagosit oleh makrofag. [147] Deteksi fenomena ini pada sekret saluran napas pasien astma mengindikasikan telah terjadinya perbaikan.[148] Iskemia dan Reperfusi Apoptosis sudah terbukti terjadi pada area iskemi dan reperfusi baik pada jaringan otak, jantung, hepar, dan ginjal. [11,82]. Seiring dengan berkembangnya pemahaman mengenai mekanisme molekuler, maka berkembanglah pendekatan terapi atau pencegahan. Traktus Gastrointestinal Obat sitotoksik memicu apoptosis pada berbagai studi pada sel kanker gastrointestinal
manusia seperti halnya pada usus normal tikus, sehingga agen tersebut berpotensi sebagai terapi antikanker. Konsumsi NSAID (non steroid anti-inflammatory drug) dimana menghambat COX-1 dan COX-2 dapat mencegah up regulasi bcl2 oleh prostaglandin dan mencegah kanker kolorektal. Efek protektif diet tinggi serat mungkin melalui fermentasi serat oleh bakteri di dalam kolon sehingga terbentu asam lemak rantai tunggal 9tak jenuh) (misalnya butirat) yang mana dapat memicu apoposis sel. [4] Kesimpulan Jejas sel sebagai dampak dari stress fisik, biokimia ataupun biologi atau defisiensi substansi vital dapat memicu ekspresi gen respon adaptif terhadap stress. Interaksi respon sel pada fase akut, heat shock, dan stress oksidatif menentukan nasib dari sel tersebut. Respon intrasel terhadap jejas merangsang ekspresi genetic yang memediasi perubahan seluler yang biasanya bersifat spesifik tergantung dari jenis sel dan jejasnya. Respon seluler tersebut biasanya berupa respon sitoprotektif namun dapat juga memicu apoptosis. Agen reduksi, antioksidan, antibody anti TNF, steroidantagonis dan inhibitor sintesis protein dapat memodulasi
apoptosis. Beberapa modalitas terapi gen untuk berbagai penyakit seperti MODS dan kanker mungkin dapat tersedia seiring dengan semakin berkembangnya pemahaman dari dampak dan mekanisme respon gen terhadap stress sampai terjadinya jejas.
Anda mungkin juga menyukai
- DM Rio NewDokumen35 halamanDM Rio Newandikaagus13Belum ada peringkat
- Persalinan MalpresentasiDokumen28 halamanPersalinan Malpresentasiandikaagus13Belum ada peringkat
- Upaya Pogi Untuk Memperluas Cakupan Pelayanan Kesehatan MaternalDokumen18 halamanUpaya Pogi Untuk Memperluas Cakupan Pelayanan Kesehatan MaternalmineresearchBelum ada peringkat
- Bab V Hasil Penelitian: Tabel Rata-Rata Usia, Onset Operasi, GCS Masuk, Sistol, HR Dan RR PaDokumen12 halamanBab V Hasil Penelitian: Tabel Rata-Rata Usia, Onset Operasi, GCS Masuk, Sistol, HR Dan RR Paandikaagus13Belum ada peringkat
- OrtoDokumen18 halamanOrtoandikaagus13Belum ada peringkat
- Protap Diabetes Dalam Kehamilan PDFDokumen19 halamanProtap Diabetes Dalam Kehamilan PDFAnonymous U6Aw7jPGBelum ada peringkat
- Summary of DatabaffffseDokumen5 halamanSummary of Databaffffseandikaagus13Belum ada peringkat
- Cardio Dok Sya ObgynDokumen9 halamanCardio Dok Sya Obgynandikaagus13Belum ada peringkat
- SasmpelDokumen1 halamanSasmpelandikaagus13Belum ada peringkat
- 1106 Yuliana (P) - Format MOGDokumen5 halaman1106 Yuliana (P) - Format MOGandikaagus13Belum ada peringkat
- Pencegahan PONVDokumen2 halamanPencegahan PONVandikaagus13Belum ada peringkat
- Anestesi Pada Bedah Mata AnakDokumen43 halamanAnestesi Pada Bedah Mata Anakandikaagus13Belum ada peringkat
- Inflamasi Referat Dokter RonDokumen4 halamanInflamasi Referat Dokter Ronandikaagus13Belum ada peringkat
- Referat IIDokumen1 halamanReferat IIandikaagus13Belum ada peringkat
- Tokolitik Da PrematureDokumen47 halamanTokolitik Da Prematureandikaagus13Belum ada peringkat
- PIT - Dr. SitDokumen5 halamanPIT - Dr. Sitandikaagus13Belum ada peringkat
- Tinjauan Jinten HitamDokumen20 halamanTinjauan Jinten Hitamandikaagus13Belum ada peringkat
- SitokinDokumen6 halamanSitokinNoni Minty BelantricBelum ada peringkat
- Belibis A17-Laringitis AkutDokumen11 halamanBelibis A17-Laringitis AkutYulianti RiskiBelum ada peringkat
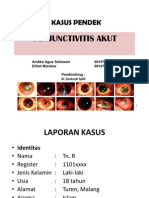
- Kasus PendekDokumen13 halamanKasus Pendekandikaagus13Belum ada peringkat