Guía 2 Física Dif 4to Medio
Diunggah oleh
María Elisa Castro OlivaresJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Guía 2 Física Dif 4to Medio
Diunggah oleh
María Elisa Castro OlivaresHak Cipta:
Format Tersedia
Trinity School Eruditio et Religio _________________________________________________________________________________ ASIGANTURA: Termodinmica (Plan Diferenciado) NOMBRE GUIA Y/O MDULO DE APRENDIZAJE: Gases
Ideales 2da Parte NIVEL: 4 Medio PROFESOR(A)/ES: Mara Elisa Castro Olivares. OBJETIVOS GUIA Y/O MODULO DE APRENDIZAJE: Identificar las variables de estado que describen un gas. Reconocer las condiciones fsicas de un gas ideal. Relacionar la presin, volumen y temperatura de una masa gaseosa (transformaciones isotrmicas e isobricas), trabajando siempre en un solo sistema de unidades. Calcular, aplicando las Leyes de Boyle y Mariotte; de Charles, Gay Lussac, Ecuacin general de los gases, Ley de Avogadro, Ley de los gases ideales a problemas. Describir el modelo cintico de un gas. Calcular la energa cintica de un gas.
Gases Ideales
2da Parte
Ley de los gases ideales
La ley de los gases ideales es la ecuacin de estado del gas ideal, un gas hipottico formado por partculas puntuales, sin atraccin ni repulsin entre ellas y cuyos choques son perfectamente elsticos (conservacin de momento y energa cintica). La energa cintica es directamente proporcional a la temperatura en un gas ideal. Los gases reales que ms se aproximan al comportamiento del gas ideal son los gases monoatmicos en condiciones de baja presin y alta temperatura. En 1648, el qumico Jan Baptist van Helmont cre el vocablo gas, a partir del trmino griego kaos (desorden) para definir las caractersticas delanhdrido carbnico. Esta denominacin se extendi luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia. La principal caracterstica de los gases respecto de los slidos y los lquidos, es que no pueden verse ni tocarse, pero tambin se encuentran compuestos de tomos y molculas. La causa de la naturaleza del gas se encuentra en sus molculas, muy separadas unas de otras y con movimientos aleatorios entre si. Al igual que ocurre con los otros dos estados de la materia, el gas tambin puede transformarse (en lquido) si se somete a temperaturas muy bajas. A este proceso se le denomina condensacin. La mayora de los gases necesitan temperaturas muy bajas para lograr condensarse. Por ejemplo, en el caso del oxgeno la temperatura necesaria es de -183C. Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, cuando los cientficos empezaron a darse cuenta de que en las relaciones entre la presin, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podra obtener una frmula que sera vlida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximacin que tienen las molculas que se encuentran ms separadas, y hoy en da la ecuacin de estado para un gas ideal se deriva de la teora cintica. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuacin del gas ideal, con una o ms de las variables mantenidas constantes. Empricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presin y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por mile Clapeyron en 1834.
Trinity School Eruditio et Religio _________________________________________________________________________________
La ecuacin de estado
La ecuacin que describe normalmente la relacin entre la presin, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde:
= Presin absoluta = Volumen = Moles de gas = Constante universal de los gases ideales = Temperatura absoluta
Teora cintica molecular
Esta teora fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
Valores de R
Todo gas ideal est formado por N pequeas partculas puntuales (tomos o molculas). Las molculas gaseosas se mueven a altas velocidades, en forma recta y desordenada. Un gas ideal ejerce una presin continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partculas con las paredes de este. Los choques moleculares son perfectamente elsticos. No hay prdida de energa cintica. No se tienen en cuenta las interacciones de atraccin y repulsin molecular. La energa cintica media de la translacin de una molcula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuacin de los gases se encuentra tericamente: donde es la constante de Boltzmann, donde N es el nmero de partculas.
Problemas Gases Ideales
1. La masa de un gas ocupa un volumen de 4.00 m3 a 758 mmHg. Calclese su volumen a 635 mmHg, si la temperatura permanece constante. Resp. 4.77 m3 2. Una masa de gas dada ocupa 38 mL a 20 C. Si su presin se mantiene constante, cul es el volumen que ocupa a una temperatura de 45 C? Resp. 41 mL 3. En un da en que la presin atmosfrica es de 75.83 cmHg, un manmetro de un tanque para gas marca la lectura de la presin de 258.5 cmHg. Cul es la presin absoluta (en atmsferas y en kPa) del gas dentro del tanque? Resp. 334.3 cmHg = 4.398 atm = 445.6 kPa 4. Un tanque que contiene un gas ideal se sella a 20C y a una presin de 1.00 atm. Cul ser la presin (en kPa y mmHg) en el tanque, si la temperatura disminuye a 35 C?
2
Trinity School Eruditio et Religio _________________________________________________________________________________
Resp. 82 kPa = 6.2 x 102 mmHg 5. Dados 1000 mL de helio a 15 C y 763 mmHg, determnese su volumen a 6 C y 420 mmHg. Resp. 1.68 x 103 mL 6. Un kilomol de gas ideal ocupa 22.4 m3 a 0 C y 1 atm. a) Cul es la presin que se requiere para comprimir 1.00 kmol de gas en un contenedor de 5.00 m3 a 100 C? b) Si se va a encerrar en un tanque de 5.00 m3, el cual puede resistir una presin manomtrica mxima de 3.00 atm, cul sera la mxima temperatura del gas si se desea que el tanque no estalle? Resp. a) 6.12 atm; b) 30 C 7. Un tanque de 5000 cm3 contiene un gas ideal (M = 40 kg/kmol) a una presin manomtrica de 530 kPa y a una temperatura de 25 C. Si se supone que la presin atmosfrica es de 100 kPa, qu cantidad de masa de gas se encuentra en el depsito? Resp. 0.051 kg 8. La presin de aire en un vaco razonablemente bueno podra ser de 2.0 x 10-5 mmHg. Qu masa de aire existe en un volumen de 250 mL a esta presin y a 25 C? Tmese M = 28 kg/kmol para el aire. Resp. 7.5 x 10-12 kg 9. Qu volumen ocupar 1.216 g de SO2 gaseoso (M = 64.1 kg/kmol) a 18.0 C y 775 mmHg, si este acta como un gas ideal? Resp. 457 mL 10. Calclese la densidad del H2 S gaseoso (M = 34.1 kg/kmol) a 27 C y 2.00 atm, considerndolo como gas ideal. Resp. 2.76 kg/m3 11. Un tubo cerrado de 30 mL, contiene 0.25 g de vapor de agua (M = 18 kg/kmol) a una temperatura de 340 C. Suponiendo que es un gas ideal, cul es su presin? Resp. 2.4 MPa 12. Un mtodo para estimar la temperatura en el centro del Sol se basa en la ley de los gases ideales. Si se supone que el centro consiste de gases cuya masa promedio es de 0.70 kg/kmol, y si la densidad y la presin son 90 x 103 kg/m3 y 1.4x 1011 atm, respectivamente; calclese la temperatura. Resp. 1.3 x 107 K 13. Una burbuja de aire de volumen V0 se deja escapar del fondo de un lago a una profundidad de 11.0 m Cul ser su volumen en la superficie? Considrese que su temperatura es de 4.0 C en el punto de partida y de 12 C en la superficie. El agua tiene una densidad de 1000 kg/m3 y la presin atmosfrica es de 75 cmHg. Resp. 2.1 V0
Anda mungkin juga menyukai
- Evaluación Ley de CoulombDokumen5 halamanEvaluación Ley de CoulombMaría Elisa Castro Olivares100% (1)
- Prueba de Principio de PAscal, Principio de ArquimidesDokumen4 halamanPrueba de Principio de PAscal, Principio de ArquimidesMaría Elisa Castro Olivares67% (3)
- Guía Ley de Gravitación UniversalDokumen3 halamanGuía Ley de Gravitación UniversalMaría Elisa Castro Olivares100% (1)
- Guía Nº1 de Trabajo Física 1ero MedioDokumen5 halamanGuía Nº1 de Trabajo Física 1ero MedioMaría Elisa Castro OlivaresBelum ada peringkat
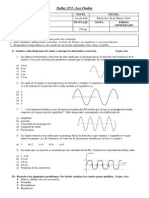
- Taller Nº1 OndasDokumen2 halamanTaller Nº1 OndasMaría Elisa Castro OlivaresBelum ada peringkat
- Guía Matemática 8vo Básico 07-03 PDFDokumen4 halamanGuía Matemática 8vo Básico 07-03 PDFMaría Elisa Castro OlivaresBelum ada peringkat
- Libreto Día Del Alumno 2013Dokumen4 halamanLibreto Día Del Alumno 2013María Elisa Castro Olivares67% (3)
- Semana 9 - Cinematica en Una DimensiónDokumen31 halamanSemana 9 - Cinematica en Una DimensiónPIZARRO SUNCION JEAN PIERBelum ada peringkat
- Informe de MacrografíaDokumen24 halamanInforme de MacrografíaWilliam DuckBelum ada peringkat
- 2º Eso Naturales - QuímicaDokumen8 halaman2º Eso Naturales - Químicamyum25Belum ada peringkat
- 25 Problemas de FisicoquimicaDokumen14 halaman25 Problemas de FisicoquimicaLisset Cori CórdovaBelum ada peringkat
- Tipos de QuemadoresDokumen6 halamanTipos de QuemadoresRoman Gabriel Merino GarciaBelum ada peringkat
- Ejercicios - de Quimica-Rxs - Qcas.Dokumen3 halamanEjercicios - de Quimica-Rxs - Qcas.FRANK GERMAN JIMENEZ CORONADOBelum ada peringkat
- Implosion Number 3Dokumen9 halamanImplosion Number 3StephanyRodriguez100% (1)
- Ejemplo de Velocidad de ReacciónDokumen6 halamanEjemplo de Velocidad de ReacciónCes CrBelum ada peringkat
- Ensayos Mecanica de SueloDokumen9 halamanEnsayos Mecanica de SueloYarubi RodriguezBelum ada peringkat
- Informe #01 PDFDokumen1 halamanInforme #01 PDFTacuri Aguirre RonaldiñoBelum ada peringkat
- 0.corte - GTPDokumen10 halaman0.corte - GTPTomas IbarlinBelum ada peringkat
- Experimento ReynoldsDokumen19 halamanExperimento ReynoldsRobinson David DíazBelum ada peringkat
- Contactodriel 1Dokumen6 halamanContactodriel 1javier pazziBelum ada peringkat
- Reporte 3 - Punto de FusiónDokumen6 halamanReporte 3 - Punto de FusiónMaría LopezBelum ada peringkat
- Prueba de Bondad de AjusteDokumen4 halamanPrueba de Bondad de AjusteAlberto Astorayme ValenzuelaBelum ada peringkat
- Practica 5Dokumen12 halamanPractica 5ruygudino100% (1)
- Bombas Sumergibles o de Pozo Profundo-Aguirre PalaciosDokumen13 halamanBombas Sumergibles o de Pozo Profundo-Aguirre PalaciosRicardoBelum ada peringkat
- Ejercicios Mas Con SolucionDokumen4 halamanEjercicios Mas Con SolucionCesar Joaquin Garcia DelacruzBelum ada peringkat
- Capitulo Iii Cinematica Objetivos PDFDokumen53 halamanCapitulo Iii Cinematica Objetivos PDFAnonymous 1EIgRSERBelum ada peringkat
- Informe de Labraorio DinamicaDokumen5 halamanInforme de Labraorio DinamicaJhon RuizBelum ada peringkat
- Informe Práctica 04Dokumen4 halamanInforme Práctica 04Victoria SuiraBelum ada peringkat
- Materiales Parte 2 RESUMENDokumen24 halamanMateriales Parte 2 RESUMENMónica Máiz GutiérrezBelum ada peringkat
- AciDokumen34 halamanAci730D4279Belum ada peringkat
- FORMULARIO de Turbinas Francis y KaplanDokumen6 halamanFORMULARIO de Turbinas Francis y KaplanGustavo Quispe LimachiBelum ada peringkat
- #3 Propiedades Coligativas Descenso Del Punto de Congelación PDFDokumen6 halaman#3 Propiedades Coligativas Descenso Del Punto de Congelación PDFJorge LuisBelum ada peringkat
- Sistema de Enfriamiento de Motor A GasolinaDokumen10 halamanSistema de Enfriamiento de Motor A GasolinaLalo Parada100% (1)
- EQUIP Y COMPO SESION-01-2022-1 SendDokumen117 halamanEQUIP Y COMPO SESION-01-2022-1 SendChester SitoBelum ada peringkat
- Taller #1 EvaporadorDokumen3 halamanTaller #1 EvaporadorJ. Cristo ABelum ada peringkat
- PTAR - Trabajos en CalienteDokumen1 halamanPTAR - Trabajos en CalienteSEGURICGBelum ada peringkat
- Fatiga de MetalesDokumen11 halamanFatiga de MetalesYunior 11Belum ada peringkat