Penentuan Rumus Empiris
Diunggah oleh
dedearyakaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Penentuan Rumus Empiris
Diunggah oleh
dedearyakaHak Cipta:
Format Tersedia
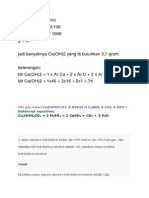
PENENTUAN RUMUS EMPIRIS, RUMUS MOLEKUL, SENYAWA HIDRAT, DAN KADAR ZAT DALAM SENYAWA Rumus empiris merupakan
rumus perbandingan jumlah mol unsur-unsur yang membentuk suatu senyawa, contoh : (CH2O)n, (CH2)n, dan lain-lain. Rumus molekul senyawa merupakan rumus kimia yang menggambarkan jumlah atom dan unsur penyusun suatu senyawa, contoh : C6H12O6 , C4H8, dan lain-lain. Dalam penentuan rumus molekul, perlu ditentukan terlebih dahulu rumus empirisnya, selanjutnya dengan menggunakan data Mr senyawa, dapatlah ditentukan rumus molekulnya. Contoh soal : 1. Suatu senyawa hidrokarbon mengandung 85,7 % massa karbon, dan sisanya massa hidrogen. Jika diketahui Mr senyawa hidrokarbon tersebut 56, tentukanlah rumus empiris dan rumus molekul senyawa tersebut ! ( Diketahui : Ar C = 12, H = 1) Jawab : Diketahui : massa karbon = 85,7 % Mr senyawa hidrokarbon = 56 Ditanya : rumus empiris dan rumus molekul % massa hidrogen = 100 % - 85,7% = 14,3 % Perbandingan mol C : mol H = (% massa C : Ar C) : (% massa H : Ar H) = (85,6: 12) : ( 14,3 : 1) = 7, 14 : 14,3 =1:2 Jadi, rumus empirisnya = (CH2)n Mr (CH2)n = 56 ( 1 x Ar C + 2 x Ar H)n = 56 {( 1 x 12) + (2 x 1)}n = 56 (12 + 2)n = 56 14 n = 56 n = 56 : 14 n=4 jadi rumus molekulnya = (CH2)4 = C4H8 2. Benzena mempunyai rumus empiris CH, dan massa molarnya adalah 78. Tentukan rumus molekulnya, jika diketahui Ar C = 12, H = 1. Jawab : Diketahui : Mr CH = 78 (CH)n = 78 {( 1 x Ar C) + ( 1 x Ar H)}n = 78 {(1 x 12) + ( 1 x 1 )}n = 78 (12 + 1)n = 78
13 n = 78 n = 78 : 13 n=6 Jadi rumus molekulnya (CH)6 = C6H6
Anda mungkin juga menyukai
- A. Tata Nama SenyawaDokumen4 halamanA. Tata Nama SenyawaruberubyBelum ada peringkat
- Daftar Nama AsamDokumen1 halamanDaftar Nama AsamGusti M. Dimas FadhlikaBelum ada peringkat
- Senyawa Turunan AlkanaDokumen23 halamanSenyawa Turunan AlkanaanzasmaraBelum ada peringkat
- Ikatan Kimia (VI & VII)Dokumen64 halamanIkatan Kimia (VI & VII)IkaBelum ada peringkat
- 09 Daftar Pustaka Dan Kunci JawabanDokumen14 halaman09 Daftar Pustaka Dan Kunci JawabanLuckyan Syah31% (16)
- Soal PSMP Kimia RachmaDokumen10 halamanSoal PSMP Kimia RachmaImron Suryawan100% (2)
- Soal Osn 2019 KimiaDokumen21 halamanSoal Osn 2019 Kimiaviona sartika dewiBelum ada peringkat
- Analisis MOdel PembelajaranDokumen6 halamanAnalisis MOdel PembelajaranRivellia KumalaBelum ada peringkat
- Soal PG Kimia 12Dokumen32 halamanSoal PG Kimia 12faizalghazyBelum ada peringkat
- Soal Hitunagn LCCDokumen4 halamanSoal Hitunagn LCCNovianti HABelum ada peringkat
- Soal NoDokumen24 halamanSoal NoWahyu Herry KurniawanBelum ada peringkat
- Logam Alkali Dalam Sistem PeriodikDokumen25 halamanLogam Alkali Dalam Sistem PeriodikAni WijayantiBelum ada peringkat
- KromosomDNADokumen16 halamanKromosomDNAdwita ramadantiBelum ada peringkat
- Contoh Soal Stoikiometri.Dokumen13 halamanContoh Soal Stoikiometri.La LaumaBelum ada peringkat
- IKATAN_KOVALENDokumen5 halamanIKATAN_KOVALENFILDZAH ADANYBelum ada peringkat
- Penamaan Iupac Dan Trivial Ester Kel.4Dokumen13 halamanPenamaan Iupac Dan Trivial Ester Kel.4IlaBelum ada peringkat
- Contoh Soal Kimia KarbonDokumen6 halamanContoh Soal Kimia Karbonfirdaus mardhanBelum ada peringkat
- MujiiiiiiiiiiiihhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhyyyyyyyytttttttttttttttttDokumen17 halamanMujiiiiiiiiiiiihhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhhyyyyyyyytttttttttttttttttLuthfiaRosyida0% (1)
- ASAM KUATDokumen5 halamanASAM KUATroslainileni100% (1)
- GEN-X-KROMOSOMDokumen44 halamanGEN-X-KROMOSOMRoihan Iqbal100% (1)
- Laju ReaksiDokumen4 halamanLaju ReaksiMelin GintingBelum ada peringkat
- CARA_MENGGUNAKAN_TISU_BASAHDokumen4 halamanCARA_MENGGUNAKAN_TISU_BASAHBank Yossy Woluslawe100% (1)
- Soal MudahDokumen4 halamanSoal MudahMala Audia SariBelum ada peringkat
- Hielmy Ihsan Fauzi - Farmasi2D - Identifikasi Fenol & Eter PDFDokumen15 halamanHielmy Ihsan Fauzi - Farmasi2D - Identifikasi Fenol & Eter PDFHielmy IhsanfauziBelum ada peringkat
- ADokumen2 halamanAFitriana ZulfaBelum ada peringkat
- DERAJAT DISOSIASIDokumen1 halamanDERAJAT DISOSIASIDiah UtamiBelum ada peringkat
- Teori RelativitasDokumen23 halamanTeori RelativitasDesy ChBelum ada peringkat
- TERMOKIMIADokumen19 halamanTERMOKIMIAmardiantoo rabangBelum ada peringkat
- Soal Try Out 2012Dokumen13 halamanSoal Try Out 2012Fauzan Romadonie100% (1)
- Soal Dan Jawaban Osn Kimia TK Kab Kota Tahun 2012 Seri CDokumen14 halamanSoal Dan Jawaban Osn Kimia TK Kab Kota Tahun 2012 Seri CHanami AsriBelum ada peringkat
- Edisi Covid SOAL & Solusi SET7Dokumen6 halamanEdisi Covid SOAL & Solusi SET7Lucas JerichoBelum ada peringkat
- Pre-Test OSN 10Dokumen4 halamanPre-Test OSN 10indra nurhidayatBelum ada peringkat
- Tata Nama Aldehid dan KetoneDokumen2 halamanTata Nama Aldehid dan KetoneNur WahyuniBelum ada peringkat
- SOALDokumen21 halamanSOALMona WulansariBelum ada peringkat
- Distribusi MatematikaDokumen9 halamanDistribusi MatematikaJohn AlfarobiBelum ada peringkat
- Rangkuman RedoksDokumen3 halamanRangkuman RedoksRahayu Maulida R50% (2)
- Sel Elektro KimiaDokumen35 halamanSel Elektro KimiaTukang MakeupBelum ada peringkat
- Modul e 11.5Dokumen21 halamanModul e 11.5dnd offi0% (1)
- 2Dokumen5 halaman2Ikrom FawzyBelum ada peringkat
- KimiaDokumen86 halamanKimiafiscyaBelum ada peringkat
- Ion KompleksDokumen12 halamanIon KompleksEka Septiani PutriBelum ada peringkat
- FRANSIUMDokumen12 halamanFRANSIUMUfi DamayantiBelum ada peringkat
- Soal Kimia Fisik RistinaDokumen6 halamanSoal Kimia Fisik Ristinaris tinaBelum ada peringkat
- Soal Hitungan Titrasi Asam Basa 2Dokumen16 halamanSoal Hitungan Titrasi Asam Basa 2keyna batrisia100% (1)
- ELEKTORLISIS NaCl & KIDokumen10 halamanELEKTORLISIS NaCl & KIainunBelum ada peringkat
- Soal Ujian Madrasah KIMIA 2019-2020Dokumen9 halamanSoal Ujian Madrasah KIMIA 2019-2020agussujadmikoBelum ada peringkat
- Titrasi Asam Lemah Dengan Basa KuatDokumen6 halamanTitrasi Asam Lemah Dengan Basa KuatGusty DyanoBelum ada peringkat
- Optimal untuk Dokumen Kimia OrganikDokumen5 halamanOptimal untuk Dokumen Kimia OrganikJessica Satrio100% (1)
- Kesetimbangan ReaksiDokumen15 halamanKesetimbangan ReaksiHendry HalimBelum ada peringkat
- Kimia Enc Encoded WrKOf4srFPu5slkd6wYF6d5anwWJEdBlu78bY3pNCUvrcu-8APqmUvMPFqRDokumen5 halamanKimia Enc Encoded WrKOf4srFPu5slkd6wYF6d5anwWJEdBlu78bY3pNCUvrcu-8APqmUvMPFqRFathur RahmanBelum ada peringkat
- Cara Penamaan Asam Karboksilat Menurut IUPAC dan Sistem TrivialDokumen5 halamanCara Penamaan Asam Karboksilat Menurut IUPAC dan Sistem TrivialStefanus Agustus JoniBelum ada peringkat
- LATIHAN SOAL SUB BAB B (Aturan Pencacahan Dan Peluang) No.9Dokumen3 halamanLATIHAN SOAL SUB BAB B (Aturan Pencacahan Dan Peluang) No.9Erni AriesBelum ada peringkat
- Soal Kimia Unsur Dan PembahasannyaDokumen17 halamanSoal Kimia Unsur Dan PembahasannyasyenaBelum ada peringkat
- Senyawa KompleksDokumen32 halamanSenyawa KompleksRoyBelum ada peringkat
- Rumus Empiris dan MolekulDokumen8 halamanRumus Empiris dan MolekulPemberdayaan Kesejahteraan Keluarga PontianakBelum ada peringkat
- Rumus MolekulDokumen9 halamanRumus MolekulasmaBelum ada peringkat
- Stoikiometri SenyawaDokumen3 halamanStoikiometri SenyawazainabBelum ada peringkat
- Bab 8. Rumus Empiris OlDokumen3 halamanBab 8. Rumus Empiris OlLina AndrianiBelum ada peringkat
- Rumus EmpirisDokumen45 halamanRumus EmpirisAde Ilham Khaled100% (1)
- Rumus Empiris dan MolekulDokumen3 halamanRumus Empiris dan MolekulChristmas TambotoBelum ada peringkat