Obtención de sulfato de amonio
Diunggah oleh
Giovanny Tapia CarlosJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Obtención de sulfato de amonio
Diunggah oleh
Giovanny Tapia CarlosHak Cipta:
Format Tersedia
UNIVERSIDAD NACIONAL AUTNOMA DE MXICO ESCUELA NACIONAL COLEGIO DE CIENCIAS Y HUMANIDADES PLANTEL ORIENTE (034) CICLO BACHILLERATO REA
DE CIENCIAS EXPERIMENTALES ASIGNATURA: QUMICA III (1507) REPORTE DE LA PRCTICA EXPERIMENTAL NMERO 03 OBTENCIN DE SULFATO DE AMONIO (NH4)2SO4 Integrantes del equipo MARIN NAJERA TANIA MRQUEZ PREZ LUIS TAPIA CARLOS GIOVANNY GRUPO: 531 EDIFICIO: SILADIN LABORATORIO: CREA
PROFESOR: ISAAS LVAREZ HERNNDEZ QUINTO SEMESTRE CLAVE DEL SEMESTRE: 2013-1 FECHA DE REALIZACIN: 31/AGOSTO/2012 FECHA DE ENTREGA: 14/SEPTIEMBRE/2012 CICLO ESCOLAR: 2012-2013
Apartado Introduccin Objetivo... Hiptesis.. Marco Terico Material y Sustancias Metodologa Esquemas... Clculos qumicos. Observaciones... Conclusiones... Cuestionario. Referencias.. Anexos...
Pgina 3-4 5 5 6-8 9 10 11 12-16 17 18 19-20 21 21
Amigo lector el presente reporte experimental tiene como finalidad conocer y valorar la importancia de la Industria Qumica de los fertilizantes, por la obtencin de un fertilizante obtenido a nivel laboratorio escolar, pues es un producto de gran impacto industrial, debido a que satisface de forma indirecta una de las necesidades primordiales de la poblacin humana: la alimentacin. Tambin a gran escala tiene impacto socioeconmico en la economa del pas (PIB), es por eso que aqu hacemos un apartado y argumentamos sobre la importancia de que Mxico produzca fertilizantes como un ingreso econmico que favorezca el desarrollo de la economa social. A continuacin redactaremos en forma breve y clara el contenido de nuestro reporte, si observan detalladamente el ndice que se encuentra a la pgina anterior se darn cuenta que el reporte est dividido en trece apartados esto con la intencin de que el lector identifique las partes de un reporte experimental adems de que la lectura que realice se le haga ms amena y comprensible. En las siguientes pginas se encuentran redactados los objetivos que pretendemos cumplir al finalizar la prctica, los objetivos fueron determinados en la clase por el grupo, adems se encuentran anexados los objetivos personales del equipo que tienen como principal meta reconocer las reacciones que se llevan a cabo en la elaboracin de un fertilizante en este caso el Sulfato de Amonio (NH4)2SO4. Es de suma importancia la elaboracin de un juicio de probabilidad de lo que pasara al finalizar la prctica, a este juicio de probabilidad lo denominamos hiptesis, esta deber de ser verdadera o en su caso falsa y lo comprobaremos cuando trminos la prctica. Despus encontramos el marco terico como un sustento de la informacin desarrollada, los materiales y sustancias que son indispensables que se lleva a cabo exitosamente la prctica, as como la metodologa empleada. Es importante mencionar que en reporte se integran los clculos qumicos, con lo que podemos afirmar que nuestro reporte es de carcter cualitativo y cuantitativo, los clculos fueron realizados en el laboratorio CREA con la ayuda de nuestro profesor. Las ltimas partes del informe constan de las conclusiones, las referencias donde pueden consultar ms informacin adems de los anexos como una forma de apoyo.
Ahora bien, la prctica es muy valiosa puesto que se lograron afirmar conceptos bsicos como mezcla, cidos, bases, reaccin de neutralizacin, entre otras. No obstante y al parecer lo ms importante para el equipo fue el ahora conocer que una reaccin qumica estn en indeterminada relacin con una serie de clculos, este es sin dunda el conocimiento adquirido ms significativo como producto de la realizacin de nuestro experimento el conocer cunticamente el comportamiento de los reactivos y productos de una reaccin qumica esto como ya mencionamos anteriormente se ver ms adelante. Lo que queremos de conocer al finalizar la prctica es lgicamente visualizar el producto obtenido que es el Sulfato de Amonio, Cmo es?, determinar su color su forma su textura y de la misma manera identificar la cadena productiva que se lleva a cabo para la obtencin de dicho fertilizante. Como parte de nuestra introduccin contestaremos a nuestro criterio la siguiente pregunta: Qu importancia tiene la industria de los fertilizantes en Mxico? Es de suma importancia, tenemos que considerar que Mxico es un pas que produce a gran escala las materias primas necesarias para la elaboracin de fertilizantes. Esta elaboracin de fertilizantes ya sean fosfatados, nitrogenados, etc., tienen su importancia en el desarrollo de la vegetacin que aporta a la nacin los alimentos que a su vez nos proporcionan los nutrientes esenciales para realizar nuestras actividades da con da y ayudar al desarrollo de nuestro pas, esto aclaro lo respondemos en trminos microeconmicos que ayudan al desarrollo de una poblacin sea cual sea. Si trasladamos la pregunta a trminos de beneficio de la economa nacional podemos decir sencillamente que la importancia de producir fertilizantes a gran escala por medio de la industria radica en el impacto de la economa del pas es decir, en el producto interno bruto (PIB), lo explicamos a partir de una analoga singular si producimos a gran escala y por el libre comercio, podemos exportar nuestro producto a diferentes sedes internacionales y con ello obtener un ingreso o fuente de riqueza esto a futuro generara el desarrollo de la industria qumica de fertilizantes en Mxico y por ende la acumulacin originaria de un capital de origen extranjero. Esperamos que al termino de que tu amigo lector leas con asombro nuestro reporte adquieras nuevos conocimientos, aclares dudas o simplemente que a partir de tu curiosidad crees cultura bsica de este tema.
Obtener a nivel laboratorio un fertilizante qumico de uso cotidiano. Conocer el tipo de reaccin que se efecta entre un cido y una base. Valorar los materiales y sus usos dentro de la actividad experimental adems de manejarlos con precaucin. Utilizar el fertilizante obtenido de una forma positiva.
Mesa del laboratorio CREA
Si el Sulfato de Amonio se obtiene a partir de la reaccin qumica entre Hidrxido de Amonio y Acido Sulfrico, y teniendo en cuenta que los reactivos estn en estado de agregacin liquida, entonces el Sulfato de Amonio lo obtendremos en el mismo estado de agregacin a sus reactivos.
Si bien de lo que hablaremos en esta ocasin es de la obtencin de una sal (NH 4)2SO4 es preciso que mencionemos algunos temas necesarios y adems elementales para la buena comprensin de este experimento. Por ejemplo, podramos preguntarnos cules son los elementos que intervienen en la obtencin del Sulfato de Amonio (y no solo las sustancias sino tambin las condiciones)? Qu importancia tiene este compuesto en nuestra vida cotidiana aunque no nos demos cuenta? Cules son los usos en la industria? Por qu es el fertilizante ms producido en nuestro pas? A continuacin presentamos informacin bsica del compuesto qumico que se pretende obtener: Nombre Qumico: Sulfato de Amonio Otros Nombres: Sulfato de Amoniaco, Sal de Azufre y Amonio Frmula Qumica: (NH4)2SO4 Peso Molecular (g/mol): 132.14 Presentacin Fsica: Cristales slidos finos de color blanco, beige o grisceo. Tamao de partcula: 0.50 a 0.85 mm Solubilidad en agua, a 20 C (100 g/100 ml): 76 gr/100 ml de agua a 25 C pH en solucin al 10%: 4.0 6.0 Unidades Densidad Aparente (Kg/m3): 960 1,040 Kg/m3 ndice de Salinidad: 69 Humedad Relativa Crtica (a 30 C): 79% Acidez equivalente a Carbonato de Calcio: 110 partes de Carbonato de Calcio por 100 partes de SAM. Ahora despus de conocer algunas propiedades de nuestra sal procedemos a explicar la cadena productiva para la obtencin del fertilizante. Obtencin de Sulfato de Amonio a nivel industrial: Obtenemos el Hidrogeno a partir de a reaccin de metano y agua:
Para producir amonio hacemos reaccionar nitrgeno diatnico con hidrogeno:
Esta es una forma de obtener sulfito:
Cabe mencionar que el gas SO2 es fundamental para obtener cido sulfrico
Obtengamos a continuacin el anin Sulfato
La forma ms sencilla de obtener acido sulfrico es la siguiente:
Finalmente hacemos reaccionar 2 moles de amonio con 1 mol de acido sulfrico para producir el fertilizante Sulfato de amonio:
El sulfato de amonio se obtiene por interaccin del amonaco con el cido sulfrico. Para la produccin de nitrato de amonio (salitre amoniacal) no se necesita ninguna materia prima complementaria adems de lo que producen las fbricas de productos nitrogenados. El sulfato de amonio presenta buenas propiedades fsicas, pero contiene poco nitrgeno. Hablando a modo de fertilizante el Sulfato de Amonio es el de mayor produccin en nuestro pas, tan solo en el 2005 fue de 1, 120,000.00 TM Produccin Nacional Sulfato de Amonio 2004 Planta Univex (Salamanca) Planta Agrogen (Quertaro) Planta Fertirrey (Torren) Planta Fegusa (Guadalajara) Planta Fesur (Minatitln) 300,000 TM 300,000 TM 220,000 TM 140,000 TM 160,000 TM
Precios promedios nacionales (Urea 46%, DAP, KCL y Sulfato de Amonio) (2011)
Fuente: Sistema de Informacin de Precios de los Insumos y Factores Asociados a la Produccin, 2011. Ministerio de Agricultura y Desarrollo Rural Corporacin Colombia Internacional. Clculos CCI
TEORIA DE ARRENIUS Arrhenius defini los cidos como electrolitos que contienen hidrgeno y que, disueltos en agua, producen una concentracin de iones hidrgeno o protones, H +, mayor que la existente en el agua pura. Del mismo modo, Arrhenius defini una base como una sustancia que disuelta en agua produca un exceso de iones hidrxido, OH - (tambin llamados aniones hidroxilo). La teora de Arrhenius ha sido objeto de crticas. La primera es que el concepto de cido se limita a especies qumicas que contienen hidrgeno y el de base a las especies que contienen iones hidrxido. La segunda crtica es que la teora solo se refiere a disoluciones acuosas, cuando en realidad se conocen muchas reacciones cido-base que tienen lugar en ausencia de agua.
H2SO4 HAc Base de Arrhenius: NaOH cidos de Arrhenius: {
HSO4Ac Na+
+ H+ + H+ + OH-
Material Soporte universal Tela de asbesto Pinza de mariposa Bureta volumtrica Matraz ERLENMEYER 200 ml. 2 vasos de precipitados de 250 ml. Probeta graduada 100 ml. Anillo metlico Agitador Pipeta de 5 ml. Balanza digital Encendedor Bata 2 mecheros de BUNSEN Esptula Jeringa graduada de 5ml. Detergente para lavar fibra, escobillones.
Sustancias cido Sulfrico (H2SO4) Fenolftalena Agua destilada (H2O) Hidrxido de Amonio NH4OH
Hacer una mezcla de 1.56 ml de Acido Sulfurico (H2 SO4 ) + 48.4 ml de H2O (primero el agua se mide en la probeta graduada y luego se deposita en el vaso de precipitados, despus con ayuda de la pipeta mide 1.56 ml de cido Sulfurico posteiormente vertelos en el vaso de precipitados notese la formacin de una solucin acuosa.
Medir 10 mililitros de la disolucin acuosa de la mezcla anterior y depositarla en el matraz ERLENMEYER,posteriormente agregar 3 gotas de Fenolftaleina.
Medir 10 ml de Hidroxido de Amonio (NH4OH) con ayuda de la pipeta y depositara en la bureta.
Despus vaciar el hidrxido de amonio en el matraz que contiene la disolucin anteriormente mencionada y observar la reaccin.
Luego, al comprobar que no ocurre ninguna reaccin, volver a adicionar 1.8 de hidrxido de amonio.
Despues de que la reaccion se efectua(notese la presencia de la reaccin a partir del cambio de color en la solucin del vaso de precipitados reaccin de neutralizacin), sometala a un cambio de temperatura en el mechero e bunsen, esperar a que se vapore todo el liquido y finalmente obtendra un solido blanquesino este es el fertilizante obtenido.
10
Tres compuestos indispensables para el desarrollo de la practica el hidrxido de amonio, el acido sulfrico y la fenolftalena
Mezcla de agua con cido sulfrico
Producto obtenido fertilizante
Calentamiento de cido sulfrico e hidrxido de amonio
Como producto final y apoyando la alimentacin el fertilizante fue agregado a una planta de chiles de rbol.
11
Clculo del peso molecular promedio (P.M.) H2SO4
98
Peso molecular promedio de H2SO4
NH4OH
35
Peso molecular promedio de HH4OH
H2O 18 Peso molecular promedio de H2O
(NH4)2SO4
132
Peso molecular promedio de (NH4)2SO4
12
Clculo de pesos equivalentes H2SO4 (cido) P.E H2SO4 P.E H2SO4= NH4OH (Base)
(NH4)2SO4 (Sulfato)
H2O
Ecuacin de la reaccin
Se cumple la ley de la conservacin de la materia
13
Porcentaje en peso y densidad del cido y de la base cido 86 % masa y densidad Base 30 % masa y densidad Para el cido
Para la base
Clculo de la normalidad del cido y de la base
[ [ ] N1 del cido
14
Para el experimento que se realizo fue necesario preparar una solucin 1N de cido sulfrico.
PROBLEMA Cuntos ml de H2SO4 se deben medir para preparar una solucin de VT (50ml) de cido a una concentracin de 1N? DATOS V1= x N1= V2= 0.05 L FRMULA
SUSTITUCIN
Del clculo anterior se tomaron 10 ml de cido 1N ya preparados Cuntos ml de NH4OH se requieren? Datos V1= 0.01 L N1= V2= x FRMULA
SUSTITUCIN
15
El equivalente qumico es una constante entre reactivos y productos
Datos V= 1.3 ml de NH4OH que se supone que fue gastado N= ( )
( ) Clculo de rendimiento de reaccin
16
Cuando mezclamos H2SO4 con el agua H2O el matraz se pone caliente. Solucin acidulada (disociacin acuosa). Teora de Arrhenius.
Tambin observamos que al agregarle a la mezcla de cido Sulfrico (H2SO4) y agua qumicamente pura (H2O), unas gotas de fenolftalena no pasa a simple vista absolutamente nada, sin embargo ocurri un fenmeno totalmente diferente cuando agregamos Hidrxido de amonio al cido, es decir, la fenolftalena logra pintar las bases las tie a un color rosa, fenmeno que reitero no pasa si la fenolftalena se agrega a un cido. No podemos dejar de mencionar que ocupamos solamente el 11.8 ml de Hidrxido de Amonio de los 15 ml que yacan en la bureta volumtrica y de acuerdo a nuestros calculo tericos solamente tenamos que ocupar 1.30 ml de NH4OH es un dato digno de analizar pues notoriamente excedimos la cantidad que requeramos para la obtencin de nuestro fertilizante. Lo mas impresionante a consideracin del equipo es la forma en cmo se obtuvo el Sulfato de Amonio tenamos dos lquidos que cambiaban su temperatura debido al sometimiento de calor aportado por un mechero de bunsen, a continuacin comenz a evaporarse toda el agua y comenzaron a surgir pequesimas partculas de un tipo de cristal slido cristalino blanquecino y grisceo adems la cantidad de fertilizante obtenido fue mnima alcanzamos apenas el 0.1 g de Fertilizante y que de acuerdo a nuestros clculos tericos tendramos que obtener como producto final 0.66 g de Sulfato de Amonio Notamos que, al menos en nuestro caso, al evaporarse las sustancias se reduca la cantidad a comparacin de lo que al principio haba. Lo que nos llevo a preguntarnos cuanto hablando en cantidad de sustancias y cuanto presupuesto gastara la industria para hacer toneladas de fertilizante.
17
La fenolftalena es capaz de teir las bases a color rosa debido: primero a que la fenolftalena es un cido dbil que pierde cationes de hidrogeno en solucin. La molcula de fenolftalena es incolora, en cambio el anin derivado de la fenolftalena es de color rosa, cuando se aade a una base la fenolftalena, los iones de equilibrio se desplazan hacia la derecha, lo que conduce a mas ionizacin como los iones hidrgenos (H+1) se eliminan, en otras palabras con un lenguaje ms sencillo decimos que cuando se agrega a una base fenolftalena, siendo esta inicialmente incolora pierde iones (H+1) formndose el anin y haciendo que tome coloracin roja. Por otra parte ocupamos 11.8 ml de Hidrxido de Amonio para efectuar la reaccin qumica y tericamente nos marcaba que gastaramos 1.33 ml de Hidrxido de Amonio esto puede deberse a las concentraciones a las que se encontraban los reactivos esta fue la mejor propuesta planteada por el equipo al intentar dar una explicacin lgica al enigma. Ahora bien nuestro fertilizante qumico es el producto de una reaccin de neutralizacin entre un acido y una base en este caso hicimos reaccionar cido Sulfrico con Hidrxido de Amonio, obtuvimos en el lado de los productos al Sulfato de Amonio y Agua en vapor por lo que comprobamos una teora que nos dice que una reaccin de neutralizacin entre un cido y una base forzosamente produce una sal ms agua. Otra ley que logramos comprobar fue la ley de la conservacin de la materia puesto en que la misma reaccin obtuvimos el mismo peso molecular promedio en los reactivos y en los productos esto se observa claramente en el apartado de este informe experimental que son los clculos qumicos. Para el caso de nuestra hiptesis esta resulto ser falsa puesto que afirmbamos antes de hacer la prctica que el Sulfato de Amonio lo obtendramos en estado de agregacin liquida por ser sus reactivos lquidos lo que no es correcto puesto que obtuvimos finsimos slidos cristalinos de color blanco, cuantitativamente fue 0.1 g del fertilizante de 0.66 g que tericamente tenamos que obtener esto debido a que no dejamos que el proceso de calentamiento se llevara a cabo mas tiempo. Finalmente decimos que nuestra sal cuaternaria es un ingreso econmico muy importante en la economa del pas en la alimentacin y su produccin en toneladas favorece el producto interno bruto de la nacin, el equipo utilizo el fertilizante para agregarlo a un planta de chiles de rbol, esperamos resultados.
18
1. Elabora un cuadro sinptico sobre la clasificacin de los fertilizantes en orgnicos e inorgnicos.
Excremento Residuos de comida Composta Basura
Orgnicos
Fertilizantes Inorgnicos
Fosfatados Nitrogenados Potsicos Amoniacales
2. A qu categora de reaccin pertenece la obtencin de Sulfato de Amonio que se efectu durante la actividad experimental? Dar la ecuacin qumica balanceada. R= Reaccin de neutralizacin donde obtuvimos como productos el sulfato de Amonio que es una sal cuaternaria mas el agua.
Nota: el 2 que aparece en la frmula del Sulfato de Amonio es un subndice, no lo tomen como coeficiente. 3. El fertilizante obtenido en el laboratorio corresponde a una mezcla o a un compuesto? R= Es un compuesto, aunque no lo podemos comprobar el equipo se encargo de limpiar todas las impurezas que haban en los materiales que usamos en el desarrollo de la prctica limpindolos con agua destilada pues al ser qumicamente pura no contiene minerales o mismas impurezas que hayan afectado para el producto que en nuestro caso fue la sal cuaternaria.
19
4. Dar la frmula qumica y el nombre de un fertilizante fosfatado, potsico y nitrogenado. Fertilizante Nitrogenado: Nitrato de Sodio Fosfatado: Superfosfato triple Potsico: Cloruro de Potasio Frmula qumica NaNO3 Ca(H2PO4)2 KCL
5. Cul es la frmula qumica y el nombre IUPAC del fertilizante intermediario para obtener Sulfato de Amonio a nivel industrial? R= Hidrxido de Amonio de frmula qumica NH4OH
20
http://www.isquisa.com/site/files/productos/Sulfato_de_Amonio.pdf (14 de septiembre 2012 a las 3:00 a.m)
http://fresno.cnice.mecd.es/fgutie6/quimica2/ArchivosHTML/Teo_4_princ.htm
(Revisadas a las 12:44 am el 9/09/2012) Alcntara B. Qumica Inorgnica Moderna, Unidad 9, paginas 562-569. Editorial ECLASA, MEXICO. Ao 1972
Sistema de Informacin de Precios de los Insumos y Factores Asociados a la Produccin, 2011. Ministerio de Agricultura y Desarrollo Rural Corporacin Colombia Internacional. Clculos CCI
Siguientes juegos de copias: Fertilizantes qumicos: productos estratgicos Obtencin de Sulfato de Amonio
21
Anda mungkin juga menyukai
- Análisis de Alimentos. Fundamentos y TécnicasDari EverandAnálisis de Alimentos. Fundamentos y TécnicasBelum ada peringkat
- Practica 9 Anetol 1Dokumen6 halamanPractica 9 Anetol 1Cora SuárezBelum ada peringkat
- Desarrollo de procesos para obtener ácido fosfórico grado fertilizanteDokumen172 halamanDesarrollo de procesos para obtener ácido fosfórico grado fertilizanteLucia Medina PimentelBelum ada peringkat
- Estudio técnico para producir SAMDokumen32 halamanEstudio técnico para producir SAManon_483991106Belum ada peringkat
- Práctica 11 y 12 Determinación de Calcio y MagnesioDokumen8 halamanPráctica 11 y 12 Determinación de Calcio y MagnesiomariaBelum ada peringkat
- Reporte Sistema Ternario Acido Acetico Cloroformo y AguaDokumen5 halamanReporte Sistema Ternario Acido Acetico Cloroformo y AguaFelipe Vilches0% (1)
- Estructura Cristalina InformeDokumen16 halamanEstructura Cristalina InformeCinthia Rassel Gutierrez MamaniBelum ada peringkat
- Informe Química Analítica - Determinación de ZincDokumen5 halamanInforme Química Analítica - Determinación de ZincDavid PabloBelum ada peringkat
- Hidrocarburos HeterociclosDokumen9 halamanHidrocarburos HeterociclosShirlly Leyton MercadoBelum ada peringkat
- Análisis Hierro Mineral Titulación DicromatoDokumen18 halamanAnálisis Hierro Mineral Titulación DicromatoYonmaycol Adrian Loza Lluque100% (1)
- Informe 1 - Cromatografia en PapelDokumen5 halamanInforme 1 - Cromatografia en PapelAlejandro QuilcaBelum ada peringkat
- Preparacion de Acido BoricoDokumen5 halamanPreparacion de Acido BoricoWilson David Enriquez100% (1)
- Informe 2 - ALCALINIDAD DEL AGUA POTABLEDokumen4 halamanInforme 2 - ALCALINIDAD DEL AGUA POTABLEFelipe ValenciaBelum ada peringkat
- Practica de Laboratorio 1 Solubilidad de Compuestos OrganicosDokumen18 halamanPractica de Laboratorio 1 Solubilidad de Compuestos OrganicosNatRodriguezBelum ada peringkat
- Guia Preparacion Slns BufferDokumen12 halamanGuia Preparacion Slns BufferCristian DiazBelum ada peringkat
- Informe de Quimica de Acidos CarboxilicosDokumen4 halamanInforme de Quimica de Acidos CarboxilicosRamirez JuanBelum ada peringkat
- Obtención de sulfato ferroso heptahidratado: propiedades químicasDokumen6 halamanObtención de sulfato ferroso heptahidratado: propiedades químicasZabala DanielBelum ada peringkat
- Proyecto Alcalinidad y Dureza Total 1.0Dokumen32 halamanProyecto Alcalinidad y Dureza Total 1.0ErickusBelum ada peringkat
- Diferencias entre hidrocarburos aromáticos y alifáticosDokumen5 halamanDiferencias entre hidrocarburos aromáticos y alifáticosThe NightmareBelum ada peringkat
- Articulo Del Polimorfismo Del ChocolateDokumen9 halamanArticulo Del Polimorfismo Del ChocolateMarjhory AylingBelum ada peringkat
- Determinacion de Carbonatos y BicarbonatosDokumen4 halamanDeterminacion de Carbonatos y BicarbonatosEstebanBelum ada peringkat
- Cómo usar y qué beneficios tiene el carbonato de sodioDokumen5 halamanCómo usar y qué beneficios tiene el carbonato de sodiomauricio rodriguezBelum ada peringkat
- Informe Lab Analitica N6vol Por RetrocesoDokumen10 halamanInforme Lab Analitica N6vol Por RetrocesoLuisReáteguiQuirozBelum ada peringkat
- Proyecto Diseño de Una Planta de Metanol A Partir Del Gas Natural PQMC Sacta UmssDokumen3 halamanProyecto Diseño de Una Planta de Metanol A Partir Del Gas Natural PQMC Sacta Umsspedro encinasBelum ada peringkat
- Práctica5.2Reacciónde EsterificaciónDokumen3 halamanPráctica5.2Reacciónde Esterificaciónedison100% (1)
- Informe de Laboratorio (Obtencion de Etanol A Partir de Lactosuero)Dokumen7 halamanInforme de Laboratorio (Obtencion de Etanol A Partir de Lactosuero)María Juliana Rojas Moncada0% (1)
- Practica de Laboratorio de Alcoholes 2018-IIDokumen9 halamanPractica de Laboratorio de Alcoholes 2018-IIYajaira Castillo HuamanBelum ada peringkat
- Informe Grupal-Cristalizacion de EucaliptolDokumen16 halamanInforme Grupal-Cristalizacion de EucaliptolCarolinaMedranoBelum ada peringkat
- SaponificacionDokumen21 halamanSaponificaciontania100% (1)
- Introduccion y Reaccion XantoproteicaDokumen14 halamanIntroduccion y Reaccion XantoproteicaJovanJiEunMiBelum ada peringkat
- Laboratorio de Química Orgánica - Cristalización y Recristalización (Juan Pabon)Dokumen5 halamanLaboratorio de Química Orgánica - Cristalización y Recristalización (Juan Pabon)Santiago SanchezBelum ada peringkat
- Aplicaciones Del Anhidrido MaleicoDokumen61 halamanAplicaciones Del Anhidrido MaleicoEduardo Elias CastellanosBelum ada peringkat
- LABORATORIO 11 (Complejos)Dokumen16 halamanLABORATORIO 11 (Complejos)jeanette_ih71% (21)
- Analisis de Cationes Del Tercer GrupoDokumen7 halamanAnalisis de Cationes Del Tercer GrupoYessenia AlejoBelum ada peringkat
- Informe de Practica #3Dokumen24 halamanInforme de Practica #3Natalia hmBelum ada peringkat
- Determinación de cationes intercambiables sodio y potasio en suelosDokumen5 halamanDeterminación de cationes intercambiables sodio y potasio en suelosYoon Marlon ZBelum ada peringkat
- Materias Primas Renovables en La Industria QuimicaDokumen3 halamanMaterias Primas Renovables en La Industria QuimicaAyrton Jimenez InfantesBelum ada peringkat
- Preparación de soluciones y titulación de precipitadosDokumen6 halamanPreparación de soluciones y titulación de precipitadosMaria Alejandra Osorio RengifoBelum ada peringkat
- Lab Volumetria Redox Quimica AnaliticaDokumen6 halamanLab Volumetria Redox Quimica AnaliticaMauricio Cruz Castillo100% (1)
- Disolución de muestras sólidasDokumen13 halamanDisolución de muestras sólidasRosember Romero AcuñaBelum ada peringkat
- Termodinamica de Una Celda GalvanicaDokumen3 halamanTermodinamica de Una Celda GalvanicaKadirAmethMontalvoMurilloBelum ada peringkat
- Volumétrica redox: preparación y valoración de permanganatoDokumen10 halamanVolumétrica redox: preparación y valoración de permanganatoingrossBelum ada peringkat
- Fermentacion Lactica EncurtidoDokumen9 halamanFermentacion Lactica EncurtidoDante Fernandez GallardoBelum ada peringkat
- Informe 5Dokumen6 halamanInforme 5Nahomi Mina RomeroBelum ada peringkat
- Determinación gravimétrica del sulfato en yesoDokumen18 halamanDeterminación gravimétrica del sulfato en yesoBryam Smith MolinaBelum ada peringkat
- AminasDokumen9 halamanAminasSabadoGrisBelum ada peringkat
- Analisis de Cobre en Un MineralDokumen5 halamanAnalisis de Cobre en Un MineralBernardo Condori LimacheBelum ada peringkat
- Sintesis de La Fenoftaleina y FluoresceinaDokumen4 halamanSintesis de La Fenoftaleina y FluoresceinaDavid Valencia Carreño100% (1)
- Obtención y Propiedades Del HidrogenoDokumen7 halamanObtención y Propiedades Del HidrogenoAstri RimonBelum ada peringkat
- Informe N°4 Del Laboratorio de Química GeneralDokumen26 halamanInforme N°4 Del Laboratorio de Química GeneralCarlos Mario Conde RodríguezBelum ada peringkat
- Obtencion de LejiaDokumen7 halamanObtencion de Lejiaedgar300950% (2)
- Determinación de Arsénico en MineralesDokumen2 halamanDeterminación de Arsénico en Mineralesjuan ganoza garciaBelum ada peringkat
- Productos de La Fermentación Alcohólica - PaperDokumen20 halamanProductos de La Fermentación Alcohólica - PaperJose Luis RodriguezBelum ada peringkat
- Analisis de Productos Tensoactivos - 1Dokumen8 halamanAnalisis de Productos Tensoactivos - 1Alvaro LLanesBelum ada peringkat
- Titulaciones Con EDTADokumen35 halamanTitulaciones Con EDTARossana100% (1)
- Operaciones Elementales de Analisis Quimico (YESO) 2Dokumen4 halamanOperaciones Elementales de Analisis Quimico (YESO) 2ariel yana morgaBelum ada peringkat
- Informe de Preparación de Soluciones y Titulacion Acido-BaseDokumen16 halamanInforme de Preparación de Soluciones y Titulacion Acido-BaseAndy Espinoza0% (1)
- Imforme Anq - 400 AcidezDokumen10 halamanImforme Anq - 400 Acidezsergio alconBelum ada peringkat
- InformesDokumen39 halamanInformesND ALEXANDRABelum ada peringkat
- Informe Final de Analisis y SintesisDokumen55 halamanInforme Final de Analisis y SintesisEdgar Jamanca AntonioBelum ada peringkat
- Práctica 2 Determinación de La CMCDokumen6 halamanPráctica 2 Determinación de La CMCGiovanny Tapia CarlosBelum ada peringkat
- Experimento 5-Viscosidad de Un Fluido NewtonianoDokumen12 halamanExperimento 5-Viscosidad de Un Fluido NewtonianoGiovanny Tapia CarlosBelum ada peringkat
- AstragalusDokumen1 halamanAstragalusGiovanny Tapia CarlosBelum ada peringkat
- Práctica 1 Determinacion de La Tension SuperficialDokumen8 halamanPráctica 1 Determinacion de La Tension SuperficialGiovanny Tapia CarlosBelum ada peringkat
- Practica 3 Oxidación de MetalesDokumen9 halamanPractica 3 Oxidación de MetalesGiovanny Tapia CarlosBelum ada peringkat
- Practica 10 Isomería GeometricaDokumen7 halamanPractica 10 Isomería GeometricaGiovanny Tapia CarlosBelum ada peringkat
- Practica 2 Cristalización SimpleDokumen7 halamanPractica 2 Cristalización SimpleGiovanny Tapia Carlos0% (1)
- Practica 6 Ley de Enfriamiento de NewtonDokumen12 halamanPractica 6 Ley de Enfriamiento de NewtonGiovanny Tapia Carlos100% (1)
- Práctica 13 Circuitos RCDokumen13 halamanPráctica 13 Circuitos RCGiovanny Tapia CarlosBelum ada peringkat
- Práctica 6 Efecto Del Disolvente en La Manifestación Del Caracter IonicoDokumen7 halamanPráctica 6 Efecto Del Disolvente en La Manifestación Del Caracter IonicoGiovanny Tapia CarlosBelum ada peringkat
- Practica 11 Sisntesis de Benzocaina ProyectoDokumen6 halamanPractica 11 Sisntesis de Benzocaina ProyectoGiovanny Tapia CarlosBelum ada peringkat
- Pract8 ExtracciónDisol OracDokumen8 halamanPract8 ExtracciónDisol OracGiovanny Tapia CarlosBelum ada peringkat
- Sintesis de ProteinasDokumen2 halamanSintesis de ProteinasGiovanny Tapia CarlosBelum ada peringkat
- Brentano, Franz - Sobre El Concepto de VerdadDokumen22 halamanBrentano, Franz - Sobre El Concepto de VerdadDaniel Otero100% (1)
- Backbone Nacional PDFDokumen40 halamanBackbone Nacional PDFmariusBelum ada peringkat
- Megane 2 Grand TourDokumen5 halamanMegane 2 Grand TourMatias Alejandro Ruiz DiazBelum ada peringkat
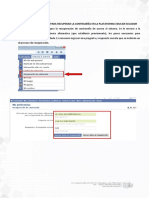
- Manual Recuperar Contraseña de La Plataforma EducarecuadorDokumen6 halamanManual Recuperar Contraseña de La Plataforma Educarecuadorrobertotenezaca100% (1)
- Estudios de planificación urbana ante desastres ZarumillaDokumen412 halamanEstudios de planificación urbana ante desastres Zarumillaeguar100% (1)
- Cuaderno de Trabajo Formador de FormadoresDokumen8 halamanCuaderno de Trabajo Formador de FormadoresOswaldo AvilaBelum ada peringkat
- Palos de la Regla CongaDokumen13 halamanPalos de la Regla CongaEduardo San MiguelBelum ada peringkat
- Responsabilidades de Contador CorregidoDokumen16 halamanResponsabilidades de Contador CorregidoSebastianVegaBelum ada peringkat
- Calendario Laboral 2023 GranadaDokumen1 halamanCalendario Laboral 2023 GranadaElvira MoredaBelum ada peringkat
- Comportamiento organizacionalDokumen31 halamanComportamiento organizacionalNicolas GuillemetBelum ada peringkat
- Bitacora de Ppe Estudiante 9Dokumen17 halamanBitacora de Ppe Estudiante 9Ivonne Lara FrancoBelum ada peringkat
- 3.1.C Acento DiacríticoDokumen4 halaman3.1.C Acento DiacríticoSelma AlbuquerqueBelum ada peringkat
- RVM #049-2022-Minedu PDFDokumen117 halamanRVM #049-2022-Minedu PDFFran Dux Soncco PuchoBelum ada peringkat
- Raz. Mat (01) Habilidad Operativa 95-100Dokumen6 halamanRaz. Mat (01) Habilidad Operativa 95-100cesar vasquez trejoBelum ada peringkat
- Es La Televisión Hispana RacistaDokumen8 halamanEs La Televisión Hispana RacistaJesús GonzálezBelum ada peringkat
- Histologia Del Tejido SanguineoDokumen45 halamanHistologia Del Tejido SanguineoKaren Ramirez100% (2)
- Generación de Contenido 2Dokumen22 halamanGeneración de Contenido 2Jenny VillarrealBelum ada peringkat
- Formato Visita de Zona 176 CDNH PREESCOLARDokumen5 halamanFormato Visita de Zona 176 CDNH PREESCOLARClaudiaMontesBelum ada peringkat
- Presentación de Costos de OperaciónDokumen27 halamanPresentación de Costos de Operaciónmariogut2000Belum ada peringkat
- Brodsky, G. Accion Lacaniana. Entrevista X S.baudiniDokumen3 halamanBrodsky, G. Accion Lacaniana. Entrevista X S.baudiniseirr100% (2)
- Calculo Inst. ElectricasDokumen5 halamanCalculo Inst. ElectricasDavid Rodriguez100% (1)
- XIV Curso de Residentes de Medicina Interna PDFDokumen218 halamanXIV Curso de Residentes de Medicina Interna PDFsoyfenix80% (5)
- Bar RestaurantDokumen88 halamanBar Restaurantrosa alejandra gamez perezBelum ada peringkat
- Gjne1 Soluciones - Odp Do Ćwiczeń PDFDokumen12 halamanGjne1 Soluciones - Odp Do Ćwiczeń PDFAgnieszka DąbekBelum ada peringkat
- Rúbrica Poesía Quinto BasicoDokumen2 halamanRúbrica Poesía Quinto BasicoAndrea Cornejo Gutierrez100% (1)
- Comete Abuso de Autoridad La Jueza Que Habría Autorizado Demoler Un Área Que No Era Parte Del ProcesoDokumen10 halamanComete Abuso de Autoridad La Jueza Que Habría Autorizado Demoler Un Área Que No Era Parte Del ProcesoRolando Roger Aguilar PachecoBelum ada peringkat
- El Tema y Los Subtemas para Tercero de SecundariaDokumen14 halamanEl Tema y Los Subtemas para Tercero de SecundariaAnonymous XpOHZlfFBelum ada peringkat
- Anexo - Protocolo para Atencion de Violencia Escolar en Las IeDokumen7 halamanAnexo - Protocolo para Atencion de Violencia Escolar en Las Ieedgar carrascoBelum ada peringkat
- Catálogo de Investigación Por LíneasDokumen98 halamanCatálogo de Investigación Por LíneasManuel Alejandro AguilarBelum ada peringkat
- CONCLUSIONES y 7Dokumen2 halamanCONCLUSIONES y 7Anggie Adela Sanchez Saldaña100% (1)