Katabolism Prot N A Amino 2013
Diunggah oleh
VeronicateukyuhaeJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Katabolism Prot N A Amino 2013
Diunggah oleh
VeronicateukyuhaeHak Cipta:
Format Tersedia
Katabolisme Protein dan
Asam Amino
Katabolisme Protein dan
Asam Amino
Dr. Heni Yohandini, MSi
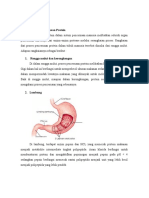
Degradasi protein diet
Lambung Pepsinogen pepsin Menyerang ik peptida residu aa
aromatik, leusin, dan metionin
Getah
pankreas
(usus halus)
kimotripsinogen
kimotripsin
tripsinogen tripsin
Prokarboksipeptidase
A&B karboksipeptidase
A&B
Ik peptida residu aa aromatik
yang mengandung karboksil
Ik peptida dari gugus karboksil
residu arginin dan lisisn
A: semua ik peptida terminal C
B: residu arginin atau lisin terminal
C
2
Getah
pankreas
(usus halus)
kimotripsinogen
kimotripsin
tripsinogen tripsin
Prokarboksipeptidase
A&B karboksipeptidase
A&B
Ik peptida residu aa aromatik
yang mengandung karboksil
Ik peptida dari gugus karboksil
residu arginin dan lisisn
A: semua ik peptida terminal C
B: residu arginin atau lisin terminal
C
Mukosa
usus
Peptidase Degradasi sempurna
AsamAmino
Aspek Penting
Menggambarkan cara nitrogen dari asam
amino diubah menjadi urea
Pada orang dewasa normal, asupan
nitrogen seimbang dengan nitrogen yang
diekskresikan.
Keseimbangan nitrogen positif: nitrogen
yang diasup melebihi nitrogen yang
diekskresikan, terjadi pada masa
pertumbuhan dan kehamilan.
keseimbangan nitrogen negatif: nitrogen
yang dikeluarkan melebihi yang diasup,
dapat terjadi setelah pembedahan, kanker
tahap lanjut, kwashiorkor atau marasmus.
Menggambarkan cara nitrogen dari asam
amino diubah menjadi urea
Pada orang dewasa normal, asupan
nitrogen seimbang dengan nitrogen yang
diekskresikan.
Keseimbangan nitrogen positif: nitrogen
yang diasup melebihi nitrogen yang
diekskresikan, terjadi pada masa
pertumbuhan dan kehamilan.
keseimbangan nitrogen negatif: nitrogen
yang dikeluarkan melebihi yang diasup,
dapat terjadi setelah pembedahan, kanker
tahap lanjut, kwashiorkor atau marasmus.
Aspek Penting
Amonia, yang terutama berasal dari
nitrogen -amino asam amino, sangat
toksik, jaringan mengubah amonia menjadi
nitrogen amida glutamin yang non toksik.
Deaminasi glutamin selanjutnya (di liver)
membebaskan amonia, yang kemudian
diubah menjadi urea yang non toksik.
Jika fungsi liver terganggu, seperti pada
sirosis atau hepatitis, peningkatan kadar
amonia darah menimbulkan tanda dan
gejala klinis.
Amonia, yang terutama berasal dari
nitrogen -amino asam amino, sangat
toksik, jaringan mengubah amonia menjadi
nitrogen amida glutamin yang non toksik.
Deaminasi glutamin selanjutnya (di liver)
membebaskan amonia, yang kemudian
diubah menjadi urea yang non toksik.
Jika fungsi liver terganggu, seperti pada
sirosis atau hepatitis, peningkatan kadar
amonia darah menimbulkan tanda dan
gejala klinis.
Pergantian Protein
Setiap hari, manusia mengganti 12%
total protein tubuhnya, terutama
protein otot.
Laju degradasi protein yang tinggi
terjadi di jaringan yang mengalami
tata-ulang struktur, seperti jaringan
uterus selama kehamilan, jaringan
ekor kecebong selama metamorfosis,
atau otot rangka saat kelaparan.
Setiap hari, manusia mengganti 12%
total protein tubuhnya, terutama
protein otot.
Laju degradasi protein yang tinggi
terjadi di jaringan yang mengalami
tata-ulang struktur, seperti jaringan
uterus selama kehamilan, jaringan
ekor kecebong selama metamorfosis,
atau otot rangka saat kelaparan.
Sekitar 75% asam amino yang
dibebaskan tsb digunakan kembali.
Kelebihan nitrogen membentuk urea.
Karena kelebihan asam amino tidak
disimpan, asam-asam amino yang
tidak segera digunakan membentuk
protein baru akan segera diuraikan
menjadi intermediet amfibolik.
Pergantian Protein
Sekitar 75% asam amino yang
dibebaskan tsb digunakan kembali.
Kelebihan nitrogen membentuk urea.
Karena kelebihan asam amino tidak
disimpan, asam-asam amino yang
tidak segera digunakan membentuk
protein baru akan segera diuraikan
menjadi intermediet amfibolik.
PROTEASE & PEPTIDASE MENDEGRADASI
PROTEIN MENJADI AMINO ACIDS
Kerentanan protein terhadap
degradasi dinyatakan sebagai waktu
paruhnya (t
1/2
).
Waktu paruh protein liver berkisar
antara di bawah 30 menit sampai
lebih dari 150 jam.
Enzim penjaga" memiliki nilai t
1/2
lebih
dari 100 jam, sedangkan enzim
regulatorik kunci 0,52 jam.
Kerentanan protein terhadap
degradasi dinyatakan sebagai waktu
paruhnya (t
1/2
).
Waktu paruh protein liver berkisar
antara di bawah 30 menit sampai
lebih dari 150 jam.
Enzim penjaga" memiliki nilai t
1/2
lebih
dari 100 jam, sedangkan enzim
regulatorik kunci 0,52 jam.
Waktu paruh beberapa protein lain:
Protein yang disekresikan (seperti
antibodi, protease, hormon, dll) half
life-nya rendah (orde dalam jam)
Hemoglobin dan eritrosit lebih lama
(orde dalam bulan)
Protein struktural (seperti histon) tahan
lama
Protein pada lensa mata (kristalin)
stabil
Waktu paruh beberapa protein lain:
Protein yang disekresikan (seperti
antibodi, protease, hormon, dll) half
life-nya rendah (orde dalam jam)
Hemoglobin dan eritrosit lebih lama
(orde dalam bulan)
Protein struktural (seperti histon) tahan
lama
Protein pada lensa mata (kristalin)
stabil
Urutan PEST, daerah kaya akan prolin (P),
glutamat (E), serin (S), dan treonin (T), menjadi
target banyak protein untuk didegradasi
cepat.
Peptida yang dihasilkan kemudian
didegradasi menjadi asam amino oleh
endopeptidase yang memotong ikatan
internal
Aminopeptidase dan karboksipeptidase
melepaskan asam amino secara berurut
masing-masing dari ujung amino dan karboksil.
Urutan PEST, daerah kaya akan prolin (P),
glutamat (E), serin (S), dan treonin (T), menjadi
target banyak protein untuk didegradasi
cepat.
Peptida yang dihasilkan kemudian
didegradasi menjadi asam amino oleh
endopeptidase yang memotong ikatan
internal
Aminopeptidase dan karboksipeptidase
melepaskan asam amino secara berurut
masing-masing dari ujung amino dan karboksil.
Protein-protein ekstrasel, protein yang
terikat membran, dan protein intrasel
yang berumur panjang didegradasi di
lisosom melalui proses yang tidak
memerlukan ATP.
Sebaliknya, degradasi protein berumur
pendek dan abnormal terjadi di sitosol
dan memerlukan ATP dan ubiquitin.
Protein-protein ekstrasel, protein yang
terikat membran, dan protein intrasel
yang berumur panjang didegradasi di
lisosom melalui proses yang tidak
memerlukan ATP.
Sebaliknya, degradasi protein berumur
pendek dan abnormal terjadi di sitosol
dan memerlukan ATP dan ubiquitin.
UBIQUITIN
Ubiquitin adalah protein kecil (8.5 kDa) yang
menarget banyak protein intrasel untuk
didegradasi.
Struktur primer ubiquitin sangat conserved.
Hanya 3 dari 76 residu yang berbeda antara
ubiquitin ragi dan manusia.
Beberapa molekul ubiquitin diikatkan
melalui ikatan non--peptida yang
terbentuk antara ujung karboksil ubiquitin
dan gugus -amino residu lisin pada protein
target.
Ubiquitin adalah protein kecil (8.5 kDa) yang
menarget banyak protein intrasel untuk
didegradasi.
Struktur primer ubiquitin sangat conserved.
Hanya 3 dari 76 residu yang berbeda antara
ubiquitin ragi dan manusia.
Beberapa molekul ubiquitin diikatkan
melalui ikatan non--peptida yang
terbentuk antara ujung karboksil ubiquitin
dan gugus -amino residu lisin pada protein
target.
Degradasi protein sitosol
oleh sistem penandaan
ubiquitin
Tahap 1: pembentukan ikatan
tioester yang bergantung-ATP
antara ujung-C ubiquitin
dengan tiol sistein pada E1
Tahap 2: transfer ubiquitin dari
E1 ke E2
Tahap 3: transfer ubiquitin ke
residu lisin pada protein target
Tahap 4: proteolisis protein-
bertanda ubiquitin yang
bergantung-ATP
14
Tahap 1: pembentukan ikatan
tioester yang bergantung-ATP
antara ujung-C ubiquitin
dengan tiol sistein pada E1
Tahap 2: transfer ubiquitin dari
E1 ke E2
Tahap 3: transfer ubiquitin ke
residu lisin pada protein target
Tahap 4: proteolisis protein-
bertanda ubiquitin yang
bergantung-ATP
UBIQUITIN
Residu yang terdapat di ujung amino
memengaruhi apakah suatu protein
di-ubiquitinasi.
Ujung amino Met atau Ser
memperlambat sedangkan Asp atau
Arg mempercepat ubiquitinasi.
Degradasi terjadi di kompleks
multikatalitik protease yang dikenal
sebagai proteasome.
Residu yang terdapat di ujung amino
memengaruhi apakah suatu protein
di-ubiquitinasi.
Ujung amino Met atau Ser
memperlambat sedangkan Asp atau
Arg mempercepat ubiquitinasi.
Degradasi terjadi di kompleks
multikatalitik protease yang dikenal
sebagai proteasome.
Produk akhir konversi nitrogen
amino pada hewan
Hewan mengeluarkan kelebihan
nitrogen dalam bentuk amonia, asam
urat, atau urea.
Ikan langsung mengeluarkan amonia
(amonotelik) yang sangat toksik ke
lingkungannya (air).
Burung, yang harus menghemat air,
bersifat urikotelik dan mengeluarkan
asam urat semisolid.
Hewan mengeluarkan kelebihan
nitrogen dalam bentuk amonia, asam
urat, atau urea.
Ikan langsung mengeluarkan amonia
(amonotelik) yang sangat toksik ke
lingkungannya (air).
Burung, yang harus menghemat air,
bersifat urikotelik dan mengeluarkan
asam urat semisolid.
Banyak hewan daratan, termasuk
manusia, bersifat ureotelik dan
mengeluarkan urea yang nontoksik
dan larut-air.
Kadar urea yang tinggi dalam darah
pada penderita penyakit ginjal
merupakan akibat, bukan sebab,
gangguan fungsi ginjal.
Banyak hewan daratan, termasuk
manusia, bersifat ureotelik dan
mengeluarkan urea yang nontoksik
dan larut-air.
Kadar urea yang tinggi dalam darah
pada penderita penyakit ginjal
merupakan akibat, bukan sebab,
gangguan fungsi ginjal.
Overview
degradasi protein
dan asam amino
Biosintesis urea terjadi dalam 4 tahap:
(1) Transaminasi
(2) Deaminasi oksidatif glutamat
(3) Transport amonia
(4) Reaksi siklus urea
Transaminasi Memindahkan
Nitrogen -Amino ke -Keto
Transaminasi saling mengkonversi
pasangan asam -amino dan asam -
keto.
Semua asam amino protein kecuali
lisin, treonin, prolin, dan hidroksiprolin
ikut serta dalam transaminasi.
Reaksi ini bersifat reversibel, dan
aminotransferase juga berfungsi di
dalam biosintesis asam amino.
Transaminasi saling mengkonversi
pasangan asam -amino dan asam -
keto.
Semua asam amino protein kecuali
lisin, treonin, prolin, dan hidroksiprolin
ikut serta dalam transaminasi.
Reaksi ini bersifat reversibel, dan
aminotransferase juga berfungsi di
dalam biosintesis asam amino.
TRANSAMINASI
PIRIDOKSAL FOSFAT
Koenzim piridoksal fosfat (PLP) terdapat
di sisi katalitik aminotransferase dan
enzim-enzim lain yang bekerja dengan
asam amino.
Selama transaminasi, PLP berfungsi
sebagai pembawa gugus amino.
Setelah nitrogen -amino dipindahkan
melalui transaminasi, kerangka"
karbon yang tersisa didegradasi.
Koenzim piridoksal fosfat (PLP) terdapat
di sisi katalitik aminotransferase dan
enzim-enzim lain yang bekerja dengan
asam amino.
Selama transaminasi, PLP berfungsi
sebagai pembawa gugus amino.
Setelah nitrogen -amino dipindahkan
melalui transaminasi, kerangka"
karbon yang tersisa didegradasi.
Keterlibatan
piridoksal fosfat
dalam reaksi
transaminasi
23
Alanin-pIruvat aminotransferase (alanin
aminotransferase) dan glutamat- -
ketoglutarat aminotransferase (glutamat
aminotransferase)
Ada 2 enzim yang mengatalisis transfer gugus
amino, yaitu transfer ke piruvat (membentuk alanin)
atau ke -ketoglutarat (membentuk glutamat)
Masing-masing aminotransferase spesifik
untuk satu pasang substrat tapi tidak spesifik
untuk pasangan lain.
Karena alanin juga substrat untuk glutamat
aminotransferase, semua nitrogen amino dari
asam amino yang mengalami transaminasi
dapat terkonsentrasi di glutamat.
Hal ini penting karena L-glutamat adalah
satu-satunya asam amino yang menjalani
deaminasi oksidatif dengan laju cukup tinggi
di jaringan mamalia.
Jadi, pembentukan amonia dari gugus -
amino terutama terjadi melalui nitrogen -
amino L-glutamat
Masing-masing aminotransferase spesifik
untuk satu pasang substrat tapi tidak spesifik
untuk pasangan lain.
Karena alanin juga substrat untuk glutamat
aminotransferase, semua nitrogen amino dari
asam amino yang mengalami transaminasi
dapat terkonsentrasi di glutamat.
Hal ini penting karena L-glutamat adalah
satu-satunya asam amino yang menjalani
deaminasi oksidatif dengan laju cukup tinggi
di jaringan mamalia.
Jadi, pembentukan amonia dari gugus -
amino terutama terjadi melalui nitrogen -
amino L-glutamat
L-GLUTAMAT DEHIDROGENASE
Pemindahan nitrogen amino ke -
ketoglutarat membentuk L-glutamat.
Pelepasan nitogen ini sebagai amonia
dikatalisis kemudian oleh L-glutamate
dehidrogenase (GDH) hati, yang dapat
menggunakan NAD
+
ataupun NADP
+
Pemindahan nitrogen amino ke -
ketoglutarat membentuk L-glutamat.
Pelepasan nitogen ini sebagai amonia
dikatalisis kemudian oleh L-glutamate
dehidrogenase (GDH) hati, yang dapat
menggunakan NAD
+
ataupun NADP
+
Perubahan nitogen -amino menjadi
amonia oleh kerja terpadu glutamat
aminotransferase dan GDH sering
disebut "transdeaminasi.
Aktivitas GDH liver diinhibisi secara
alosterik oleh ATP, GTP, dan NADH dan
diaktivasi oleh ADP.
Reaksi yang dikatalisis oleh GDH bersifat
reversibel sepenuhnya dan berfungsi
juga dalam biosintesis asam amino
Perubahan nitogen -amino menjadi
amonia oleh kerja terpadu glutamat
aminotransferase dan GDH sering
disebut "transdeaminasi.
Aktivitas GDH liver diinhibisi secara
alosterik oleh ATP, GTP, dan NADH dan
diaktivasi oleh ADP.
Reaksi yang dikatalisis oleh GDH bersifat
reversibel sepenuhnya dan berfungsi
juga dalam biosintesis asam amino
Intoksikasi Amonia
Amonia yang dihasilkan bakteri usus dan
terabsopsi ke dalam darah vena porta dan
amonia yang dihasilkan jaringan segera
dihilangkan dari sirkulasi oleh liver dan
diubah menjadi urea.
Jadi, hanya sedikit (1020 g/dL) yang
normalnya terdapat dalam darah perifer.
Hal ini sangat penting karena amonia
bersifat toksik bagi susunan saraf pusat.
Amonia yang dihasilkan bakteri usus dan
terabsopsi ke dalam darah vena porta dan
amonia yang dihasilkan jaringan segera
dihilangkan dari sirkulasi oleh liver dan
diubah menjadi urea.
Jadi, hanya sedikit (1020 g/dL) yang
normalnya terdapat dalam darah perifer.
Hal ini sangat penting karena amonia
bersifat toksik bagi susunan saraf pusat.
Pada gangguan hati yang parah, kadar
amonia darah dapat meningkat ke kadar
toksik.
Gejala intoksikasi amonia mencakup
tremor, berbicara pelo, penglihatan kabur,
koma, dan kematian.
Amonia dapat bersifat toksik bagi otak,
sebagian karena bereaksi dengan -
ketoglutarat membentuk glutamat.
Kadar -ketoglutarat yang menurun
kemudian mengganggu fungsi daur TCA di
neuron.
Pada gangguan hati yang parah, kadar
amonia darah dapat meningkat ke kadar
toksik.
Gejala intoksikasi amonia mencakup
tremor, berbicara pelo, penglihatan kabur,
koma, dan kematian.
Amonia dapat bersifat toksik bagi otak,
sebagian karena bereaksi dengan -
ketoglutarat membentuk glutamat.
Kadar -ketoglutarat yang menurun
kemudian mengganggu fungsi daur TCA di
neuron.
Transpor amonia ke Liver
Setiap organ pada hewan
mendegradasi asam amino dan
menghasilkan amonia
Ada 2 mekanisme transpor amonia dari
jaringan ke liver untuk diubah menjadi
urea, yaitu melalui pembentukan
glutamin dan siklus glukosa-alanin
Setiap organ pada hewan
mendegradasi asam amino dan
menghasilkan amonia
Ada 2 mekanisme transpor amonia dari
jaringan ke liver untuk diubah menjadi
urea, yaitu melalui pembentukan
glutamin dan siklus glukosa-alanin
Kebanyakan jaringan menggunakan
glutamin sintase untuk mengubah
amonia menjadi glutamin, yang
nontoksik dan tidak bermuatan
Glutamin ditranspor dalam darah ke
liver dan dipecah secara hidrolitik
menjadi amonia oleh glutaminase
Kebanyakan jaringan menggunakan
glutamin sintase untuk mengubah
amonia menjadi glutamin, yang
nontoksik dan tidak bermuatan
Glutamin ditranspor dalam darah ke
liver dan dipecah secara hidrolitik
menjadi amonia oleh glutaminase
Glutamin Sintase mengikat Amonia
menjadi Glutamin
pembentukan glutamin dikatalisis oleh glutamin
sintase mitokondria
Karena sintesis ikatan amida digabung dengan
hidrolisis ATP menjadi ADP dan Pi, reaksi cenderung
mengarah pada sintesis glutamin.
Glutaminase Mendeaminasi Glutamin
Pembebasan hidrolitik nitrogen amida glutamin
menjadi amonia, yang dikatalisis glutaminase,
sangat condong pada pembentukan glutamat.
Kerja terpadu glutamin sintase dan glutaminase
karenanya mengkatalisis interkonversi ion amonium
bebas dan glutamin.
Transpor amonia dari otot
melalui Siklus glukosa-alanin
Otot, yang banyak mendapatkan
energinya dari reaksi glikolisis,
menggunakan jalur yang berbeda
dalam transpor amonia ke liver
dibandingkan dengan jaringan lain,
yaitu melalui siklus glukosa-alanin
Amonia diikatkan ke -ketoglutarat
membentuk glutamat melalui kerja
enzim glutamat dehidrogenase.
Otot, yang banyak mendapatkan
energinya dari reaksi glikolisis,
menggunakan jalur yang berbeda
dalam transpor amonia ke liver
dibandingkan dengan jaringan lain,
yaitu melalui siklus glukosa-alanin
Amonia diikatkan ke -ketoglutarat
membentuk glutamat melalui kerja
enzim glutamat dehidrogenase.
Glikolisis menghasilkan piruvat yang
mengalami transaminasi dengan
glutamat menjadi alanin dan -
ketoglutarat
Alanin yang terbentuk kemudian
dibawa ke liver dan mengalami
kehilangan nitrogennya melalui
kebalikan proses sebelumnya.
Reaksi kebalikannya ini menghasilkan
piruvat dan amonia untuk sintesis urea
Glikolisis menghasilkan piruvat yang
mengalami transaminasi dengan
glutamat menjadi alanin dan -
ketoglutarat
Alanin yang terbentuk kemudian
dibawa ke liver dan mengalami
kehilangan nitrogennya melalui
kebalikan proses sebelumnya.
Reaksi kebalikannya ini menghasilkan
piruvat dan amonia untuk sintesis urea
Piruvat memasuki jalur glukoneogenesis
menghasilkan glukosa yang kemudian
dilepas ke dalam darah untuk
ditranspor balik ke otot atau untuk ke
otak.
Piruvat memasuki jalur glukoneogenesis
menghasilkan glukosa yang kemudian
dilepas ke dalam darah untuk
ditranspor balik ke otot atau untuk ke
otak.
Transpor amonia menuju liver untuk sintesis urea
37
Pembawa amonia adalah glutamin untuk sebagian besar jaringan tetapi alanin
untuk otot
SIKLUS UREA
Urea merupakan produk akhir utama
katabolisme nitrogen pada manusia
Sintesis 1 mol urea memerlukan 3 mol
ATP plus 1 mol ion amonium dan 1 mol
nitrogen -amino aspartat
Melibatkan beberapa asam amino
yang berfungsi sebagai pembawa
atom-atom yang akhirnya menjadi
urea
Urea merupakan produk akhir utama
katabolisme nitrogen pada manusia
Sintesis 1 mol urea memerlukan 3 mol
ATP plus 1 mol ion amonium dan 1 mol
nitrogen -amino aspartat
Melibatkan beberapa asam amino
yang berfungsi sebagai pembawa
atom-atom yang akhirnya menjadi
urea
Terdapat di matriks mitokondria liver:
1. Karbamoil fosfat sintetase I mengkondensasi ion
amonium bebas dan bikarbonat membentuk
karbamoil fosfat. Walaupun bukan bagian dari siklus
urea tapi penting dalam sintesis urea.
2. Ornitin transkarbamoilase mengkatalisis
pembentukan sitrulin
Terdapat di sitosol liver:
3. Arginosuksinat sintetase mengkatalisis sintesis
arginosuksinat.
4. Argnosuksinat liase memecah arginosuksinat
menghasilkan fumarat dan arginin
5. Arginase memecah arginin menjadi ornitin dan urea
Enzim-enzim yang diperlukan dalam
sintesis urea
Terdapat di matriks mitokondria liver:
1. Karbamoil fosfat sintetase I mengkondensasi ion
amonium bebas dan bikarbonat membentuk
karbamoil fosfat. Walaupun bukan bagian dari siklus
urea tapi penting dalam sintesis urea.
2. Ornitin transkarbamoilase mengkatalisis
pembentukan sitrulin
Terdapat di sitosol liver:
3. Arginosuksinat sintetase mengkatalisis sintesis
arginosuksinat.
4. Argnosuksinat liase memecah arginosuksinat
menghasilkan fumarat dan arginin
5. Arginase memecah arginin menjadi ornitin dan urea
Siklus urea Krebs-Henseleit
1
2
5
40
3 4
Karbamoil Fosfat Sintase I
Kondensasi CO2, amonia, dan ATP
membentuk karbamoil fosfat dikatalisis oleh
karbamoil fosfat sintase I mitokondria
Enzim ini menjadi pembatas-laju pada siklus
urea dan hanya aktif jika terdapat aktivator
alosteriknya, N-asetilglutamat, yang
meningkatkan afinitas sintase untuk ATP.
Pembentukan karbamoil fosfat memerlukan
2 mol ATP
Kondensasi CO2, amonia, dan ATP
membentuk karbamoil fosfat dikatalisis oleh
karbamoil fosfat sintase I mitokondria
Enzim ini menjadi pembatas-laju pada siklus
urea dan hanya aktif jika terdapat aktivator
alosteriknya, N-asetilglutamat, yang
meningkatkan afinitas sintase untuk ATP.
Pembentukan karbamoil fosfat memerlukan
2 mol ATP
L-Ornitin transkarbamoilase
L-Ornitin transkarbamoilase
mengkatalisis transfer gugus karbamoil
dari karbamoil fosfat ke ornitin,
membentuk sitrulin dan ortofosfat
Walaupun reaksi terjadi di matriks
mitokondria, pembentukan ornitin dan
metabolisme sitrulin lebih lanjut terjadi
di sitosol.
L-Ornitin transkarbamoilase
mengkatalisis transfer gugus karbamoil
dari karbamoil fosfat ke ornitin,
membentuk sitrulin dan ortofosfat
Walaupun reaksi terjadi di matriks
mitokondria, pembentukan ornitin dan
metabolisme sitrulin lebih lanjut terjadi
di sitosol.
Ornitin Transporter
Sindrom hiperornitinemia, hiperamonemia,
dan homositrulinuria (sindrom HHH) terjadi
akibat mutasi gen ORNT1 yang menyandi
pengangkut ornitin mitokondria.
Kegagalan memasukan ornittin sitosol ke
dalam matriks mitokondria menyebabkan
siklus urea tidak dapat berlangsung
sehingga terjadi hiperamonemia, sementara
akumulasi ornitin sitosol menyebabkan
hiperornitinemia.
Tanpa adanya akseptor normalnya, yaitu
ornitin, karbamoil fosfat mitokondria
mengkarbamoilasikan lisin menjadi
homositrulin sehingga terjadi homositrulinuria.
Sindrom hiperornitinemia, hiperamonemia,
dan homositrulinuria (sindrom HHH) terjadi
akibat mutasi gen ORNT1 yang menyandi
pengangkut ornitin mitokondria.
Kegagalan memasukan ornittin sitosol ke
dalam matriks mitokondria menyebabkan
siklus urea tidak dapat berlangsung
sehingga terjadi hiperamonemia, sementara
akumulasi ornitin sitosol menyebabkan
hiperornitinemia.
Tanpa adanya akseptor normalnya, yaitu
ornitin, karbamoil fosfat mitokondria
mengkarbamoilasikan lisin menjadi
homositrulin sehingga terjadi homositrulinuria.
Ornitine Transkarbamoilase
Defisiensi terkait kromosom-X yang disebut
"hiperamonemia tipe 2" mencerminkan
suatu defek pada ornitin transkarbamoilase
Ibu pasien juga mengalami hiperamonemia
dan tidak menyukai makanan berprotein
tinggi
Kadar glutamin meningkat di darah, cairan
serebrospinal, dan urin, yang kemungkinan
akibat peningkatan sintesis glutamin
sebagai respon terhadap peningkatan
kadar amonia jaringan
Defisiensi terkait kromosom-X yang disebut
"hiperamonemia tipe 2" mencerminkan
suatu defek pada ornitin transkarbamoilase
Ibu pasien juga mengalami hiperamonemia
dan tidak menyukai makanan berprotein
tinggi
Kadar glutamin meningkat di darah, cairan
serebrospinal, dan urin, yang kemungkinan
akibat peningkatan sintesis glutamin
sebagai respon terhadap peningkatan
kadar amonia jaringan
Argininosuksinat sintase
Argininosuksinat sintase
menghubungkan aspartat dan sitrulin
melalui gugus amino aspartat dan
memberikan nitogen urea yang kedua.
Reaksi ini memerlukan ATP dan
melibatkan pembentukan intermediate
sitrulil-AMP.
Argininosuksinat sintase
menghubungkan aspartat dan sitrulin
melalui gugus amino aspartat dan
memberikan nitogen urea yang kedua.
Reaksi ini memerlukan ATP dan
melibatkan pembentukan intermediate
sitrulil-AMP.
Argininosuksinase
Pemecahan argininosuksinat, yang dikatalisis
oleh argininosuksinase, berlangsung dengan
penyimpanan nitrogen pada arginin dan
pelepasan kerangka aspartat sebagai
fumarat
Penambahan air pada fumarat membentuk
L-malat, dan selanjutnya oksidasi malat yang
bergantung NAD+ membentuk oksaloasetat.
Dua reaksi ini analog dengan reaksi siklus
asam sitrat tapi dikatalisis oleh fumarase dan
malat dehidrogenase sitosol.
Transaminasi oksaloasetat oleh glutamat
aminotransferase kemudian membentuk
kembali aspartat.
Pemecahan argininosuksinat, yang dikatalisis
oleh argininosuksinase, berlangsung dengan
penyimpanan nitrogen pada arginin dan
pelepasan kerangka aspartat sebagai
fumarat
Penambahan air pada fumarat membentuk
L-malat, dan selanjutnya oksidasi malat yang
bergantung NAD+ membentuk oksaloasetat.
Dua reaksi ini analog dengan reaksi siklus
asam sitrat tapi dikatalisis oleh fumarase dan
malat dehidrogenase sitosol.
Transaminasi oksaloasetat oleh glutamat
aminotransferase kemudian membentuk
kembali aspartat.
Arginase
Penguraian hidrolitik gugus guanidino
arginin, yang dikatalisis oleh arginase liver,
melepaskan urea
Produk lain, ornitin, masuk kembali ke
mitokondria liver untuk putaran sintesis urea
selanjutnya.
Ornitin dan lisin adalah inhibitor potensial
arginase, bersaing dengan arginin.
Penguraian hidrolitik gugus guanidino
arginin, yang dikatalisis oleh arginase liver,
melepaskan urea
Produk lain, ornitin, masuk kembali ke
mitokondria liver untuk putaran sintesis urea
selanjutnya.
Ornitin dan lisin adalah inhibitor potensial
arginase, bersaing dengan arginin.
Kelainan metabolik siklus urea
Semua defek pada sintesis urea menyebabkan
intoksikasi amonia
Simptom klinik yang umum untuk semua kelainan
siklus urea diantaranya muntah, penghindaran
pada makanan berprotein tinggi, kehilangan
perasaan kesetimbangan (ataxia), mudah marah,
lesu, dan beberapa keterbelakangan mental.
Perbaikan yang signifikan dan minimisasi kerusakan
otak dapat dilakukan dengan mengkonsumsi
makanan rendah-protein sebagai cemilan untuk
mencegah peningkatan tiba-tiba level amonia
darah.
Semua defek pada sintesis urea menyebabkan
intoksikasi amonia
Simptom klinik yang umum untuk semua kelainan
siklus urea diantaranya muntah, penghindaran
pada makanan berprotein tinggi, kehilangan
perasaan kesetimbangan (ataxia), mudah marah,
lesu, dan beberapa keterbelakangan mental.
Perbaikan yang signifikan dan minimisasi kerusakan
otak dapat dilakukan dengan mengkonsumsi
makanan rendah-protein sebagai cemilan untuk
mencegah peningkatan tiba-tiba level amonia
darah.
Kerangka karbon asam
amino
Kerangka karbon yang dihasilkan dari
degradasi asam amino dapat diproses
lebih lanjut ke dalam siklus asam sitrat
atau digunakan untuk biosintesis
karbohidrat.
Setiap kerangka karbon asam amino
memiliki jalurnya masing-masing.
Secara umum dapat dilihat pada
gambar di slide berikutnya.
Kerangka karbon yang dihasilkan dari
degradasi asam amino dapat diproses
lebih lanjut ke dalam siklus asam sitrat
atau digunakan untuk biosintesis
karbohidrat.
Setiap kerangka karbon asam amino
memiliki jalurnya masing-masing.
Secara umum dapat dilihat pada
gambar di slide berikutnya.
Jalur metabolisme
kerangka karbon
asam amino
50
ketogenik
glukogenik
Anda mungkin juga menyukai
- Buku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!Dari EverandBuku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!Penilaian: 3.5 dari 5 bintang3.5/5 (4)
- Pencernaan ProteinDokumen9 halamanPencernaan ProteinEmma Purwitasari100% (1)
- Teknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Dari EverandTeknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Penilaian: 5 dari 5 bintang5/5 (2)
- Metabolisme ProteinDokumen14 halamanMetabolisme Proteinlidia maharani50% (2)
- Metabolisme Asam Amino 2Dokumen29 halamanMetabolisme Asam Amino 2Adhia DekaBelum ada peringkat
- Metabolisme ProteinDokumen16 halamanMetabolisme ProteinChristella BatbualBelum ada peringkat
- Metabolisme Asam Amino dalam TubuhDokumen29 halamanMetabolisme Asam Amino dalam TubuhIsman ToroBelum ada peringkat
- Metabolisme ProteinDokumen74 halamanMetabolisme ProteinMeliaa E.RBelum ada peringkat
- Metabolisme ProteinDokumen53 halamanMetabolisme ProteinIlma AmaliaBelum ada peringkat
- Metabolisme ProteinDokumen17 halamanMetabolisme Proteinalgiparwicak0805Belum ada peringkat
- Metabolisme ProteinDokumen50 halamanMetabolisme ProteinMaulana SaktiBelum ada peringkat
- METABOLISME PROTEINDokumen26 halamanMETABOLISME PROTEINRetno FitriatiBelum ada peringkat
- Metabolisme Protein: Kelompok 7Dokumen124 halamanMetabolisme Protein: Kelompok 7Wisnu YusronBelum ada peringkat
- Metabolisme Protein dan Asam AminoDokumen29 halamanMetabolisme Protein dan Asam AminoErindra Putra AdityaBelum ada peringkat
- Asam AminoDokumen35 halamanAsam AminoYulia YestiBelum ada peringkat
- Metabolisme Protein 2018-Compressed (1) .En - IdDokumen56 halamanMetabolisme Protein 2018-Compressed (1) .En - IdDominoBelum ada peringkat
- TM 7&8 - Metabolisme ProteinDokumen49 halamanTM 7&8 - Metabolisme ProteinIntan Meidha Puspita SariBelum ada peringkat
- Metabolisme ProteinDokumen21 halamanMetabolisme ProteinPutri Dwi Adha MJBelum ada peringkat
- 4 Metabolisme ProteinDokumen27 halaman4 Metabolisme ProteindimasBelum ada peringkat
- Metabolisme Protein MusDokumen24 halamanMetabolisme Protein Musmusrinsalila100% (3)
- 6 Metabolisme-ProteinDokumen35 halaman6 Metabolisme-ProteinIpah SaripahBelum ada peringkat
- Metabolisme Protein Dan Asam Amino - Doc MakalahDokumen23 halamanMetabolisme Protein Dan Asam Amino - Doc MakalahMardanputraranto D'Vilex50% (4)
- Pembahasan AlbuminDokumen12 halamanPembahasan AlbuminDyno Manembu100% (1)
- Makalah SINTESIS & DEGRADASIDokumen105 halamanMakalah SINTESIS & DEGRADASIL Ahmad Asmayadi100% (1)
- Metabolisme Protein Dan Asam AminoDokumen23 halamanMetabolisme Protein Dan Asam AminoDiah Pradnya KerthiariBelum ada peringkat
- Metabolisme ProteinDokumen17 halamanMetabolisme ProteinyusmiariiBelum ada peringkat
- Metabolisme Protein Dan Asam Amino-1Dokumen26 halamanMetabolisme Protein Dan Asam Amino-1Raja Rola WBelum ada peringkat
- ProteinDokumen16 halamanProteinzakaria ezisBelum ada peringkat
- Metabolisme Protein Dan Asam AminoDokumen14 halamanMetabolisme Protein Dan Asam AminoIndaahh Amabelle Qhii MyhubbyBelum ada peringkat
- Resume Metabolisme Protein MelisaDokumen5 halamanResume Metabolisme Protein MelisaMelisa PutriBelum ada peringkat
- Metabolisme Dan Fungsi Protein Pert. 3Dokumen28 halamanMetabolisme Dan Fungsi Protein Pert. 3Sella PermataBelum ada peringkat
- Katabolisme ProteinDokumen29 halamanKatabolisme ProteinFathul HijrBelum ada peringkat
- METABOLISME PROTEINDokumen42 halamanMETABOLISME PROTEINHesti FathanBelum ada peringkat
- Katabolisme Asam AminoDokumen4 halamanKatabolisme Asam AminoMohammad LutfiBelum ada peringkat
- Biokimia Metabolisme ProteinDokumen14 halamanBiokimia Metabolisme ProteinSucik WahyuniBelum ada peringkat
- Metabolisme Protein: Prof, DR Eti Yerizel, Ms Bagin Biokimia FK UnandDokumen37 halamanMetabolisme Protein: Prof, DR Eti Yerizel, Ms Bagin Biokimia FK UnandHidzra Wafi HabibBelum ada peringkat
- Biokimia Metabolisme Protein Dan Asam AminoDokumen26 halamanBiokimia Metabolisme Protein Dan Asam AminoWillySianiparBelum ada peringkat
- Metabolisme ProteinDokumen9 halamanMetabolisme ProteinDeby FebriyantiBelum ada peringkat
- MATERI 11, PROTEIN BAHAN MAKANAN, ANALISA KIMIA AMAMI, Agus Sudrajat, S.Si, M.TDokumen20 halamanMATERI 11, PROTEIN BAHAN MAKANAN, ANALISA KIMIA AMAMI, Agus Sudrajat, S.Si, M.TIqbal Pratama NurdiansyahBelum ada peringkat
- Metabolisme ProteinDokumen47 halamanMetabolisme Proteindekawm95Belum ada peringkat
- Pertemuan Iv. ProteinDokumen23 halamanPertemuan Iv. ProteinTesia YosepaBelum ada peringkat
- Kuliah HepatobilierDokumen50 halamanKuliah Hepatobiliersulastri triBelum ada peringkat
- ProteinDokumen15 halamanProtein9qtnjynczpBelum ada peringkat
- Biomet - Nancy Agalalis Sibarani - 4203331024 - Pspk2020aDokumen6 halamanBiomet - Nancy Agalalis Sibarani - 4203331024 - Pspk2020aNancy Agalalis SibaraniBelum ada peringkat
- Protein MetabolismeDokumen29 halamanProtein MetabolismePegi SukmaBelum ada peringkat
- Metabolisme Asam AminoDokumen37 halamanMetabolisme Asam AminoMifthahul khoirBelum ada peringkat
- Biokimia PPT Kel 7Dokumen18 halamanBiokimia PPT Kel 7Dhea Clasia SuarsonoBelum ada peringkat
- Asam Amino Dan Protein 1Dokumen56 halamanAsam Amino Dan Protein 1Maulida FajriyahBelum ada peringkat
- Metabolisme Protein 2013Dokumen23 halamanMetabolisme Protein 2013nahdatul AuliaBelum ada peringkat
- BIOASAMDokumen35 halamanBIOASAMraden hilmiBelum ada peringkat
- Asam Amino Dan Protein (Sa)Dokumen21 halamanAsam Amino Dan Protein (Sa)Fransiska MelaniaBelum ada peringkat
- Metabolisme ProteinDokumen73 halamanMetabolisme ProteinMutya Frida UtamiBelum ada peringkat
- ASAM AMINO DAN PROTEINDokumen67 halamanASAM AMINO DAN PROTEINRizki AzmiBelum ada peringkat
- Met Prot FKG 24Dokumen38 halamanMet Prot FKG 242311111120007Belum ada peringkat
- Biokimia Metabolisme Protein Dan Asam AminoDokumen26 halamanBiokimia Metabolisme Protein Dan Asam AminoPutri Martina YantiBelum ada peringkat
- Nomor 4Dokumen7 halamanNomor 4DIANA SUSANTIBelum ada peringkat
- DEGRADASI PROTEIN DALAMDokumen26 halamanDEGRADASI PROTEIN DALAMElsa Chacha AmaliaBelum ada peringkat
- Metabolisme ProteinDokumen21 halamanMetabolisme ProteinDian Puspa0% (1)
- Karakterisasi Molekular Bakteri Asam Laktat (Bal)Dokumen10 halamanKarakterisasi Molekular Bakteri Asam Laktat (Bal)VeronicateukyuhaeBelum ada peringkat
- Sistem RespirasiDokumen34 halamanSistem RespirasiVeronicateukyuhaeBelum ada peringkat
- Tentang ISODokumen14 halamanTentang ISOVeronicateukyuhaeBelum ada peringkat
- Macam Macam Jaringan TumbuhanDokumen7 halamanMacam Macam Jaringan TumbuhanVeronicateukyuhae100% (1)
- 53 97 1 SMDokumen10 halaman53 97 1 SMVeronicateukyuhaeBelum ada peringkat
- Panduan PKM Tahun 2013Dokumen142 halamanPanduan PKM Tahun 2013imambudiBelum ada peringkat
- Digital 20279307 S359 Ekspresi GenDokumen108 halamanDigital 20279307 S359 Ekspresi GenVeronicateukyuhaeBelum ada peringkat
- Agrobio 5 1 29-36Dokumen8 halamanAgrobio 5 1 29-36Agi Semangat100% (1)
- Struktur LaporanDokumen2 halamanStruktur Laporanviruz2_09Belum ada peringkat
- Chapter IIDokumen17 halamanChapter IIAngga HarahapBelum ada peringkat
- Praktikum SpektrometriDokumen17 halamanPraktikum SpektrometriVeronicateukyuhaeBelum ada peringkat
- Praktikum DNA PDFDokumen27 halamanPraktikum DNA PDFVeronicateukyuhaeBelum ada peringkat
- Laporan PKM KDokumen11 halamanLaporan PKM KVeronicateukyuhaeBelum ada peringkat
- Fermentasi KluwakDokumen15 halamanFermentasi KluwakVeronicateukyuhaeBelum ada peringkat
- JSTF v12 1 07 Elidahanum090814Dokumen5 halamanJSTF v12 1 07 Elidahanum090814VeronicateukyuhaeBelum ada peringkat
- Undang2 Ling HidupDokumen25 halamanUndang2 Ling HidupVeronicateukyuhaeBelum ada peringkat
- Jalur Info Genetik 2013Dokumen74 halamanJalur Info Genetik 2013VeronicateukyuhaeBelum ada peringkat
- 6 Pengawasan MutuDokumen46 halaman6 Pengawasan MutuHarrizul RivaiBelum ada peringkat
- Praktikum DkaDokumen6 halamanPraktikum DkaVeronicateukyuhaeBelum ada peringkat
- Praktikum SpektrometriDokumen17 halamanPraktikum SpektrometriVeronicateukyuhaeBelum ada peringkat
- Mekanisasi Proses Olahan Biji Durian Menjadi Produk Pangan Yang Kompetitif - AJI PRASETYANINGRUMDokumen6 halamanMekanisasi Proses Olahan Biji Durian Menjadi Produk Pangan Yang Kompetitif - AJI PRASETYANINGRUMJang Djazz HolicBelum ada peringkat
- 3 KLTDokumen33 halaman3 KLTVeronicateukyuhaeBelum ada peringkat
- Program Kreativitas MahasiswaDokumen20 halamanProgram Kreativitas MahasiswaVeronicateukyuhaeBelum ada peringkat
- Praktikum DkaDokumen6 halamanPraktikum DkaVeronicateukyuhaeBelum ada peringkat
- AsetnilidaDokumen3 halamanAsetnilidaVeronicateukyuhaeBelum ada peringkat
- 4-ekstraksiBAB I PENDAHULUAN Analisis adalah suatu upaya penguraian satu pengertian ilmiah yang bertujuan untuk menentukan susunan bahan baik secara kualitatif, kuantitatif, maupun struktur. Analisis kuantitatif adalah analisis kimia yang menyangkut penetuan jumlah zat tertentu yang ada di dalam suatu sample. Analisis kuantitatif terdiri atas analisa titrimetri, analisa gravimetri dan analisa instrumental. Analisis titrimetri berkaitan dengan pengukuran volume suatu larutan dengan konsentrasi yang diketahui yang diperlukan untuk bereaksi dengan analit. Analisis gravimetri merupakan analisa yang menyangkut pengukuran berat. Sedangkan, analisa instrumental adalah merupakan analisa yang menyangkut pengukuran berat. Tujuan dari praktikum Pengenalan Analisa Kuantitatif adalah untuk mengenal metode analisa kuantitatif dan mengukur kadar asam cuka. Manfaat dari praktikum ini adalah agar mahasiswa mengenal dan memahami apa yang disebut analisa kuantitatif danDokumen29 halaman4-ekstraksiBAB I PENDAHULUAN Analisis adalah suatu upaya penguraian satu pengertian ilmiah yang bertujuan untuk menentukan susunan bahan baik secara kualitatif, kuantitatif, maupun struktur. Analisis kuantitatif adalah analisis kimia yang menyangkut penetuan jumlah zat tertentu yang ada di dalam suatu sample. Analisis kuantitatif terdiri atas analisa titrimetri, analisa gravimetri dan analisa instrumental. Analisis titrimetri berkaitan dengan pengukuran volume suatu larutan dengan konsentrasi yang diketahui yang diperlukan untuk bereaksi dengan analit. Analisis gravimetri merupakan analisa yang menyangkut pengukuran berat. Sedangkan, analisa instrumental adalah merupakan analisa yang menyangkut pengukuran berat. Tujuan dari praktikum Pengenalan Analisa Kuantitatif adalah untuk mengenal metode analisa kuantitatif dan mengukur kadar asam cuka. Manfaat dari praktikum ini adalah agar mahasiswa mengenal dan memahami apa yang disebut analisa kuantitatif danNurhayati SurbaktiBelum ada peringkat
- Sifat Fisika Dan Kimia Asam SulfatDokumen1 halamanSifat Fisika Dan Kimia Asam SulfatVeronicateukyuhaeBelum ada peringkat
- Cover, Buku Pedoman Skripsi KimiaDokumen7 halamanCover, Buku Pedoman Skripsi KimiaVeronicateukyuhaeBelum ada peringkat
- Kromatografi Teknik Pemisahan CampuranDokumen25 halamanKromatografi Teknik Pemisahan CampuranVeronicateukyuhaeBelum ada peringkat