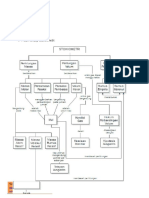
Presentasi Stoikiometri 1 Edit
Diunggah oleh
deviamalia160 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
27 tayangan21 halamanuffuyg
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPT, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Iniuffuyg
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
27 tayangan21 halamanPresentasi Stoikiometri 1 Edit
Diunggah oleh
deviamalia16uffuyg
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 21
Nama Anggota :
Guruh Immamul (073001300041)
Hafidh Afif Ardhi (073001300042)
Hafiz Zulkarami R. (073001300043)
Hafiz fahmi H. (073001300044)
Hardi Airachman (073001300045)
Helmy (073001300046)
Hukum kekekalan massa berlaku pada reaksi kimia, dimana
massa pereaksi harus sama dengan massa produk.
Cth: Magnesium (Mg) + Khlor (Cl) Magnesium Khlor (MgCl
2
)
1,0 g 2,9 g 3,9 g
Hukum perbandingan Tetap yang menyatakan bahwa suatu
senyawa kimia terdiri dari unsur-unsur dengan perbandingan massa
yang selalu tepat sama. Dengan kata lain, setiap sampel suatu
senyawa memiliki komposisi unsur-unsur yang tetap. (Hukum ini
tidak berlaku untuk senyawa non stoikiometris contoh Cu
1,7
S)
Cth : air terdiri dari
8
/
9
massa oksigen dan
1
/
9
massa hidrogen.
Hukum kelipatan perbandingan Jika dua unsur dapat membentuk
satu atau lebih senyawa maka perbandingan massa dari unsur yang
satu dengan sejumlah unsur lain yang tertentu massanya akan
merupakan bilangan mudah dan bulat.
Cth:
Hukum penyatuan volume Pada kondisi suhu dan teanan yang
sama, perbandingan volume gas pereaksi dan gas hasil reaksi
merupakan bilangan yang mudah dan bulat.
Cth: Hidrogen (H
2
) + Oksigen (O
2
) Air (2 H
2
O)
2vol 1vol 2vol
Hukum Avogadro Pada kondisi suhu dan teanan yang sama,
volume yang sama sejumlah gas, mengandung jumlah molekul yang
sama
Cth:
Hidrogen (H
2
) + Oksigen (O
2
) Air (2 H
2
O)
2vol 1vol 2vol
2n mol 1n mol 2n mol
Teori Atom Dalton
Unsur tersusun dari partikel-partikel yang sangat kecil yang tidak
dapat dipecah lagi disebut atom. Atom-atom unsur murni selalu
identik yaitu mempunyai sifat yang sama (ukuran, bentuk dan
massa) dan berlainan dengan atom unsur lain.
Senyawa tersusun atas atom-atom dari dua unsur atau lebih.
Dalam setiap senyawa, perbandingan jumlah atom setiap atom
merupakan bilangan bulat atau pecahan sederhana.
Dalam reaksi kimia hanyalah pemisahan, penggabungan atau
penyusunan ulang atom-atom, reaksi kimia tidak mengakibatkan
penciptaan atau pemusnahan atom-atom.
Setiap atom mempunyai massa tertentu yang sangat kecil
satuan massa atom (sma)
SI: I sma = 1/12 massa satu atom karbon (isotop
12
C)
Massa atom relatif (Ar) menyatakan perbandingan massa
rata-rata satu atom suatu unsur.
Massa molekul relatif (Mr) adalah bilangan yang
menyatakan harga perbandingan massa 1 molekul suatu
senyawa.
Massa formula relatif nyaadalah massa dari suatu ion
relatif terhadap massa satu atom isotop 12C, yang
merupakan jumlah massa dari ion-ion sesuai dengan
atomnya atau jumlah berat atom unsur pembentukannya
Konsep Mol
Mol adalah jumlah dari suatu zat yang mengandung jumlah satuan
dasar (atom, molekul, ion) yang sama dengan atom-atom dalam
12C.
Jumlah partikel (atom, molekul atau ion) dalam satu mol disebut
bilangan Avogadro (atau tetapan Avogadro) dengan lambang n.
1 mol = N partikel
1 mol = 6,02 x 10
23
/ mol
Jumlah partikel = mol x n
Cth :
massa 7liter nitrogen pada suhu dan tekanan tertentu 5,6gr.
Tentukan jumlah atom hidrogen yang terdapat dalam 17,5 liter gas
hidrogen pada suhu dan tekanan sama jika diketahui bil avogadro
6,02 x 10
23
23
2
2
2 2
2
2
2
10 x 3,01 10 x 6,02 x 0,5
hidrogen atom jumlah jadi
mol 0,5 mol
7
3,5
H mol
H mol x 7 17,5 x 0,2
17,5
7
H mol
28
5,6
H vol.gas
N vol.gas
H gas n
N gas n
23
Rumus Empiris adalah rumus kimia yang paling sederhana yang
menyatakan perbandingan atom-atom dari unsur-unsur perbentuk
senyawa tersebut.
Cth:
Dalam 6 gram senyawa ,terdapat 2,4 gram karbon 0,4 gram
hidrogen,dan sisanya oksigen.Tentukan
rumus empiris senyawa tersebut!(Ar H=1 C=12 O=16)
Massa oksigen = massa senyawa (massa C + massa H)
= 6 - (2,4+0,4) = 3,2 gram
C : H : O
Perbandingan massa 2,4 : 0,4 : 3,2
Perbandingan mol 2,4/ArC : 0,4/ArH : 3,2/ArO
2,4/12 : 0,4 /1 : 3,2/16
0,2 : 0,4 : 0,2
1 : 2 : 1
Rumus empiris = CH
2
O
Rumus Molekul adalah rumus kimia yang memberikan informasi
secara tepat tentang jenis unsur pembentuk satu molekul senyawa
dan jumlah atom masing-masing unsur.
Cth:
Suatu senyawa mempunyai rumus empiris CH
2
O mempunyai Mr=
60.Tentukan rumus molekul senyawa tersebut! Ar C=12 H=1 O=16.
Mr (CH
2
O)n = 60
(ArC + 2Ar H + Ar O)n =60
(12+2.1+16)n=60
30n=60
n=2
Rumus molekul =(CH
2
O)
2
= C
2
H
4
O
2
Persamaan Reaksi biasanya
dinyatakan dengan persamaan
kimia.cara penulisan didasari
atas hukum kekalan massa.
Antara zat produk denan zat
reakstan dihubungkan dengan
tanda panah ().
2H
2(g)
+ O
2(g)
2H
2
O
(l)
1. Zat-zat yang berada sebelum
tanda panah disebut reaktan,
yaitu 2H
2(g)
+ O
2(g)
2. Zat-zat yang berada sesudah
panah disebut produk yaitu
2H
2
O
(l)
.
3. Angka didepan zat disebut
koefisien reaksi
4. Angka dibelakang zat disebut
indeks
5. Tanda wujud dari zat dalam
persamaan reaksi ditulis sebagai
berikut:
(s) = padat (g) = gas
(l) = cair (aq) = larutan dlm air
6. Harga-harga koefisien reaksi
dalam persamaan reaksi dapat
menunjukkanperbandingan
molekul atau mol
Bilangan oksidasi adalah
ukuran kemampuan suatu atom
untuk melepaskan atau
menerima elektron dalam
pembentukan suatu senyawa.
Harga bilangan oksidasi
menunjukkan banyaknya
elektron yang dapat dilepaskan
atau dapat diterima, harga ini
dapat positif dapat pula negatif.
Jika bertanda positif berarti atom
melepaskan elektron dan jika
bertanda negatif artinya atom
menerima elektron.
1. Bilangan oksidasi unsur bebas =
0, unsur dengan indeks (s), (l),
(g)
2. Biloks senyawa = 0
H
2
O = 0 NaCl = 0
3. Biloks unsur dalam senyawa:
gol IA = +1
Gol IIA = + 2
Logam (gol B) = +
4. Bilangan oksidasi ion :
- Ion monoatom sama dengan
muatan ionnya.
Ex.
Na
+
= +1 Ca
2+
= +2
Cl
-1
= -1 O
-2
= -2
- Ion poliatom, unsur yang
berbentuk senyawa tapi punya
muatan
Ex. SO
4
2-
= -2 NO
3
-
= -1
PO
4
3-
= - 3 NH
4
+
= +1
5. Biloks penentu dalam senyawa:
H = +1 O = -2
Gol VIIA (F, Cl, Br, I) = -1
Menyetarakan persamaan reaksi tanpa perubahan
biloks
1. Tuliskan persamaan reaksi dengan rumus kimia pada reaktan dan
produk yang benar.
2. Seimbangkan koefisien reaksi dengan patokan jumlah atom di kiri
dan di kanan anak panah harus sama tanpa merubah rumus
kimianya.
Cth: C
8
H
18
+ O
2
CO
2
+ H
2
O
C
8
H
18
+ O
2
8 CO
2
+ 9 H
2
O
2 C
8
H
18
+ 25 O
2
16 CO
2
+ 18 H
2
O
Reaksi Redoks adalah reaksi yang diesertai dengan perpindahan
elektron dari satu molekul/ion/atom reaktan (pereaksi) ke
molekul/ion/atom produk (hasil reaksi) dimana terjadi peristiwa
berkurangnya elektron atau bertambahnya bilangan oksidasi
suatu zat / ion.
> Sn
+2
Sn
+2
+ 2e Sn
+2
+ 2Hg
+2
+ 2Cl
-
Sn
+4
+ Hg
2
Cl
2
> 2e + 2Hg
+2
+ 2Cl
-
Hg
2
Cl
2
Menyetarakan Persamaan Reaksi Redoks
1) Metoda bilangan oksidasi
a. Tuliskan persamaan reaksi dengan rumus kimia yang benar.
b. Hitunglah bilangan oksidasi dari tiap-tiap unsur yang ada.
c. Periksalah satu persatu mana yang mengalami perubahan
bilangan oksidasi dan hitunglah perubahannya dan masukkan
koefisien reaksi sementara
d. Setarakan perubahan bilangan oksidasi, dalam arti:
elektron yang diberikan = elektron yang diterima
e. Setarakan unsur-unsur lain.
f. Bila diperlukan tambahkan H
2
O disebelah kiri dan/atau kanan
anak panah. Untuk menyetarakan tambahkan ion H
+
(suasana
asam) atau ion OH
-
(suasana basa) pada sisi berlawanan.
Reduksi: 6
6Fe
2+
+ Cr
2
O
7
2-
6Fe
3+
+ 2Cr
+2 +12 3+ +6
oksidasi : 1
6Fe
2+
+ Cr
2
O
7
2-
+ 14H
+
-> 6Fe
3+
+ 2Cr
3+
+ 7H
2
O
2) Metode Ion Elektron
a. Tuliskan persamaan reaksi dengan rumus kimia yang benar.
b. Bagi reaksi menjadi dua, masing2 setengah reaksi yaitu setengah reaksi reduksi
dan setengah reaksi oksidasi.
c. Setiap setengah reaksi disetarakan.
d. Samakan jumlah atom-atom selain atom H dan O diruas kiri dan kanan anak panah
dengan membubuhkan koefisien.
e. Samakan jumlah atom H dan O di ruas kiri dan kanan anak panah dengan:
Untuk reaksi dalam suasana asam:
pada ruas yang kekurangan oksigen ditambahkan H
2
O
pada ruas yang kekurangan hidrogen ditambah ion H
+
Untuk reaksi dalam suasana basa:
pada ruas yang kekurangan 1 oksigen ditambahkan 2 OH
-
pada ruas yang kekurangan hidrogen ditambahkan H2O
f. Samakan muatan masing-masing setengah reaksi pada ruas kanan dan ruas kiri
dengan jalan menambahkan elektron pada ruas yang kekurangan muatan negatif.
g. Samakan jumlah elektron pada kedua setengah reaksi
elektron yang dilepas = elektron yang diterima
h. Jumlahkan kedua setengah reaksi tersebut.
i. Hasil-hasil yang sama diruas kanan dan ruas kiri dapat dihapuskan.
PERHITUNGAN BERDASARKAN PERSAMAAN REAKSI
Stoikiometri melibatkan hubungan kuantitatif dalam reaksi kimia. Faktor
stoikiometri atau dikenal dengan rasio mol didasarkan pada koefisien
dalam persamaan setara dan digunakan untuk menghubungkan
reaktan atau produk. Massa molar dan faktor stoikiometri digunakan
untuk mengetahui informasi tentang salah satu reaktan atau produk
dalam reaksi kimia.
Cth:
Permukaan alumunium direaksikan dengan oksigen menghasilkan
oksidanya berdasarkan reaksi, dan berapa gram O2 diperlukan
untuk bereaksi dengan 0,3mol Al
4Al +3O2 2Al2O3
jadi yang didapat terdapat 4mol Al dan 3mol O2
sehingga 0,3 mol Al membutuhkan oksigen = x 0,3 = 0,225 mol
O2 yang diperlukan = 0,2225 mol= 0,225 x 32 = 7,2 gram
PEREAKSI PEMBATAS adalah zat-zat yang habis terlebih dahulu
dalam suatu suatu reaksi kimia.
(catatan: koefisien pada persamaan reaksi menyetakan jumlah atau
perbandingan mol dari senyawa-senyawa yang direaksikan)
Cth:
1. Satu mol larutan natrium hidroksida (NaOH) direaksikan dengan 1
mol larutan asam sulfat (H
2
SO
4
) sesuai reaksi: dan tentukan reaksi
pembatasnya!
2 NaOH(aq) + H
2
SO
4
(aq) > Na
2
SO
4
(aq) + 2 H
2
O(l)
Mol masing-masing zat dibagi koefisien, kemudian pilih hasil bagi yang
kecil sebagai pereaksi pembatas
mol NaOH/koefisien NaOH
= 0,5 mol
mol H
2
SO
4
/koefisien H
2
SO
4
=1/1 mol
= 1 mol
Karena hasil bagi NaOH < H
2
SO
4
, maka NaOH adalah pereaksi
pembatas, sehingga NaOH akan habis bereaksi lebih dahulu.
HASIL TEORITIS DAN PERSEN HASIL adalah hasil
maksimum yang mungkin terjadi bila hanya terjadi reaksi tunggal.
Sedangkan persen adalah
Cth :
Apabila diketahui massa CO
2
3,48 gr secara hasil nyata, dan
didapatkan didapatkan 5,43 CO
2
gr secara teoritis, hitunglah persen
hasilnya!
100% x
teoritis Hasil
nyata Hasil
Hasil Persen
64,1% 100% x
5,43
3,48
100% x
teoritis Hasil
nyata Hasil
Hasil Persen
ASPEK KUANTITATIP REAKSI KIMIA DALAM LARUTAN
AIR
1) Persen
Menunjukan bagian zat terlarut per 100 bagian larutan.
% bobot / bobot (b/b) sejumlah massa zat terlarut
(solut) tiap satuan massa larutan.
Contoh: 5 gr NaCl dalam100 gr larutan: 5,00% (b/b)
5,0% NaCl dalam air, berarti 5,00 g NaCl di dalam 100
gr larutan.
Maka larutan NaCl 5,00% dibuat dengan melarutkan
5,00 gr NaCl dalam (100 5) = 95 gr air.
% bobot / volume (b/v) sejumlah massa zat terlarut
tiap satuan volume larutan.
Contoh 5 gr glukosa dalam 100 ml larutan: glukosa 5%
(b/v)
% volume / volume (v/v) sejumlah volume zat terlarut
tiap satuan volume larutan.
Contoh 5 ml etanol dalam 100 ml larutan: etanol 5% (v/v)
2) PPM (PART PER MILLION)
Bagian zat terlarut per 10
6
bagian larutan.
dapat berupa ppm berat maupun ppm volume
Cth :
Berapa bpj kadar CO2 di udara, jika udara bersih
mengandung 0,00025% CO2?
6
10 x
total massa
ut zat terlar Massa
Ppm
bpj 5 , 2 10 x
100
0,00025
CO kadar
6
2
Molaritas (M) menyatakan jumlah mol zat terlarut dalam 1 Liter
larutan.
M = molaritas (satuan M)
massa = dalam satuan g
Mr = massa molar (satuan g/mol)
V = volume (satuan mL)
Cth:
Berapakah molaritas 9,8 gram H2SO4 (Mr=98) dalam 250 ml larutan?
M H2SO4= (9,8/98) mol / 0,25 liter
= (0,1 x 4) mol/liter
= 0,4 M
Larutan CuSO
4
0,1 M berarti 0,1 mol CuSO
4
dalam 1 liter larutan
CuSO
4
Larutan H
2
SO
4
18 M berarti 18 mol H
2
SO
4
dalam 1 liter larutan H
2
SO
4
Anda mungkin juga menyukai
- StoikiometriDokumen23 halamanStoikiometriPutri Putey100% (1)
- Stoikiometri 121128213928 Phpapp01Dokumen10 halamanStoikiometri 121128213928 Phpapp01Luqman LBelum ada peringkat
- 4 StoikiometriDokumen36 halaman4 StoikiometriMudatsir KhaikalBelum ada peringkat
- Persamaan ReaksiDokumen7 halamanPersamaan ReaksiRizky LestariBelum ada peringkat
- MR DAN PERSAMAAN REAKSIDokumen10 halamanMR DAN PERSAMAAN REAKSIZaini AjaBelum ada peringkat
- Stoikeometri UnhasDokumen27 halamanStoikeometri UnhasFirman MuhBelum ada peringkat
- STOIKIOMETRI KIMIADokumen50 halamanSTOIKIOMETRI KIMIADyah Ayu HadiatiBelum ada peringkat
- Materi 3.10Dokumen25 halamanMateri 3.10darnitaBelum ada peringkat
- Stoikiometri Reaksi KimiaDokumen24 halamanStoikiometri Reaksi Kimiakukut kucingBelum ada peringkat
- StokiometriDokumen60 halamanStokiometriMuhammad Naufal ibnu ilyasBelum ada peringkat
- STOIKIOMETRIDokumen16 halamanSTOIKIOMETRIMonita MialisBelum ada peringkat
- Kimia Industri - 3 STOIKIOMETRI - MR - Ihwan HamdalaDokumen33 halamanKimia Industri - 3 STOIKIOMETRI - MR - Ihwan HamdalaIhram RachmansyahBelum ada peringkat
- StokiometriDokumen60 halamanStokiometrikhusnulBelum ada peringkat
- Rumus Empiris Dan Rumus MolekulerDokumen29 halamanRumus Empiris Dan Rumus MolekuleranthinsiinBelum ada peringkat
- 6-7 Kimia StoikiometriDokumen14 halaman6-7 Kimia StoikiometriIzal MuriduBelum ada peringkat
- STOIKIOMETRIDokumen21 halamanSTOIKIOMETRIRolan AlfianBelum ada peringkat
- Persamaan ReaksiDokumen56 halamanPersamaan ReaksiDhevBelum ada peringkat
- Rumus KimiaDokumen11 halamanRumus KimiaIndra SaputraBelum ada peringkat
- Rumus MolekulDokumen16 halamanRumus MolekulHestyPratiwyLuphALmazBelum ada peringkat
- Deswan Sinaga - Kimia Diskusi 3Dokumen7 halamanDeswan Sinaga - Kimia Diskusi 3Silvia MonicaBelum ada peringkat
- Stokiometri Bag.2Dokumen24 halamanStokiometri Bag.2Naufal PrasetyaBelum ada peringkat
- Hand Out Materi Reaksi Oksidasi ReduksiDokumen11 halamanHand Out Materi Reaksi Oksidasi ReduksiBeny SaputraBelum ada peringkat
- Tugas Izma (Catatan Kimia)Dokumen33 halamanTugas Izma (Catatan Kimia)Asma DewhyBelum ada peringkat
- Stoikiometri SulispdfDokumen39 halamanStoikiometri SulispdfElni Yosevin LaoliBelum ada peringkat
- Optimized Title for Stoichiometry Concepts and Chemical Reactions (39Dokumen30 halamanOptimized Title for Stoichiometry Concepts and Chemical Reactions (39Natasya BooBelum ada peringkat
- STOIKIOMETRI KIMIADokumen19 halamanSTOIKIOMETRI KIMIASyahrir MuhsalBelum ada peringkat
- STOIKIOMETRIDokumen33 halamanSTOIKIOMETRIhuman sinnerBelum ada peringkat
- StoikiometriDokumen51 halamanStoikiometriHadi Maulana HamzahBelum ada peringkat
- Tata Nama SenyawaDokumen10 halamanTata Nama SenyawaM Abdi Abdul AfisBelum ada peringkat
- PDF Stoikiometri DLDokumen55 halamanPDF Stoikiometri DLAdinda novia SalsabillaBelum ada peringkat
- STOIKIOMETRIDokumen31 halamanSTOIKIOMETRINandya AristaBelum ada peringkat
- Kimia Dasar 4Dokumen11 halamanKimia Dasar 4Marwan RamadhanBelum ada peringkat
- KimiaDokumen12 halamanKimiaNoevitha Jmblhwti Pncricnta100% (1)
- Reaksi Kimia Dan PenyetaraanDokumen15 halamanReaksi Kimia Dan PenyetaraanTUTIBelum ada peringkat
- Hukum Dasar Kimia dan Perhitungan KimiaDokumen10 halamanHukum Dasar Kimia dan Perhitungan Kimiaai nurlelaBelum ada peringkat
- STOIKIOMETRIDokumen55 halamanSTOIKIOMETRIStuart YoungBelum ada peringkat
- STOIKIOMETRIDokumen40 halamanSTOIKIOMETRIAzmy Almas DalilaBelum ada peringkat
- 5 - Stoikiometri 6Dokumen41 halaman5 - Stoikiometri 6Hairun NisaBelum ada peringkat
- STOIKIOMETRI KIMIADokumen28 halamanSTOIKIOMETRI KIMIAFaridul FuadiBelum ada peringkat
- Materi Stoikiometri LanjutanDokumen35 halamanMateri Stoikiometri LanjutanMuhammad FadliBelum ada peringkat
- Modul StoikiometriDokumen15 halamanModul StoikiometriSyahru AhmadBelum ada peringkat
- 2 StokiometriDokumen9 halaman2 StokiometriFrido FaizalBelum ada peringkat
- Bahan AjarPersamaan Reaksi KimiaDokumen9 halamanBahan AjarPersamaan Reaksi Kimiaisrul hadiBelum ada peringkat
- Materi BimbelDokumen98 halamanMateri BimbelSangkala MarosBelum ada peringkat
- Bab II (Kimia X)Dokumen61 halamanBab II (Kimia X)NeenkzheeBelum ada peringkat
- Kelas X Perhitungan Kimia PDFDokumen26 halamanKelas X Perhitungan Kimia PDF[ EnrG ]Belum ada peringkat
- Al(s) + O2(g) → Al2O3(sDokumen45 halamanAl(s) + O2(g) → Al2O3(sAdnanRifqyGhiffarinBelum ada peringkat
- STOIKIOMETRIDokumen43 halamanSTOIKIOMETRIMuhammad RahmawanBelum ada peringkat
- 2 STOIKIOMETRI-kidasDokumen23 halaman2 STOIKIOMETRI-kidasHafidz YudisiyaBelum ada peringkat
- Bab 2. Persamaan Kimia Dan StoikiometriDokumen26 halamanBab 2. Persamaan Kimia Dan StoikiometriRacie YaNcie FarlopthyBelum ada peringkat
- PERSAMAAN REAKSIDokumen8 halamanPERSAMAAN REAKSIFUjiaBelum ada peringkat
- Persamaan RX & Hk. Dasar Kimia (FULL)Dokumen13 halamanPersamaan RX & Hk. Dasar Kimia (FULL)Khotimah Nurul AiniBelum ada peringkat
- Lecture - Note - Sesi-13 - STOIKIOMETRIDokumen23 halamanLecture - Note - Sesi-13 - STOIKIOMETRIberkasmengajardanangBelum ada peringkat
- StoikiometriDokumen36 halamanStoikiometriArumBelum ada peringkat
- HUKUM-HUKUM KIMIA DASARDokumen22 halamanHUKUM-HUKUM KIMIA DASARRickyFernando0% (1)
- Bahan Belajar 3 Kimia TeknikDokumen11 halamanBahan Belajar 3 Kimia TeknikWijayaBelum ada peringkat
- Persamaan ReaksiDokumen17 halamanPersamaan Reaksiwidya megantoroBelum ada peringkat
- P3. StoikiometriDokumen33 halamanP3. StoikiometriRaraBelum ada peringkat