REACCIONES Y ECUACIONES QUÍMICAS Plan
Diunggah oleh
Henry Rodriguez ArceJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
REACCIONES Y ECUACIONES QUÍMICAS Plan
Diunggah oleh
Henry Rodriguez ArceHak Cipta:
Format Tersedia
PLAN DE UNIDAD DE APRENDIZAJE 1.
- DATOS GENERALES: Unidad educativa: Col Quillacollo Tipo de establecimiento: Particular Turno: Maana Nivel: Secundaria Asignatura: Qumica Profesor: Gestin: II- 2012 Tema de la unidad didctica: REACCIONES Y ECUACIONES QUMICAS Tiempo: 240min 2.- COMPETENCIAS E INDICADORES: COMPETENCIAS Describe y analiza las distintas reacciones qumicas, en situaciones practicas relacionndolas con la vida cotidiana. INDICADORES Conoce el concepto de Ecuacin Qumica (1). Reconoce las caractersticas de las distintas reacciones Qumicos (2). Comprende la simbologa en escritura de una Ecuacin Qumica (3). Reconoce las caractersticas de las distintas clases de reacciones Qumicas (4). Comprende como se realizan los distintos mtodos de igualacin de reacciones Qumicas (5).
3.- PROPSITO PEDAGGICO: Que los estudiantes desarrollen conocimientos tericos y prcticos referentes a las caractersticas de los distintos mtodos de igualacin de Ecuaciones Qumica, mediante actividades ligadas a las explicaciones de los distintos conceptos y la realizacin de un trabajo prctico, para alcanzar aprendizajes significativos que le permitan entender en su totalidad las caractersticas de los distintos mtodos de igualacin de Ecuaciones Qumica.
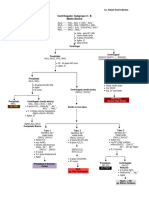
4.- CONTENIDOS: CONCEPTUALES Unidad 4: REACCIONES Y ECUACIONES QUMICAS 1. Ecuacin Qumica. 2.Clases de Reacciones Qumicas. 3.Escritura y equilibrio de una Ecuacin Qumica. 3.1. Mtodo de ensayo y error a simple inspeccin. 3.2. Mtodo de Oxidacin Reduccin 3.3. Mtodo del in electrn 3.4. Mtodo algebraico PROCEDIMENTALES Comprensin y lectura del texto Resolucin de cuestionario. Participacin en grupos de trabajo cooperativos. Sistematizacin de la informacin. Realizacin de un trabajo practico. ACTITUDINALES Respeta las ideas de los dems compaeros. Se responsabiliza en la presentacin de trabajos. Se compromete en el trabajo dentro y fuera del aula. Se interesa por la indagacin y bsqueda de la informacin.
5.- TRANSVERSAL A ENFATIZAR: Educacin para el medio ambiente CONTEXTO DE RELEVANCIA SOCIAL Valora crticamente distintas prcticas Propone alternativas de prevencin y Insuficiente informacin sobre la relacionadas con el manejo de los recursos solucin para distintos problemas importancia del medio ambiente y el naturales y del medio ambiente y promueve ambientales en su entorno inmediato (6). cuidado del mismo acciones de conservacin, considerando las normas ambientales vigentes. COMPETENCIA INDICADORES
6.- SECUENCIA DIDCTICA: MOMENTOS INICIO -Motivacin. -Presentacin de propsitos. -Recuperacin de conocimientos previos. DESARROLLO -Contratacin de conocimientos nuevos con previos. -Estructuracin de conocimientos nuevos. -Aplicabilidad. -Producto. SITUACIONES DIDCTICAS (ACTIVIDADES) Se atrae la atencin de los estudiantes con grficos que muestran ejemplo de las distintas reacciones Qumicas. Presentacin del tema y el propsito del mismo. Aplicacin de preguntas a los estudiantes para identificar sus conocimientos previos mediante sus participaciones. Leemos el texto de Qumica para conocer los distintos conceptos de ecuaciones Qumicas, igualacin, reaccin qumica, etc. Este trabajo se realiza de manera personal. Los estudiantes elaboran una sntesis de la lectura utilizando cualquier organizador grafico de su preferencia. Este trabajo se realiza de manera personal. Explicacin y reforzamiento del contenido del texto, (por parte del profesor) a travs de una explicacin interactiva. RECURSOS -Ppelo grafos -Texto gua. -Pizarra. -Tizas. TIEMPO EVALUACIN Evaluacin diagnostica: 30min Lista de cotejo. (1) (2)
Evaluacin de proceso: -Texto gua. -Texto gua -Pizarra. -Tizas. -Cuestionario. -Texto gua. -Lpiz o lapicero -Formulario de pregunta. -Texto gua -Pizarra. -Tizas. -Texto gua. -Lpiz o lapicero 60min 30min Lista de cotejo. (1) (2) (3) (4) (5) 30min Lista de cotejo. (1) (2) (3) (4) (5) 30min Cuestionario. (2) (3) (4) (5) Evaluacin final: Lista de cotejo. (1) (2) (3) (4) (5) Lista de cotejo. (1) (2) (3) (5) (6)
FINALIZACIN -Sntesis. -Metacognicin. -Celebracin.
Resolucin del cuestionario de prctica del texto. Aplicacin de una prueba objetiva del tema. Los estudiantes reflexionaran sobre los nuevos saberes que han aprendido, a travs de un comentario. Un momento de reflexin durante el cual los estudiantes anotan en tarjetas sus ideas de como lo aprendido se relaciona con el medio en que
60min
viven.
Bibliografa.Qumica Bsica 2 medio PAGINAS WEB.:
Autor: Ronaldo Albares
2010
http://es.wikipedia.org/wiki/Ecuaci%C3%B3n_qu%C3%ADmica
http://www.slideshare.net/guest34f42b1/clasificacion-de-reacciones-quimicas-presentation http://es.wikipedia.org/wiki/Reacci%C3%B3n_qu%C3%ADmica http://es.wikipedia.org/wiki/Equilibrio_qu%C3%ADmico
Prueba de qumica Nombre
1. Qu es una Reaccin Qumica?
curso
2. Qu es una Ecuacin Qumica?
3. Qu tipos de Reacciones Qumicas conoces?
4. Cul es la diferencia entre una reaccin de simple sustitucin y una de doble sustitucin?
5. Por qu es importante igualar una Ecuacin Qumica?
6. en qu consiste los siguientes mtodos de igualacin ? Tanteo:
In electrn:
Redox:
Algebraico
Problemas Resueltos: 1 Balancee por el mtodo del in-electrn las siguientes reacciones: a) Zn + NO3- + H+ Zn+2 + NH4+ + H2O b) Fe+2 + NO3- Fe+3 + NO (solucin cida) c) MnO4- + I- + H2O MnO2 + I2 + OHd) CIO3- + I- CI- + I2 (solucin bsica) Soluciones: La ecuacin est en forma inica y est en medio cido por contener iones hidrgenos H+. Escribimos las ecuaciones inicas parciales del agente oxidante y reductor, y le aplicamos todos los pasos: 4 x (Zn Zn+2 + 2e- ) Ag. Reductor 1 x ( NO3- + 10 H+ + 8 e- NH4+ + 3 H2O) Ag. Oxidante 4 Zn 4Zn+2 + 8eNO3- + 10 H+ + 8 e- NH4+ + 3 H2O 4Zn + NO3- + 10 H+ 4Zn+2 + NH+4 + 3 H2O Otra forma de resolverlo: Zn Zn+2 NO3- NH4+ Zn Zn+2 NO3- NH4+ + 3 H2O Zn Zn+2 NO3- + 10 H+ NH4+ + 3 H2O 4 x (Zn Zn+2 + 2 e-) NO3- + 10 H+ + 8e- NH4+ + 3 H2O
4 Zn 4Zn+2 + 8eNO3- + 10 H+ + 8 e- NH4+ + 3H2O 4 Zn + NO3- + 10 H+ + 8e- 4Zn+2 + NH4- + 3 H2O b) La ecuacin est en solucin cida no tiene los iones de H+ pero al balancearla le colocaremos los iones de H+ y H2O. 3 x ( Fe+2 Fe+3 + 1 e- ) (Ag. Reductor) NO3- + 4 H+ + 3e- NO + 2 H2O (Ag. Oxidante) 3Fe+2 3Fe+3 + 3 eNO3- + 4 H+ + 3e- NO + 2 H2O 3Fe+2 + NO3- + 4 H+ 3Fe+3 + NO + 2 H2O Otra forma: Fe+2 Fe+3 3Fe-3 NO Fe+2 Fe+3 NO3- NO + 2 H2O Fe+2 Fe+3 NO3- 4 H+ + NO + 2 H2O Fe+2 Fe+3 + e- NO3- + 4 H+ + 3e- NO + 2 H2O 3 Fe+2 3 Fe+3 + 3 eNO3- + 4 H+ + 3e NO + 2 H2O 3 Fe+2 + NO3- + 4 H+ 3 Fe+2 + NO + 2 H2O c) La ecuacin est en medio alcalino por presencia de OH-. Se realizan los pasos comunes hasta el 6 y luego se agrega a cada miembro tanto OH- como H+ haya, luego se eliminan los H+ formando agua y se eliminan los O2O duplicados en ambos miembros. MnO4- + 4 H+ + 3 e- MnO2 + 2 H2O Ag. Oxidante 2 I- I2 + 2 e- Ag. Reductor Ahora agrego al agente oxidante a la izquierda y a la derecha 4 OH-, combino los 4 OH- con 4 H+ y formo 4 H2O y elimino 4 H2O a la izquierda con 2 H2O a la derecha y nos quedan 2 H2O a la izquierda.
MnO4- + 4 H+ + 4 OH- + 3 e- MnO2 + 2 H2O + 4 OH2 4 H2O 2 I- I2 + 2 e2 x (MnO4- + 2 H2O + 3 e- MnO2 + 4 OH-) 3 x (2 I- I2 + 2 e-) 2 MnO4- + 4 H2O + 6 e- 2 MnO2 + 8 OH6 I- 3 I2 + 6 e2 MnO4- + 6 I- + 4 H2O 2 MnO2 + 3 I2 + 8 OHd) La ecuacin est en solucin bsica, no aparecen los iones OH-, pero stos los colocaremos junto con el agua al balancear la ecuacin. ClO3- + 6 H+ + 6 e- Cl- + 3 H2O Ag. Oxidante 2 I- I2 + 2 e- Ag. Reductor ClO3- + 6 H+ + 6 OH- + 3 e- Cl- + 3 H2O + 6 OH3 6 H2O 2 I- I2 + 2 e1 x (ClO3- + 3 H2O + 6 e- Cl- + 6 OH-) 3 x (2 I- I2 + 2 e-) ClO3- + 3 H2O + 6 e- Cl- + 6 OH6 I- 3I2 + 6 eClO3- + 6 I- + 3 H2O Cl- + 6 I2 + 6 OH2 Balancee por medio de la media reaccin e indique cul es el agente oxidante y cul el agente reductor.
a) Bi2O3 + KOH + KClO KBiO3 + KCl + H2O b) Cl2 + KOH KClO3 + KCl + H2O c) C + HNO3 CO2 + NO2 + H2O Soluciones: Estas ecuaciones estn en forma molecular, debemos pasarla a forma inica. a) Bi2O3 + K+OH- + K+ClO K+BiO3- + K+Cl - + H2O Se escriben las ecuaciones inicas parciales de los agentes oxidante y reductor. Bi2O3 + 3 H2O 2 BiO3- + 6H+ + 4 e- Ag. Reductor. ClO- + 2H+ + 2 e- Cl- + H2O Ag. Oxidante. Como est en medio alcalino por contener iones OH- (KOH), se deben eliminar los H+ agregando en ambos miembros de cada semi-reaccin tantos OH- como H+ haya, luego combinar los H+ para formar H2O y eliminar el H2O duplicando en ambos miembros. 1 x (Bi2O3 + 3 H2O + 6 OH- 2 BiO3- + 6H+ + 6 OH- + 4 e-e) 3 6 H2O 2 x (ClO- + 2H+ + 2 OH- + 2 e- Cl- + H2O + 2 OH-) 2 H2O 2 Bi2O3 + 6 OH- 2 BiO3- + 6H+ + 3 H2O + 4 e-e 2 ClO- + 2 H2O + 4 e-e 2 Cl- + 4 OHBi2O3 + 2 OH- + 2 ClO- 2 BiO3- + 2 Cl- + H2O y trasladamos los coeficientes a la ecuacin molecular: Bi2O3 + 2 KOH + 2KClO 2 KBiO3 + H2O
b) Esta reaccin es en solucin bsica por la presencia de KOH. Esta es una reaccin de dismutacin. Cl2 + K+ OH- K+ ClO3- + K+ Cl- + H2O Se escriben las ecuaciones inicas parciales de los agentes oxidante y reductor Cl2 + 6 H2O 2 ClO3- + 12 H+ + 10 eCl2 + 2 e- 2 Cl1 x ( Cl2 + 6 H2O + 12 OH- 2 ClO3- + 12 H+ + 12 OH- + 10 e- ) 6 12 H2O 5 x (Cl2 + 2 e- 2 Cl-) Cl2 + 12 OH- 2 ClO3- + 6 H2O + 10 e-) 5 Cl2 + 10 e- 10 Cl6 Cl2 + 12 OH- 2 ClO3- + 6 H2O + 10 ClSimplificando tenemos: 3 Cl2 + 6 OH- ClO3- + 3 H2O + 5 Cly trasladamos estos coeficientes a la ecuacin molecular: c) C + H+NO3- CO2 + NO2 + H2O Esta reaccin esta en solucin cida por la presencia de HNO3 cida trioxontrico (v) o Trioxonitrato (v) de hidrgeno, tradicionalmente llamado cido ntrico. Se escriben las reacciones inicas parciales de los agentes: oxidante y reductor. 1 x (C + 6H2O CO2 + 4 H+ + 4 e-) Ag. Reductor. 4 x (NO3- + 2 H+ + e- NO2 + H2O) Ag. Oxidante. C + 2 H2O CO2 + 4 H+ + 4 e42
4 NO3- + 8 H+ + 4 e- 4 NO2 + 4 H2O) C + 4 NO3- + 4 H+ CO2 + 4 NO2 + 2 H2O y se trasladan los coeficientes a la ecuacin molecular: C + 4 HNO3 CO2 + 4 NO2 + 2H2O Otra forma de resolverlo: C CO2 HNO3 NO2 C + 2 H2O CO2 HNO3 + H+ NO2 + H2O C + 2 H2O + 4 e- CO2 + 4 H+ HNO3 + H+ NO2 + H2O + eC + 2 H2O + 4 e- CO2 + 4 H+ 2 4HNO3 + 4 H+ 4 NO2 + 4 H2O + 4 eC + 4 HNO3 CO2 + 4 NO2 + 2 H2O
Anda mungkin juga menyukai
- Informe de Resistencia de Aislamiento, Laboratorio de Medidas Eléctricas 2 - FIEE UNI.Dokumen6 halamanInforme de Resistencia de Aislamiento, Laboratorio de Medidas Eléctricas 2 - FIEE UNI.jesusBelum ada peringkat
- Minería Metálica en el PerúDokumen32 halamanMinería Metálica en el PerúClaudia Abanto LLican ʚïɞBelum ada peringkat
- CampbellDokumen22 halamanCampbellSergio Malta Rosa100% (4)
- Tema 1 IntroducciónDokumen33 halamanTema 1 IntroducciónHenry Rodriguez ArceBelum ada peringkat
- Funciones de Las ProteínasDokumen3 halamanFunciones de Las ProteínasHenry Rodriguez ArceBelum ada peringkat
- Reglamento InternoDokumen3 halamanReglamento InternoHenry Rodriguez ArceBelum ada peringkat
- CartillasDokumen28 halamanCartillasHenry Rodriguez Arce100% (1)
- Que Es El Código BinarioDokumen4 halamanQue Es El Código BinarioHenry Rodriguez Arce100% (1)
- Experimento de FisicaDokumen4 halamanExperimento de FisicaHenry Rodriguez ArceBelum ada peringkat
- PLAN de CirculatorioDokumen10 halamanPLAN de CirculatorioHenry Rodriguez ArceBelum ada peringkat
- Em Briolo GiaDokumen16 halamanEm Briolo GiaHenry Rodriguez ArceBelum ada peringkat
- Alquenos y AlquinosDokumen22 halamanAlquenos y AlquinosHenry Rodriguez ArceBelum ada peringkat
- Apuntes Metodologia 2013Dokumen26 halamanApuntes Metodologia 2013Henry Rodriguez ArceBelum ada peringkat
- 2 Formas de Ganar Dinero Realmente Por InternetDokumen7 halaman2 Formas de Ganar Dinero Realmente Por InternetpokeritoBelum ada peringkat
- 2 Formas de Ganar Dinero Realmente Por InternetDokumen7 halaman2 Formas de Ganar Dinero Realmente Por InternetpokeritoBelum ada peringkat
- ToxoplasmosisDokumen32 halamanToxoplasmosisHenry Rodriguez ArceBelum ada peringkat
- Filiacion Personal Del Alumno (A)Dokumen2 halamanFiliacion Personal Del Alumno (A)Henry Rodriguez ArceBelum ada peringkat
- Secado Fac Quimica UNAMDokumen23 halamanSecado Fac Quimica UNAMRicardo Segura FBelum ada peringkat
- Presion CapilarDokumen6 halamanPresion CapilarVanesa CalleBelum ada peringkat
- S3 - Informe de HibridacionDokumen5 halamanS3 - Informe de HibridacionJorge Luis Martínez ChaupeBelum ada peringkat
- UNIDAD 3 Sistema de Generación de EnergiaDokumen14 halamanUNIDAD 3 Sistema de Generación de EnergiaCsar PantojasBelum ada peringkat
- Choques en Dos DimensionesDokumen7 halamanChoques en Dos DimensioneskelvinBelum ada peringkat
- Parcial No. 2 Martha LeguizamonDokumen3 halamanParcial No. 2 Martha LeguizamonVictor Hugo Rincon RoseroBelum ada peringkat
- Valoraciones RedoxDokumen13 halamanValoraciones RedoxMara MarquezBelum ada peringkat
- Tipos de Corrosión.Dokumen22 halamanTipos de Corrosión.javier aldereteBelum ada peringkat
- HEMPEL'S CURING AGENT 9765200000 Es-EsDokumen17 halamanHEMPEL'S CURING AGENT 9765200000 Es-EsJose ManuelBelum ada peringkat
- Matriz de PeligrosDokumen1.130 halamanMatriz de Peligrosvanessa arrighiBelum ada peringkat
- Propiedades de Los SolidosDokumen2 halamanPropiedades de Los SolidosLuis GonzBelum ada peringkat
- Quimica 3 Pat 1Dokumen19 halamanQuimica 3 Pat 1lorena garciaBelum ada peringkat
- Apuntes Fisica y Quimica 4º EsoDokumen5 halamanApuntes Fisica y Quimica 4º EsoMario Garcia RomoBelum ada peringkat
- Incendios Maestria1Dokumen45 halamanIncendios Maestria1Abel Foraquita ChoqueBelum ada peringkat
- Unidad La Tierra y Su Entorno Guia 3 2do Ciclo JunioDokumen10 halamanUnidad La Tierra y Su Entorno Guia 3 2do Ciclo Junioyesenia0312Belum ada peringkat
- Caracteristicas Fisicas y Quimicas Del Material ParticuladoDokumen8 halamanCaracteristicas Fisicas y Quimicas Del Material ParticuladoRuelas Mijhael100% (1)
- Jar TestDokumen15 halamanJar TestGabriel Opazo QuezadaBelum ada peringkat
- Azul de BromotimolDokumen12 halamanAzul de BromotimolEsteban IsazaBelum ada peringkat
- Presentación 5Dokumen16 halamanPresentación 5a21080045Belum ada peringkat
- INFORME 3 Balance Macroscopico de Energia-Tall. y Labs. 4Dokumen8 halamanINFORME 3 Balance Macroscopico de Energia-Tall. y Labs. 4CARLOS ANDRES PEÑA BARCOBelum ada peringkat
- Crucigrama Repaso SABER-ICFES - Once PDFDokumen5 halamanCrucigrama Repaso SABER-ICFES - Once PDFLukas LunaBelum ada peringkat
- Introducción A La ÓpticaDokumen2 halamanIntroducción A La ÓpticaJorge CaviedesBelum ada peringkat
- Lab - Ii-Variacion de Presion Con La ProfundidaDokumen7 halamanLab - Ii-Variacion de Presion Con La ProfundidaheberBelum ada peringkat
- Laboratorio #1Dokumen3 halamanLaboratorio #1Darielys AcostaBelum ada peringkat
- Analisis Subgrupo II B de CationesDokumen1 halamanAnalisis Subgrupo II B de CationesCocarico Quispe Jhoseline RosyBelum ada peringkat
- Antropometría.: Arq. María Cecilia Torres Vargas Con Algunas Diapositivas Cortesía de Miluska NewmanDokumen34 halamanAntropometría.: Arq. María Cecilia Torres Vargas Con Algunas Diapositivas Cortesía de Miluska NewmanMayra Tamayo ReyesBelum ada peringkat
- Strawn 2021Dokumen22 halamanStrawn 2021Fernando GutiérrezBelum ada peringkat