Perguntas de Fermentação
Diunggah oleh
10a06Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Perguntas de Fermentação
Diunggah oleh
10a06Hak Cipta:
Format Tersedia
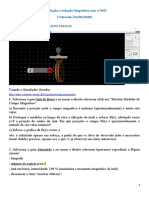
1. Definir constante de Michaelis-Mentem (Km) e mostrar a relao entre seu valor e a afinidade da enzima pelo seu substrato.
A constante de Michaelis-Mentem, Km , definida como a concentrao na qual a velocidade de uma reao enzimtica metade da velocidade mxima, a Vmax. Sua equao nos permite demonstrar como a velocidade de uma reao varia em diferentes concentraes de substrato. Esta equao pode ser expressa graficamente, e representa o efeito da concentrao de substrato sobre a velocidade de reao enzimtica. O Km de um substrato para uma enzima especfica caracterstico, e nos fornece um parmetro de especificidade deste substrato em relao enzima. Quanto menor o Km, maior a especificidade, e vice-versa. 2. Definir enzima, substrato e stio ativo.
- Enzimas so catalisadores biolgicos, formados por longas cadeias de molculas pequenas, chamadas de aminocidos. So, portanto, um tipo de protena com atividade cataltica, sendo encontradas na natureza em todos os seres vivos. - Substratos so reagentes/composto qumico que ligam-se molcula da enzima em uma regio especfica, o stio ativo, de modo a permitir a catlise. Eles se encaixam em enzimas seguindo um modelo chave-fechadura ou encaixe induzido. - O stio ativo uma cavidade da enzima, com forma definida, aberta na superfcie da molcula globular da enzima, constituda por grupos R de aminocidos, no qual os substratos se ligam de forma a permitir a ocorrncia da catlise. 3. Temperatura e pH podem interferir na atividade enzimtica? Justifique sua resposta.
A temperatura, assim como o pH, so fatores de grande influncia sobre a atividade enzimtica, visto que so agentes capazes de provocar mudanas conformacionais na estrutura proteica. A elevao da temperatura, dentro de um certo limite, produz aumento na velocidade de uma reao catalisada enzimaticamente. Mas, a partir de certa temperatura, a velocidade da reao diminui devido a desnaturao da enzima (quando a enzima perde suas propriedades). Cada enzima trabalha melhor em uma faixa de temperatura caracterstica, a temperatura tima, na qual a velocidade da reao catalisada a mxima possvel e sem a ocorrncia de desnaturao. Cada enzima tem seu pH timo especfico de atuao, onde sua atividade ser mxima. Para a maioria das enzimas, o pH timo est prximo de 7, ou seja, do neutro. Alteraes extremas de pH podem modificar a estrutura da enzima devido a uma repulso de cargas, assim como alteraes mais leves de pH podem causar a dissociao de enzimas oligomricas. 4. vantajoso o uso de enzimas em transformaes bioqumicas? Justifique. Sim, pois as enzimas, em transformaes bioqumicas, ocasionam: - Diminuio da energia de ativao, causando altas velocidades de reao. - So bastante especficas. - So sintetizadas pelas prprias clulas. - Possuem concentrao e atividade ajustveis, permitindo ajuste fino do metabolismo ao ambiente celular.
Anda mungkin juga menyukai
- Apostila Teórica ST405Dokumen34 halamanApostila Teórica ST405Gabrielle AssumpçãoBelum ada peringkat
- Legislacao Poluicao Ar Jose PereiraDokumen12 halamanLegislacao Poluicao Ar Jose PereiraWellington LimaBelum ada peringkat
- Perguntas de Fermentação IIDokumen3 halamanPerguntas de Fermentação II10a06Belum ada peringkat
- Expressão gênica procariotasDokumen8 halamanExpressão gênica procariotastheodorathaysBelum ada peringkat
- Lei 5.991 de 17 de Dezembro de 1973Dokumen8 halamanLei 5.991 de 17 de Dezembro de 197310a06Belum ada peringkat
- Dieta Da UspDokumen1 halamanDieta Da Usp10a06Belum ada peringkat
- Biotecnologia L 06Dokumen58 halamanBiotecnologia L 0610a06Belum ada peringkat
- 01-Citacoes e Referencias BibliograficasDokumen16 halaman01-Citacoes e Referencias Bibliograficas10a06Belum ada peringkat
- T0213-2 (1)Dokumen1 halamanT0213-2 (1)10a06Belum ada peringkat
- Lista Exercícios BGMDokumen2 halamanLista Exercícios BGM10a06100% (1)
- Química Orgânica FundamentosDokumen54 halamanQuímica Orgânica Fundamentos10a06100% (1)
- Exercício Sobre A Linguagem Dos Mapas e Os Erros Da Cartografia TemáticaDokumen1 halamanExercício Sobre A Linguagem Dos Mapas e Os Erros Da Cartografia TemáticaMarcus Vinicius Figueiredo GomesBelum ada peringkat
- Lei de Lenz Transformador Gerador ExpFaraday PhET Tomaz 17 06 20Dokumen4 halamanLei de Lenz Transformador Gerador ExpFaraday PhET Tomaz 17 06 20Kelly CrysBelum ada peringkat
- MRUV: Relatório de prática experimentalDokumen8 halamanMRUV: Relatório de prática experimentaldiego garciaBelum ada peringkat
- Apostila de OplatDokumen59 halamanApostila de OplatTania Barbosa50% (2)
- Importancia Das Planilhas Eletronicas para Atuação Na EngenhariaDokumen2 halamanImportancia Das Planilhas Eletronicas para Atuação Na EngenhariaGustavoAlmeidaBelum ada peringkat
- Apostila AV - Basica - Hottec PDFDokumen42 halamanApostila AV - Basica - Hottec PDFAmanda GamaBelum ada peringkat
- Registrador de dados LogBox-AADokumen9 halamanRegistrador de dados LogBox-AAEverson DantasBelum ada peringkat
- Ensino Estruturas Aço Engenharia ArquiteturaDokumen171 halamanEnsino Estruturas Aço Engenharia ArquiteturapeanutfilBelum ada peringkat
- Orientações para entrega da lista de carnavalDokumen22 halamanOrientações para entrega da lista de carnavalAnonymous JJbrn9zebBelum ada peringkat
- Análise de Esperando GodotDokumen8 halamanAnálise de Esperando GodotPepaSilvaBelum ada peringkat
- Funções de mais de duas variáveisDokumen11 halamanFunções de mais de duas variáveisPaulo SampaioBelum ada peringkat
- Comparativo Da Revista Náutica Entre A Evolve 265 e A Ventura 265Dokumen2 halamanComparativo Da Revista Náutica Entre A Evolve 265 e A Ventura 265Rômulo MartinsBelum ada peringkat
- Teste3 - 2P - 9ºano (Fev21)Dokumen3 halamanTeste3 - 2P - 9ºano (Fev21)Sónia PereiraBelum ada peringkat
- Gestão de frota em tempo realDokumen73 halamanGestão de frota em tempo realmotocas128Belum ada peringkat
- Atuacao Fisico MedicoDokumen42 halamanAtuacao Fisico MedicoSamuel MartiniBelum ada peringkat
- Ficha V - Cinetica Quimica - Parte II - Equacao de ArrheniusDokumen2 halamanFicha V - Cinetica Quimica - Parte II - Equacao de ArrheniusAngelique ViannyBelum ada peringkat
- Programas de Curso - Villa-Lobos 2021Dokumen11 halamanProgramas de Curso - Villa-Lobos 2021Vanessa Antunes Terra PassosBelum ada peringkat
- Estudo de Confiabilidade - Preditiva VALE X Engenharia SKFDokumen30 halamanEstudo de Confiabilidade - Preditiva VALE X Engenharia SKFdaniel atachaguaBelum ada peringkat
- Relatorio Emulsão EscabicidaDokumen6 halamanRelatorio Emulsão EscabicidaSegundo ChavesBelum ada peringkat
- 48V Battery Bank SpecificationDokumen54 halaman48V Battery Bank SpecificationamhtetBelum ada peringkat
- Análise de Sistemas LinearesDokumen38 halamanAnálise de Sistemas LinearesVictorBelum ada peringkat
- Conjuntos numéricos e intervalosDokumen4 halamanConjuntos numéricos e intervalosJean Zanchettin Dutra0% (1)
- Isaac Newton - Biografia - O GloboDokumen34 halamanIsaac Newton - Biografia - O GloboJose MeraBelum ada peringkat
- 3 Estabilidade Estatica Latero DirecionalDokumen46 halaman3 Estabilidade Estatica Latero DirecionalLeandro BarbosaBelum ada peringkat
- Aeroporto de Lisboa. Portela: Prolongar TaxiwayDokumen9 halamanAeroporto de Lisboa. Portela: Prolongar TaxiwayAntónio Cerveira PintoBelum ada peringkat
- Aula 05 - Confiabilidade e Disponibilidade PDFDokumen25 halamanAula 05 - Confiabilidade e Disponibilidade PDFJulianodeLimaBelum ada peringkat
- Simulado Enade UnifacsDokumen1 halamanSimulado Enade UnifacsDanilo de OliveiraBelum ada peringkat
- Catalogo de Peças MWM NGD 3.0eDokumen126 halamanCatalogo de Peças MWM NGD 3.0eRick AlvesBelum ada peringkat
- Eletrólise e estequiometria em exercíciosDokumen24 halamanEletrólise e estequiometria em exercíciosPaulo VictorBelum ada peringkat
- Modelo de VerhulstDokumen34 halamanModelo de VerhulstsilviaBelum ada peringkat