Laboratorio N8
Diunggah oleh
Leandro CarrilloDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Laboratorio N8
Diunggah oleh
Leandro CarrilloHak Cipta:
Format Tersedia
AO DE LA INTEGRACION NACIONAL Y EL RECONOCIMIENTO DE NUESTRA
TEMA: ESTANDARIZACION DE SOLUCIONES
CATEDRATICO : Lic. Ing. Petronila Mrida Fanola. ALUMNO : CARRILLO MARTELL, Leandro CARRERA AULA TURNO : Ing. Mecatrnica Ciclo I : : NOCHE 1221503
2012-2
Lima, 26 de Noviembre del 2012.
ESTANDARIZACION DE SOLUCIONES: 1. OBJETIVOS: Aprender las tcnicas de valoracin de una solucin. Determinar la concentracin real de una solucin de HCl.
2.
PRINCIPIOS TERICOS: a. Estandarizacin:
El reactivo de concentracin exactamente conocida usado en una titulacin se conoce como solucin estndar. La exactitud de la concentracin de esta solucin impone un lmite fijo y definitivo en la exactitud del mtodo. Debido a esto, la preparacin de dichas soluciones se hace con mucho cuidado.
Se puede establecer la concentracin de una solucin estndar de forma directa o indirecta. La forma directa requiere que se disuelva una cantidad exactamente pesada de un reactivo de alta pureza en un volumen exactamente conocido.
La forma indirecta requiere la titulacin de una solucin que contiene una cantidad pesada de un compuesto puro con la solucin estndar. En ambos casos, se requiere de un compuesto qumico de alta purea como material de referencia. Este compuesto se conoce como estndar o patrn primario. El proceso por el cual se determina la concentracin de una solucin estndar titulado un patrn primario se conoce como valoracin.
Ing. Mecatronica - I Semestre
b.
Unidades Qumicas de concentracin:
Molaridad:
La molaridad (M), o concentracin molar, es el nmero de moles de soluto por cada litro de disolucin. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolucin, se tiene una concentracin de ese soluto de 0,5 M (0,5 molar). Para preparar una disolucin de esta concentracin habitualmente se disuelve primero el soluto en un volumen menor, p o r e j e m p l o 3 0 0 m L , y s e t r a s l a d a e s a d i s o l u c i n a u n matraz aforado, p a r a d e s p u s enrasarlo con ms disolvente hasta los 1000 mL. Es el mtodo ms comn de expresar la concentracin en qumica, sobre todo cuando se trabaja con reacciones qumicas y relaciones estequiomtricas.
Molalidad:
La molalidad (m) e s e l n m e r o d e moles de soluto por kilogramo de disolvente (n o d e disolucin). Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analtica, previo peso del vaso vaco para poderle restar el correspondiente valor.
La principal ventaja de este mtodo de medida respecto a la molaridade s q u e c o m o e l volumen d e u n a d i s o l u c i n d e p e n d e d e l a temperatura y de l a presin, c u a n d o s t a s cambian, el
volumen cambia con ellas. Gracias a que la molalidad no est en funcin del v o l u m e n , e s i n d e p e n d i e n t e d e l a t e m p e r a t u r a y l a
Ing. Mecatronica - I Semestre
p r e s i n , y p u e d e m e d i r s e c o n m a y o r precisin. Es menos empleada que la molaridad pero igual de importante.
La Normalidad:
La normalidad (N) es el nmero de equivalentes(n) de soluto (sto) por litro de disolucin (sc) . El nmero de equivalentes se calcula
d i v i d i e n d o l a m a s a t o t a l p o r l a m a s a d e u n equivalente:
Fraccin Molar:
En la fraccin molar relacionamos los moles del soluto con el que trabajamos con los moles de disolvente, con lo que se anulan los moles. Es un numero adimensional.
Patrones Primarios:
Son sustancias que permiten conocer por pesada la cantidad exacta tomada, ya que no se perturban en contacto con el aire. Caractersticas: Pureza alta y Estable, que no se altere con el tiempo, no higroscpico ni eflorescente fcil de conseguir y que no sea caro. Peso equivalente alto, solubilidad apreciable y carcter cido, base, oxidante o reductor fuerte.
Volumetra:
Es la determinacin de la concentracin de una sustancia mediante una valoracin, que es el clculo de volumen necesario de una sustancia de concentracin conocida (solucin
Ing. Mecatronica - I Semestre
patrn) que ha de reaccionar completamente con la sustancia a analizar .En el punto final de la valoracin.
3.
PROCEDIMIENTO EXPERIMENTAL:
a.
Materiales:
Vaso de precipitado. Matraz de Erlenmeyer. Bureta. Probeta. Soporte universal. Piceta.
b.
Reactivos: cido clorhdrico (HCl) 0.1N. Agua destilada. Carbonato de sodio anhidro (Na2 CO3) 0.05g. Indicador anaranjado de metilo.
c.
Procedimientos:
Estandarizacin de una Solucin de cido Clorhidrico: Poner el Carbonato de Sodio a un matraz Erlenmeyer. Disolverlo con 25 ml de agua destilada. Aadir 2 gotas de indicador anaranjado de metilo.
5 Ing. Mecatronica - I Semestre
Llenar la bureta con solucin preparada de cido clorhdrico hasta un volumen referencial y verificando que el pico se encuentre
completamente lleno y sin burbujas. Coloque el matraz con solucin de carbonato debajo de la bureta y deje caer lentamente el cido gota hasta que la solucin con anaranjado de metilo vire de color, (tenga en cuenta que el matraz debe estar sobre un fondo blanco, agitndolo continuamente con la mano derecha y abriendo la llave de la bureta con la mano izquierda). Anote el volumen gastado de cido.
4.
TABLA DE RESULTADO:
Peso exacto de NA2 CO3 (g) Volumen gastado de HCl en la valoracin (ml) Concentracin exacta del HCl (N)
0.05 11.3 0.0113
Ing. Mecatronica - I Semestre
5.
CUESTIONARIO: 1. Define con sus propias palabras: Valoracin volumtrica, Punto de Equivalencia e Indicador de reaccin.
Una valoracin volumtrica es aadir volmenes conocidos de una sustancia de concentracin conocida a una solucin, para determinar su concentracin. El punto de equivalencia es el punto del volumen en el cual se neutraliza una solucin. El Indicador, es una sustancia que al cambiar de color, te indica cuando la solucin llego a su punto de equivalencia, a este cambio de color se le llama vire del indicador.
2. Qu funcin cumple el NA2 CO3 en la valoracin realizada?
3. Se prepara NaOH en solucin acuosa de la siguiente manera: se pesaran 2 g de dicho compuesto y se diluyeron con H20 cantidad suficiente para 250 ml, Cul ser su normalidad aproximada?
4. Defina que es un patrn primario e indique su importancia en la volumetra. 5. Mencione las diferentes aplicaciones de la volumetra.
Ing. Mecatronica - I Semestre
Anda mungkin juga menyukai
- Guia de Laboratorio de Quimica IndustrialDokumen73 halamanGuia de Laboratorio de Quimica IndustrialJorge Alvites CardenasBelum ada peringkat
- 5 Preparacion y Estandarizacion de SolucionesDokumen7 halaman5 Preparacion y Estandarizacion de SolucionesAlexis Silva ParraBelum ada peringkat
- Practica 1Dokumen17 halamanPractica 1jhordanleoBelum ada peringkat
- Practica 7 SolucionesDokumen20 halamanPractica 7 SolucionesCarol PerezBelum ada peringkat
- Laboratorio 2. SolucionesDokumen6 halamanLaboratorio 2. SolucionesTiziano VirlaBelum ada peringkat
- REPORTE U1 E2 Química AnalíticaDokumen17 halamanREPORTE U1 E2 Química AnalíticaJuan antonio Barrera vazquezBelum ada peringkat
- Analitica 1Dokumen7 halamanAnalitica 1liguisBelum ada peringkat
- UntitledDokumen6 halamanUntitledMAYLI SOLANGE BERROCAL ALANYABelum ada peringkat
- Lab 4 Preparacion Soluciones Concentraciones Fisicas y QuimicasDokumen36 halamanLab 4 Preparacion Soluciones Concentraciones Fisicas y QuimicasMoises Tordoya100% (1)
- 7 QuimDokumen13 halaman7 QuimElis Terrel GamarraBelum ada peringkat
- Química Analitica I (#3) Dominical - Inicio II ParcialDokumen7 halamanQuímica Analitica I (#3) Dominical - Inicio II ParcialJosue TellezBelum ada peringkat
- Preparación y Estandarización de SolucionesDokumen10 halamanPreparación y Estandarización de SolucionesBriggitte RodríguezBelum ada peringkat
- Practica No 3 AnaliticaDokumen5 halamanPractica No 3 AnaliticaHector Rojas0% (1)
- Analisis VolumetricoDokumen10 halamanAnalisis VolumetricoAnonymous BDb4ul4VzvBelum ada peringkat
- Laboratorio N3 QuimicaDokumen10 halamanLaboratorio N3 QuimicaJohanna J. Pérez DucasaBelum ada peringkat
- Análisis Químico LQDokumen54 halamanAnálisis Químico LQJorge BucioBelum ada peringkat
- Estandarizacion KOHDokumen5 halamanEstandarizacion KOHheberth simancasBelum ada peringkat
- Informe 3 QuímicaDokumen11 halamanInforme 3 QuímicaJuan F. LermaBelum ada peringkat
- Quimica Analitica Informe 6Dokumen35 halamanQuimica Analitica Informe 6Eduardo Sandro Collas DuranBelum ada peringkat
- P7 Quimica AplicadaDokumen19 halamanP7 Quimica AplicadaMarco GoldenBelum ada peringkat
- PRACTICA 5 Química GeneralDokumen7 halamanPRACTICA 5 Química GeneralJose SalgueroBelum ada peringkat
- Estandarizacic3b3n Del Acido NitricoDokumen15 halamanEstandarizacic3b3n Del Acido NitricoAlejandro Muñoz LazoBelum ada peringkat
- Lab de Quimica 10Dokumen10 halamanLab de Quimica 10Nataniel HuarachiiBelum ada peringkat
- Laboratorio #01 - Preparación y Valoración de HCL Al 0.1 NDokumen8 halamanLaboratorio #01 - Preparación y Valoración de HCL Al 0.1 NAnthony Salas CaballeroBelum ada peringkat
- P11-Preparación de Soluciones-1Dokumen5 halamanP11-Preparación de Soluciones-1Mariajose FuentesBelum ada peringkat
- A: Ing. Alejandro Monroy Vergara DE Guadalupe Ccalla CoilaDokumen13 halamanA: Ing. Alejandro Monroy Vergara DE Guadalupe Ccalla CoilaSolange Lupe CoilaBelum ada peringkat
- Practica #07Dokumen13 halamanPractica #07Jennifer RobertsBelum ada peringkat
- Practica 1: Preparacion de Soluciones.Dokumen14 halamanPractica 1: Preparacion de Soluciones.Samuel LepeBelum ada peringkat
- Informe 4 QuimicaDokumen14 halamanInforme 4 QuimicaKevin Tapia RagasBelum ada peringkat
- Informe Previo Quimica Part 3Dokumen13 halamanInforme Previo Quimica Part 3Mar CeloBelum ada peringkat
- Practica 17 7a - Miramontes Alvarez Natalia JimenaDokumen11 halamanPractica 17 7a - Miramontes Alvarez Natalia Jimenanatalia alvarezBelum ada peringkat
- IME 20 2022 GuiaInfDokumen13 halamanIME 20 2022 GuiaInfMellerny Huaman ClementeBelum ada peringkat
- Informe s7 Química Práctica FinalDokumen23 halamanInforme s7 Química Práctica FinalBruno FernándezBelum ada peringkat
- P R A C T I C A Ii1Dokumen8 halamanP R A C T I C A Ii1Citlalli Arcadia OrozcoBelum ada peringkat
- Preparación y Valoración de HCL Al 0.1 NDokumen10 halamanPreparación y Valoración de HCL Al 0.1 NAryans Garden GyJho50% (4)
- Luis Enrique Islas García - VolumetriaDokumen20 halamanLuis Enrique Islas García - VolumetriaIslas StockBelum ada peringkat
- Luis Enrique Islas García - VolumetriaDokumen19 halamanLuis Enrique Islas García - VolumetriaEnrique100% (1)
- 4INFORME DE LABORATORIO DE BIOQUÍMICA (Soluciones)Dokumen24 halaman4INFORME DE LABORATORIO DE BIOQUÍMICA (Soluciones)andy180375% (12)
- Normalidad LaboratorioDokumen8 halamanNormalidad LaboratorioSebastianBelum ada peringkat
- Practica de Laboratorio N°5 2023-2Dokumen12 halamanPractica de Laboratorio N°5 2023-2Altamirano Lopez SandersBelum ada peringkat
- Guia N°6 Grado11° 2021Dokumen7 halamanGuia N°6 Grado11° 2021saray baldovino velasquezBelum ada peringkat
- Anteproyecto 3. Bojórquez Méndez Edward AntonioDokumen15 halamanAnteproyecto 3. Bojórquez Méndez Edward AntonioEdward MendezBelum ada peringkat
- Iv Analitica LaboratorioDokumen17 halamanIv Analitica LaboratorioJEFFERSON DAITON GOMEZ SHUPINGAHUABelum ada peringkat
- Laboratorio # 12 (Titulacion)Dokumen9 halamanLaboratorio # 12 (Titulacion)Ruben PeñaBelum ada peringkat
- Estandarización de SolucionesDokumen7 halamanEstandarización de SolucionesFrank Huamani SullaBelum ada peringkat
- Guía 5 QQ Preparacion de Titulaciones PDFDokumen8 halamanGuía 5 QQ Preparacion de Titulaciones PDFAlex FuBelum ada peringkat
- Aq 09 2019-Ii UnmsmDokumen40 halamanAq 09 2019-Ii UnmsmmeryBelum ada peringkat
- Informe Numero 6Dokumen20 halamanInforme Numero 6Christiam Del Castillo KustermanBelum ada peringkat
- Apartado2 - QUIMICADokumen21 halamanApartado2 - QUIMICAJose L. Montenegro P.Belum ada peringkat
- Practica SolucionesDokumen10 halamanPractica SolucionesMichell MéndezBelum ada peringkat
- Informe.06 Soluciones2.0Dokumen19 halamanInforme.06 Soluciones2.0DanaBelum ada peringkat
- Titulacion 1Dokumen3 halamanTitulacion 1Rosa SatoBelum ada peringkat
- Practica 06 Quimica GeneralDokumen28 halamanPractica 06 Quimica GeneralpieroBelum ada peringkat
- Practica 2Dokumen4 halamanPractica 2Eric MaldonadoBelum ada peringkat
- Practica N 6Dokumen8 halamanPractica N 6Kate ElizabethBelum ada peringkat
- Practica 5 Quimica IMM UAEHDokumen8 halamanPractica 5 Quimica IMM UAEHZuͥriͣeͫl MeyerBelum ada peringkat
- Soluciones y ExtandarizacionDokumen7 halamanSoluciones y ExtandarizacionStefany MamaniBelum ada peringkat
- Guía Nº4 - Lab. Titulación Ácido-BaseDokumen5 halamanGuía Nº4 - Lab. Titulación Ácido-Basejuan francisco urzua ramirezBelum ada peringkat
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDari EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadBelum ada peringkat
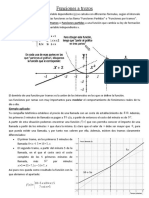
- Apunte Funciones Por TramosDokumen4 halamanApunte Funciones Por TramosBERYLL ZICARELLIBelum ada peringkat
- Informe 3 - Circuitos 3Dokumen6 halamanInforme 3 - Circuitos 3Daniel J. LopezBelum ada peringkat
- Cuidado Intensivo: Acta Colombiana deDokumen5 halamanCuidado Intensivo: Acta Colombiana deGreyss GamboaBelum ada peringkat
- Franz Bardon Practica de La Evocacion MagicaDokumen520 halamanFranz Bardon Practica de La Evocacion MagicaSandino Grullon100% (2)
- Conocete A Ti MismoDokumen35 halamanConocete A Ti MismoIng Jimmy De la CruzBelum ada peringkat
- Corea HuntingtonDokumen3 halamanCorea HuntingtonMarvin SalazarBelum ada peringkat
- OfimaticaDokumen80 halamanOfimaticameducacion1aBelum ada peringkat
- F-Cronograma de Inspecciones PlaneadasDokumen6 halamanF-Cronograma de Inspecciones Planeadashumberto sepulveda sandovalBelum ada peringkat
- Inte Iso 8995-1 2016Dokumen31 halamanInte Iso 8995-1 2016Robert Esteban Rockwood IglesiasBelum ada peringkat
- Lcg-1103 Mercadotecnia InternacionalDokumen13 halamanLcg-1103 Mercadotecnia InternacionalJulio Cesar Zamudio CerdaBelum ada peringkat
- Banco de DatosDokumen3 halamanBanco de DatosDiario Gestión100% (1)
- Introduccion y Objetivos Generales AYzygBKsDokumen5 halamanIntroduccion y Objetivos Generales AYzygBKsIgnacio De La CruzBelum ada peringkat
- Tipos de Clima Del MundoDokumen4 halamanTipos de Clima Del MundoYon Grober Aquise OrtizBelum ada peringkat
- Pip Creacion de La Losa Deportiva de MachacDokumen109 halamanPip Creacion de La Losa Deportiva de MachacRaul ColoniaBelum ada peringkat
- Unidad 3. Actividad 2. Práctica de Laboratorio Configurar El Switch Cisco 2960Dokumen14 halamanUnidad 3. Actividad 2. Práctica de Laboratorio Configurar El Switch Cisco 2960J Manuel BuenoBelum ada peringkat
- Report e Alum No Matric UlaDokumen1 halamanReport e Alum No Matric UlaBrayanBelum ada peringkat
- "Año de La Unidad, La Paz y Desarrollo": Situaciones Que Afectan Mi BienestarDokumen6 halaman"Año de La Unidad, La Paz y Desarrollo": Situaciones Que Afectan Mi BienestarJuank JvnakvBelum ada peringkat
- Taller 4 GrupalDokumen8 halamanTaller 4 GrupalJean Piero C. UrcoBelum ada peringkat
- Cultivos Marginados 1492 t0646s TextDokumen345 halamanCultivos Marginados 1492 t0646s TextVhumberto BaizavelarBelum ada peringkat
- Manual de Eval de DesempeñoDokumen20 halamanManual de Eval de DesempeñoestefnypolorBelum ada peringkat
- Imagen de La Ciudad de Quilpué, Sebastian TejadaDokumen7 halamanImagen de La Ciudad de Quilpué, Sebastian TejadaSebastian Tejada EstevezBelum ada peringkat
- GuiaPublica Modelos Formales de Procesos CognitivosDokumen10 halamanGuiaPublica Modelos Formales de Procesos CognitivosTony PignoliBelum ada peringkat
- BullyuingDokumen3 halamanBullyuingAleja JiemenezBelum ada peringkat
- Presentacion Diario TerapeuticoDokumen12 halamanPresentacion Diario Terapeuticoyolima rosero0% (1)
- Equipo de Protección Contra Incendios-1-45Dokumen45 halamanEquipo de Protección Contra Incendios-1-45LITZY RIVERABelum ada peringkat
- Restriccion Del Crecimiento IntrauterinoDokumen33 halamanRestriccion Del Crecimiento IntrauterinoXochilt itzel Cornelio HuertaBelum ada peringkat
- CatalogoDokumen44 halamanCatalogoPalacio De Los CosmeticosBelum ada peringkat
- Practica 2Dokumen13 halamanPractica 2neyderBelum ada peringkat
- Economía 1Dokumen2 halamanEconomía 1JosephBelum ada peringkat
- Charlas de 5 Minutos - 1era Quincena de Marzo 2024Dokumen15 halamanCharlas de 5 Minutos - 1era Quincena de Marzo 2024Agustin ValderramaBelum ada peringkat