Poli Meros
Diunggah oleh
Andrea Yoss MartinezHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Poli Meros
Diunggah oleh
Andrea Yoss MartinezHak Cipta:
Format Tersedia
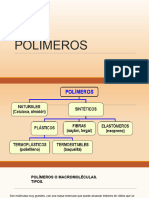
Qu son los polmeros?
La materia esta formada por molculas que pueden ser de tamao normal o molculas gigantes llamadas polmeros. Los polmeros se producen por la unin de cientos de miles de molculas pequeas denominadas monmeros que forman enormes cadenas de las formas ms diversas. Algunas parecen fideos, otras tienen ramificaciones. algunas ms se asemejan a las escaleras de mano y otras son como redes tridimensionales. Existen polmeros naturales de gran significacin comercial como el algodn, formado por fibras de celulosas. La celulosa se encuentra en la madera y en los tallos de muchas plantas, y se emplean para hacer telas y papel. La seda es otro polmero natural muy apreciado y es una poliamida semejante al nylon. La lana, protena del pelo de las ovejas, es otro ejemplo. El hule de los rboles de hevea y de los arbustos de Guayule, son tambin polmeros naturales importantes. Sin embargo, la mayor parte de los polmeros que usamos en nuestra vida diaria son materiales sintticos con propiedades y aplicaciones variadas. Lo que distingue a los polmeros de los materiales constitudos por molculas de tamao normal son sus propiedades mecnicas. En general, los polmeros tienen una excelente resistencia mecnica debido a que las grandes cadenas polimricas se atraen. Las fuerzas de atraccin intermoleculares dependen de la composicin qumica del polmero y pueden ser de varias clases.
Fuerzas de Van der Waals.
Tambin llamadas fuerzas de dispersin, presentes en las molculas de muy baja polaridad, generalmente hidrocarburos. Estas fuerzas provienen de dipolos transitorios: como resultado de los movimientos de electrones, en cierto instante una porcin de la molcula se vuelve ligeramente negativa, mientras que en otra regin aparece una carga positiva equivalente. As se forman dipolos no-permanentes. Estos dipolos producen atracciones electroestticas muy dbiles en las molculas de tamao normal, pero en los polmeros, formados por miles de estas pequeas molculas, las fuerzas de atraccin se multiplican y llegan a ser enormes, como en el caso del polietileno. En la tabla 1.1 se observa como cambian la densidad y la temperatura de fusin, al aumentar el nmero de tomos de carbono en la serie de los hidrocarburos. Los compuestos ms pequeos son gases a la temperatura ambiente. al aumentar progresivamente el nmero de carbonos, los compuestos se vuelven lquidos y luego slidos, cada vez con mayor densidad y mayor temperatura de fusin, hasta llegar a los polietilenos con densidades que van de 0,92 a 0, 96 g / cm3 y temperaturas de fusin entre 105 y 135 C.
Hidrocarburo
Frmula
Peso molecular 16 30 44 58 72 86 100 114 128 142 156 170 212 283 423 28000
Densidad
T. de fusin
Metano Etano Propano butano Pentano Hexano Heptano Octano Nonano Decano Undecano Dodecano Pentadecano Eicosano Triacontano Polietileno
CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 C11H24 C12H26 C15H32 C20H42 C30H62 C2000H4002
gas gas gas gas 0,63 0,66 0,68 0,70 0,72 0,73 0,74 0,75 0,77 0,79 0,78 0,93
-182 C -183 C -190 C -138 C -130 C -95 C -91 C -57 C -52 C -30 C -25 C -10 C 10 C 37 C 66 C 100 C
Densidad y temperatura de fusin de hidrocarburos.
Fuerzas de atraccin.
Debidas a dipolos permanentes, como en el caso de los polisteres. Estas atracciones son mucho ms potentes y a ellas se debe la gran resistencia tensil de las fibras de los polisteres.
Enlaces de hidrgeno.
Como en las poliamidas (nylon).
Estas interacciones son tan fuertes, que una fibra obtenida con estas poliamidas tiene resistencia tensil mayor que la de una fibra de acero de igual masa.
Otros polmeros.
Hay atracciones de tipo inico que son las ms intensas: Un ejemplo sera el copolmero etileno-cido acrlico, que al ser neutralizado con la base M(OH)2, producir la estructura indicada. Estos materiales se llaman ionmeros y se usan, por ejemplo, para hacer pelculas transparentes de alta resistencia.
Tipo de enlace Van der Waals en CH4 Dipolos permanentes Enlaces hidrgeno Inicos
Kcal / mol 2,4 3a5 5 a 12 mayores a 100
Energa requerida para romper cada enlace.
La fuerza total de atraccin entre las molculas del polmero, dependera del nmero de las interacciones. Como mximo, sera igual a la energa de enlace segn la tabla, multiplicada por el nmero de tomos de carbono en el caso del polietileno o por el nmero de carbonlicos C = O en los polisteres, etc. rara vez se alcanza este valor mximo, porque las cadenas de los polmeros no pueden, por lo general, acomodarse con la perfeccin que sera requerida.
Anda mungkin juga menyukai
- Las resinas sintéticas usadas para el tratamiento de obras policromasDari EverandLas resinas sintéticas usadas para el tratamiento de obras policromasBelum ada peringkat
- Transformación de materiales termoplásticos. QUIT0209Dari EverandTransformación de materiales termoplásticos. QUIT0209Penilaian: 2 dari 5 bintang2/5 (1)
- Qué Son Los PolímerosDokumen17 halamanQué Son Los PolímerosAmerico Paz torresBelum ada peringkat
- POLIMEROSDokumen24 halamanPOLIMEROSMijail PerezBelum ada peringkat
- LIBRO DIGITAL DEL CURSO Polimeros Ureta Baron Código BibliotecaDokumen160 halamanLIBRO DIGITAL DEL CURSO Polimeros Ureta Baron Código BibliotecajriacosqBelum ada peringkat
- PolimerosDokumen155 halamanPolimerosservando1957Belum ada peringkat
- Informe de Tecnología de Los MaterialesDokumen97 halamanInforme de Tecnología de Los MaterialesNarjax100% (1)
- ¿Qué Son Los Polímeros? - Textos Científicos PDFDokumen6 halaman¿Qué Son Los Polímeros? - Textos Científicos PDFNuriban RamírezBelum ada peringkat
- Propiedades de Los PlasticosDokumen18 halamanPropiedades de Los PlasticosJoaquin MendezBelum ada peringkat
- Texto PolimerosDokumen201 halamanTexto PolimerosDaniel Márquez EspinozaBelum ada peringkat
- Texto PolímerosDokumen204 halamanTexto PolímerosAlejandro MoscosoBelum ada peringkat
- Texto PolimerosDokumen204 halamanTexto PolimerosIvan TrigoBelum ada peringkat
- Ingeniería de PolímerosDokumen34 halamanIngeniería de PolímerosIolanda BascauBelum ada peringkat
- Los PolímerosDokumen5 halamanLos PolímerosmassielBelum ada peringkat
- PolimerosDokumen22 halamanPolimerosRoyer Checke YamBelum ada peringkat
- PolimerosDokumen16 halamanPolimerosMiriam FloresBelum ada peringkat
- POLIMEROSDokumen13 halamanPOLIMEROSRodrigo ChavezBelum ada peringkat
- ENSAYO SOBRE POLÍMEROS BRDokumen1 halamanENSAYO SOBRE POLÍMEROS BRjosejjrc100% (6)
- Trabajo Virtual#9-Rodriguez Bermudez AlejandroDokumen3 halamanTrabajo Virtual#9-Rodriguez Bermudez AlejandroAlejandro RodriguezBelum ada peringkat
- Materiales PolimericosDokumen14 halamanMateriales PolimericosNoel CarpioBelum ada peringkat
- Obtencion de Materiales PolimericosDokumen21 halamanObtencion de Materiales PolimericosJayro HuayhuaBelum ada peringkat
- PolímerosDokumen14 halamanPolímerosEduardo LandaBelum ada peringkat
- Materiales AglomerantesDokumen26 halamanMateriales AglomerantescleverrBelum ada peringkat
- Materiales de ConstruccionDokumen16 halamanMateriales de ConstruccionPolarBelum ada peringkat
- POLIMEROSDokumen4 halamanPOLIMEROSWilmer RiosBelum ada peringkat
- PolimerosDokumen6 halamanPolimerosDiego MendozaBelum ada peringkat
- Kimika ExposicionDokumen40 halamanKimika ExposicionJulian Julian CastellanosBelum ada peringkat
- Ensayo Sobre PolimerosDokumen2 halamanEnsayo Sobre PolimerosCarrada JasielBelum ada peringkat
- Polimeros ImprimirDokumen24 halamanPolimeros ImprimirCMarcos VilasBelum ada peringkat
- Trabajo de Quimica PlasticosDokumen43 halamanTrabajo de Quimica PlasticosDiana Ferreira De VelascoBelum ada peringkat
- Introducción A Los PolimerosDokumen45 halamanIntroducción A Los PolimerosJairo AndresBelum ada peringkat
- POLIMEROSDokumen17 halamanPOLIMEROSWilma Veronica Rivera BurgosBelum ada peringkat
- 1º) Polimeros Parte 1Dokumen8 halaman1º) Polimeros Parte 1Jorge LabourdetteBelum ada peringkat
- 3 PolimerosDokumen28 halaman3 Polimerosmaxi roaBelum ada peringkat
- Propiedades de Los PolimerosDokumen22 halamanPropiedades de Los Polimeroskirusu el papu supremo100% (1)
- PolimerosDokumen1 halamanPolimerosJoseiito CamberoBelum ada peringkat
- Polimeros 2Dokumen15 halamanPolimeros 2EDINSON AUGUSTO GUTIERREZ SALAZARBelum ada peringkat
- Investigación de Los PolímerosDokumen23 halamanInvestigación de Los PolímerosJorge Braulio Rostro Ramos100% (1)
- PolimerosDokumen32 halamanPolimerosMiguelBelum ada peringkat
- Como Se Sintetiza Un Material ElásticoDokumen18 halamanComo Se Sintetiza Un Material ElásticoQuiQue GaOtBelum ada peringkat
- Clase 17. Materiales PoliméricosDokumen38 halamanClase 17. Materiales PoliméricosJuan Diego LandaetaBelum ada peringkat
- Inf Polimeros NaturalesDokumen16 halamanInf Polimeros NaturalesAndrea ArenalesBelum ada peringkat
- Procesos en PolímerosDokumen15 halamanProcesos en PolímerosJuan Daniel Felix PalominoBelum ada peringkat
- Práctica 5 Química Básica ESIMEDokumen8 halamanPráctica 5 Química Básica ESIMEloco2Belum ada peringkat
- Analisis de Productos PlasticosDokumen11 halamanAnalisis de Productos PlasticosRuddy MoranteBelum ada peringkat
- 7-Materiales PoliméricosDokumen44 halaman7-Materiales PoliméricosJose LemusBelum ada peringkat
- Capitulo 21 - 22 - 23 - 24.en - EsDokumen66 halamanCapitulo 21 - 22 - 23 - 24.en - EsJavierSamakBelum ada peringkat
- Capitulo 7Dokumen30 halamanCapitulo 7Neiry AceitunoBelum ada peringkat
- PolimerosDokumen111 halamanPolimeroscouldfusionBelum ada peringkat
- Trabajo de Refinacion de Polimeros y PalsticosDokumen31 halamanTrabajo de Refinacion de Polimeros y PalsticosYixon RuizBelum ada peringkat
- Polímeros y CerámicosDokumen21 halamanPolímeros y CerámicosMauricio Gutiérrez MontorBelum ada peringkat
- POLIMEROS CompletoDokumen24 halamanPOLIMEROS Completoyarely jazmin molina villarBelum ada peringkat
- Unidad IDokumen37 halamanUnidad IIran Fernanda Delgado VelozBelum ada peringkat
- Informe 8 de Laboratorio de OrganicaDokumen8 halamanInforme 8 de Laboratorio de OrganicaBruno ValverdeBelum ada peringkat
- Plastic OsDokumen43 halamanPlastic Oskaesar66Belum ada peringkat
- Actividad 19 Polimerización Por AdiciónDokumen3 halamanActividad 19 Polimerización Por Adiciónmanuel FigueiraBelum ada peringkat
- Guia de PolimerosDokumen7 halamanGuia de PolimerosAnonymous yEL4YvJCBelum ada peringkat
- Informe Quimica OrganicaDokumen12 halamanInforme Quimica OrganicaESCOBEDO VARGAS CARLOS ANDREBelum ada peringkat
- Exposicion de PDM Cap 7Dokumen32 halamanExposicion de PDM Cap 7HectorBelum ada peringkat