Cinética Química
Diunggah oleh
Jennifer SandersJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Cinética Química
Diunggah oleh
Jennifer SandersHak Cipta:
Format Tersedia
1.
INTRODUO Na indstria, s vezes, precisa-se acelerar a velocidade com que as reaes acontecem e a parte da qumica que estuda a velocidade das reaes a cintica qumica. A cintica qumica o estudo das velocidades e mecanismos das reaes qumicas. A velocidade das reaes a medida da rapidez com que se formam os produtos e se consomem os reagentes. E o mecanismo de uma reao consiste na descrio detalhada da sequncia de etapas individuais que conduzem os reagentes aos produtos. [1] Alguns fatores influenciam na velocidade com que as reaes acontecem e eles so: - A temperatura: quanto maior a temperatura, mais rapidamente se processa a reao no sentido endotrmico. Podemos acelerar uma reao lenta, submetendo os reagentes a uma temperatura mais elevada. [2] - A superfcie de contato: quanto maior a superfcie de contato dos reagentes, maior ser a velocidade da reao. [2] - A concentrao dos reagentes: quanto maior a concentrao dos reagentes, mais rpida ser a reao qumica. Essa propriedade est relacionada com o nmero de colises entre as partculas. [2] - Presena de catalisador: substncia capaz de acelerar uma reao. [2]
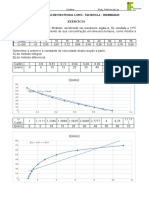
2. OBJETIVOS Estudar a variao da velocidade em funo de diferentes parmetros reacionais. 3. PARTE EXPERIMENTAL
MATERIAIS E REAGENTES
- 1 Termmetro - Bqueres - Lmina de corte - Pipetas - H2O2 (10 volumes)
- Comprimidos efervescentes - Soluo de Na2S2O3 0,25 mol.L-1 - Soluo de H2SO4 2 mol.L-1 - Tubo de ensaio - SiO2 (s)
- Cronmetro - gua destilada - Banana - MnO2 (s) - PbO2 (s)
PROCEDIMENTO EXPERIMENTAL
Na primeira parte, colocou-se 100 mL de gua destilada a temperatura ambiente em um bquer, 100 mL em outro a aproximadamente 40C e mais 100 mL de gua gelada em outro. Pegou-se um comprimido efervescente e com um estilete dividiu-o em quatro partes, pesou-se estas partes e utilizou trs partes do comprimido colocando-o um em cada bquer e anotando o tempo necessrio para decomposio do mesmo em cada bquer. Na segunda parte, pegou-se aquela parte do comprimido que no foi utilizado na primeira etapa e dividiu-o em duas partes sendo que um triturou-o no almofariz com pistilo. Colocou-se 100 mL de gua destilada em dois bqueres, em um colocou o comprimido inteiro, em outro colocou a parte triturada e anotou-se o tempo que as partes levaram para se dissolver. Na terceira parte, pegaram-se oito tubos de ensaio e os enumerou. Em cada tubo seguiu-se o preenchimento de acordo com o diagrama abaixo: Tubos n Soluo Na2S2O3 gua destilada H2SO4 2mol.L-1 0,25 mol.L-1 (mL) (mL) (mL) 1 8 0 2 2 7 1 2 3 6 2 2 4 5 3 2 5 4 4 2 6 3 5 2 7 2 6 2 8 1 7 2 Logo depois, anotou o tempo necessrio para o desaparecimento da marca vista atravs do tubo conforme o desenho. Na quarta parte, colocou uma fatia fina de banana para cozinhar por 5 minutos na chapa de aquecimento em um bquer com gua. Depois de cozida a banana colocou-a em um vidro relgio e uma fatia fina crua em outro. Pegou-se mais trs vidros de relgio e em um colocou uma pequena poro de MnO2, em outro SiO2 e em outro PbO2. Depois, despejaram-se pequenas gotas de gua oxigenada sobre esses materiais, observou se alguma mudana ocorreu e fez as anotaes. REFERNCIAS [1] RUSSEL, Jonh B. Qumica geral. 2. ed. So Paulo: Pearson Makron Books, 1994.vol.2. [2]- < http://www.mundoeducacao.com.br/quimica/velocidade-das-reacoesquimicas.htm > Acessado em 06/ABRIL s 15h35min
Anda mungkin juga menyukai
- Exercício Cinética QuímicaDokumen6 halamanExercício Cinética QuímicaLucas BentesBelum ada peringkat
- Cinética Química – Reação relógio iodeto/iodoDokumen11 halamanCinética Química – Reação relógio iodeto/iodoRafael Araújo Borges100% (1)
- CM 250 - Bioquímica 10-05-21Dokumen39 halamanCM 250 - Bioquímica 10-05-21Rafael BachBelum ada peringkat
- Atv - Cinética QuímicaDokumen3 halamanAtv - Cinética Químicamourabraga09Belum ada peringkat
- Cinética e ReatoresDokumen55 halamanCinética e Reatoresbrayamperini100% (1)
- Ficha V - Cinetica Quimica - Parte II - Equacao de ArrheniusDokumen2 halamanFicha V - Cinetica Quimica - Parte II - Equacao de ArrheniusAngelique ViannyBelum ada peringkat
- Wilson Carlos Lopes Silva Blast Efeitos Onda ChoquDokumen106 halamanWilson Carlos Lopes Silva Blast Efeitos Onda ChoquGlauber ExplosivistaBelum ada peringkat
- Cinética e Cálculo de Reatores - Avaliação 1Dokumen2 halamanCinética e Cálculo de Reatores - Avaliação 1Chanéle KaminskiBelum ada peringkat
- Cinética Química: Lista de ExercíciosDokumen10 halamanCinética Química: Lista de ExercíciosMárcio Adriano33% (3)
- Cinética Química I - Fatores que Influenciam a Velocidade de ReaçãoDokumen36 halamanCinética Química I - Fatores que Influenciam a Velocidade de ReaçãoPedro H. FassarellaBelum ada peringkat
- Biom8 - Enzimas Estrutura e FunçãoDokumen32 halamanBiom8 - Enzimas Estrutura e FunçãoDavid Duarte100% (1)
- Cinetica Quimica If ExercDokumen5 halamanCinetica Quimica If ExercRaquel Andreola ValenteBelum ada peringkat
- Determinação Da Energia de Ativação de Uma Reação Iônica em Meio AquosoDokumen10 halamanDeterminação Da Energia de Ativação de Uma Reação Iônica em Meio AquosoAlexsander LopesBelum ada peringkat
- Química lista exercícios fixação AV02Dokumen6 halamanQuímica lista exercícios fixação AV02Natalia AmaralBelum ada peringkat
- A Evolução Da Teoria AtômicaDokumen15 halamanA Evolução Da Teoria AtômicaCastigo NderBelum ada peringkat
- Relatorio 3Dokumen7 halamanRelatorio 3Murilo de LimaBelum ada peringkat
- Lista de exercícios de cinética químicaDokumen4 halamanLista de exercícios de cinética químicasebottendorfBelum ada peringkat
- CINÉTICA - Lista de ExeríciosDokumen3 halamanCINÉTICA - Lista de ExeríciosrobsonBelum ada peringkat
- Apostila Introdutória - Cinética Química - 2013Dokumen13 halamanApostila Introdutória - Cinética Química - 2013Fabio ReisBelum ada peringkat
- Laboratório de Química: Segurança ExperimentalDokumen44 halamanLaboratório de Química: Segurança ExperimentalIzaias AiresBelum ada peringkat
- Didática - Plano de AulaDokumen12 halamanDidática - Plano de AulaRaiana Canzian LimaBelum ada peringkat
- Quimica 2 - P1 3triDokumen2 halamanQuimica 2 - P1 3triMarcella MagaldiBelum ada peringkat
- Lista 01Dokumen2 halamanLista 01Sarah AraujoBelum ada peringkat
- Cinetica Quimica Das Reacoes Homogeneas Benedito PDFDokumen92 halamanCinetica Quimica Das Reacoes Homogeneas Benedito PDFEládio R Moura AraujoBelum ada peringkat
- Aplicações dos reagentes Labtest para o BA-88ADokumen52 halamanAplicações dos reagentes Labtest para o BA-88ALaboratorio de BioquimicaBelum ada peringkat
- Fatores que afetam a cinética químicaDokumen17 halamanFatores que afetam a cinética químicaMateus DinizBelum ada peringkat
- Introdução à cinética químicaDokumen63 halamanIntrodução à cinética químicaGermanomartins100% (1)
- Aula 6 Combinacao Reatores PDFDokumen53 halamanAula 6 Combinacao Reatores PDFwillisson santos100% (1)
- Lista Cinética QuímicaDokumen6 halamanLista Cinética QuímicavfmgarciaBelum ada peringkat
- Cinética químicaDokumen10 halamanCinética químicaItalo PiresBelum ada peringkat