Estudio preliminar de los efectos de los inhibidores de la sintesis de eicosanoides sobre la actividad de fenoloxidasa del acocil (Cambarellus montezumae)Vinnitsa Buzoianu, Mónika Garrido, Marisela Villalobos, Itsel Alva Antonio García, Fernando García y Fidel Hernández
Diunggah oleh
Investigación Universitaria MultidisciplinariaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Estudio preliminar de los efectos de los inhibidores de la sintesis de eicosanoides sobre la actividad de fenoloxidasa del acocil (Cambarellus montezumae)Vinnitsa Buzoianu, Mónika Garrido, Marisela Villalobos, Itsel Alva Antonio García, Fernando García y Fidel Hernández
Diunggah oleh
Investigación Universitaria MultidisciplinariaHak Cipta:
Format Tersedia
Facultad de Ciencia y Tecnología
Estudio preliminar de los efectos de los inhibidores de la
sintesis de eicosanoides sobre la actividad de fenoloxidasa
del acocil (Cambarellus montezumae)
Vinnitsa Buzoianu1, Mónika Garrido1, Marisela Villalobos1, Itsel Alva1
Antonio García1, Fernando García1 y Fidel Hernández1-2.
1
Universidad Simón Bolívar, 2CINVESTAV-IPN
Resumen
Uno de los mecanismos de defensa mejor caracterizados en crustáceos, es el sistema feno-
loxidasa, éste es activado por componentes de pared celular microbiana como lipopolisacá-
ridos (LPS), péptidoglicanos y b 1-3 glucanos (zimosan). En el presente estudio se midió la ac-
tividad de fenoloxidasa (FO) en la hemolinfa (HL) de Cambarellus montezumae en ausencia
y presencia de inhibidores de la síntesis de eicosanoides. Los resultados obtenidos muestran
que la dexametasona abate la actividad de la fosfolipasa A 2, disminuyendo significativa-
mente su actividad, en contraste al naproxeno, no modificó la actividad de fenoloxidasa.
Palabras clave: respuesta inmune, dexametasona, naproxeno; hemolinfa, camarón, Cambarellus,
artrópodo.
Abstract:
One of the main characteristic mechanisms of defense in crustaceans is the phenoloxidase
(cyclooxigenase) system, which is activated by microbial components like lipopolysaccharide
(LPS), peptideglicans and b 1-3 glucans (zymosan). The current study measured the prophe-
noloxidase (FO) effect on the hemolymph of Cambarellus montezumae, in the absence and
presence of inhibitors of eicosanoids synthesis.
The results show that dexamethasone eliminates the activity of phospholipase A2, dimin-
ishing its activity considerably in contrast to naproxen, which did not show any change.
Keywords: immune response, dexamethasone, naproxen, hemolymph, shrimp, Cambarel-
lus, arthropod.
Introducción
Cambarellus montezumae, es un crustáceo que se cultiva a escala comercial en México, el cual constituye una
fuente de alimento rico en proteínas para humanos. Este camarón es afectado por enfermedades infecciosas,
micóticas, virales y bacterianas que ponen en riesgo su cultivo. Como todos los invertebrados, C. montezumae,
posee un sistema inmune innato caracterizado por ser inespecífico y no estar mediado por anticuerpos, lo
que impide el diseño de vacunas. Los elementos principales del sistema inmune de los crustáceos están en la
hemolinfa (HL) donde actúan y los descritos hasta ahora incluyen: la fagocitosis, nodulación, encapsulación,
coagulación y producción de péptidos antimicrobianos. En la mayoría de estos mecanismos está involucrado
el sistema de la proFenoloxidasa (proFO) el cual es un mecanismo tanto efector como regulador del sistema
I n v e s t i g a ci ó n U n i v e r s i t a r i a M u l t idi s ci p l i n a r i a - Año 5, Nº5, diciembre 2006 7
F a c u l t a d d e C i e n c i a y T e c n o l o g í a
inmune, compuesto por un conjunto de proteí- dentro de la célula es muy baja, su disponibilidad
nas, aun no totalmente conocidas, que se activan resulta de la liberación de los depósitos celulares
en cascada y desencadenan la melanización del de lípidos mediante numerosas hidrolasas (fosfoli-
agente invasor. Algunos miembros de la cascada pasa A 2, fosfolipasa C y la lipasa diacilglicerol. Estas
son proteasas en forma inactiva (zimógenos) que fosfolipasas son activadas por diferentes estímulos
al ser activados, adquieren capacidad proteolítica físicos, químicos y hormonales, como son: trau-
llegando finalmente al corte de la proFO para ma, infección, infusión con solución hipertónica,
generar la forma activa (FO). La FO participa en la trombos, endotoxinas, estiramiento mecánico,
melanización y formación de nódulos y cápsulas, así esteroides sexuales y catecolaminas. La fosfolipasa
como en la liberación de moléculas opsonizantes, A2 (PLA 2) hidroliza la unión éster de los fosfolípidos
quimiocinesis celular y coagulación (Söderhäll y de membrana, particularmente los que contienen
Cols., 1990; Ashida, 1991). fosfatidilcolina y fosfatidiletanolamina y liberan
ácido araquidónico. En contraposición la fosfoli-
El sistema proFO está ampliamente descrito en los pasa C separa el puente fosfodiéster, provocando
invertebrados y actúa en la amplificación de la reac- una liberación de fosfatidilinositol, que libera
ción inmune y en la inactivación de microorganismos ácido araquidónico a través de la desintegración
invasores; para dispararse requiere: de la lipasa diacilglicerol. Una vez liberado el ácido
araquidónico, la vía de síntesis puede tomar dos
1.- Reconocimiento: el reconocimiento de partículas direcciones: la vía de la lipooxigenasa o la vía de
ajenas al cuerpo de los artrópodos ocurre cuando cé- la ciclooxigenasa (Stanley, 2005).
lulas de la hemolinfa (hemocitos) o de otros órganos
como el cuerpo graso reconocen específicamente Los inhibidores de la respuesta inmune seleccio-
(aunque aún no esta definido molecularmente cómo), nados para este trabajo fueron: naproxeno, com-
componentes microbianos de la pared celular de bac- puesto que en mamíferos causa la disminución de
terias, como lipopolisacáridos de las Gram (-), los pepti- los mediadores de inflamación al inhibir la Ciclooxi-
doglicanos de las Gram (+), el zimosán (b 1,3 glucanos) genasa tipo I de tipo constitutivo. Por otro lado, la
de levaduras y hongos, así como células o parásitos de dexametasona que induce la lipocortina, proteína
mayor tamaño (Johansson y Söderhäll 1989; Söderhäll anti-inflamatoria, que inhibe la fosfolipasa A 2, lo
y Cols., 1990; Ashida, 1990) y reaccionan liberando al cual inhabilita la síntesis de PGS y lipooxigenasa
medio los componentes del sistema proFO. (Stanley, 2006).
2.- Activación: una vez en la hemolinfa, las enzimas
de la vía proFO se activan una tras otra ("reacción en
cascada") comenzando con la activación de al menos Objetivo
dos serina-proteasas llamadas proteínas activadoras
de la profenoloxidasa 1 y 2. La serina-proteasa 1 En este trabajo se evaluó la actividad de la proFO en
actúa sobre la número dos, amplificando la reacción, la hemolinfa de C. montezumae en ausencia y pre-
y la enzima dos a su vez sobre la profenoloxidasa sencia los inhibidores de la síntesis de eicosanoides
convirtiéndola en fenoloxidasa y activándola. Ésta naproxeno (npx) y dexametasona (dexa).
última, al estar activa, es la encargada de la con-
versión, por oxidación, de fenoles en quinonas, las
cuales se polimerizan formando melanina. La mela-
nina inhibe la actividad enzimática tanto bacteriana Método
como fúngica (Cerenius y Söderhall, 2001).
Reactivos: los reactivos utilizados en este trabajo
En los últimos años se ha descrito, a las prosta- fueron de la más alta calidad y se obtuvieron de
glandinas (PGs) como moléculas moduladoras de la las compañías Sigma Chem (St. Louis Missouri),
respuesta inmune en algunos artrópodos (Rowley Invitrogen y PE Applied Biosystems. Los reactivos
et al., 2005). Las PGs derivan de los ácidos grasos para electroforesis provinieron de Gibco- BRL Life
esenciales de 20 carbonos, y el ácido araquidónico Technologies.
es el precursor más abundante; el cual puede a su
vez, formarse a partir del ácido linoléico. Dado Material Biológico: para este trabajo se utilizaron
que la concentración de ácido araquidónico libre acociles adultos de ambos sexos (C. montezumae),
8 I n v e s t i g a ci ó n U n i v e r s i t a r i a M u l t idi s ci p l i n a r i a - Año 5, Nº5, diciembre 2006
F a c u l t a d d e C i e n c i a y T e c n o l o g í a
(Saussure, 1857) obtenidos comercialmente, los cua- para evaluar si existieron diferencias significativas
les se mantuvieron en peceras con agua corriente entre los diferentes tratamientos.
a una temperatura de 20 a 22 °C, alimentados con
peces pequeños. Resultados
Obtención y cuantificación de proteínas: para Análisis de la actividad de proFO en HL de C.
llevar a cabo la obtención y cuantificación de montezumae y efecto de los inhibidores: en un
proteínas, a los acociles se les inyectó al hemo- ensayo in vitro la HL de C. montezumae se puso en
cele (entre la cabeza y el tórax) 100 ml de solu- contacto con laminarina, compuesto de la pared
ción salina al 0.9% con los inhibidores de PGS de hongos que en otros artrópodos se ha descrito
(Npx y Dexa 100 mg / ml). La HL fue obtenida por que es capaz de iniciar la cascada de la FO y en
perfusión (30 minutos post-inoculación). A las presencia de L-DOPA, el cual de manera natural
muestras se les agregaron 10 ml de un mezcla de esta presente en la HL y es oxidado y polimeriza-
inhibidores de proteasas (TLCK 10 mM; TPCK 10 do por acción de la FO generando el compuesto
mM y o-fenantrolina 50 mM) posteriormente se colorido melanina y se observó la formación de
incubaron en una temperatura de 60 °C durante 10 un precipitado negro que indicó la funcionalidad
minutos, a continuación se separó la fase acuosa del sistema. Cuando la L-DOPA se sustituyó por
por centrifugación a 13000 rpm / 5min y se tomó el ácido carmínico, pigmento presente en la HL
el empastillado, el cual se resuspendió en 40 ml del homóptero Dactylopius coccus , también se
ual de amortiguador de muestra 2X. La pastilla observó la formación de color, indicando que
se guardó a -20 °C para cuantificación y ensayos; este sustrato, el cual es el que utiliza este insecto
la cuantificación se realizó por el método de Bra- durante sus reacciones de melanización, también
dford (Smith, 1989). es utilizable por el sistema de FO de C. montezu-
mae (figura 1a).
Separación de Proteínas: las muestras de proteínas
fueron analizadas por medio de electroforesis en Figura 1a. Ensayo espectofotométrico in vitro de la actividad de
geles de acrilamida (PAGE-SDS) al 10% (pH 8.8), proFO de la HL de C. montezumae
preparados según métodos estándar (Smith, 1989).
Posteriormente el gel se colocó en una cámara
Pozos
de electroforesis agregándole amortiguador de
corrida (0.025 M de Tris- glicina 0.192 M pH 8.3, A1 HL Control A1
SDS 0.1%). La electroforesis se realizó a 40 – 60V A2 HL Control + Laminarina + L-Dopa A2
y a temperatura ambiente durante 16 horas. Des- A3 HL Control + Laminarina + Carmín A3
pués se tiñó el gel con azul de Coomassie (Smith,
A4 HL npx + Laminarina + L-Dopa A4
1989).
A5 HL npx + Laminarina + Carmín A5
Medición Espectrofotométrica de la actividad de A6 HL Control + L-Dopa A6
la proFO: para determinar por un método colori- A7 HL npx + L-Dopa A7
métrico la actividad de la FO se tomaron 20 ml de la
HL, se colocaron en pozos de una multiplaca para
ELISA de 96 posiciones, se les agregaron 20 ml de La HL fue incubada con diferentes sustratos (L-Dopa y carmín)
PBS 1X (pH de 7.4), y 10 ml de Laminarina (1 mg / durante 10 minutos; posteriormente se trató con un componente
patógeno (laminarina) durante 30 minutos. a) A1: HL de acocil;
ml; componente de pared celular de levaduras). pozo control. A2: HL + Laminarina + L-Dopa (sustrato). A3: HL +
Posteriormente se les agregó L-dihidroxifenilala- Laminarina+ Carmín (sustrato). A4: HL + npx + Laminarina + L-Dopa
nina (L-Dopa) (4 mg / ml en amortiguador PBS 1X), (sustrato) A5 : HL + npx + Laminarina + Carmín. A6: HL + L-Dopa
(sustrato). A7: HL + npx + L-Dopa (sustrato). En los pozos A2 a A7
se incubaron a temperatura ambiente durante 20 se observa melanización.
minutos en oscuridad, se observaron los resulta-
dos y se midieron las densidades ópticas a 570 nm
Cuando se añadieron al sistema los inhibidores dexa
(Lanz, 1993).
y npx aún hubo actividad de melanización in vitro
(figura 1b).
Los experimentos se hicieron por triplicado y se
les aplicó la prueba estadística de Kruskal-Walis
I n v e s t i g a ci ó n U n i v e r s i t a r i a M u l t idi s ci p l i n a r i a - Año 5, Nº5, diciembre 2006 9
F a c u l t a d d e C i e n c i a y T e c n o l o g í a
Figura 1b. Actividad de melanización por inhibidores
Pozos
A1 HL Control A1
A2 HL Control + Laminarina + L-Dopa A2
A3 Vacío A3
A4 HL npx + Laminarina + L-Dopa A4
A5 Dexa1+ Laminarina + L-Dopa A5
A6 Dexa2+ Laminarina + L-Dopa A6
A1: HL de acocil; pozo control. A2: HL + Laminarina + L-Dopa (sustrato). A3: Blanco. A4: HL + npx + Laminarina + L-Dopa (sustrato) A5 : HL
+ dexa + Laminarina + L-Dopa (sustrato). A6: HL + dexa+ Laminarina + L-Dopa (sustrato).
Sin embargo, cuando se midieron espectrofotométricamente las cantidades de melanina producida y se compara-
ron estadísticamente los valores se encontró una ligera, pero significativa, disminución con la dexa (figura 2).
Figura 2. Disminución con la dexa por presencia de melanina
Cuantificación de actividad de profenoloxidasa en la respuesta inmune de C. montezumae en presencia de diferentes inhibidores (dexa y
npx), por método espectofotométrico a 570nm. Observándose en el tratamiento con dexa un ligero descenso en la absorbancia, mientras
que en el tratamiento con npx no se presenta ninguna disminución en la actividad ( n=3;Kruskal-Wallis, p < 0.05).
Figura 3. Resultados del tratamiento con naproxeno
kDa 1 2 3
68
50
43
29
25
Electroforesis en gel de poliacrilamida PAGE-SDS al 10%. Carril 1: Tratamiento con npx. Carril 2: Tratamiento con dexa. Carril 3: Control.
En los patrones proteícos de HL se observa un enriquecimiento en la banda de 50 kDa en el tratamiento con npx (1), a diferencia de los
otros dos tratamientos (2 y 3).
10 I n v e s t i g a ci ó n U n i v e r s i t a r i a M u l t idi s ci p l i n a r i a - Año 5, Nº5, diciembre 2006
F a c u l t a d d e C i e n c i a y T e c n o l o g í a
Discusión Conclusión
En el presente trabajo se observó el efecto de la dexa El estudio de la acción de las prostaglandinas y
y npx en la ruta proFO en C. montezumae. su papel en la inmunidad de crustáceos, es de
gran interés comercial ya que abre una enorme
En el lepidoptero Galleria mellonella se reportó que la posibilidad para diseñar medidas más eficientes de
melanización producida en HL por la acción de agentes control de enfermedades en estos invertebrados,
microbianos es inhibida totalmente en presencia de con el propósito de incrementar las producciones
dexa y npx (Mandato, Moore, Downer, 1996). En con- comerciales.
traste en C. montezumae el efecto no fue tan radical.
Sin embargo, quedan otras condiciones por probar
como por ejemplo analizar dosis más altas de los inhibi-
dores. Cabe aclarar, que esta es la primera descripción Referencias
de la interacción de estos compuestos con la HL del
Ashida, M: (1990). The profenoloxidasa cascade in insect immunity.
crustáceo. Aunque la inhibición de la melanización fue
Response Immunologic. 141, 898.
parcial, se puede observar, al realizar la cuantificación
de la actividad profenoloxidasa, que la dexa tiene un Cerenius L, Söderhäll K, (2001). The prophenoloxidase-activat-
efecto parcial sobre la melanización, indicando que ha ing system in invertebrates . Immunological Reviews
198, 116-126
actuado como inhibidor; a diferencia de lo observado
en npx, donde no se apreció ningún cambio. Johansson, M. W, y Söderhäll, K. (1989). Cellular immunity in
crustaceans and the proPo System. Parasitology Today.
Al analizar las proteínas de la HL por medio de elec- 5: 171.
troforesis en gel de acrilamida, se observó que una
Lanz-Mendoza H, Hernández S, Garrido-Guerrero E, Tsutsumi V,
banda de 50 kDa solamente se presentan en los carriles Aréchiga H. (1993). Prophenoloxydase system activation
de npx y de control, no así en el carril de dexa. Con el in the Crayfish: Procambarus clarki. Dev Comp Immunol
antecedente de que las moléculas del sistema inmune 17, 399-406.
de artrópodos se ven afectadas en actividad y síntesis
Mandato, C. Diehl-Jones. W, Moore, S. Downer, R. (1996). T he
por los inhibidores de la síntesis de eicosanoides la effects of eicosanoid biosynthesis inhibitors on prophe-
(s) proteína (s) de 50kDa pueden ser consideradas a nolxidase activation, phagocytosis and cell spreading in
candidatos a participar del sistema inmune. Por otra Galleria mellonella. Insect Physiology. 43, 1 – 8
parte, también se observó la presencia de una banda
Miller, J. et al., (1994). Eicosanoids mediate insect nodulation
prominente de 20 kDa, que solamente aparece en el responses to bacterial infections, Insect Biochemistry/
carril de dexa. Tomando como referencia su peso, po- Phisiology Laboratory, Department of Entomology, Uni-
versity of Nebraska, Lincon.
dría especularse de que se trate de un posible péptido
antimicrobiano, sintetizado como una ruta alternativa
Ratcliffe, N. A. y Götz, P. (1990). Funcional studies on insect
por el organismo, al verse inhibidas algunas rutas de haemocytes including non-self recongnition. Response
respuesta inmune. Para conocer la identidad y posible Immunologic. 141, 919.
papel de estas moléculas se recurrirá a su caracteriza-
Rowley, A, Vogan, C, Taylor G, Clare A. (2004). Prostanglandins in
ción en trabajos posteriores por medio de electroforesis non- insectan invertebrates: recent insights and unsolved
bidimensional y MALDI-TOF. problems. Experimental Biology, 208,3-14.
Se tiene también contemplado evaluar la activi-dad Smith J. (1989). Electrophoretic separation of proteins. In: Ausubel F,
Brent R, Kingston R, Moore D, Seidman J, Smith J, Struhl K,
de melanización en presencia de otros inhibidores de Editors. Current protocols in molecular biology. New York:
PGS no esteroidales (AINs) como son los ibuprofenos, Green Publishing and John Wiley and Sons. 10.2.1-10.2.9.
ácido acetilsalicílico, ácido mefenámico o bien la
indometacina, actuando de manera similar que Stanley, D., (1998). Eicosanoids mediate insect celular inmune
reactions to bacterial infections. Recent Advanced in
el npx con el fin de inhibir las diferentes isoformas Prostanglandin, Tromboxane an Leucotriene Research,
de ciclooxigenasas (I y II) que están involucradas en Edit by Sinzinger et al., Plennum Press, New York.
la formación de PGs, en el caso de compuestos de
naturaleza corticosteroides, los cuales su mecanismo Stanley, D. (2006). Prostanglandins and other eicosanoids in Insects:
Biological Significance, Annu. Rev. Entomol.51, 25-44.
de acción inhibe la producción de la fosfolipasa A2,
la 5-lipo-oxigenasa y la ciclooxigenasa; se pretende
realizar ensayos de dosis-respuesta para estudiar la
posible acción de estos fármacos.
I n v e s t i g a ci ó n U n i v e r s i t a r i a M u l t idi s ci p l i n a r i a - Año 5, Nº5, diciembre 2006 11
Anda mungkin juga menyukai
- Investigación Universitaria Multidisciplinaria 2014Dokumen104 halamanInvestigación Universitaria Multidisciplinaria 2014Investigación Universitaria MultidisciplinariaBelum ada peringkat
- Inv Univ Mult 2013Dokumen200 halamanInv Univ Mult 2013Investigación Universitaria MultidisciplinariaBelum ada peringkat
- Art3 InvUnivMult2013 PDFDokumen8 halamanArt3 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art5 InvUnivMult2013 PDFDokumen9 halamanArt5 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art7 InvUnivMult2013 PDFDokumen8 halamanArt7 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art17 InvUnivMult2013 PDFDokumen9 halamanArt17 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art4 InvUnivMult2013 PDFDokumen9 halamanArt4 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- InvUnivMultB2013 PDFDokumen200 halamanInvUnivMultB2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art1 InvUnivMult2013 PDFDokumen8 halamanArt1 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art2 InvUnivMult2013 PDFDokumen12 halamanArt2 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art6 InvUnivMult2013 PDFDokumen16 halamanArt6 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- GuiaAutoresInvUnivMult2013 PDFDokumen5 halamanGuiaAutoresInvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art15 InvUnivMult2013 PDFDokumen5 halamanArt15 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art16 InvUnivMult2013 PDFDokumen5 halamanArt16 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art19 InvUnivMult2013 PDFDokumen16 halamanArt19 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- AutoresInvUnivMult2013 PDFDokumen8 halamanAutoresInvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art18 InvUnivMult2013 PDFDokumen7 halamanArt18 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- EditorialInvUnivMult2013 PDFDokumen1 halamanEditorialInvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- IndiceInvUnivMult2013 PDFDokumen2 halamanIndiceInvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art14 InvUnivMult2013 PDFDokumen12 halamanArt14 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art11 InvUnivMult2013 PDFDokumen9 halamanArt11 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art13 InvUnivMult2013 PDFDokumen12 halamanArt13 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Inv Univ Mult 2012Dokumen160 halamanInv Univ Mult 2012Investigación Universitaria MultidisciplinariaBelum ada peringkat
- Art12 InvUnivMult2013 PDFDokumen9 halamanArt12 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art9 InvUnivMult2013 PDFDokumen9 halamanArt9 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Editorial InvUnivMult2012Dokumen1 halamanEditorial InvUnivMult2012Investigación Universitaria MultidisciplinariaBelum ada peringkat
- Art8 InvUnivMult2013 PDFDokumen9 halamanArt8 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Art10 InvUnivMult2013 PDFDokumen8 halamanArt10 InvUnivMult2013 PDFInvestigación Universitaria MultidisciplinariaBelum ada peringkat
- Indice InvUnivMult2012Dokumen2 halamanIndice InvUnivMult2012Investigación Universitaria MultidisciplinariaBelum ada peringkat
- GuiaAutores InvUnivMult2012Dokumen5 halamanGuiaAutores InvUnivMult2012Investigación Universitaria MultidisciplinariaBelum ada peringkat
- La Mujer en La Biblia - Opresión y LiberaciónDokumen21 halamanLa Mujer en La Biblia - Opresión y LiberaciónByron Albizures GonzálezBelum ada peringkat
- Resumen 5. Recompensa de La SantidadDokumen1 halamanResumen 5. Recompensa de La SantidadJesusbastos MBelum ada peringkat
- Clase 1 - Sistemas de InyeccionDokumen15 halamanClase 1 - Sistemas de Inyecciondamian floresBelum ada peringkat
- 7 El Pensamiento de PAbloDokumen5 halaman7 El Pensamiento de PAbloAriel CoyosBelum ada peringkat
- Enfoques económicos y relaciones interdisciplinariasDokumen3 halamanEnfoques económicos y relaciones interdisciplinariasGherveth Santis SantizoBelum ada peringkat
- Desarrollo Infantil Primer Año de Vida Interacciones PDFDokumen12 halamanDesarrollo Infantil Primer Año de Vida Interacciones PDFMaría Pastor MayorBelum ada peringkat
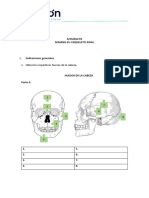
- Tarea Esqueleto AxialDokumen6 halamanTarea Esqueleto AxialdieneBelum ada peringkat
- 6.3.4.4 Packet Tracer - Investigating DUAL FSM InstructionsDokumen4 halaman6.3.4.4 Packet Tracer - Investigating DUAL FSM InstructionsÓscar Vega López100% (1)
- La Evolución y La Sobrepoblación HumanaDokumen1 halamanLa Evolución y La Sobrepoblación HumanaInes LazoBelum ada peringkat
- Informe Práctica 2 EnzimasDokumen3 halamanInforme Práctica 2 EnzimasIsabella RendónBelum ada peringkat
- Clase 1 - Lunes - Construcciones RuralesDokumen74 halamanClase 1 - Lunes - Construcciones RuralesRocio BenítezBelum ada peringkat
- Valvula de Agua BELIMODokumen4 halamanValvula de Agua BELIMOJesús MarquinaBelum ada peringkat
- Dulanto LibroConstrucción SocilaAdolescencia2014 Academia PDFDokumen257 halamanDulanto LibroConstrucción SocilaAdolescencia2014 Academia PDFMaría Estela Fernández100% (1)
- PermanecerEnCristoDokumen91 halamanPermanecerEnCristoEdwin Torres GomezBelum ada peringkat
- Condiciones y Elementos de Las MuestrasDokumen11 halamanCondiciones y Elementos de Las MuestrasMercy Escobar50% (6)
- Edgar Morin Complejidad Restringida y Complejidad GeneralizadaDokumen18 halamanEdgar Morin Complejidad Restringida y Complejidad GeneralizadaNini PoBelum ada peringkat
- Procesos Metalurgicos Laboratorio N 2 inDokumen18 halamanProcesos Metalurgicos Laboratorio N 2 inHeydi CalloBelum ada peringkat
- Ecp Uce 18003 Gcu Id02 0 Gen CD 001 - 0Dokumen55 halamanEcp Uce 18003 Gcu Id02 0 Gen CD 001 - 0David Fernando Bedoya Romero100% (1)
- COMPASS Valvulas Reguladoras CaudalDokumen6 halamanCOMPASS Valvulas Reguladoras Caudaleddy ortegaBelum ada peringkat
- OBJETIVODokumen5 halamanOBJETIVOmarcoBelum ada peringkat
- Antologia de Los Documentos Reales de La Dinastia Carlista - Melchor Ferrer (Org.), 1951Dokumen104 halamanAntologia de Los Documentos Reales de La Dinastia Carlista - Melchor Ferrer (Org.), 1951Eduardo CruzBelum ada peringkat
- Notas para Una Simbología de La RosaDokumen30 halamanNotas para Una Simbología de La Rosaluchinov100% (1)
- Profundiza U5Dokumen14 halamanProfundiza U5Arlex Dauricio Beltran LozanoBelum ada peringkat
- Apunte 11. Dimensionamiento de Pavimentos FlexiblesDokumen264 halamanApunte 11. Dimensionamiento de Pavimentos FlexiblesJhonny Gabriel TorrezBelum ada peringkat
- Fantasma L.J SmithDokumen354 halamanFantasma L.J SmithLina Isabel Lopez Ahumada100% (3)
- Qué Beneficios Podemos Extraer Hoy Del TRABAJO EN REDDokumen5 halamanQué Beneficios Podemos Extraer Hoy Del TRABAJO EN REDcapitan barreraBelum ada peringkat
- Boletín Técnico 12-2022-IPCDokumen16 halamanBoletín Técnico 12-2022-IPCAnthony LunaBelum ada peringkat
- Diagrama de Control para AtributosDokumen23 halamanDiagrama de Control para AtributosGilmarys MartinezBelum ada peringkat
- Clase 33A Excel BASICO - INTERMEDIO - AVANZADO - Ejercicios de Algunos Temas AnterioresDokumen6 halamanClase 33A Excel BASICO - INTERMEDIO - AVANZADO - Ejercicios de Algunos Temas AnterioresLuis PalacioBelum ada peringkat
- Orientación vocacional: elección profesionalDokumen23 halamanOrientación vocacional: elección profesionalLiliana OrtegaBelum ada peringkat