Ecuación de Estado de Van Der Waals
Diunggah oleh
Daniel Maldonado OroscoDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Ecuación de Estado de Van Der Waals
Diunggah oleh
Daniel Maldonado OroscoHak Cipta:
Format Tersedia
Ecuacin de Estado de Van der Waals
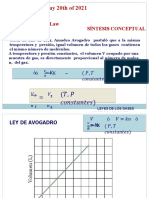
La ley de gas ideal trata a las molculas de un gas, como partculas puntuales con colisiones perfectamente elsticas. Esto funciona bien en muchas circunstancias experimentales, con gases diluidos. Pero las molculas de gas no son masas puntuales, y hay circunstancias donde las propiedades de las molculas, tienen un efecto medible experimentalmente. Johannes D. van der Waals en 1873 propuso una modificacin de la ley de gas ideal, para tener en cuenta el tamao molecular y las fuerzas de interaccin moleculares. Se la refiere normalmente como la ecuacin de estado de van der Waals.
Las constantes a y b tiene valores positivos y son caractersticas del gas individual. La ecuacin de estado de van der Waals, se aproxima a la ley de gas ideal PV=nRT a medida que el valor de estas constantes se acercan a cero. La constante a provee una correccin para las fuerzas intermoleculares. La constante b es una correccin para el tamao molecular finito y su valor es el volumen de una mol de tomos o molculas.
Coeficientes de van der Waals Gas Helio Nen Hidrgeno Vapor de agua
a (Pa m3) b(m3/mol)
3,46 x 10-3 23,71 x 10-6 2,12 x 10-2 17,10 x 10-6 2,45 x 10-2 26,61 x 10-6 5,47 x 10-1 30,52 x 10-6
Dixido de Carbono 3,96 x 10-1 42,69 x 10-6
Datos de Fishbane, et al. Puesto que la constante b es indicativa del volumen molecular, se podra usar para la estimacin del radio de un tomo o molcula modelado como una esfera. Fishbane et al. da el valor de b para el gas nitrgeno como 39,4 x 10 -6m3/mol. Esto nos lleva a la siguiente estimacin del radio:
En la tabla peridica se encuentra un radio atmico de 0,075 nm. para el nitrgeno, de modo que es creible la estimacin de arriba para la molcula de nitrgeno. Con este supuesto de "molcula esfrica", un valor de b = corresponde a un radio molecular r = nm. x 10-6m3/mol
Con el otro parmetro a = Pa m3 se puede calcular la diferencia entre la ecuacin de estado de van der Waals y la ley de gas ideal. Con el propsito de realizar una exploracin numrica del comportamiento del gas, especifquese la presin, el volumen y la temperatura. El nmero de moles se calcular de la ley de gas ideal, y el valor de PV/nT para la ecuacin de estado de van der Waals, se calcular por comparacin con la constante de gas R. Para las variables de estado P= V= T= kPa = m3 K atmsferas
el nmero de moles de un gas ideal sera n = Para la ecuacin de estado de van der Waals, esto dara PV/nT = J/mol K comparado con la constante de gas R = 8,3145 J/mol K.
La grfica de abajo (por Fishbane, et al.) muestra la diferencia significativa con la ley de gas ideal, un 3% en 20 atmsferas de presin para el oxgeno. La desviacin es medible incluso a una atmsfera de presin, pero no es grande. El hecho de que todos los gases se extrapolen al mismo valor, es la base para la definicin de la escala de temperaturas Kelvin en funcin de ese valor lmite.
Anda mungkin juga menyukai
- Química GASES REALESDokumen6 halamanQuímica GASES REALESLeonardo LaraBelum ada peringkat
- 3-180 y 5-32Dokumen6 halaman3-180 y 5-32Julia Ruíz100% (1)
- Correccion Azúcar Estándar Primer ParcialDokumen52 halamanCorreccion Azúcar Estándar Primer ParcialMiguel Angel CardielBelum ada peringkat
- Unidad IV Diagramas de FaseDokumen23 halamanUnidad IV Diagramas de FaseJesus Santiago PabloBelum ada peringkat
- 25 PreguntasDokumen6 halaman25 PreguntasLuis CVBelum ada peringkat
- Estados de Liquido Saturado y de Vapor SaturadoDokumen3 halamanEstados de Liquido Saturado y de Vapor SaturadoING. Miguel Angel Sanchez MonzonBelum ada peringkat
- Determinacion Del Calor EspecificoDokumen19 halamanDeterminacion Del Calor EspecificoGustavo MuñozBelum ada peringkat
- Laboratorio #1 - Algoritmos - 2017Dokumen4 halamanLaboratorio #1 - Algoritmos - 2017Will AparicioBelum ada peringkat
- Iq 4 Fluidos OCW PDFDokumen35 halamanIq 4 Fluidos OCW PDFJnr JhomarBelum ada peringkat
- Cuestionario 4 II Unidad Cap 19 11 de Marzo 2021 Revisi N Del Intento PDFDokumen5 halamanCuestionario 4 II Unidad Cap 19 11 de Marzo 2021 Revisi N Del Intento PDFHijo De la nocheBelum ada peringkat
- PDF Ecuacion de Peng Robinson - CompressDokumen18 halamanPDF Ecuacion de Peng Robinson - CompressSuri Perez Maria TeresaBelum ada peringkat
- Experimento 4 Laboratorio Fisica 1Dokumen10 halamanExperimento 4 Laboratorio Fisica 1CarolinaBelum ada peringkat
- Diapositivas de ReaccionesDokumen62 halamanDiapositivas de ReaccionesJuanChavezBelum ada peringkat
- Diseño de Reactores No IsotermicosDokumen5 halamanDiseño de Reactores No IsotermicosAndreéita SaDiBelum ada peringkat
- Grupo 2 - EntalpiaDokumen14 halamanGrupo 2 - EntalpiaHache ZG FernandoBelum ada peringkat
- Electroestática Folleto Oficial Depto de Fisica MARZO 2017Dokumen19 halamanElectroestática Folleto Oficial Depto de Fisica MARZO 2017Jairo Silva CoreaBelum ada peringkat
- ChapraCap12 - 8 9 10 11Dokumen13 halamanChapraCap12 - 8 9 10 11Pedro AlcantaraBelum ada peringkat
- Mezclas Reactivas de Gases, Ciclos Binarios, Plantas Nucleares y Ciclos Combinados Termodinamica IIDokumen20 halamanMezclas Reactivas de Gases, Ciclos Binarios, Plantas Nucleares y Ciclos Combinados Termodinamica IIMilton MurilloBelum ada peringkat
- Cinetica EjerciciosDokumen4 halamanCinetica EjerciciosKathy Alarcon EspinozaBelum ada peringkat
- Termodinámica - Taller 2Dokumen3 halamanTermodinámica - Taller 2Daniel Ayala RomanBelum ada peringkat
- Calentador CaseroDokumen17 halamanCalentador CaseroandresBelum ada peringkat
- Correlaciones Generalizadas para El Coeficiente de FugacidadDokumen3 halamanCorrelaciones Generalizadas para El Coeficiente de FugacidadLeonardo RoblesBelum ada peringkat
- CUESTIONARIO QuimicaDokumen6 halamanCUESTIONARIO Quimicagregory pardoBelum ada peringkat
- Ejercicios de Calor, Maquinas, Vapor y Primera LeyDokumen12 halamanEjercicios de Calor, Maquinas, Vapor y Primera LeypaolaBelum ada peringkat
- Trabajo de Investigación Equilibrio Químico ESTRADA JOSELINDokumen5 halamanTrabajo de Investigación Equilibrio Químico ESTRADA JOSELINJositaEstradaBelum ada peringkat
- Práctica4 B4 G02Dokumen12 halamanPráctica4 B4 G02don quijote de la manchaBelum ada peringkat
- Modelo Matemático Del Gas RealDokumen4 halamanModelo Matemático Del Gas RealLuna Sherezadee ASBelum ada peringkat
- ProcesosDokumen3 halamanProcesosCristian CelyBelum ada peringkat
- TRABAJO EN CASA - TermodinámicaDokumen19 halamanTRABAJO EN CASA - TermodinámicaadrianBelum ada peringkat
- ProblemarioDokumen10 halamanProblemariomagBelum ada peringkat
- Arc 840Dokumen64 halamanArc 840Willian PastranaBelum ada peringkat
- PROBLEMA 2 Sistema Cerrado Con Interpolación Realizado en ClaseDokumen2 halamanPROBLEMA 2 Sistema Cerrado Con Interpolación Realizado en ClaseVXXIVBelum ada peringkat
- Solutions Manual Fundamentals of Thermodynamics Sonntag Borgnakke Van WylenDokumen3 halamanSolutions Manual Fundamentals of Thermodynamics Sonntag Borgnakke Van WylenCristian KanoBelum ada peringkat
- Practica #1Dokumen8 halamanPractica #1Kyu Naty HyunBelum ada peringkat
- Cuaderno Ejercicios FFDokumen70 halamanCuaderno Ejercicios FFOmar Velasco100% (1)
- Sistemas Concentrados y No ConcentradosDokumen4 halamanSistemas Concentrados y No ConcentradosManuel Aguilar MartinezBelum ada peringkat
- Taller1.Gases FisicoquimicaDokumen6 halamanTaller1.Gases FisicoquimicaMiguel Angel SortizBelum ada peringkat
- LEY DE HESS, DIAGRAMA EQUILIBRIO para FQ2020 VERSION FINALDokumen17 halamanLEY DE HESS, DIAGRAMA EQUILIBRIO para FQ2020 VERSION FINALJuanita rosasBelum ada peringkat
- Ley de Gay LussacDokumen2 halamanLey de Gay LussacEncarna Fuertes ReboiroBelum ada peringkat
- Informe de Fisica II #1Dokumen5 halamanInforme de Fisica II #1Alejandro MartinezBelum ada peringkat
- Aplicacion de Determinantes Aplicada A La Ingenieria Civil Con Caso PracticoDokumen5 halamanAplicacion de Determinantes Aplicada A La Ingenieria Civil Con Caso PracticoMateo Nicolas Tapia Aguirre100% (1)
- Ejercicios Resueltos Isoterma de Bet y Langmuir PDF FreeDokumen9 halamanEjercicios Resueltos Isoterma de Bet y Langmuir PDF FreeJOSE CARLOS QUEVEDO CABARCAS ESTUDIANTE ACTIVOBelum ada peringkat
- 4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Dokumen4 halaman4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Katherine JacayBelum ada peringkat
- D Deber 4 Capacidad Calorífica Promedio y Calor Latente PromedioDokumen5 halamanD Deber 4 Capacidad Calorífica Promedio y Calor Latente PromedioEliana RomeroBelum ada peringkat
- 2 PROCESOS ISOTERMICO Y ADIABATICOSolucion de Ejercicios.Dokumen7 halaman2 PROCESOS ISOTERMICO Y ADIABATICOSolucion de Ejercicios.MarBelum ada peringkat
- Laboratorio 1 TermodinamicaDokumen10 halamanLaboratorio 1 TermodinamicaGarcia SebastianBelum ada peringkat
- TALLER 5 - Diseño Factorial 2k y 3kDokumen10 halamanTALLER 5 - Diseño Factorial 2k y 3kMelissa0% (1)
- 05 - Problemas Termoquimica PDFDokumen43 halaman05 - Problemas Termoquimica PDFAnonymous HJ7JiXBelum ada peringkat
- Capítulo 2Dokumen105 halamanCapítulo 2Rosa Maria Fernandez ReyesBelum ada peringkat
- Diagnostico Inicio UANDokumen3 halamanDiagnostico Inicio UANJuan EscobarBelum ada peringkat
- Equilibrio Quimico FicoDokumen9 halamanEquilibrio Quimico FicoSherlin Almanza Obregon0% (1)
- Aplicaciones de La Transformada de Laplace PDFDokumen27 halamanAplicaciones de La Transformada de Laplace PDFJorgethorrBelum ada peringkat
- Trabajo Grupal - Unidad 02Dokumen33 halamanTrabajo Grupal - Unidad 02Edgar Alvarez Ponce100% (1)
- Caracteristica de Los Procesos Con Floculos MicrobianosDokumen48 halamanCaracteristica de Los Procesos Con Floculos MicrobianosAndre Quintana Aylas100% (1)
- Ecuación de Estado de Van Der WaalsDokumen3 halamanEcuación de Estado de Van Der Waalsrosario_noyolaBelum ada peringkat
- Ecuación de Estado de Van Der WaalsDokumen3 halamanEcuación de Estado de Van Der WaalsHola Yesenia DiazBelum ada peringkat
- Ecuación de Estado de Van Der WaalsDokumen3 halamanEcuación de Estado de Van Der WaalsHola Yesenia DiazBelum ada peringkat
- Ecuación de Estado de Van Der WaalsDokumen3 halamanEcuación de Estado de Van Der WaalsHola Yesenia DiazBelum ada peringkat
- Ecuación de Estado de Van Der WaalsDokumen6 halamanEcuación de Estado de Van Der WaalsMiguelBelum ada peringkat
- Euaciones de EstadoDokumen12 halamanEuaciones de EstadoEsther Ramos GonzalezBelum ada peringkat
- Tarea Caudal de DiseñoDokumen14 halamanTarea Caudal de DiseñoDaniel Maldonado OroscoBelum ada peringkat
- Trabajo Fina Mod 01Dokumen24 halamanTrabajo Fina Mod 01Daniel Maldonado OroscoBelum ada peringkat
- PF-D0 (Esp)Dokumen2 halamanPF-D0 (Esp)Daniel Maldonado OroscoBelum ada peringkat
- Tratamiento Preliminar: Esam - Diplomado en Diseño Y Operación de PtarDokumen35 halamanTratamiento Preliminar: Esam - Diplomado en Diseño Y Operación de PtarDaniel Maldonado OroscoBelum ada peringkat
- Formato PF-D1Dokumen5 halamanFormato PF-D1Daniel Maldonado OroscoBelum ada peringkat
- 01 Informe Inicial Bloque ColoradosDokumen9 halaman01 Informe Inicial Bloque ColoradosDaniel Maldonado OroscoBelum ada peringkat
- Epz - Manual Suministro Energia Electrica en BTDokumen47 halamanEpz - Manual Suministro Energia Electrica en BTDaniel Maldonado Orosco100% (4)
- Informe de Condiciones Previas de Un ProyectoDokumen14 halamanInforme de Condiciones Previas de Un ProyectoDaniel Maldonado Orosco100% (2)
- Especificaciones SirenasDokumen4 halamanEspecificaciones SirenasDaniel Maldonado OroscoBelum ada peringkat
- 03 Presupuesto General 2 ViviendaDokumen2 halaman03 Presupuesto General 2 ViviendaDaniel Maldonado OroscoBelum ada peringkat
- Oficio InfraestructuraDokumen7 halamanOficio InfraestructuraDaniel Maldonado OroscoBelum ada peringkat
- Residuos SolidosDokumen218 halamanResiduos SolidosDaniel Maldonado OroscoBelum ada peringkat
- Especificaciones Tecnicas Tanque Challapata.Dokumen44 halamanEspecificaciones Tecnicas Tanque Challapata.Daniel Maldonado OroscoBelum ada peringkat
- Normativa AmbientalDokumen410 halamanNormativa AmbientalDaniel Maldonado Orosco100% (1)
- 3 Resumen EjecutivoDokumen3 halaman3 Resumen EjecutivoDaniel Maldonado OroscoBelum ada peringkat
- Principios Constitucionales Del Derecho Ambiental EcuatorianoDokumen2 halamanPrincipios Constitucionales Del Derecho Ambiental EcuatorianoDaniel Maldonado OroscoBelum ada peringkat
- Que Invadimos AhoraDokumen1 halamanQue Invadimos AhoraDaniel Maldonado OroscoBelum ada peringkat
- Interpretación de Determinantes y Aplicaciones de MatricesDokumen26 halamanInterpretación de Determinantes y Aplicaciones de MatricesFabiola Calderon0% (2)
- Taller Leyes de Newton 10 y 11Dokumen3 halamanTaller Leyes de Newton 10 y 11Rolando Cardona GonzalezBelum ada peringkat
- Estructuras Pre Esforzadas - Jjc-Cem IVDokumen143 halamanEstructuras Pre Esforzadas - Jjc-Cem IVKenyo LoaBelum ada peringkat
- 1-Neurobiología de La ConcienciaDokumen14 halaman1-Neurobiología de La ConcienciaNicanor TremebundoBelum ada peringkat
- c3d Content Mexico v1 Doc Spanish 2014Dokumen131 halamanc3d Content Mexico v1 Doc Spanish 2014Marvin MoranBelum ada peringkat
- REVENIDODokumen13 halamanREVENIDOMaricielo SagumaBelum ada peringkat
- Cuestionario 5Dokumen5 halamanCuestionario 5Bryan Isnado ArceBelum ada peringkat
- ALMACENAMIENTODokumen14 halamanALMACENAMIENTOAltic DgjBelum ada peringkat
- Clasificación para Fines EstructuralesDokumen22 halamanClasificación para Fines EstructuralesMaryori Evelyn0% (1)
- Seguidor de LineaDokumen13 halamanSeguidor de LineaKevin Alejandro100% (1)
- Alternativas de Decisión Mediante Distribuciones de ProbabilidadDokumen5 halamanAlternativas de Decisión Mediante Distribuciones de ProbabilidadEdgard Alberto Lugo SolorzanoBelum ada peringkat
- Pets BuenVENTURADokumen3 halamanPets BuenVENTURAJhon WillBelum ada peringkat
- TD3-2019.2 Tarea Corta 03 PDFDokumen3 halamanTD3-2019.2 Tarea Corta 03 PDFDiego LópezBelum ada peringkat
- Sistemas LinealesDokumen6 halamanSistemas LinealesRodrigo Gabriel Torres TerronesBelum ada peringkat
- El Motor DieselDokumen13 halamanEl Motor DieselAndrea Cortes Monroy ArriazaBelum ada peringkat
- Muestreo y DistribucionesDokumen76 halamanMuestreo y DistribucionesYoselin Dayana Banegas HumireBelum ada peringkat
- Examen Unidad 4Dokumen1 halamanExamen Unidad 4Vicente Morales NavaBelum ada peringkat
- Hds Acido Muriatico 2018Dokumen5 halamanHds Acido Muriatico 2018borisBelum ada peringkat
- Avogadro y DaltonDokumen16 halamanAvogadro y DaltonLIC. Jenny Marcela Capera RodriguezBelum ada peringkat
- Linea Del TiempoDokumen2 halamanLinea Del TiempoCaroLina Del Carmen César100% (1)
- Laboratorio No. 4 Permeabilidad de Suelos GranularesDokumen8 halamanLaboratorio No. 4 Permeabilidad de Suelos GranularesJaime quinteroBelum ada peringkat
- Ejercicios Extremos Con RespuestaDokumen3 halamanEjercicios Extremos Con RespuestaRicardo RoaBelum ada peringkat
- Analisis de Sistemas de Potencia SilabusDokumen3 halamanAnalisis de Sistemas de Potencia SilabusDany PamoBelum ada peringkat
- Examen - Bimestral 3er (2do Bimestre Examen Final)Dokumen2 halamanExamen - Bimestral 3er (2do Bimestre Examen Final)Grecia Grecia GreciaBelum ada peringkat
- Examen Sexto ParcialDokumen4 halamanExamen Sexto ParcialJohan Acevedo100% (1)
- Presentación Generalidades Sobre PuentesDokumen71 halamanPresentación Generalidades Sobre PuentesAndrei SalasBelum ada peringkat
- Muestreo de Aguas SubterráneasDokumen19 halamanMuestreo de Aguas SubterráneasRichard Pantoja BazanBelum ada peringkat
- Continuacion Trigonometria PDFDokumen10 halamanContinuacion Trigonometria PDFClaudio Carrasco BenavidesBelum ada peringkat
- MONOGRAFÍADokumen15 halamanMONOGRAFÍARonal Ramírez AlhuayBelum ada peringkat
- Unidad 8fuerzas IntermolecularesDokumen30 halamanUnidad 8fuerzas IntermolecularesMaria Stella Avendaño HerreraBelum ada peringkat