Titulacion 222
Diunggah oleh
Joel Calderon MezaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Titulacion 222
Diunggah oleh
Joel Calderon MezaHak Cipta:
Format Tersedia
QUIMICA ANALITICA CUANTITATIVA
31/10/12
Qumica analtica cuantitativa
PRACTICA N 4
DETERMINACION DE PORCENTAJE DE
CaO EN UNA MUESTRA DE CAL
CURSO:
QUIMICA ANALITICA CUANTITATIVA
DOCENTE:
ING. RAMOS MARTINEZ, J,
ALUMNA:
REYES DIEGO, P.
SEMESTRE: IV
Cerro de Pasco - 2012
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
INFORME N 004/RSJF/METIV/UNDAC/2012
PARA DE ASUNTO FECHA
: Ing. RAMOS MARTINEZ, Jons : REYES DIEGO, P. : Determinacin de %CaO en una muestra de cal : 31 10 12
A Ud. Con el debido respeto presento el informe en el cual nos informaremos de la existencia de Determinacin de %CaO en una muestra de cal; as tambin le informamos sobre el trabajo desarrollado en el laboratorio con cada uno de estos compuestos. Seguros de haber aprendido casi en su totalidad el tema tratado agradecemos su enseanza.
Atentamente;
REYES DIEGO, P. Alumna
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
INTRODUCCION Las reacciones cido-base son reacciones de equilibrio homogneo (neutralizacin) entre los iones, que se producen al estar en contacto un cido con una base obtenindose una sal mas agua. Durante las operaciones rutinarias en el laboratorio as como en la de los anlisis volumtricos son prcticamente mayor los problemas relacionados con la estequiometria, una de ellas es la normalidad que se define como el nmero de equivalentes de soluto por litro de solucin. La normalidad es til porque el equivalente se obtiene de manera que un equivalente de un agente oxidante reaccione con un equivalente de un agente reductor, un mol de electrones adquiridos y un mol de electrones perdidos. De manera semejante. Un equivalente de un cido neutraliza completa y precisamente un equivalente de una base, puesto que un mol H+ reaccionar con un mol de OH-. Esto significa que al mezclar volmenes iguales de soluciones que tienen la misma normalidad llevara a una reaccin completa entre sus solutos, un litro de cido 1N neutralizar completamente un litro de base 1N porque un equivalente de cido reaccionara con un equivalente de base. Esta reaccin se utiliza para averiguar la cantidad de cido que posee una disolucin a partir de una cantidad de base conocida, o viceversa.
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
1.1.
MARCO TEORICO
La naturaleza de las sustancias es una de los temas ms estudiados por la
qumica, ya que de acuerdo a sta, estn determinados los tipos de reacciones que se presentan de acuerdo a los reactivos en un proceso. LA TITULACIN
DEFINICION.- Una reaccin de neutralizacin es aquella en la que un cido y una base en solucin acuosa, interactan para producir agua y una sal.
Estas reacciones son importantes industrialmente pues constituyen un mtodo eficaz de producir sales de alta pureza. Durante la neutralizacin, los iones H y OH reaccionan entre s para producir agua, al tiempo que los iones restantes, es decir, los pares conjugados del cido y la base, generan la sal. Sin embargo, por lo general estos iones continan disociados en solucin acuosa, por lo que la sal, como tal, no se forma sino hasta que el agua es retirada, por ejemplo, por evaporacin. El pH de la solucin luego de que ha ocurrido la neutralizacin es cercano a la neutralidad, aunque su valor exacto depende de los iones presentes.
La titulacin o valoracin de soluciones tiene como principal objetivo determinar la concentracin de una solucin cida o bsica desconocida denominada solucin analizada. Esto se logra a travs de la adicin de pequeos volmenes de una solucin cida o bsica de concentracin conocida-la solucin valorada- a la solucin analizada. El proceso se basa en la neutralizacin que se lleva a cabo entre las dos soluciones, ya que una es cida y la otra es bsica. As, si sabemos la concentracin de iones H de la solucin valorada, podremos deducir la concentracin de iones OH en la solucin analizada, a partir del volumen de solucin valorada usado para neutralizarla, pues la H debe ser igual a la . Cuando esto sucede se dice que se ha alcanzado el punto de equivalencia. En este punto, el nmero de equivalentes-gramo del cido y la base son iguales.Es un mtodo para determinar la cantidad
de una sustancia presente en solucin. Una solucin de concentracin conocida, llamada solucin valorada, se agrega con una bureta a la solucin que se analiza
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
En trminos generales la reaccin entre cantidades equivalentes de cidos y bases se llama neutralizacin o reaccin de neutralizacin, la caracterstica de una reaccin de neutralizacin es siempre la combinacin de hidrogeniones que proceden del cido, con hidroxiliones procedentes de la base para dar molculas de agua sin disociar, con liberacin de energa calorfica como calor de neutralizacin y formacin de una sal. En una expresin como la siguiente expresin:
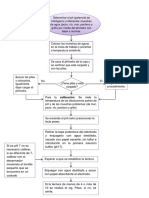
As pues, la titulacin es un proceso en el cual la solucin estndar (del patrn primario) se combina con una solucin de concentracin desconocida para determinar dicha
concentracin, la curva de titulacin es la grfica que indica como el pH de la solucin cambia durante el transcurso de la misma (el pH se grfica contra el volumen de base o cido agregado). Entonces podra entenderse como final de la titulacin al momento en que el pH llegase a 7, sin embargo, esto est en funcin de la fuerza del cido o la base que se estn titulando. As cuando la neutralizacin se produce entre un cido fuerte y una base fuerte. El pH en el punto de equivalencia es 7 ya que todos los iones han sido neutralizados. Por otra parte, cuando la reaccin ocurre entre una base fuerte y un cido dbil, el anin del cido sufre una hidrlisis, por lo que el pH al que ocurre la neutralizacin es mayor que 7. Y en la situacin contraria, entre cido fuerte y una base dbil, el catin de la base sufre una hidrlisis producindose iones hidrnio, por lo que el pH es menor que 7.
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
PARA DETERMINAR STE PUNTO (DE EQUIVALENCIA) Podemos utilizar la curva de titulacin potenciomtrica de la reaccin cido-bsica cuya grfica resulta del pH del sistema contra volumen de cido o de base agregados en la titulacin (Umland, 2000, p.602). En las titulaciones se pueden utilizar indicadores internos. Los indicadores son compuestos orgnicos de estructura compleja que cambian de color en solucin a medida que cambia el pH. A continuacin se describen algunos de ellos. RANGO DE pH DEL CAMBIO DE COLOR 1.2 2.8 3.1 4.5
INDICADOR Azul de timol Anaranjado de metilo
COLOR CIDO
COLOR ALCALINO
Rojo Rojo
Amarillo Amarillo
Verde de bromocresol
Amarillo
3.8 5.5
Azul
Rojo de metilo Papel de tornasol Azul de bromotimol Azul de timol Fenolftalena Amarillo de alizarina
Rojo Rojo Amarillo Amarillo Incoloro Amarillo
4.2 6.3 5.0 8.0 6.0 7.6 8.0 9.6 8.3 10.0 10.0 12.1
Amarillo Azul Azul Azul Rojo Alhucema
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
En este tipo de titulaciones (con indicador interno) no se requiere de ningn grfico para determinar el punto de equivalencia, solo se requiere observar el cambio de coloracin de la solucin para concluir el final de la reaccin y hacer las mediciones correspondientes. LAS TITULACIONES POTENCIOMTRICAS Al igual que en el caso anterior, son un proceso en el cual la solucin estndar (del patrn primario) se combina con una solucin de concentracin desconocida para determinar dicha concentracin, la curva de titulacin es la grfica que indica como el pH de la solucin cambia durante el transcurso de la misma ( [*] el pH se grfica contra el volumen de base o cido agregado). Para determinar el punto de equivalencia, podemos utilizar la curva de titulacin potenciomtrica de la reaccin cido-bsica (Umland, 2000, p.602). Como se observa, la concentracin de los iones hidrnio, antes de agregar el cido y comenzar la titulacin corresponde a la concentracin de iones hidrnio de la solucin de la base dbil. A medida que se agrega el cido, la base dbil se transforma en su sal, la solucin contiene la base dbil y la sal del cido fuerte, y por consiguiente est amortiguada.
Vml = PM Molar Volumen Pureza Densidad
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
II. PROCEDIMIENTO
2.1.
OBJETIVOS
Determinar el punto final de una reaccin utilizando indicadores. Determinar la naturaleza de una solucin, si es cida o bsica. Identificar por medio de la curva de titulacin cido-base el volumen y el pH en el punto de equilibrio.
2.2.
EQUIPOS Y MATERIALES
Para esta prctica se necesitaran los siguientes materiales y equipos los cuales harn ms eficaz el trabajo de la prctica. REACTIVOS Cal ( CaO) Sacarosa fenolftalena. cido sulfrico (H2SO4) Agua de cao Agua destilada. MATERIALES Probeta Bureta Vaso de precipitados Fiola (500 ml) Gotero Embudo
Matraz
Hoja de filtro.
UNDAC
Qumica analtica cuantitativa Para esta prctica se nos fueron planteadas lo siguiente:
PRACTICA N 4
A. Preparar una solucin de deci normal de H2SO4 en 500 ml.
REALIZANDO LOS CALCULOS:
Teniendo en cuenta la densidad y pureza. Y la siguiente formula:
Vml = PM Molar Volumen Pureza Densidad
HALLANDO LA MOLARIDAD:
Mediante la frmula:
M = N nmero de iones de hidrogeno
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
Vml = PM Molar Volumen Pureza Densidad
OBTENEMOS:
V = 5.43ml rpta
B. Hallar en porcentaje de CaO:
% CaO = Vml (H2SO4) x 2.8
El porcentaje de CaO; ser la incgnita.
10
UNDAC
Qumica analtica cuantitativa DESARROLLO DE LA PRCTICA
PRACTICA N 4
1.
Para realizar uso de cualquiera de los materiales de laboratorio; tenemos que primero lavarlo con agua de cao y en seguida con agua destilada.
2.
Pesar 30 g de sacarosa, pulverizado.
11
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
3.
En una Fiola preparamos la muestra de sacarosa pulveriza y 1g de cal disolverlas en agua. En seguida agitarlo por lo menos 30 minutos.
4.
En otra Fiola echamos 2,76 ml de H2SO4 de agua. Hasta la marca que tiene la Fiola.
12
UNDAC
Qumica analtica cuantitativa LUEGO:
PRACTICA N 4
5.
Nuevamente con sumo cuidado, en la bureta se vierte 100ml de la solucin que tenamos en la Fiola, es decir: H2SO4 + agua destilada.
POR OTRO LADO:
6.
Filtrar 2.8ml de la solucin de sacarosa y la muestra de cal. En una probeta.
13
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
POR CONSIGUIENTE:
7.
En un matraz de 50ml , agregamos 2.8 de la muestra filtrada.
8.
Mientras en el matraz tenemos filtrado 2.8ml de la solucin de sacarosa y la muestra de cal, en ella agregamos 3 gotas de fenolftalena disuelta. Y notamos que el color de esta solucin cambia a rocella.
IMPORTANTE: Como podemos observar la solucin actual presenta una
coloracin rocella, tan solo a partir de 3 gotas de fenolftalena.
14
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
9.
Ahora colocamos debajo de la bureta el matraz con la solucin actual de color rocella. Dejamos caer en esta 8.8ml de (H2SO4 + agua destilada), y notamos que con un suave movimiento ejercido en el matraz la solucin rcela pasa a ser incolora. De esta manera:
10.
RESULTADO: Como mencionamos anteriormente para hallar la incgnita que
viene a ser el porcentaje de CaO, ser:
% CaO = Vml (H2SO4) x 2.8
Reemplazando:
% CaO = Vml (H2SO4) x 2.8 % CaO = 8.8 x 2.8 % CaO = 24.64
15
.. Rpta.
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
III.
CONCLUSIONES
Los resultados fueron buenos ya que en la prueba se obtuvo que el porcentaje de CaO fue de 24.64%, mediante la titulacin anterior.
El punto final de la titulacin es llamado es llamado punto de equilibrio que puede conocerse gracias a los indicadores, los cuales pueden variar sus concentraciones fsicas dependiendo del tipo de solucin presente.
Al tener conocimiento de la concentracin desconocida, se determina el porcentaje masa / volumen.
El punto final la titilacin se puede determinar cualitativamente uniendo las soluciones de cido actico e hidrxido de sodio hasta producirse el color rosado plido, en donde se encuentran cantidades iguales de equivalentes de cido y base
16
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
IV.
ANEXOS
Materiales que se emplean en la practica
BURETA
VASO DE PRECIPITADOS
FIOLA DE 500ml
PROBETA
GOTERO
FENOLFTALEINA
17
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
ACIDO SULFURICO - H2SO4
CAL
SACAROSA
AGUA DESTILADA
18
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
V.
RECOMENDACIONES
Ingresar de forma ordenada al laboratorio.
En primer lugar seguir las instrucciones del ingeniero encargado de realizar la prctica.
Manipular con mucho cuidado los diversos reactivos-
Tomar los apuntes respectivos de cada una de los procedimientos realizados.
No tocar con las manos las partes mviles de la balanza.
Llevar los implementos necesarios para emplearlos en el laboratorio.
Y lo ms importante tener cuidado con las sustancias qumicas que sern otorgadas por el Ingeniero a cargo.
19
UNDAC
Qumica analtica cuantitativa
PRACTICA N 4
VI.
BIBLIOGRAFIA
Brown Leway Bursten Murphy_ qumica La ciencia central Qumica general Brown le May. Raymond Chang, Qumica. Cuarta Edicin. http://www.abanacinal.jimdo.com http://www.monografias.com http://www.wikipedia.com
20
UNDAC
Anda mungkin juga menyukai
- Preparacion y ValoracionDokumen10 halamanPreparacion y ValoracionJoel Calderon MezaBelum ada peringkat
- Preparacion de La MuestraDokumen9 halamanPreparacion de La MuestraJoel Calderon MezaBelum ada peringkat
- Preparacion de La MuestraDokumen9 halamanPreparacion de La MuestraJoel Calderon MezaBelum ada peringkat
- Formatos de RequerimientoDokumen1 halamanFormatos de RequerimientoJoel Calderon MezaBelum ada peringkat
- Flotacion Inversa de La SiliceDokumen14 halamanFlotacion Inversa de La SiliceJoel Calderon MezaBelum ada peringkat
- Visita Tecnica Junin-SicayaDokumen16 halamanVisita Tecnica Junin-SicayaJoel Calderon MezaBelum ada peringkat
- Flotación inversa del carbón para concentrar no metálicosDokumen14 halamanFlotación inversa del carbón para concentrar no metálicosJoel Calderon MezaBelum ada peringkat
- Formatos de Requerimiento EmpresaDokumen1 halamanFormatos de Requerimiento EmpresaJoel Calderon MezaBelum ada peringkat
- Presentación Medio AmbienteDokumen23 halamanPresentación Medio AmbienteJoel Calderon MezaBelum ada peringkat
- Codigo ColoresDokumen19 halamanCodigo ColoresJoel Calderon MezaBelum ada peringkat
- Flotacion Inversa de La SiliceDokumen14 halamanFlotacion Inversa de La SiliceJoel Calderon MezaBelum ada peringkat
- BIOLIXIVIACIONDokumen16 halamanBIOLIXIVIACIONJoel Calderon MezaBelum ada peringkat
- Preparacion de La MuestraDokumen8 halamanPreparacion de La MuestraJoel Calderon MezaBelum ada peringkat
- Flotacion Inversa CarbonDokumen12 halamanFlotacion Inversa CarbonJoel Calderon Meza100% (1)
- Flotacion Inversa BaritinaDokumen14 halamanFlotacion Inversa BaritinaJoel Calderon MezaBelum ada peringkat
- Módulo AGUAS - JONASDokumen40 halamanMódulo AGUAS - JONASJoel Calderon MezaBelum ada peringkat
- Flotacion Inversa de La SiliceDokumen14 halamanFlotacion Inversa de La SiliceJoel Calderon MezaBelum ada peringkat
- Concentracion Gravimetrica en Caja de Simulacion JigsDokumen12 halamanConcentracion Gravimetrica en Caja de Simulacion JigsJoel Calderon MezaBelum ada peringkat
- Inf.2 BalanzaDokumen9 halamanInf.2 BalanzaJoel Calderon MezaBelum ada peringkat
- Practica de SedimentaciónDokumen6 halamanPractica de SedimentaciónJoel Calderon MezaBelum ada peringkat
- Concentracion en Medios DensosDokumen10 halamanConcentracion en Medios DensosJoel Calderon MezaBelum ada peringkat
- EcosistemaDokumen8 halamanEcosistemaJoel Calderon MezaBelum ada peringkat
- Concentracion en Medios DensosDokumen10 halamanConcentracion en Medios DensosJoel Calderon MezaBelum ada peringkat
- Concentracion en Medios DensosDokumen10 halamanConcentracion en Medios DensosJoel Calderon MezaBelum ada peringkat
- Inf.2 BalanzaDokumen9 halamanInf.2 BalanzaJoel Calderon MezaBelum ada peringkat
- Libro ING OliveraDokumen13 halamanLibro ING OliveraJoel Calderon MezaBelum ada peringkat
- Rreacciones Alcalinas-ToxicologiaDokumen20 halamanRreacciones Alcalinas-Toxicologiaramos1989Belum ada peringkat
- Ayuda SupletorioDokumen197 halamanAyuda SupletorioAnthony HurtadoBelum ada peringkat
- Determinación fallida del índice de peróxido en grasasDokumen7 halamanDeterminación fallida del índice de peróxido en grasasAnahí Vasquez RodriguezBelum ada peringkat
- Ejercicios VolumetriaiDokumen4 halamanEjercicios VolumetriaiSheyla Maybee Yantas EspirituBelum ada peringkat
- Cuento Ludico Acido - BaseDokumen2 halamanCuento Ludico Acido - BaseJose Antonio Méndez RamirezBelum ada peringkat
- Acidez NectarDokumen2 halamanAcidez NectarConsuelo Garcia OrtizBelum ada peringkat
- Reactivos Indicadores Acido-BaseDokumen25 halamanReactivos Indicadores Acido-BaseKevin AnthonyBelum ada peringkat
- Montelongo PHDokumen2 halamanMontelongo PHOscar0% (1)
- Manual de Bioquimica I LaboratorioDokumen35 halamanManual de Bioquimica I LaboratorioQUIMICO CLINICO WILLIANS SANCHEZ100% (2)
- Preguntas - MatemáticaDokumen28 halamanPreguntas - MatemáticaRodrigo RamónBelum ada peringkat
- Forrajes y nutrición animalDokumen7 halamanForrajes y nutrición animalJosé FloresBelum ada peringkat
- Reglas pH reaccionesDokumen6 halamanReglas pH reaccionesAislin IxchelBelum ada peringkat
- Bioquimica ARTICULODokumen6 halamanBioquimica ARTICULOLuis LuaBelum ada peringkat
- Exp 2-3 Labo 6Dokumen10 halamanExp 2-3 Labo 6Villaverde LazoBelum ada peringkat
- Análisis microbiológico y fisicoquímico de la lecheDokumen10 halamanAnálisis microbiológico y fisicoquímico de la lecheJordi ClaudioBelum ada peringkat
- Iii Taller 2020 Quimica (Corte 3)Dokumen3 halamanIii Taller 2020 Quimica (Corte 3)johan sierraBelum ada peringkat
- ACI 222R en EspañolDokumen24 halamanACI 222R en EspañolMarcelaBelum ada peringkat
- MP-Medidores Portátiles de La Serie MP-MANUAL DEL USUARIODokumen66 halamanMP-Medidores Portátiles de La Serie MP-MANUAL DEL USUARIOsirgueloBelum ada peringkat
- Sin TítuloDokumen13 halamanSin Títulojuan de diosBelum ada peringkat
- Acidez y BasicidadDokumen18 halamanAcidez y BasicidadClaudiaBelum ada peringkat
- Pensamiento Químico: Primer ParcialDokumen27 halamanPensamiento Químico: Primer ParcialBruno DiazBelum ada peringkat
- Diagram de Au-Ag-CuDokumen6 halamanDiagram de Au-Ag-CuRaul Wilbert Quispe ToledoBelum ada peringkat
- Curso 1 LixiviacionDokumen72 halamanCurso 1 LixiviacionEduardo Lara MadariagaBelum ada peringkat
- El Manejo Del CianuroDokumen40 halamanEl Manejo Del CianuroFernando VillanuevaBelum ada peringkat
- Equilibrio Iónico Del AguaDokumen4 halamanEquilibrio Iónico Del AguaMauricio CasanovaBelum ada peringkat
- Tester HALO2Dokumen5 halamanTester HALO2JORGE JACOMEBelum ada peringkat
- Taller Quimica InorganicaDokumen2 halamanTaller Quimica InorganicaHarold MeloBelum ada peringkat
- Informe Demanda de Cloro PDFDokumen9 halamanInforme Demanda de Cloro PDFMarisol Ortega DelgadoBelum ada peringkat
- Manual LB AD 2022 - Final - AlumnosDokumen131 halamanManual LB AD 2022 - Final - AlumnosSebastian VillanuevaBelum ada peringkat