Membrana Celular 3 Decadas Despues Del Modelo Singer Nicolson
Diunggah oleh
USMP FN ARCHIVOSHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Membrana Celular 3 Decadas Despues Del Modelo Singer Nicolson
Diunggah oleh
USMP FN ARCHIVOSHak Cipta:
Format Tersedia
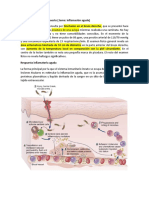
Dinmicos, pero estructurados: La membrana celular tres dcadas despus del modelo SingerNicolson El modelo de membrana mosaico fluido
demostr ser una hiptesis muy til para explicar muchos, pero ciertamente no todos, los fenmenos que tienen lugar en las membranas biolgicas. Nuevos datos experimentales muestran que la compartimentacin de componentes de la membrana puede ser tan importante para la transduccin de seal efectiva como es la fluidez de la membrana. En este trabajo, queremos rendir homenaje al modelo de Singer-Nicolson, que est cerca de su 30 aniversario, en honor a sus caractersticas bsicas, mosaicismo'' y'' difusin'', que predice el interspersion de las protenas y los lpidos y su capacidad para someterse reordenamiento dinmico mediante el movimiento browniano. Al mismo tiempo, se proponen modificaciones basadas en los datos cuantitativos, destacando la frecuencia predestinada genticamente, pero flexible, estructura multinivel implementacin de un gran complejidad de las funciones celulares. Este nuevo'' dinmicamente estructurado mosaico modelo'' tiene las siguientes caractersticas: el nfasis se desplaza de fluidez al mosaicismo, que, en nuestra interpretacin, significa que los patrones no aleatorios codistribucin de tipos especficos de protenas de membrana que forman racimos pequea escala a nivel molecular y en gran escala clusters (grupos de racimos, islas) a nivel submicromtrico. Las fuerzas de cohesin, que mantienen estos conjuntos como elementos principales de las membranas, se originan desde dentro de una estructura de microdominio, donde lpido-lpido, protenaprotena, y las interacciones protena-lpido, as como sub y supramembrana (citoesqueleto, de la matriz extracelular, otra de clulas) efectores, muchos de ellos predestinada genticamente, juegan un papel igual de importantes. El concepto de la fluidez en el modelo original ahora se interpreta como la permisividad de la arquitectura de continua, la reestructuracin dinmica de los grupos moleculares y nivel superior de acuerdo con las necesidades de la clula y como evocado por el medio ambiente. Dogmas Cientficos, permiten modelos solos, rara vez sobreviven ms de un cuarto de siglo sin modificaciones significativas. Alrededor de su 30 aniversario, el tiempo parece estar madura para, al menos, una modesta modificacin de un viejo paradigma. El
modelo de membrana mosaico fluido SingerNicolson (modelo SN) predice la libertad lateral y de rotacin y la distribucin aleatoria de los componentes moleculares en la membrana. Las membranas haban sido consideradas por el modelo SN como'' una solucin orientada bidimensional de protenas integrales... en la bicapa de fosfolpidos viscosa''. Ahora se sabe, sin embargo, que esta libertad de la protena (y de lpidos) la movilidad est lejos de ser sin restricciones. Uno de los primeros indicios de una distribucin no aleatoria de protenas fue proporcionada por el descubrimiento de co-taponado. La evidencia emergente sobre jerrquicamente construidas complejos de protenas supramoleculares obstaculizada la difusin de las protenas en la membrana, y la existencia de distintos dominios de la membrana denominadas balsas'' tambin contradice el modelo SN. Por lo tanto, Jacobson et al. han indicado correctamente, "La mayora de las protenas de la membrana no disfrutan de la difusin lateral continuo y sin restricciones ... En su lugar, las protenas se difunden de una forma ms complicada que indica una heterogeneidad considerable en la estructura de la membrana lateral, al menos en una escala nanomtrica.'' La gran variedad de las especies moleculares de fosfolpidos, las diferencias en sus formas moleculares y propiedades fsicas, y su distribucin asimtrica en la bicapa de la membrana, indican una heterogeneidad molecular y la posible formacin de dominios de la membrana micro. Mvil Metodologa Biolgica y Biofsica Molecular Avanzada proporciona datos cuantitativos sobre la organizacin esttica y dinmica de las membranas Dinmica de la membrana, es decir, la movilidad siempre cambiante y las relaciones de proximidad de molculas de lpidos y protenas en la membrana plasmtica, tienen un impacto significativo en los procesos celulares esenciales, tales como la activacin, el reconocimiento de ligando-receptor, la presentacin de antgeno, las interacciones intercelulares (por ejemplo, entre el objetivo y las clulas killer), etc Las mediciones cuantitativas de la dinmica de la membrana son posibles con la recuperacin de la fluorescencia despus de foto blanqueo, tcnicas de rastreo de partcula individual, y de captura por lser ptico pinzas. Espectroscopia de correlacin de fluorescencia, un mtodo con la tradicin en el
estudio de la cintica de la reaccin y las interacciones moleculares en solucin, tambin se ha aplicado al estudio de los sistemas celulares recientemente. El mtodo permite la determinacin de la concentracin absoluta molecular, la movilidad y co-movilidad en pequeos elementos, confocal de volumen de clulas vivas. Microscopa de escaneo lser confocal en el borde de sus lmites de resolucin result ser exitosa en la determinacin de la distribucin desigual de la superficie celular de diversos antgenos. La microscopa de barrido ptico de campo cercano (NSOM), un mtodo ideal para evaluar la localizacin de las protenas de membrana en la resolucin de varias decenas de nanmetros, tambin ha ido ganando espacio en la investigacin de la membrana citoplasmtica , aunque, como Edidin seala,'' mientras NSOM promete mucho, su aplicacin a la biologa es acerca de dnde microscopa electrnica fue hace 40 o 50 aos.'' Estas metodologas apoyadas por procesamiento digital de imgenes aaden informacin valiosa a los datos dinmicos sobre la distribucin espacial y compartimentacin de constituyentes de la membrana. En general, estos enfoques proporcionan pruebas de la distribucin de dominio-como de los lpidos y las protenas en las membranas biolgicas. Las restricciones en la movilidad lateral de ambos lpidos y protenas componentes fueron estudiados ampliamente por el uso de la recuperacin de fluorescencia despus de fotoblanqueado tcnica, la medicin de la difusin de componentes de la membrana de las zonas marcadas con fluorescencia no blanqueada en un pequeo punto, blanqueada. Parmetros de la difusin lateral de molculas de MHC eran altamente dependientes del tamao de la blanqueada in situ. Debido a que se espera que la tasa de difusin en una bicapa lipdica que ser independiente de este tamao, una explicacin plausible es la estructura de dominios de tipo mosaico de las membranas biolgicas que limitan el camino libre de obstculos de las protenas y puede ser en parte responsable de los arreglos de clster de membrana protenas. Seguimiento individualpartcula sigue el pie'''' al azar de una partcula de oro fijado a una protena de la superficie celular. Para el receptor de la transferencia y Ecadherina, se determin un paso sin barrera de 400nm, mientras que para la clase mutante de tipo salvaje y citoplasmtico truncada MHC I, 600 y 1, se midieron 700nm, respectivamente, lo que indica
que, para las protenas que atraviesan la membrana, el paso sin barrera est en la misma gama y que las barreras a la difusin'' libre'' estn presentes 2-3nm bajo la bicapa de la membrana. Como se muestra en la figura. 1, los elementos del citoesqueleto y molculas del citoplasma con conexiones funcionales a receptores de superficie de la clula la capacidad ya sea para reducir la velocidad o parar completamente el movimiento lateral de las protenas transmembrana. La transferencia de energa de resonancia fluorescente (FRET) Destacados asociaciones a escala nanomtrica en la membrana celular Se ha sugerido que las protenas de membrana se pueden codistribuidas no aleatoria, y sin embargo, este patrn no aleatorio codistribucin dinmico incluso puede ser controlado genticamente (3235). Esta hiptesis ha sido apoyada por una cantidad significativa de datos experimentales (36, 37). Un activo importante en el estudio de estas codistribucin fue la aplicacin de FRET a los sistemas celulares. En FRET, un colorante fluorescente excitado (donante) dona energa a un colorante aceptor si la distancia de separacin entre ellos es 1-10nm. En la dcada de 1970, las lecitinas de la superficie celular fueron los primeros en ser investigado por FRET (38, 39). Desde principios de la dcada de 1980, la adquisicin de datos ms sistemtica y mejor establecida y los mtodos de evaluacin de FRET se introdujeron en citometra de flujo. Un mtodo cuantitativo se introdujo en microscopa de fluorescencia digital que explota las diferencias en la cintica de fotoblanqueo de tintes donantes en presencia y ausencia de aceptores. Recientemente, un nuevo mtodo, basado en sistemtica normalizada y mediciones de FRET entre pares de receptores individuales produciendo un mapa del receptor por triangulacin, se ha introducido para describir la topologa exacta de dos dimensiones de grupos de receptores. El homo y asociaciones hetero de MHC de clase I y II, el receptor de IL-2-subunidad y la molcula de adhesin intercelular 1, las molculas de MHC y transferrina receptores (46), CD4 y CD8 antgenos, el receptor de antgeno de clulas T (TCR) CD3, las molculas de tetraspan (CD53, CD81, CD82) y CD20 con MHC de clase I y clase II (50) , las tres subunidades del receptor de mltiples subunidades de IL-2, el receptor del factor de necrosis tumoral, Fas (CD95;. Ref. 52), y muchos
otros han sido analizados en detalle. Se encontraron muchos receptores para ser premontados sin oligmeros de unin de ligandos, incluyendo los receptores del factor de necrosis tumoral, Fas, y TCR. Resultados para el receptor de IL-2 indicaron que sus subunidades estn preensamblados en las clulas T y no requieren la agregacin inducida por citoquinas. Esta colocalizacin fue significativamente modulada por la unin de las normas internacionales pertinentes. Adems, hay evidencia de que el receptor IL-15 subunidad, que comparte la y subunidades con IL-2R, tambin pueden formar estructuras supramoleculares premontado con IL2R y el'' cadena comn''. Estos datos han cuestionado el paradigma aplicado con frecuencia que los receptores de mltiples subunidades se ensamblan bajo la influencia de sus ligandos especficos y apoyan un modelo alternativo en el que grupos de receptores premontados facilitar respuestas biolgicas ms rpido y ms fuerte, porque no hay necesidad de que la difusin lateral de los receptores a asociarse. Microscopa Electrnica y microscopa de de fuerza atmica revelan agrupaciones submicromtricas de receptores de membrana FRET mediciones detectar asociaciones moleculares en el 1 a la gama de 10 nm. Aplicacin combinada de electrones y microscopa de fuerza atmica hizo posible el descubrimiento de un nuevo y ms alto nivel jerrquico de la agrupacin de receptores en las clulas linfoides (36). La distribucin de etiquetas Inmunoelectrnica unidos a receptores mostr un patrn no aleatorio, que difiere de la distribucin de Poisson asumido para las molculas dispersas al azar. El mtodo tambin se utiliza en condiciones cercanas a las fisiolgicas, donde se detectaron las partculas de oro con el anlisis en microscopa de fuerza mediante el modo tapping en muestras hidratadas (36). La observacin de que los islotes de escala nanomtrica de las molculas MHC de clase I en la membrana celular se organizan en tamao micromtrico grupos de islas'''' se extendi a MHC de clase II (56) y para el receptor de IL-2-_ subunidad y la transferrina receptor (24). La aplicacin secuencial de etiquetas de oro de diferentes tamaos dirigidos a las clases de MHC I y II tambin revel que sucesivamente positivo FRET datos no significa necesariamente que cada receptor era homo o hetero asociado en una poblacin grande. El grado de asociacin de MHC
de clase II de MHC de clase I fue del 66%, pero slo el 25% de las molculas MHC de clase I se encontraban en las proximidades molecular de MHC de clase II. Adems de establecer la distribucin no aleatoria de los receptores, inmunomarcaje prevea tambin la estimacin del tamao medio de los grupos moleculares de orden superior (o grupos de islas). Estos estaban en el rango de 400-800 nm para diversos receptores, en buena correlacin con los caminos de medios libres de barreras inform anteriormente . Microscopa confocal de escaneo lser de las clulas marcadas con fluorescencia, en vivo, y fija seguida de reconstruccin de la superficie y el anlisis de autocorrelacin espacial confirm la existencia de tales grupos de receptores con tamaos esencialmente igual a la deducida a partir de microscopa electrnica. Las balsas de lpidos: el equivalente funcional de las Islas del receptor? Numerosos estudios dirigidos a la membrana plasmtica han proporcionado evidencia de la existencia de distintos dominios en el rango submicrnico. Paralelamente a estas observaciones, el trmino'' balsas de lpidos'' fue acuado en base a estudios de la polaridad celular epitelial y gan gran popularidad en los ltimos aos (11). El anlisis bioqumico sugiri que las balsas consisten en colesterol y esfingolpidos en el folleto exoplasmic de la bicapa de lpidos y el colesterol y los fosfolpidos con cidos grasos saturados en el prospecto endoplsmico (61). Estn rodeados de dominios de membrana ms fluidas, que son abundantes en cidos grasos insaturados (62). Se detectaron fosfatidilcolinas poliinsaturados y fosfatidiletanolaminas (63) incluyendo plasmalgenos etanolamina en balsas por ionizacin por electrospray cuantitativa y espectrometra de masas (64), lo que probablemente refleja un mecanismo de regulacin que compensa el efecto de rigidizacin de colesterol (63). Adems, fosfatidiletanolaminas 18:01 y 22:06 y plasmalgenos etanolamina son propensos a formar fases nonbilayer (65, 66), y la asociacin de las protenas solubles (tales como las protenas G) a las membranas depende de la propensin de las zonas hexagonal de fase inversa (67). Esta observacin pone de relieve el posible papel de las balsas de lpidos en los procesos de transduccin de seales. Aislamiento de las balsas de lpidos como dominios de membrana resistentes
a detergentes, seguido por transferencia Western, indicaron que las balsas de hecho son concentradores eficiente de varias protenas, muchos de ellos activo en la sealizacin celular. Entre stos se encontraban glicosilfosfatidilinositol protenas ancladas (68), protenas y colesterol vinculados palmitoylated como Erizo (69), quinasas de la familia Src y _subunidades de protenas G heterotrimeric (70), receptores de citoquinas (71), y las integrinas (72 ). La cuestin es cmo estos dominios de la membrana, detergentresistant identificadas bioqumicamente corresponden al confinamiento observado de protenas de membrana. Como Jacobson y Dietrich (73) sealaron,'' ... la naturaleza de la correlacin in vivo de tales membranas resistentes a detergentes sigue siendo enigmtica. En principio, la microscopa debe ser capaz de determinar si existen las balsas postuladas.'' Recientemente, se ha demostrado que los equivalentes de hecho microscpicas de balsas, o, ms bien, los agregados de las balsas, se pueden detectar mediante el uso de microscopa confocal de alta resolucin y que su desmontaje por el agotamiento o en la formacin de complejos in situ de colesterol no slo destruye su morfologa (24), pero tambin deteriora sus capacidades de sealizacin, por ejemplo, en las clulas T, que impide la fosforilacin de STAT3 y STAT5 a travs del receptor de IL-2 (71). Basado en la idea de que las balsas son esencialmente unidades de membrana formado a partir de la fusin de vesculas de transporte a la membrana, se esperara que su tamao sea muy pequeo (59). En fotnicos experimentos microscpicas de fuerza, se determin que el tamao de balsa es _50 nm de dimetro (74), que representan _3, 500 molculas de esfingolpidos. Esto indica que los parches de membrana observadas en microscopa de fluorescencia, teniendo balsa marcador protenas lpidos and_or, probablemente son agregados de estos bloques de construccin bsicos. En algunos casos, estos agregados de mayor tamao no se observan en las clulas en reposo (75, 76) y slo se pueden ver durante la reticulacin de las balsas de la unidad (75''''). En otros casos, las clulas presentes en sus parches de superficie estado nativo de tamao submicromtrico, identificables como balsas en funcin de su composicin. Las balsas son estructuras dinmicas reconfigurado como funcin requiere
Hace unos aos, se saba muy poco acerca de la estabilidad y la vida til de las balsas lipdicas en las clulas vivas. Parece ahora que, en comparacin con la naturaleza relativamente estable de fases en bicapas artificiales, balsas de lpidos en las clulas son relativamente de corta duracin. Como seala Edidin fuera en una revisin reciente (78),'' ... dominios estn ahora cree que son ms pequeos y menos estable que eran en 1992'' sondas de lpidos con cadenas saturadas gastan en promedio 13 ms en un dominio (79).; la vida media de dominios estables se encontr que en la escala de decenas de segundos (10). Mediciones EPR Pulsada indican un tipo de cambio muy rpido entre los dominios ricos en protenas y el volumen de la membrana, alcanzando tiempos de residencia tan bajo como 15 s. Esta posibilidad de cambiar rpidamente la composicin y la ubicacin en la membrana, as como la capacidad para formar agregados de diferentes tamaos, fcilmente puede dar cuenta de las balsas de lpidos papel regulador dinmicos jugar en diversos procesos de sealizacin. Tal funcin se ha establecido para las quinasas de tirosina del receptor (27) y para los receptores inmunes tales como el TCR (81) y el receptor de IgE (82, 83). El primer paso en la sealizacin inmunoreceptor est representado por la agregacin del receptor dependiente de ligando, seguido por la fosforilacin del receptor de tirosina quinasas de la familia Src. Las balsas de lpidos se han identificado como plataformas en el que las molculas de transduccin de seales pueden interactuar con los inmunoreceptores agregados. Receptores de reconocimiento inmunitario multicatenario tales como TCR (84) y Fc_RI (83) utilizan mecanismos comunes por los que las balsas de lpidos ayudan en la iniciacin de la sealizacin. El inicio de la activacin de clulas T se asocia con la formacin de la sinapsis llamada'''' inmunolgica (85) entre las clulas T y las clulas que se estn reconociendo. Esta sinapsis comienza con la primera agrupacin de los receptores y promueve la acumulacin centralizada de los TCR que se ha denominado el'' centro de activacin supramolecular'' complejo con un anillo perifrico correspondiente, que consiste en linfocitos antgeno asociado a la funcin 1 (LFA-1) ligandos ( 86). Los componentes de la superficie de clulas presentadoras de antgeno tambin son parte integral de estos grupos; complejos de MHCpptido se encuentran en el complejo central de activacin supramolecular, mientras que la
molcula de adhesin intercelular 1, el contrarreceptor LFA-1, se concentra en el complejo de activacin supramolecular perifrica. Inicialmente, los TCR no estn necesariamente comprometidos en el centro, pero como la interaccin clula-clula se desarrolla, que se translocan desde la periferia hacia el centro de la sinapsis (87, 88). De acuerdo con el modelo de desencadenamiento en serie, de esta manera, muy pocas molculas de MHC presentadoras de pptido pueden activar un gran nmero de TCR (89). Parece importante en trminos de la interaccin que palmitoilacin de las cistenas membraneproximal de CD4 y la asociacin de Lck con CD4 contribuye al enriquecimiento de las clulas CD4 en las balsas de lpidos (90) y que, adems, canales K_ tambin residen en balsas en la proximidad molecular de TCR (91). La estructura del contacto celular CTLobjetivo es similar a la observada entre clulas T y clulas antigenpresenting, un anillo de protenas de adhesin que rodean el dominio molcula de seal interno. La secrecin de grnulos lticos se produce en un dominio independiente dentro del anillo de adhesin (92). En cuanto a la coordinacin espaciotemporal de la sealizacin por la alta afinidad del receptor de IgE Fc_RI, balsas de lpidos primero se concentran protenas quinasas Lyn mientras que excluye los Fc_RIs de estos dominios. Al Fc_RIs de reticulacin por el antgeno, los receptores translocan rpidamente en las balsas de lpidos seguido de su fosforilacin y la posterior reclutamiento de Syk y PLC_ en estos dominios (93). El ltimo proceso tambin implica la acumulacin de la actina del citoesqueleto a los dominios activos (82). Un reciente intento de repetir el experimento clsico de Frye y Edidin (94) con las tecnologas actualmente disponibles proporcionan datos interesantes que subrayan el dinamismo de dominios de la membrana. Las clulas marcadas con diferentes anticuerpos fluorescentes se fusionaron entre s. De exploracin de campo cercano estudios microscpicos y FRET paralelo pticos revelaron que entremezcla de grupos de protenas micrometerscale empez justo despus de la fusin celular, pero no haba un retraso de aproximadamente 20 minutos en el entremezclado de las asociaciones de protenas a escala nanomtrica (28), lo que indica claramente la jerarqua de las asociaciones de protenas (fig. 2). Aunque estos experimentos corroboran la existencia de grupos de protenas, que hacen hincapi en su dinamismo, que puede ser
importante para la reorganizacin rpidamente las interacciones protena. Los factores estticos y dinmicos Organizador dominios de membrana Las fuerzas fsicas y qumicas que dan lugar a dominios de la membrana son objeto de investigacin intensiva (2, 57). Uno presume que varias limitaciones y las fuerzas intracelulares y extracelulares influyen en el tamao y la distribucin de estos grupos, siendo uno de ellos el contenido de colesterol de la rea de la membrana en cuestin (11, 95), y el cambio de la composicin de colesterol de la membrana de la clula altera la asociacin patrn y las propiedades de sealizacin de diversas molculas (71, 95). Recientemente, se propuso que los lpidos tienden a adoptar una distribucin superred en bicapas de fosfolpidos y de distribucin en estas estructuras mixtas de lquido se determina por la forma molecular y la carga del grupo de cabeza (96, 97). Estas estructuras superred no cubren toda la superficie de la membrana, sino que estn en equilibrio dinmico con las reas en las que los lpidos se distribuyen al azar. La presencia de protenas puede modificar estas estructuras por el agotamiento o atraer ciertas especies de lpidos debido a las similitudes o diferencias en las formas moleculares. Sin embargo, el cido graso y el grupo de cabeza polar composicin de fosfolpidos (96), as como las transiciones de fase no lamelar termotrpicos y lamelar-a, se controlan con precisin de una manera que se alcanza la fluidez en general por debajo de la temperatura corporal. Arquitectura molecular de ciertos fosfolpidos (98) y la proporcin de los lpidos formadores de nonbilayer (66) puede contribuir a este fenmeno. Sorprendentemente, la temperatura de transicin lquido-lquido ordenadaa-desordenada-fase de balsas adecuadas es 13-15 C por encima de (99) la principal temperatura de transicin de las membranas (100) debido al colesterol alto y el contenido de esfingomielina. En condiciones patolgicas, como enfermedades neurodegenerativas, este equilibrio se rompe. Las balsas de lpidos son a menudo vistos como estructuras procedentes exclusivamente de las interacciones lpido-lpido. Uno no debe, sin embargo, pasar por alto el hecho de que las protenas y las interacciones protena-lpidos podran ser igualmente importante en la formacin, el mantenimiento, y la dinmica de estos
dominios. De hecho, uno puede imaginar la unidad bsica de una balsa como una sola molcula de protena rodeado por lpidos que son especialmente adecuados como su medio ambiente debido a la polaridad y la complementariedad estrica. Adems de las investigaciones clsicos (101), donde se les dio predicciones muy precisas sobre la membrana-que abarca _-hlices, datos recientes tambin sugieren que la composicin exacta y la naturaleza de las estructuras _helicoidales influirn en gran medida de cmo y en qu entorno de este fosfolpido cadena de polipptidos se puede alojar, en todo caso (102). Esto por s solo sera suficiente para dar cuenta de los patrones de protenas en las membranas celulares que estn predestinados genticamente, como se ha predicho hace dcadas (32). La estructura primaria y secundaria de las protenas recin sintetizadas, junto con las capacidades de clasificacin en el transporte vesicular, puede determinar fcilmente qu protenas se pueden incrustar en un determinado entorno de lpidos y otras protenas que sern sus vecinos inmediatos. Por ejemplo, se ha demostrado que el dominio transmembrana de CD40 (103) y la hemaglutinina de la gripe (104) determina su reparticin en las balsas de lpidos. En una nota similar pero mirando el lado dinmico, los cambios en la estructura de las protenas [un ejemplo ms evidente de ser los que se producen despus de su interaccin con otras protenas o los generados por los cambios en el potencial de membrana (105)], as como los cambios en la constitucin o el espesor de las diversas regiones de lpidos, pueden causar fcilmente reorganizacin de los componentes de las balsas lipdicas de manera que la mejor estabilidad steric_energetic se consigue de nuevo (106). La fuerza de la interaccin entre las protenas y su entorno inmediato de lpidos est bien caracterizado cuando las clulas linfoides con molculas MHC marcadas se fusionan (28). Molculas de MHC de clase II de las dos clulas no se entremezclan, incluso despus de 80 minutos y mantuvieron su comportamiento monomrico. Se propuso que el pequeo tamao de la microdominio permiti una fuerte interaccin con las partes tales que abarca la membrana de la molcula de protena que las fuerzas de cohesin impide la fusin de estos microdominios. Curiosamente, las molculas de clase II hicieron entremezclan con las molculas de clase I de la otra clula. MHC de clase I
probablemente fue acomodado en balsas ms grandes, que podran incorporar las pequeas balsas de molculas de clase II en su totalidad. Como para el montaje y mantenimiento de grupos de protenas, la maquinaria de reciclaje de internalizacin es un candidato importante fuerza'''': las protenas son reclutados a los sitios de formacin de endosomas, que da lugar a las asociaciones de protenas (107, 108). Bonos SOS entre las protenas integrales de membrana estaban implicados en el caso de los receptores activadores de clulas asesinas humanos expresados en la membrana plasmtica de las clulas asesinas naturales como complejos multimricos (109). Compartimentacin ligados covalentemente, cadenas de acilo saturados en dominios de fase lquido-ordenados es probable que sea un mecanismo importante para dirigir protenas a las balsas, mientras que las protenas preniladas tienden a ser excluidos de all (110). Por lo tanto, incluso sin las interacciones protenaprotena directos, acumulacin preferencial de ciertas protenas en un dominio de lpidos puede inducir homoor heteroassociation as como la formacin de grupos de protenas de tamao micromtrico (fig. 3). Por qu necesitamos un nuevo paradigma? Los datos recientes que no se ajustan al modelo de SN se pueden resumir de la siguiente manera: (i) patrones de codistribucin no aleatorias de receptores en la membrana plasmtica en los diferentes niveles jerrquicos; (ii) contactos moleculares quasipermanent a elementos del citoesqueleto y las molculas de transduccin de seales, (iii) mucho ms corto paso sin barrera de lo esperado para la difusin sin restricciones; (iv) la estructura del dominio de los componentes lpidos de las membranas tiene la capacidad para segregar o colocalize protenas de la membrana; (v) la participacin de las protenas integrales de membrana en el mantenimiento de los dominios de la membrana sugiere que las protenas son tan importantes como elementos estructurales como los lpidos, y (vi) reorganizacin dinmica de elementos proteicos en dominios de la membrana permite respuestas celulares simplificados y est restringido por la protenalpido e interacciones protena-protena. Por lo tanto, la aplicacin directa del modelo de SN como marco de los acontecimientos es imposible sin la introduccin de un nuevo concepto. Este nuevo
concepto tiene los siguientes atributos haciendo hincapi en la colocalizacin, comobility, y no aleatoria codistribucin de un nmero significativo de molculas de la superficie celular: (i) la movilidad de la superficie celular (transmembrana, lycosylphosphatidylinositolanchored, o cualquier otro tipo de) protenas est restringida por la segregacin lipiddomain y la longitud de la va de difusin libre de cubierta sin toparse con lmites; (ii) protenas de la membrana pueden colocalize uno con el otro en el 1 - a escala de 10 nm de una manera homloga o heterloga, haciendo que el mosaicismo del modelo SN prevalente; (iii) un segundo nivel jerrquico de la agrupacin de protenas que van a varios cientos de nanmetros se puede observar para muchas protenas de membrana, (iv) protenas o grupos de protenas con frecuencia se alojan por balsas de lpidos organizados por interacciones dbiles o fuertes ms arriba, dentro, o por debajo la membrana de la clula; (v) algunos tipos de receptores (por ejemplo, factor de necrosis tumoral y los receptores IL) estn en una formacin supramolecular premontado, incluso en ausencia de sus ligandos fisiolgicos y puede formar una formacin ms estrecha la unin del ligando; (vi) ligando-evocado agregaciones del receptor (por ejemplo, familia de receptores de factor de crecimiento epidrmico) son claramente diferentes de oligmeros preformados, sin embargo, pueden servir como igualmente importantes factores de amplificacin de la sealizacin transmembrana; (vii) los microdominios ms pequeas pueden ser considerados mdulos que se adaptan a las protenas de membrana ya sea solo o en oligmeros funcionales preensamblados a partir de subunidades, y estos pueden ser las unidades de construccin de dominios de sealizacin ms grandes (tales como los formados en la sinapsis inmunolgica); (viii) la _-helicoidal que abarca la membrana partes de protenas transmembrana se hacen coincidir en longitud y forma por el lado aliftico cadenas de lpidos que constituyen los dominios de la membrana que preferentemente se adaptan a ellos; (ix) la localizacin de las protenas en diferentes regiones de lpidos de la membrana plasmtica puede ser determinada genticamente debido a que la secuencia de aminocidos del dominio transmembrana y la secuencia que dependen de modificaciones covalentes definir la posible, interacciones especficas lpido-
protena, (x) las protenas pueden tener un papel igualmente importante en la determinacin de los componentes, estructura y dinmica de los dominios de la membrana, (xi), mientras que las bicapas lipdicas artificiales tienden a formar espontneamente estructuras segregadas, la dinmica y la especificidad en la membrana de clula viva se proporcionan por la protena-protena y protena-lpido interacciones especficas, as como la naturaleza especfica y regulada sensibilidad de los procesos de transporte vesiculares, y (xii) la identificacin del origen y las caractersticas de microdominios y conjuntos de receptores en el mismo nos puede ayudar comprender el pasado reciente y el futuro de las clulas, su estado de activacin y reactividad. Tales seales pueden llevar a diagnstico, pronstico, o incluso valores teraputicos si estos patrones de receptores no aleatorias pueden estar vinculadas a las enfermedades que afectan a los diferentes estados y alterado material gentico de la clula. A la luz de los atributos anteriores, debemos entender que los detalles biolgicos son mucho ms complicados que el poder de resolucin de un modelo simple, que describe el comportamiento generalizado y uniforme de las molculas en la membrana. El modelo de SN es vlido, y la libre difusin puede ocurrir dentro de las fronteras de dominio, donde las interacciones moleculares no interfieran. Esto significa que el nfasis debe desplazarse de la fluidez al mosaicismo del modelo SN. El mosaicismo puede restringir la difusin libre a travs de una de las siguientes formas: (i) la estructura del dominio lipdico, (ii) interacciones citoslicas citoesqueleto u otro, o (iii) homo-y heteroassociations con otras protenas integrales. Estas interacciones tienen la capacidad de aumentar la vida til de un encuentro intermolecular, lo que aumenta las posibilidades de interacciones bi-o multilateral, que a veces simplemente se llaman receptor de diafona. Por lo tanto, la movilidad global de elementos moleculares de la membrana puede ser aceptada con las restricciones anteriores, por lo que la membrana una estructura fuertemente compartimentada, cuasi-bidimensional, que es ms de tipo mosaico de fluido. En este plano bidimensional, la difusin, las fuerzas intermoleculares, el siempre cambiante potencial de membrana, y las influencias extracelulares puede generar de forma dinmica y destruir estructuras supramoleculares. Proponemos que este nuevo modelo de la membrana celular se llama
el modelo de mosaico dinmico estructurado.
Figura 1. Las protenas experimentan diferentes tipos de restricciones para la difusin traslacional en la membrana plasmtica. La vista de la membrana se muestra desde abajo. A, protenas que muestran una acumulacin preferencial en microdominios lpidos pueden ser confinados a la zona de la microdominio si la energa de activacin de pasar el dominio de barrera es mayor que la energa cintica de la protena. La medida en que pasar una barrera dominio se prohbe, se determina por la preferencia de la protena para el medio ambiente de lpidos: si la protena interacta preferentemente con avidez y con los lpidos de la microdominio, puede ser reacios a dejar.B y C, El citoesqueleto es tambin importante en la restriccin de la libre, la difusin lateral de protenas de membrana. Las protenas cuyo dominio intracelular est siempre son incapaces de pasar a travs de una valla compuesta por afilament del citoesqueleto (B), mientras que las protenas con un dominio intracelular corta son libres de moverse a travs de dicha gua (C). D, asociaciones de protenas experimentan fuerza ms viscoso, por lo tanto, su velocidad de difusin traslacional es generalmente ms pequeo que el de las protenas monomricas. Figura 2. Dinmica de la relacin jerrquica de las protenas de membrana. Obtencin de imgenes de racimos nanmetros y en protenas de tamao micromtrico dar una visin general de la asociacin jerrquica de protenas de membrana. Dos muestras de clulas previamente marcadas con diferentes anticuerpos fluorescentes (smbolos verde y rojo) se fusionaron. Las balsas de lpidos (crculos azules) son conocidas por acumular un conjunto especfico de protenas. Grupos de protenas de tamao micromtrico intercambiaron los componentes uno con el otro, pero este proceso respetados lpidos barreras microdominio: protenas que se sabe que en diferentes microdominios de membrana nunca entremezclados unos con otros. Despus de un perodo de latencia de _20 min, entremezclando de nanometersized grupos de protenas tambin se llevaron a cabo. Sin embargo, este proceso no fue tan generalizado como el mestizaje de las
agrupaciones de tamao micromtrico, porque algunas protenas (por ejemplo, MHCclass II) no mostraron una significativa capacidad de pasar de un clster de nanmetros de tamao a otro.
Figura 3. Asociacin de las protenas puede ser inducida por la acumulacin selectiva de las protenas en microdominios lipdicos distintas (una) o por interacciones protena-protena especficas (b). (un) La membrana contiene microdominios lipdicos con composiciones lipdicas distintas. Estas reas de membrana albergan diferentes conjuntos de protenas. Molculas de lpidos verdes acumulan preferentemente protenas cuya transmembrana del dominio se muestra en las protenas negro y tambin que se adjuntan a la valva extracelular de la membrana (protenas ancladas a glicosilfosfatidilinositol). El mecanismo para la acumulacin selectiva de las protenas en un entorno de lpidos dado puede ser explicado por una preferencia de protenas para el producto qumico (hidrofobicidad) o propiedades fsicas (grosor de la membrana, microviscosidad) de la microdominios lpidos. Asociaciones de protenas de tamao nanomtrico se pueden considerar una interaccin mediada por lpidos en este caso. ( b ) las interacciones protena-protena especficas mediadas por protenas de transmembrana o ligandos de unin a ellos tambin pueden ser responsables de la generacin de las asociaciones de protenas.
Anda mungkin juga menyukai
- Medicina III - InfluenzaDokumen21 halamanMedicina III - InfluenzaUSMP FN ARCHIVOSBelum ada peringkat
- ArnDokumen58 halamanArnUSMP FN ARCHIVOSBelum ada peringkat
- Manual de Medicina Respiratoria. Parte 1Dokumen445 halamanManual de Medicina Respiratoria. Parte 1USMP FN ARCHIVOS100% (1)
- Medicina III - Neumonía AtípicaDokumen21 halamanMedicina III - Neumonía AtípicaUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - DermatomiositisDokumen25 halamanMedicina III - DermatomiositisUSMP FN ARCHIVOSBelum ada peringkat
- Banco PediatríaDokumen25 halamanBanco PediatríaUSMP FN ARCHIVOS100% (5)
- Banco CardiologíaDokumen16 halamanBanco CardiologíaUSMP FN ARCHIVOS100% (2)
- Medicina III - InfluenzaDokumen21 halamanMedicina III - InfluenzaUSMP FN ARCHIVOSBelum ada peringkat
- Banco Ee2v19 InfectologiaDokumen15 halamanBanco Ee2v19 InfectologiaEmilia Yañez PodoroskaBelum ada peringkat
- Banco QX GeneralDokumen30 halamanBanco QX GeneralUSMP FN ARCHIVOS100% (4)
- DermatologíaDokumen7 halamanDermatologíaKevin Mendoza MezaBelum ada peringkat
- Terapéutica - Dengue y MalariaDokumen70 halamanTerapéutica - Dengue y MalariaUSMP FN ARCHIVOS100% (1)
- Banco NeonatologíaDokumen14 halamanBanco NeonatologíaUSMP FN ARCHIVOS100% (1)
- Banco Ee2v19 ObstetriciaDokumen31 halamanBanco Ee2v19 ObstetriciaEmilia Yañez PodoroskaBelum ada peringkat
- Banco QX PlasticaDokumen3 halamanBanco QX PlasticaUSMP FN ARCHIVOS100% (1)
- Banco GinecologíaDokumen28 halamanBanco GinecologíaUSMP FN ARCHIVOSBelum ada peringkat
- Tesis I - Población, Muestra y MuestreoDokumen56 halamanTesis I - Población, Muestra y MuestreoUSMP FN ARCHIVOS100% (1)
- Asfixia NeonatalDokumen20 halamanAsfixia NeonatalUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - PsoriasisDokumen74 halamanMedicina III - PsoriasisUSMP FN ARCHIVOS100% (3)
- Medicina III - PiodermiasDokumen47 halamanMedicina III - PiodermiasUSMP FN ARCHIVOS0% (1)
- Medicina III - AcneDokumen70 halamanMedicina III - AcneUSMP FN ARCHIVOSBelum ada peringkat
- Tesis I - Técnicas de Recolección e InstrumentosDokumen57 halamanTesis I - Técnicas de Recolección e InstrumentosUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - RosaceaDokumen18 halamanMedicina III - RosaceaUSMP FN ARCHIVOSBelum ada peringkat
- Terapéutica - EDA e ITUDokumen39 halamanTerapéutica - EDA e ITUUSMP FN ARCHIVOS100% (1)
- Medicina III - Micosis SuperficialDokumen71 halamanMedicina III - Micosis SuperficialUSMP FN ARCHIVOS100% (1)
- Medicina III - Miastenia Gravis y OtrosDokumen58 halamanMedicina III - Miastenia Gravis y OtrosUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - Dermatosis ApollaresDokumen93 halamanMedicina III - Dermatosis ApollaresUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - FotodermatosisDokumen51 halamanMedicina III - FotodermatosisUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - Anatomía y Fsiología de La PielDokumen106 halamanMedicina III - Anatomía y Fsiología de La PielUSMP FN ARCHIVOSBelum ada peringkat
- Medicina III - Urticaria y AngioedemaDokumen38 halamanMedicina III - Urticaria y AngioedemaUSMP FN ARCHIVOS100% (1)
- Casos Clínicos SI 202310Dokumen46 halamanCasos Clínicos SI 202310Avery DreamsBelum ada peringkat
- Capítulo 4 - CMH PDFDokumen8 halamanCapítulo 4 - CMH PDFJorgeBelum ada peringkat
- Resumen Biologia Celular MedicinaDokumen100 halamanResumen Biologia Celular MedicinaSebastián AgudeloBelum ada peringkat
- Linfocito B: origen, maduración y funcionesDokumen4 halamanLinfocito B: origen, maduración y funcionesDavid AlvaradoBelum ada peringkat
- Unidad 5 Fase de Reconocimiento, Activación y EfectoraDokumen29 halamanUnidad 5 Fase de Reconocimiento, Activación y EfectoralitorBelum ada peringkat
- 2° ParcialDokumen420 halaman2° ParcialMaria Fernanda Padron RiosBelum ada peringkat
- CyD UP5Dokumen7 halamanCyD UP5Anna CarolinaBelum ada peringkat
- 7 - Inmunidad Adaptativa IDokumen61 halaman7 - Inmunidad Adaptativa Imarcelo alvarezBelum ada peringkat
- Inmunidad CelularDokumen16 halamanInmunidad Celular̿T̿e̿o̿ M̿o̿n̿t̿a̿n̿o̿ ̿G̿a̿m̿e̿z̿Belum ada peringkat
- Balsas Lipídicas en La Activación de LinfocitosDokumen5 halamanBalsas Lipídicas en La Activación de LinfocitosKarlaMayedaBelum ada peringkat
- Tema 4Dokumen14 halamanTema 4José AndrésBelum ada peringkat
- Kuby Inmunología. Estructura de Los AnticuerposDokumen11 halamanKuby Inmunología. Estructura de Los AnticuerposClaudio Pérez FernándezBelum ada peringkat
- PREGUNTAS INMUNOLOGÍADokumen18 halamanPREGUNTAS INMUNOLOGÍAPablo Paricahua50% (2)
- Generación de Diversidad de Linfocitos B y TDokumen23 halamanGeneración de Diversidad de Linfocitos B y TMariano Félix DemasiBelum ada peringkat
- El complejo receptor TCR-CD3 y su papel en el reconocimiento antigénicoDokumen31 halamanEl complejo receptor TCR-CD3 y su papel en el reconocimiento antigénicoRosa PeñaBelum ada peringkat
- Hoja de PresentacionDokumen21 halamanHoja de Presentacionjabes cotesBelum ada peringkat
- 4 Receptores de Membrana para El AntígenoDokumen11 halaman4 Receptores de Membrana para El AntígenoNayelli Farías.Belum ada peringkat
- Mod 1Dokumen177 halamanMod 1Cristians VivasBelum ada peringkat
- 2015 Novak Et Al Guía de Preguntas para El Estudio Del Sistema InmuneDokumen11 halaman2015 Novak Et Al Guía de Preguntas para El Estudio Del Sistema InmuneRossy Rocha RidruguezBelum ada peringkat
- Manual InmunologíaDokumen44 halamanManual InmunologíaSara Chavez100% (1)
- Inmunidad AdaptativaDokumen84 halamanInmunidad AdaptativaAngelika Maya0% (1)
- Mono InmunodeficenciasDokumen43 halamanMono InmunodeficenciasNadia Alexandra AgurtoBelum ada peringkat
- 02 Sistema LinfoideDokumen28 halaman02 Sistema LinfoideDulce AntiguaBelum ada peringkat
- Linfocitos TDokumen22 halamanLinfocitos TSamBelum ada peringkat
- Anticuerpos, receptores de antígenos y estructura de las inmunoglobulinasDokumen9 halamanAnticuerpos, receptores de antígenos y estructura de las inmunoglobulinasTannia CoronelBelum ada peringkat
- Sistema InmunologicoDokumen8 halamanSistema Inmunologiconelson samuel quispe itusacaBelum ada peringkat
- Receptores de los linfocitos B y TDokumen11 halamanReceptores de los linfocitos B y TPaola PintoBelum ada peringkat
- Cap 8 InmunologíaDokumen25 halamanCap 8 InmunologíaAlex IzaBelum ada peringkat
- Inmuno PresentacionesDokumen893 halamanInmuno PresentacionesEduardo RodríguezBelum ada peringkat
- TCR 1Dokumen14 halamanTCR 1Kevin alberto Pérez de la cruzBelum ada peringkat