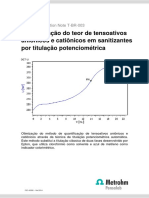
Relatorio Experimental - Tampão
Diunggah oleh
Sandra FagundesJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Relatorio Experimental - Tampão
Diunggah oleh
Sandra FagundesHak Cipta:
Format Tersedia
INSTITUTO FEDERAL DO ESPIRITO SANTO CURSO SUPERIOR DE LICENCIATURA EM QUMICA
MARCIANA BIANCA ROSA DIVINO SANDRA FAGUNDES FARIA SHIRLENE MAASS
SOLUO TAMPO
ARACRUZ 2013
MARCIANA BIANCA ROSA DIVINO SANDRA FAGUNDES FARIA SHIRLENE MAASS
SOLUO TAMPO
Trabalho apresentado disciplina de Qumica Geral Experimenta II do curso de Licenciatura em Qumica do Instituto Federal do Esprito Santo, como requisito parcial de avaliao.
Professor: Frederico S. Fortunato
ARACRUZ 2013
1. INTRODUO O conceito original de ao tamponante surgiu de estudos bioqumicos e da necessidade do controle do pH em diversos aspectos da pesquisa biolgica, como por exemplo em estudos com enzimas que tm sua atividade cataltica muito sensvel a variaes de pH. Neste contexto, em 1900, Fernbach e Hubert, em seus estudos com a enzima amilase, descobriram que uma soluo de cido fosfrico parcialmente neutralizado agia como uma proteo contra mudanas abruptas na acidez e alcalinidade. Esta resistncia mudana na concentrao
hidrogeninica livre de uma soluo foi ento descrita por estes pesquisadores como ao tamponante. Seguindo esta constatao, em 1904, Fels mostrou que o uso de misturas de cidos fracos com seus sais (ou de bases fracas com seus sais) permitia a obteno de solues cuja acidez (ou basicidade) no era alterada pela presena de traos de impurezas cidas ou bsicas na gua ou nos sais utilizados na sua preparao, em decorrncia de dificuldades experimentais tais como a ausncia de reagentes e de gua com elevado grau de pureza. Uma das definies mais atuais para soluo tampo foi apresentada por Harris em 1999. Segundo este: Uma soluo tamponada resiste a mudanas de pH quando cidos ou bases so adicionados ou quando uma diluio ocorre. Existem outros tipos de soluo tampo, mas geralmente estas so constitudas de uma mistura de um acido fraco e sua base conjugada, ou da mistura de uma base fraca e seu acido conjugado. 2.OBEJETIVO - Identificar o pH de diferentes solues. - Observar se a diluio causa grande mudana de pH em solues tampo.
3. EXPERIMENTAL 3.1 MATERIAIS UTILIZADOS
Basto de vidro
Bquer Filtro e papel Filtro Garra H2O destilada HCl NaOH pHmetro Pipeta de pauster Pisseta Proveta Suporte universal
3.2 PROCEDIMENTO - Preparar 1 litro de uma soluo de cido actico 0,5 M e 1 litro de NaOH 0,5 M; - Misturar 100 mL da soluo de cido actico com 100 mL da soluo de NaOH; - Medir o pH da soluo tampo (A) formada com o auxilio do pHmetro; - Preparar 1 litro de soluo de HCl 0,1 M a partir do cido concentrado. - Definir o volume de cido concentrado que deve ser utilizado para preparar 1L da soluo 0,1M; - Retirar 25 mL da soluo A e adicione 225 mL de gua destilada, chamar esta de soluo B; - Definir quantas vezes a soluo A foi diluda at obter-se a soluo B; - Definir o pH da soluo B;
- Retirar 2,5 mL da Soluo A e adicionar 247,5 mL de gua destilada, chamar esta de soluo C; - Definir quantas vezes a soluo A foi diluda ate obter a soluo C e o pH desta nova soluo; 4. RESULTADOS E DISCUSSES Em uma proveta, mediu-se 100 mL de acido actico e transferiu-se para um bquer, o qual denominamos de soluo A, e mediu-se o pH (2,58), a esta soluo A adicionou-se 20 mL de NaOH e mediu-se novamente o pH (4,03). Desta soluo A retirou-se uma alquota de 25 mL e transferiu-se para um bquer, o qual denominouse soluo B e adicionou-se a esta soluo 225 mL de gua destilada, mediu-se o seu pH (4,09). Novamente da soluo A retirou-se 25 mL e transferiu-se para um bquer, o qual chamou-se de soluo C. Nesta soluo adicionou-se 247,5 mL de gua destilada e mediu-se o pH (4,20).
Mediu-se com o auxilio de uma proveta, 100 mL de HCl 0,1M e adicionou-se a um bquer e mediu-se o pH(0,82), neste mesmo bquer adicionou-se 100 mL de gua destilada e mediu-se o pH novamente (1,08).
Do bquer que continha a soluo A, retirou-se uma alquota de 100 mL e adicionouse 2 mL de HCl e com o auxilio de um basto de vidro, agitou-se e mediu-se novamente o pH (4,02). Da soluo B, retirou-se 100 mL e transferiu-se para outro bquer e adicionou-se 1mL de HCl e mediu-se o pH (4,03). A soluo C, realizou-se o mesmo processo anterior que havia sido feito com B e observou-se o pH(3,13). Anotaes gerais:
Notou-se que o volume de cido concentrado necessrio para prepara-se 1 litro de soluo 0,1M 8,23 mL, esse valor foi obtido atravs do calculo a seguir: 0,1mol ___ 1L 1mol _____36,5g 0,1 _______x 37,25g _____100g Sl 3,65g ________x
x = 3,65g
x=9,79g
D = m/v 1,19= 9,79/V V= 8,23mL A soluo A foi diluda 9 vezes ate se obter a soluo B, e outra mostra de soluo A foi diluda 99 vezes para virar a soluo C. 5. CONCLUSES Normalmente solues tampo no sofrem grandes variaes, como conseguimos observar por meio dos experimentos, que a variao entre um experimento e outro foi pequena, mesmo que no experimento A teve uma variao maior em relao os outros, no pode ser considerado como um alto desvio. Pudemos observar a importncia das solues tampo no sistema qumico, que mantm o ph constante e uma pequena variao, praticamente insignificante, quando adicionamos nas solues cidas ou bases.
Na capacidade temponante observamos que a eficincia de uma soluo tampo restrita a uma faixa de ph na qual a concentrao de acido ou base conjugado deve se suficiente para compensar a adio. Conclumos por meio da tabela que quanto mais adicionarmos o acido diminuindo assim a quantidade de base a soluo tente a chegar no seu ph inicial, ou seja, diminuir seu ph.
6. EXERCCIOS PROPOSTOS 1) Qual o pH do tampo formado pela mistura de 200 ml de cido frmico 0,4 M e 300 mL de formiato de sdio 1M? (Ka = 1,8.104) Ka = 1,8.104 pKa = - log Ka 3,74
pKa = - log 1,8.10-4 pKa = pH = pKa + log { [FDP] / [FP] } Conc. c. Frmico: M1V1 = 0,4x200 =M2 x 500M2 = 0,16mol/L Conc. Formiato de Sdio: M1V1 = M2V2 1x300 = M2 x 500 M2 = 0,6mol/L pH = pKa + log { [FDP] / [FP] } pH = 3,74 + log { 0,6 / 0,16 } pH = 4,31
M2V2
2) Qual o pH do tampo quando 200 ml de NaOH 0,1M so adicionado a 800 mL de cido actico 0,1 M? (Ka = 1,8.10-5) Dados: 200 ml de NaOH 0,1M; 800 mL de CH3COOH 0,1 M;
CH3COOH + NaOH CH3COO- Na+ + H2O
n de mols : n = C.V.10-3 n de mols de cido Actico: n= 0,1 x 800 x 10-3 n = 0,08 mol n de mols de NaOH: n = 0,1 x 200 x 10-3 n= 0,02 mol * n de mols de cido actico no sistema aps a adio de NaOH n = 0,08 0,02 n= 0,06 mol de cido Actico * como o volume final 1000mL temos: 0,06M de Ac. Actico e 0,02M de Acetato de Na+ pH = pKa + log { [FDP] / [FP] } pH = 4,74 + log {0,02 / 0,06} pH = 4,26
3) Qual o efeito da diluio sobre a soluo tampo? A diluio da soluo tampo praticamente no altera o pH.
4) Qual o pH de uma soluo tampo quando se adiciona 20,0 mL de KOH 0,05 mol/L a 50 mL de cido benzico, HC7H5O2, 0,025 mol/L (Ka = 6,5.10-5)?
5) Quantos gramas de formato de sdio (HCOO1-Na1+) devemos adicionar a 250 mL de uma soluo 0,01 mol.L-1 de cido frmico (HCOOH) para obtermos 500 mL de um tampo de pH 4,80? Dados: Pka = 3,77 / HCOO-Na+= 68 g/mol
6) Qual a concentrao mol/L de fosfatomonobsico de sdio (NaH2PO4) que devemos encontrar em 100mL de um tampo que apresenta 0,01 mol/L de fosfatodibsico de sdio (Na2HPO4) e pH igual a 7,51 ? Dados: pK1 = 2,1; pK2 = 7,21 e pK3 = 12,67
7) A 210 mL de uma soluo de TRIS 0,3 M foram adicionados um determinado volume de uma soluo de HNO3 1 M at alcanar um pH de 7,50. Sabendo que foram preparados 250 mL da soluo 1 M de HNO3 a partir do cido ntrico concentrado 69,5% p/p e 1,424 g/mL, responda: a) qual o volume do cido ntrico concentrado , que devemos utilizar para preparar 250 mL de uma soluo 1 M de HNO3 ?
b) qual o volume da soluo de HNO3 1 M que devemos adicionar a soluo de TRIS para alcanar um pH de 7,50. DADOS: (HO-CH2-)3C-NH2 TRIS / pKa = 8,1 / HNO3 (63 g/mol)
7. REFERNCIAS BIBLIOGRAFICAS: QUIMICA NOVA INTERATIVA. O conceito de soluo tampo. Disponvel em: <http://qnint.sbq.org.br/qni/visualizarConceito.php?idConceito=27> Acesso em 16/12/2012.
Anda mungkin juga menyukai
- Pratica 2Dokumen4 halamanPratica 2Sandra FagundesBelum ada peringkat
- Relatorio Experimental - Equilibrio QuimicoDokumen7 halamanRelatorio Experimental - Equilibrio QuimicoSandra FagundesBelum ada peringkat
- Como preparar teseDokumen16 halamanComo preparar teseSandra FagundesBelum ada peringkat
- Resenha SandraDokumen2 halamanResenha SandraSandra FagundesBelum ada peringkat
- Como preparar teseDokumen16 halamanComo preparar teseSandra FagundesBelum ada peringkat
- Resenha EducacionismoDokumen4 halamanResenha EducacionismoSandra FagundesBelum ada peringkat
- Resenha Educação Como Exercicio de PoderDokumen4 halamanResenha Educação Como Exercicio de PoderSandra Fagundes100% (1)
- Organic Compound Identification Handbook TablesDokumen5 halamanOrganic Compound Identification Handbook TablesJosé SendimBelum ada peringkat
- Equilíbrio químico e deslocamento do estado de equilíbrioDokumen6 halamanEquilíbrio químico e deslocamento do estado de equilíbrioKauã RenatoBelum ada peringkat
- Análise química do óleo essencial de Ylang YlangDokumen1 halamanAnálise química do óleo essencial de Ylang YlangAndreia OliveiraBelum ada peringkat
- Composição Quantitativa de Uma SoluçãoDokumen3 halamanComposição Quantitativa de Uma SoluçãoAnabelaLeitão75% (4)
- Óleo Essencial de Bay Rum - Análise QuímicaDokumen1 halamanÓleo Essencial de Bay Rum - Análise QuímicaMargarete da Conceição SantosBelum ada peringkat
- Leite de MagnsiaDokumen2 halamanLeite de MagnsiaChronus AutomaçãoBelum ada peringkat
- Relatorio Analitica.Dokumen15 halamanRelatorio Analitica.Marcella Purificacao Di GirolamoBelum ada peringkat
- Kps e solubilidade de saisDokumen10 halamanKps e solubilidade de saisRodrigo Gabriel BastosBelum ada peringkat
- Relatorio de Quimica AnaliticaDokumen43 halamanRelatorio de Quimica Analiticawilianinacio84100% (1)
- Saponificação Do Acetato de EtilaDokumen13 halamanSaponificação Do Acetato de EtilaCristiane ColodelBelum ada peringkat
- Lista de Exercícios Química AnalíticaDokumen2 halamanLista de Exercícios Química AnalíticaJean FranciscoBelum ada peringkat
- CurtipotDokumen190 halamanCurtipotDiogo SantanaBelum ada peringkat
- Determinação de tensoativos por titulação potenciométricaDokumen3 halamanDeterminação de tensoativos por titulação potenciométricaGabriella Evelyn LopesBelum ada peringkat
- POP 71 - Validação de Métodos AnalíticosDokumen6 halamanPOP 71 - Validação de Métodos AnalíticosClean Face100% (2)
- Determinação do pH de substânciasDokumen12 halamanDeterminação do pH de substânciasGeise Mezzari100% (1)
- RELATORIO 23.05 - Retrotitulação Leite MagnesioDokumen5 halamanRELATORIO 23.05 - Retrotitulação Leite MagnesioRosi elane nunesBelum ada peringkat
- Relatorio 4Dokumen7 halamanRelatorio 4AnnabellyBelum ada peringkat
- Ácidos e BasesDokumen8 halamanÁcidos e BasesAna Paula PereiraBelum ada peringkat
- Equilibrio Ácido-BaseDokumen9 halamanEquilibrio Ácido-BaseGraciete QuentalBelum ada peringkat
- Relatorio Volhard e MohrDokumen12 halamanRelatorio Volhard e MohrAndre FernandesBelum ada peringkat
- Lista de Exercícios 1AVA PDFDokumen2 halamanLista de Exercícios 1AVA PDFJonatha SantosBelum ada peringkat
- QA Introdução Analise Instrumental PDFDokumen9 halamanQA Introdução Analise Instrumental PDFCypriano NetoBelum ada peringkat
- Estudo Células Galvânicas e Soluções TampãoDokumen16 halamanEstudo Células Galvânicas e Soluções TampãoAna Marta MartinhoBelum ada peringkat
- Determinação Da Constante de Ionização Do Ácido Benzóico em Água e em Água-Etanol Usando Medições de PH (Versão Final) PDFDokumen16 halamanDeterminação Da Constante de Ionização Do Ácido Benzóico em Água e em Água-Etanol Usando Medições de PH (Versão Final) PDFFCiências100% (1)
- Relatório de Determinação Do PH de Diferentes Soluções e o Processo de Titulação Do Ácido Acético em Vinagre.Dokumen11 halamanRelatório de Determinação Do PH de Diferentes Soluções e o Processo de Titulação Do Ácido Acético em Vinagre.Zeca Vieira AlencarBelum ada peringkat
- Introdução à Química AnalíticaDokumen21 halamanIntrodução à Química AnalíticamarkonniiBelum ada peringkat
- Discussão e Resultados de Experimentos TBQ LaboratorioDokumen20 halamanDiscussão e Resultados de Experimentos TBQ LaboratorioWilliam PachecoBelum ada peringkat
- Relatorio de Analise - Potenciometria e CondutimetriaDokumen4 halamanRelatorio de Analise - Potenciometria e Condutimetriaerica pereiraBelum ada peringkat
- Análise gravimétrica em química analíticaDokumen7 halamanAnálise gravimétrica em química analíticaEdma NhantumboBelum ada peringkat
- Curso Unipré 110 - Exercícios de equilíbrio químico e pHDokumen2 halamanCurso Unipré 110 - Exercícios de equilíbrio químico e pHLeonardo JacquesBelum ada peringkat