Síntesis y Caracterización de Cloruro de Hexaminoníquel
Diunggah oleh
Jose Julián LópezDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Síntesis y Caracterización de Cloruro de Hexaminoníquel
Diunggah oleh
Jose Julián LópezHak Cipta:
Format Tersedia
SNTESIS Y CARACTERIZACIN DE CLORURO DE HEXAMINONQUEL (II)
Jenifer Nieto Vasquez Laura Maria Arroyave Murillo Jose Julian Lpez Osorio
RESUMEN Al agregarle NH4OH al [Ni(H2O)6]Cl2 y filtrar se produce un precipitado color azul correspondiente al [Ni(NH3)6]Cl2. Este complejo se caracteriza con Ni2+ produciendo un precipitado color rosa enemdio bsico y en emdio acido incoloro, cuando se caracteriza con Cl- se forma un precipitado blanco al agregarle AgNO3 y al caracterizarlo con NH3 se formo NH3OH basificando el medio. PALABRAS CLAVES Compuesto de coordinacin, Anlisis espectroscpico, infrarrojo, ultravioletavisible, tablas de Tanabe-Sugano, energa de desdoblamiento de campo cristalino. INTRODUCCIN Nquel es un metal dctil y resistente a la corrosin. Se encuentra en la naturaleza combinado con arsnico, antimonio o azufre. Presenta conductividades elctricas y trmicas muy elevadas. En solucin acuosa el estado de oxidacin +2 es el ms importante, siendo poco comunes las reacciones de oxidacin de +2 a +3. El ion nquel en solucin acuosa se encuentra coordinado a molculas de agua en una geometra octadrica, formando el ion complejo [Ni(H2O)6]2+, de color verde. En muchos casos, la formacin de otros complejos ocurre a travs de reacciones de sustitucin de las molculas de agua por otros ligantes (molculas neutras como NH3; 1,2etilenodiamino, etc.) [1] Los complejos de nquel (II) presentan formas octadricas, tetradricas y cuadrados, similar al Cu (II). Se da precisamente porque es 3d8, disponiendo esos 8 electrones en dos niveles (t2g)6 (eg)2
que debido a las distorsiones se desdoblan. Forma complejos paramagnticos, con dos electrones desapareados, por ello sus momentos magnticos oscilan entre los 2,9 y 3,4. El color depende de , valor que depende de la distorsin que a su vez no slo se ve afectada por la interaccin elctrica que provocan los ligandos con sus pares electrnicos, siguiendo la serie espectroqumica de Tschusida, sino tambin por efectos estricos al acomodar dichos ligandos en el tetraedro distorsionado. En este caso al aumentar el desdoble energtico, se produce un ligero corrimiento hacia al azul, caracterstico de los hexaaminoniquel(II). [2]. MATERIALES Y REACTIVOS Materiales: Beaker 50 mL Beaker 100 mL Equipo de filtracin al vacio Gotero Papel filtro Cpsula de porcelana Probeta 10 y 50 mL Vidrio de reloj Tubos de ensayo Esptula Frasco lavador Balanza analtica. Varilla de agitacin Estufa
Reactivos: Cloruro de hexacuonquel (II) Cloruro de amonio Solucin alcohlica de dimetilglioxima NH4OH ter Nitrato de plata 0,1M cido ntrico 3 M Papel tornasol Alcohol etlico METODOLOGIA
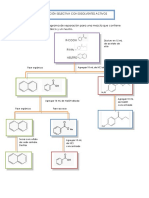
CARACTERIZACION
DISCUSIN En la caracterizacin de nquel, se hizo reaccionar el complejo de nquel con dimetilglioxima, la cual es un ligando bidentado y desplaza los ligandos amino, formando un complejo de color coral (rosarojo), pero esto slo se logra en medio bsico, por eso al adicionar cido ntrico se acidifica el medio y el complejo rosa desaparece hasta que se vuelve a basificar. En la caracterizacin de cloruro, al adicionar nitrato de plata inmediatamente se form un precipitado blanco espeso, pues pareca como una nube densa. Este precipitado es el cloruro de plata, caracterizado por su baja solubilidad y que confirma la presencia del ion cloruro en el complejo. La prueba del calentamiento del compuesto arroj un pH=12 en el papel tornasol, lo que indica que haba grupos amino que se liberaron como amoniaco y con el agua formaron hidrxido de amonio, encardado de poner el pH en su valor.
% RENDIMIENTO:
CONCLUSIONES En la sntesis del complejo se logr un rendimiento de CUESTIONARIO
1). Escribir todas las reacciones que se presentan en la prctica.
5). Cules son las cantidades necesarias de (Ni(H2O)6)Cl2 100% puro y de NH3 15M, para obtener exactamente 20g del compuesto? 20g [Ni(NH3)6]Cl2 x 237.6882g [Ni(H2O)6]Cl2 / 231.7836g
[Ni(H2O)6]Cl2 [Ni(NH3)6]Cl2 = 20.5094 g
20g [Ni(NH3)6]Cl2 x 102.18425g NH3 231.7836g [Ni(NH3)6]Cl2 x 1mol NH3 mL NH3 2). Citar otras reacciones que pueden ser usadas para caracterizar: a) Cloruros. b) Amoniaco. c) Nquel. No se encontraron muchas alternativas a las pruebas de caracterizacin llevadas a cabo durante la prctica. 3). Considerando que el [Ni(H2O)6]Cl2 utilizado para la prctica contiene 15% de impurezas, cual es la masa de (Ni(NH3)6)Cl2 que puede ser obtenida? 1.25g [Ni(H2O)6]Cl2 x 85g / 231.7836 [Ni(NH3)6]Cl2 /
[Ni(H2O)6]Cl2 = 1.036g [Ni(NH3)6]Cl2
/ / 17.0307g x 1L / 15 mol x 1000mL / 1L = 34.5149
6). La separacin de los cristales (Ni(NH3)6)Cl2 se realiza por filtracin al vaco. Cules son las ventajas con respecto a la filtracin comn? La filtracin al vaco reduce la humedad en el residuo despus de filtrarlo, es ms rpida que la filtracin a gravedad y ms prctica. 7). Despus de la separacin de los cristales de (Ni(NH3)6)Cl2, stos son lavados con etanol y finalmente con ter. Se puede reemplazar etanol o ter por agua? Estos solventes no se pueden reemplazar por agua, pues sus molculas pueden reaccionar con el compuesto y desplazar los ligandos del complejo formando uno diferente, en este caso se volvera al inicial. 8). Es posible determinar el punto de fusin del compuesto? No es posible, pues antes de fundirse, el compuesto se descompondr liberando los ligandos amino que lo acompaan y ser un compuesto diferente.
100g
237.668
4).Cul es el rendimiento prctico del proceso cuando se obtiene de 2 g del compuesto? Sera imposible lograr tal cantidad, pues a partir de 1,25 g de cloruro de hexacuonquel (II) no es posible obtener 2 g de cloruro de hexaminonquel (II); si as fuera el rendimiento sera mayor a 100% siendo esto completamente ilgico.
BIBLIOGRAFA [1] Prcticas de Laboratorios de Qumica Inorgnica I y II. FERNANDO CUEN CABEZAS. [2] Consultado online el dia 25 de agosto de 2013.http://www.heurema.com/QG/QG23/Co mplejosNi%28II%29-1.pdf
Bibliografa
[2]Consultado online el dia 25 de agosto de 2013 http://www.heurema.com/QG/QG23/ComplejosNi%28II%29-1.pdf
Anda mungkin juga menyukai
- Preparación y Análisis Del Complejo Cloruro de Pentaaminclorocobalto (III) TerminadoDokumen4 halamanPreparación y Análisis Del Complejo Cloruro de Pentaaminclorocobalto (III) TerminadoSamuel Fernando DelgadoBelum ada peringkat
- Sintesis Del Cloruro de Hexaaminniquel IiDokumen3 halamanSintesis Del Cloruro de Hexaaminniquel IiLuisana TintoBelum ada peringkat
- 4-Informe (Giraldo, Garzón, Silgado)Dokumen5 halaman4-Informe (Giraldo, Garzón, Silgado)Daniel Gerardo Silgado CortazarBelum ada peringkat
- Hibridacion de ComplejosDokumen10 halamanHibridacion de ComplejosSergio FloresBelum ada peringkat
- Evi 04 Analisis-Instrumental-2022Dokumen5 halamanEvi 04 Analisis-Instrumental-2022Ramos Robles Jennifer GuadalupeBelum ada peringkat
- Quiz #3-Virtual-SRDokumen2 halamanQuiz #3-Virtual-SRSantiago ValenciaBelum ada peringkat
- CobaltoDokumen7 halamanCobaltoLuz Marina Peña MorajxkfjjkkzkfBelum ada peringkat
- Práctica 2A Sintesis y Caracterización de Un Complejo de CobaltoDokumen6 halamanPráctica 2A Sintesis y Caracterización de Un Complejo de CobaltoJuanpa MosqueraBelum ada peringkat
- Cinetica de Reaccion Entre Un Ester Con El Ion HidroxiloDokumen3 halamanCinetica de Reaccion Entre Un Ester Con El Ion HidroxiloLeonardo Medina GermanottaBelum ada peringkat
- Determinación Gravimétrica y Complejométrica de Calcio en Una Cáscara de HuevoDokumen9 halamanDeterminación Gravimétrica y Complejométrica de Calcio en Una Cáscara de Huevobrayner arteagaBelum ada peringkat
- Resumen Del Complejo de NiquelDokumen3 halamanResumen Del Complejo de NiquelCamila MolanoBelum ada peringkat
- Quiz #4-Virtual-SRDokumen2 halamanQuiz #4-Virtual-SRSantiago ValenciaBelum ada peringkat
- Practica No - 7 Sintesis de BencildenacetofenonaDokumen2 halamanPractica No - 7 Sintesis de BencildenacetofenonaAmy GuillenBelum ada peringkat
- Reporte 3 - Extracción de Sudán IIIDokumen5 halamanReporte 3 - Extracción de Sudán IIIGatica17Belum ada peringkat
- Laboratorio No 8 Química Analítica IIIDokumen5 halamanLaboratorio No 8 Química Analítica IIIJairArmandoGomezPerezBelum ada peringkat
- Titulación Por Formación de ComplejosDokumen15 halamanTitulación Por Formación de ComplejosJorge RosalesBelum ada peringkat
- Practica CobaltoDokumen18 halamanPractica CobaltoNerea MariblancaBelum ada peringkat
- Ejercicios Resueltos #04Dokumen8 halamanEjercicios Resueltos #04RENATO JAIR COSTA MINGABelum ada peringkat
- Informe de Claisen-SchmidtDokumen6 halamanInforme de Claisen-SchmidtVerónicaLilibethBelum ada peringkat
- Informe Pka Rojo de MetiloDokumen6 halamanInforme Pka Rojo de MetiloCAMILA SALINASBelum ada peringkat
- Soluciones ReguladorasDokumen9 halamanSoluciones ReguladorasJhonatan Albert Alban Narvaez100% (1)
- Análisis de Las Características y Propiedades de Detergentes Jabonosos y No JabonososDokumen11 halamanAnálisis de Las Características y Propiedades de Detergentes Jabonosos y No JabonososJoan Sebastian Luna Martinez0% (1)
- Informe 1. Cinética de Oxidación de Etanol Con CromoDokumen4 halamanInforme 1. Cinética de Oxidación de Etanol Con CromoStevens Garcia NovoaBelum ada peringkat
- Sintesis y Analisis de Un Compuesto de Oxalato de Aluminio Final.Dokumen5 halamanSintesis y Analisis de Un Compuesto de Oxalato de Aluminio Final.jessica lozadaBelum ada peringkat
- Informe I Compuestos Coordinación 2018 1Dokumen8 halamanInforme I Compuestos Coordinación 2018 1DanielAngelPeñaBohorquezBelum ada peringkat
- Sintesis de Sulfato de Tris Tiourea Cobre (I)Dokumen6 halamanSintesis de Sulfato de Tris Tiourea Cobre (I)JavieraBelum ada peringkat
- Isomeros Geometricos Cis Trans Glicinato de CobreDokumen5 halamanIsomeros Geometricos Cis Trans Glicinato de Cobreجبرائيل جبرائيلBelum ada peringkat
- Laboratorio de Química Inorgánica Ii-Informe I Sal de MöhrDokumen23 halamanLaboratorio de Química Inorgánica Ii-Informe I Sal de MöhrAna CarolinaBelum ada peringkat
- Informe SINTESIS DE TRIOXALATO CROMATO (III) DE POTASIO TRIHIDRATADO Y TRIOXALATO FERRATO (III) DE POTASIO TRIHIDRATADODokumen7 halamanInforme SINTESIS DE TRIOXALATO CROMATO (III) DE POTASIO TRIHIDRATADO Y TRIOXALATO FERRATO (III) DE POTASIO TRIHIDRATADOAlejo Gómez CampoBelum ada peringkat
- Informe de Laboratorio 2 CorregidoDokumen7 halamanInforme de Laboratorio 2 CorregidoDome VásconezBelum ada peringkat
- TALLER No. 1 EJERCICIOS Soluciones, Titulaciones Directas y Por Retroceso PDFDokumen4 halamanTALLER No. 1 EJERCICIOS Soluciones, Titulaciones Directas y Por Retroceso PDFYulieth PedrazaBelum ada peringkat
- Practica 7 Cloruro de Hexaminniquel IIDokumen9 halamanPractica 7 Cloruro de Hexaminniquel IIJorge PilcoBelum ada peringkat
- Practica 3 QO.Dokumen14 halamanPractica 3 QO.mikke pereaBelum ada peringkat
- Informe SN2Dokumen3 halamanInforme SN2lorenaBelum ada peringkat
- Informe Benzocaína FQ 1Dokumen3 halamanInforme Benzocaína FQ 1Andres Osorio ZambranoBelum ada peringkat
- GJJ-Sintesis de OxalatosDokumen10 halamanGJJ-Sintesis de OxalatosGABRIELA ANDREA VELEZ CERONBelum ada peringkat
- Infrome Sal de MohrDokumen8 halamanInfrome Sal de MohrmariaBelum ada peringkat
- Informe Diels AlderDokumen3 halamanInforme Diels AlderPaula HerreraBelum ada peringkat
- Informe #9 Determinación Permanganimetrica.Dokumen5 halamanInforme #9 Determinación Permanganimetrica.richard dominguezBelum ada peringkat
- Sintesis de K3 (MN (OX) 3) .3H2ODokumen4 halamanSintesis de K3 (MN (OX) 3) .3H2OCARLOS EDUARDO ZORRO RIVERABelum ada peringkat
- Sustitución Electrofílica Aromática en La Síntesis de P-BromoacetanilidaDokumen7 halamanSustitución Electrofílica Aromática en La Síntesis de P-BromoacetanilidaVALERIA ALEJANDRA VILLEGAS ALVAREZBelum ada peringkat
- Practica 8 Organica 1 Parte 2Dokumen8 halamanPractica 8 Organica 1 Parte 2RichardBelum ada peringkat
- Valoraciones Con Dos Indicadores: Determinación de Carbonatos y FosfatosDokumen3 halamanValoraciones Con Dos Indicadores: Determinación de Carbonatos y FosfatosCARLOS MARIO RAMOS CALDERONBelum ada peringkat
- Practica #3Dokumen6 halamanPractica #3zaira aguirreBelum ada peringkat
- Informe 4 Fotorreduccion de BenzofenonaDokumen9 halamanInforme 4 Fotorreduccion de BenzofenonaJuan Diego TrujilloBelum ada peringkat
- TAREADokumen10 halamanTAREAKevin Anthony Oré MaldonadoBelum ada peringkat
- Manual de Quimica Oranica 2Dokumen56 halamanManual de Quimica Oranica 2tsukinogaara100% (11)
- Preguta de CarbohidratoDokumen3 halamanPreguta de Carbohidratojhon fernando100% (1)
- Sintesis HBRDokumen5 halamanSintesis HBRKaren Inostroza VásquezBelum ada peringkat
- Sintesis Del Complejo Bis Glicinato de Cobre (II) OriginalDokumen4 halamanSintesis Del Complejo Bis Glicinato de Cobre (II) OriginalPaholo Renato Quispe CondoriBelum ada peringkat
- Determinación de Cloruros Por El Método de FajansDokumen5 halamanDeterminación de Cloruros Por El Método de FajansMontserrat CansinoBelum ada peringkat
- Formación y Acoplamiento de Sales de DiazonioDokumen6 halamanFormación y Acoplamiento de Sales de Diazonioalmuchis12Belum ada peringkat
- Analisis de Niquel en Muestra de Acero Por Espectrofotometria Uv-VisibleDokumen6 halamanAnalisis de Niquel en Muestra de Acero Por Espectrofotometria Uv-VisibleJulio BlancoBelum ada peringkat
- Química de Los Complejos de CobaltoDokumen4 halamanQuímica de Los Complejos de CobaltoNestor OrozcoBelum ada peringkat
- Practica N°1 Quimica AnaliticaDokumen6 halamanPractica N°1 Quimica AnaliticaFranco Garcia ValeraBelum ada peringkat
- Informe 2 InorganicaDokumen12 halamanInforme 2 InorganicaLuis FerBelum ada peringkat
- Informe de Química 1 - Estequiometría - Reacciones QuímicasDokumen13 halamanInforme de Química 1 - Estequiometría - Reacciones QuímicasErnestoNuñez100% (1)
- Preparación de Cloruro de HexaminocobaltoDokumen7 halamanPreparación de Cloruro de HexaminocobaltoDome VásconezBelum ada peringkat
- Reacciones QuímicasDokumen7 halamanReacciones QuímicasDianeth Sara Lima BejarBelum ada peringkat
- Informe 2 Inorganica Isomeria de EnlaceDokumen8 halamanInforme 2 Inorganica Isomeria de EnlaceRodrigoMoranCoral100% (1)
- Adulterantes y Conservantes de La LecheDokumen5 halamanAdulterantes y Conservantes de La LecheJose Julián LópezBelum ada peringkat
- Extracción de PiperinaDokumen7 halamanExtracción de PiperinaJose Julián LópezBelum ada peringkat
- Ciclo Del Cobre TerminadoDokumen7 halamanCiclo Del Cobre TerminadoJose Julián LópezBelum ada peringkat
- Guia Como Trabjar IssuuDokumen41 halamanGuia Como Trabjar IssuuJose Julián LópezBelum ada peringkat
- Coquizacion Del Carbon 1Dokumen4 halamanCoquizacion Del Carbon 1Jose Julián LópezBelum ada peringkat
- Simetria MolecularDokumen24 halamanSimetria MolecularJose Julián López100% (1)
- PtomainasDokumen7 halamanPtomainasKaren Patricia Polo LozanoBelum ada peringkat
- Lab 5. Os..Dokumen7 halamanLab 5. Os..Jose Julián LópezBelum ada peringkat
- Simetria MolecularDokumen24 halamanSimetria MolecularJose Julián López100% (1)
- Reporte de Practica 1 CA y CD MalacaraDokumen2 halamanReporte de Practica 1 CA y CD MalacaraAlan DoradoBelum ada peringkat
- Familias Logicas de Circuitos Integrados TTL y CmosDokumen4 halamanFamilias Logicas de Circuitos Integrados TTL y CmosJuan Karlos PastranaBelum ada peringkat
- MÓDULO III - Soporte Global - ResumidoDokumen9 halamanMÓDULO III - Soporte Global - ResumidoOmar ValenzuelaBelum ada peringkat
- Teorema de DeMorganDokumen13 halamanTeorema de DeMorganjuan cejaBelum ada peringkat
- Acumulativa de Informatica y Tecnologia 3 PeriodoDokumen1 halamanAcumulativa de Informatica y Tecnologia 3 PeriodomileBelum ada peringkat
- Plan de Auditoria en Tecnologias de La InformacionDokumen6 halamanPlan de Auditoria en Tecnologias de La InformacionAxel Sunem Mora OlveraBelum ada peringkat
- 23 CYPELEC REBT - Manual Del UsuarioDokumen44 halaman23 CYPELEC REBT - Manual Del UsuarioDiego FusterBelum ada peringkat
- 01 Guía para Proyectos de Energia Solar Fotovoltaica PDFDokumen21 halaman01 Guía para Proyectos de Energia Solar Fotovoltaica PDFJorge VillegasBelum ada peringkat
- Temporizador Con Retardo A La Desconexión Con 555Dokumen3 halamanTemporizador Con Retardo A La Desconexión Con 555Feder BazGodBelum ada peringkat
- Cuadro Sinoptico RedesDokumen2 halamanCuadro Sinoptico Redesedwin67% (6)
- Demodulacion FMDokumen5 halamanDemodulacion FMCristian Arce RomeroBelum ada peringkat
- Guia Laboratorio 1 - Niveles LogicosDokumen8 halamanGuia Laboratorio 1 - Niveles LogicosChristian David Garavito ChBelum ada peringkat
- ElectroNika - El Software para El Técnico Reparador - CARGADOR A FLOTE DE BATERIAS DE 6 VOLTS SELLADAS DE GELDokumen25 halamanElectroNika - El Software para El Técnico Reparador - CARGADOR A FLOTE DE BATERIAS DE 6 VOLTS SELLADAS DE GELFaithful Friend100% (1)
- Tutorial - El Blocking Del Hack de TecladoDokumen13 halamanTutorial - El Blocking Del Hack de TecladoRandy L. TobarBelum ada peringkat
- Plan de Mantenimiento SubestacionDokumen17 halamanPlan de Mantenimiento SubestacionJoseph Cristian MalagaBelum ada peringkat
- Unidad 1. Tipos de Datos de VHDLDokumen26 halamanUnidad 1. Tipos de Datos de VHDLFortinoBelum ada peringkat
- 16 01 Coordinación Protecciones Sistemas Potencia CoPro-SPDokumen2 halaman16 01 Coordinación Protecciones Sistemas Potencia CoPro-SPANDYAFANADORBelum ada peringkat
- Historia de Los Sistemas OperativosDokumen15 halamanHistoria de Los Sistemas OperativosEsther JimenezBelum ada peringkat
- Electric Id Ad y Circuitos - ESODokumen25 halamanElectric Id Ad y Circuitos - ESOapi-3850582100% (4)
- 15 Tema - Poli-Geosint-Plasticos-2018-IDokumen31 halaman15 Tema - Poli-Geosint-Plasticos-2018-IYoviz CQBelum ada peringkat
- Introduccion Perforacion DireccionalDokumen7 halamanIntroduccion Perforacion DireccionalJosé Luis Cornelio VeraBelum ada peringkat
- Formulario para Calcuo 2 UmsaDokumen2 halamanFormulario para Calcuo 2 UmsaNoel Angel Leon TiconaBelum ada peringkat
- U4 - Texto - Control Electrónico - 2021Dokumen19 halamanU4 - Texto - Control Electrónico - 2021Henry Sullca CcorahuaBelum ada peringkat
- Infografía Redes PDH-SDH SONETDokumen1 halamanInfografía Redes PDH-SDH SONETLuis Mario De La Paz VizqueiraBelum ada peringkat
- HP StorageWorks 4400 EVA - EspañolDokumen4 halamanHP StorageWorks 4400 EVA - Españolomar182Belum ada peringkat
- Electric Id Ad 3º ESO - ALUMNOS para 3ºDokumen44 halamanElectric Id Ad 3º ESO - ALUMNOS para 3ºcarpecb100% (1)
- FUSIBLESDokumen16 halamanFUSIBLESEdison Joselito LecBelum ada peringkat
- Control de Un Sistema de Riego Con El PLC S7-200 PDFDokumen64 halamanControl de Un Sistema de Riego Con El PLC S7-200 PDFJose Adrian Marquez100% (3)
- CAPÍTULO 2. Corriente ContinuaDokumen31 halamanCAPÍTULO 2. Corriente ContinuaLeonel Jordy PerezBelum ada peringkat
- Apuntes Sobre Ensayos No DestructivosDokumen204 halamanApuntes Sobre Ensayos No Destructivosgeologia1000Belum ada peringkat