Serie Redox 13-II
Diunggah oleh
Handal Emiliano Baca SolanoHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Serie Redox 13-II
Diunggah oleh
Handal Emiliano Baca SolanoHak Cipta:
Format Tersedia
SERIE DE PROBLEMAS DE XIDO-REDUCCIN PARA QUIMICA ANALTICA I (Q. IND.) GPO: 2301 SEMESTRE 2013-II 1.
- Balancear los equilibrios electroqumicos de los siguientes pares redox y asociar a cada uno de ellos la ecuacin de Nernst correspondiente a) BrO3 - / Br2 (medio cido) b) AgCl / Ag (medio neutro) c) MnO4 - / MnO2 (medio alcalino) d) H2O / O2 (medio cido) e) IO3 - / I2 (medio alcalino) f) Cl2 / Cl - (medio neutro)
2.- Balancear la siguiente reaccin e indicar: a) La especie oxidante y la reductora. b) Cul es el proceso de oxidacin y cul es el de reduccin? I2 + IO3 + Cl I Cl2 -
3.- Considere una mezcla de 50 mL de cloruro mercrico 0.05 M y 50 mL de cloruro estanoso 0.10 M a) Establezca el estado de equilibrio de la mezcla y calcule el valor de su Keq. b) Calcule el potencial de equilibrio (E eq.) de la mezcla.
DATOS: Sn 4+ / Sn 2+ E = 0.15 V Hg 2+ / Hg E = 0.854 V
4.- Se tienen 10 mL de una solucin mezcla formada por las sales de: Cr 2+, Sn 2+, Fe 2+ y Tl +, con una concentracin de 0.1 M de cada uno de los reductores. A la mezcla anterior se le agrega una solucin de una sal de Ce 4+. Si la cantidad agregada de la solucin de Ce 4+es: a) 1 mmol b) 2 mmoles c) 4 mmoles d) 6 mmoles e) 7 mmoles
4.1) Plantear la o las posibles reacciones que se llevan a cabo en cada mezcla 4.2) Calcular la Keq de cada reaccin que se lleve a cabo 4.3) Calcular la concentracin molar de cada especie presente en el equilibrio final de cada Mezcla 4.4) Calcular el potencial (E) de equilibrio para cada mezcla 5.- Considere las siguientes mezclas: a) 163.47 mg. de Zn + 40 mL de solucin de VO2 + de concentracin 0.1 M. b) 261.56 mg. De Zn + 160 mL de solucin de VO2 + de concentracin 0.1 M. Para cada mezcla: 1) Escriba las reacciones balanceadas que se llevan a cabo y plantee el estado de equilibrio final en la solucin. 2) Calcule el potencial de equilibrio final en la solucin DATOS: E ( Zn 2+ / Zn ) = -0.76 V E (VO 2+ / V 3+) = 0.33 V Zn : M.A. = 65.39 g/mol E (VO2 + / VO 2+) = 1.00 V E (V 3+ / V 2+) = - 0.25 V
6.- Se tienen 20 mL de una solucin que contiene H2C2O4 que se valora en medio cido a un pH = 0 con una solucin de Ce 4+ 0.1062 N gastndose 20.55 mL para alcanzar el punto de equivalencia. a) Plantee la reaccin de valoracin balanceada y calcule el valor de su Keq. b) Calcule la concentracin Normal y Molar inicial del H2C2O4 c) Establezca la TVCM particular para todo el transcurso de la valoracin d) Escriba la ecuacin de la Ley de Nernst para calcular el Eeq. en el punto de equivalencia. DATOS: Ce 4+ / Ce 3+ E = 1.7 V H2C2O4 / CO2 E = - 0.5 V
7.- 20 gramos de un mineral que contiene Uranio se disuelve en una solucin cida manteniendo dicha especie como U (III) y se aforan a 1000 ml con la misma solucin, se toma una alcuota de 25 ml y se titula con Cr 2O7 2- 0.01 N alcanzndose el punto de equivalencia en 20 ml. a) b) c) d) e) DATOS Escribir la reaccin de valoracin Calcular la constante de equilibrio termodinmica Calcular la concentracin del U(III) en la alcuota valorada. Determine el porciento de pureza de uranio en los 20 gramos del mineral. Calcular el E eq. en el punto de equivalencia de la valoracin. U(4+) / U (3+) EO = - 0.577 Cr2O72- / Cr 3+ EO = 1.33 Uranio M.A. = 238.028 g/mol
8.- 40.6 g de las sal Ce(NO3)4 se disolvieron en 750 mL de cido sulfrico a pH = 0, Si se toman 50 mL de sta solucin. a) Calcular los gramos necesarios de oxalato de sodio, para que reaccionen estequiomtricamente con el cerio. b) Calcular la constante de equilibrio de la reaccin. DATOS:
E Ce4+/Ce3+ = 1.44 V E C2O42-/CO2 = - 0.49 V M.M. Ce(NO3)4 = 386.12 g/mol M.M. Na2C2O4 = 144 g/mol
9.- Para cuantificar el contenido de nitratos (NO 3 -) en una muestra de agua de pozo, se procede de la siguiente manera: Se miden 50 mL de la muestra de agua se le agregan una gotas de un cido fuerte para imponerle un pH de 1.0 y se le adicionan 3 mL de una solucin de yoduro de potasio (KI) al 10 % (p/v). Esta solucin se valora con una solucin de tiosulfato de sodio de concentracin 0.015 M gastndose un volumen de 21.34 mL de este para alcanzar el punto de equivalencia. a) Escriba las reacciones balanceadas que se llevaron a cabo, antes de la valoracin y en el proceso de la misma y calcule sus constantes de equilibrio correspondientes. b) Calcule el % (p/v) de nitratos que contiene el agua de pozo. c) Calcule el E eq. en el punto de equivalencia de la valoracin. DATOS: NO3 - P.M. = 62 g /mol E (S4O6 = / HS2O3 -) = 0.10 V E (I3 -/ I -) = 0.53 V E (NO3 -/ HNO2 ) = 0.94 V
10.- 20 gramos de un mineral que contiene Fe(II) se disuelven y aforan a 1000 mL de esta solucin, se toma una alcuota de 25 mL y se titula con Cr2O7 2- 0.01 N alcanzndose el punto de equivalencia en 20 mL. a) b) c) d) e) f) g) f) g) Ubicar los pares redox en una escala de prediccin de reaccin (a pH = 0) Escribir la reaccin de valoracin Calcular la constante de equilibrio termodinmica Calcular la concentracin del Fe(II) en la alcuota valorada. Escribir la tabla de variacin de cantidades molares Calcular los potenciales en cada zona de la tabla Grafique los resultados de E en funcin de volumen de reactivo valorante agregado Determine el % de pureza de hierro en los 20 gramos del mineral. Si la titulacin se realiz potenciomtricamente, describa el montaje experimental sealando cada una de sus partes.
DATOS Fe 3+ / Fe (2+) Cr2O7 2- / Cr 3+ EO = 0.77 V EO = 1.33 V Fe M.A. = 55. 85 g/mol
Anda mungkin juga menyukai
- Problemas resueltos de Hidráulica de CanalesDari EverandProblemas resueltos de Hidráulica de CanalesPenilaian: 4.5 dari 5 bintang4.5/5 (7)
- Serie1 33217Dokumen5 halamanSerie1 33217Mario MoralesBelum ada peringkat
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDari EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSPenilaian: 4.5 dari 5 bintang4.5/5 (7)
- Ejercicios REDOXDokumen2 halamanEjercicios REDOXHumbertoSalamancaBelum ada peringkat
- serredoxDokumen2 halamanserredoxPedro BarónBelum ada peringkat
- Calculos Hidro Electro UDA FinalDokumen50 halamanCalculos Hidro Electro UDA FinalAlex Alberto Alave0% (1)
- Examen 1 de Química Analítica 1 sobre equilibrio REDOXDokumen2 halamanExamen 1 de Química Analítica 1 sobre equilibrio REDOXMiriam HansBelum ada peringkat
- Boletín 3Dokumen4 halamanBoletín 3sieirabravomariaBelum ada peringkat
- Boletin Problemas QuímicaDokumen4 halamanBoletin Problemas QuímicamaykafyqBelum ada peringkat
- Serredox2022 2Dokumen2 halamanSerredox2022 2Fanny MartínezBelum ada peringkat
- Serie de Ejercicios Equilibrio REDOXDokumen2 halamanSerie de Ejercicios Equilibrio REDOXPaco García TenaBelum ada peringkat
- Problemas Adicionales Quimica I 2016Dokumen15 halamanProblemas Adicionales Quimica I 2016tomiespiBelum ada peringkat
- Guía 9 - Equilibrio y Volumetría REDOXDokumen3 halamanGuía 9 - Equilibrio y Volumetría REDOXJuanBelum ada peringkat
- Examen 1Dokumen15 halamanExamen 1zeida2311100% (1)
- Set de Problemas 3 v2Dokumen2 halamanSet de Problemas 3 v2Enar RasecBelum ada peringkat
- Practica N 3 Reacciones Solucion Acuosa y SolucionesDokumen3 halamanPractica N 3 Reacciones Solucion Acuosa y SolucionesAlejandro Villalobos ViaBelum ada peringkat
- Equilibrio RedoxDokumen2 halamanEquilibrio Redoxpiscoron89Belum ada peringkat
- Taller Estequiometria RedoxDokumen3 halamanTaller Estequiometria RedoxwaseBelum ada peringkat
- Problemas Tema 8Dokumen6 halamanProblemas Tema 8CHOLOSIMEONEBelum ada peringkat
- Taller 3Dokumen3 halamanTaller 3Edson Diaz0% (1)
- Guia de Ejercicios PDFDokumen72 halamanGuia de Ejercicios PDFYanina FerreiraBelum ada peringkat
- Ejercicios QuímicaDokumen7 halamanEjercicios Químicadva07 07Belum ada peringkat
- GLOBAL - Redox y Orgánica - 2 - SolucionesDokumen12 halamanGLOBAL - Redox y Orgánica - 2 - SolucionesHala DeyaeBelum ada peringkat
- Química Analítica I: Exámenes anterioresDokumen12 halamanQuímica Analítica I: Exámenes anterioresVENIALVOBelum ada peringkat
- ABAUQuim Jun 18 EsDokumen10 halamanABAUQuim Jun 18 EsAcademicScientistsBelum ada peringkat
- EQUILIBRIO REDOX Y VOLUMETRÍADokumen9 halamanEQUILIBRIO REDOX Y VOLUMETRÍAJuanBelum ada peringkat
- Ejemplo de Examen (Alumnos)Dokumen6 halamanEjemplo de Examen (Alumnos)LiliaBelum ada peringkat
- Química General: Taller de Disoluciones y ReaccionesDokumen3 halamanQuímica General: Taller de Disoluciones y ReaccionesMauricio AcevedoBelum ada peringkat
- Examen Química de Navarra (Ordinaria de 2019)Dokumen2 halamanExamen Química de Navarra (Ordinaria de 2019)Iván RedradoBelum ada peringkat
- Examen 2012 Ebq IIDokumen2 halamanExamen 2012 Ebq IIDavidSenderBelum ada peringkat
- Serie III (2019)Dokumen3 halamanSerie III (2019)alejandro caztañonBelum ada peringkat
- Repaso Química Básica 2: Constante cinética, equilibrio químico y ácidos-basesDokumen5 halamanRepaso Química Básica 2: Constante cinética, equilibrio químico y ácidos-basesValentina50% (2)
- Ejercicios II (Para VueltaA) - 2Dokumen3 halamanEjercicios II (Para VueltaA) - 2kevinlarios290798Belum ada peringkat
- Analisis1examenes 4 y 5toDokumen11 halamanAnalisis1examenes 4 y 5toJavan ZaldivarBelum ada peringkat
- TP 8 Volumetría RedoxDokumen3 halamanTP 8 Volumetría RedoxSol PolitanoBelum ada peringkat
- Cuestionario QuimicaDokumen7 halamanCuestionario QuimicaByteenggBelum ada peringkat
- Problemas Examen FinalDokumen4 halamanProblemas Examen FinalDaniel Marcelo VelasquezBelum ada peringkat
- Ejercicios de Equilibrio Qu - Ã - MicoDokumen2 halamanEjercicios de Equilibrio Qu - Ã - MicoLuis AlbertoBelum ada peringkat
- Repaso Integradora 2023Dokumen8 halamanRepaso Integradora 2023Pipi ZubiaBelum ada peringkat
- QuimiDokumen3 halamanQuimiMario BuilBelum ada peringkat
- Guia06 (2021)Dokumen6 halamanGuia06 (2021)ChasconaBelum ada peringkat
- Serie de Problemas - QaiiDokumen10 halamanSerie de Problemas - QaiiJuan José MendozaBelum ada peringkat
- Coligativas UTNDokumen12 halamanColigativas UTNAnonymous ZAr1RKBelum ada peringkat
- ESTANDARIZACIÓN Y VALORACIÓN DE SOLUCIONESDokumen4 halamanESTANDARIZACIÓN Y VALORACIÓN DE SOLUCIONESJuan Camilo Guerrero ParedesBelum ada peringkat
- Modelos de Exámenes QAIDokumen46 halamanModelos de Exámenes QAIMiilenne100% (1)
- Modelos de Examenes Quimica AnaliticaDokumen37 halamanModelos de Examenes Quimica AnaliticajoseluiswubBelum ada peringkat
- Prob QA-IQ 21-BDokumen5 halamanProb QA-IQ 21-BChucho Chucho NepomuzenoBelum ada peringkat
- Parciales AnaliticaDokumen12 halamanParciales AnaliticaMario Fernando Hurtado AnguloBelum ada peringkat
- Química general II. Balanceo de ecuaciones y estequiometríaDokumen4 halamanQuímica general II. Balanceo de ecuaciones y estequiometríaMCBlackHeart0% (1)
- Repaso 2º Trimestre (1)Dokumen4 halamanRepaso 2º Trimestre (1)julita1726Belum ada peringkat
- EJERCICIOS DE REACCIONES REDOXDokumen5 halamanEJERCICIOS DE REACCIONES REDOXSergio Medrano JimenezBelum ada peringkat
- Taller General de EstequiometríaDokumen1 halamanTaller General de EstequiometríaSergioTorresCortésBelum ada peringkat
- Taller # 1 - QA - UdeA - 02-2018Dokumen3 halamanTaller # 1 - QA - UdeA - 02-2018Efra MortinattoBelum ada peringkat
- Examenes de QuimicaDokumen5 halamanExamenes de QuimicaJorge Leonardo ReinosoBelum ada peringkat
- Repaso Segundo Sumativo CepuntDokumen4 halamanRepaso Segundo Sumativo CepuntagramontetrujilloBelum ada peringkat
- Guia de Problemas - Segunda ParteDokumen3 halamanGuia de Problemas - Segunda ParteFernando TrinidadBelum ada peringkat
- Ejercicios Tema 4 - Disoluciones y ReaccionesDokumen6 halamanEjercicios Tema 4 - Disoluciones y ReaccionesOwens BorchBelum ada peringkat
- Cuestionario Previo Practica 1 BismutoDokumen3 halamanCuestionario Previo Practica 1 BismutoHandal Emiliano Baca SolanoBelum ada peringkat
- Scan Doc0001Dokumen7 halamanScan Doc0001Handal Emiliano Baca SolanoBelum ada peringkat
- Ácido NítricoDokumen5 halamanÁcido NítricoHandal Emiliano Baca SolanoBelum ada peringkat
- Cinetica QuimicaDokumen14 halamanCinetica QuimicaHandal Emiliano Baca SolanoBelum ada peringkat
- Cianuro de Hidrógeno, Anilina y T.D.I.Dokumen12 halamanCianuro de Hidrógeno, Anilina y T.D.I.Handal Emiliano Baca SolanoBelum ada peringkat
- Soluciones Ideales Delta G y ADokumen4 halamanSoluciones Ideales Delta G y AHandal Emiliano Baca SolanoBelum ada peringkat
- Reporte 1 QA2Dokumen4 halamanReporte 1 QA2Handal Emiliano Baca SolanoBelum ada peringkat
- Tarea Calculos de G de Exceso Con Diferentes ModelosDokumen18 halamanTarea Calculos de G de Exceso Con Diferentes ModelosHandal Emiliano Baca SolanoBelum ada peringkat
- ALQUENOSDokumen2 halamanALQUENOSHandal Emiliano Baca SolanoBelum ada peringkat
- Mantenimiento de chancadores Sandvik Serie 1800Dokumen128 halamanMantenimiento de chancadores Sandvik Serie 1800Stephanie Espinoza Castañeda100% (6)
- Agua PH y AmortiguadoresDokumen26 halamanAgua PH y AmortiguadoresCRARELI100% (1)
- Materiales de Uso TécnicoDokumen4 halamanMateriales de Uso TécnicoMáximo Huber Vásquez AcostaBelum ada peringkat
- Poes y GoesDokumen79 halamanPoes y GoesjosisBelum ada peringkat
- Fluidos 3Dokumen14 halamanFluidos 3Fito MenaBelum ada peringkat
- Análisis químico con espectrofotometría visibleDokumen2 halamanAnálisis químico con espectrofotometría visibleCami BacaBelum ada peringkat
- Laboratorio de Microbiología e Higiene de los AlimentosDokumen3 halamanLaboratorio de Microbiología e Higiene de los AlimentosmateoBelum ada peringkat
- Celulosa Circuito AproximaciónDokumen24 halamanCelulosa Circuito AproximaciónLuis Guerra Vega100% (1)
- Ciencias Y Tecnología. Química: Segundo TrimestreDokumen42 halamanCiencias Y Tecnología. Química: Segundo TrimestreKarina Gomez100% (1)
- OrdeñoDokumen7 halamanOrdeñoRoger_Fernandez_HBelum ada peringkat
- Apuntes Sobre Materiales CeramicosDokumen33 halamanApuntes Sobre Materiales CeramicosNancy Germán JiménezBelum ada peringkat
- Informe 08-ConductimetriaDokumen17 halamanInforme 08-ConductimetriaKatia Yesica Tineo CanalesBelum ada peringkat
- Lagunas FacultativasDokumen21 halamanLagunas FacultativasCinthiaMilagrosTincoDominguezBelum ada peringkat
- KROMASOL Presentación PDFDokumen34 halamanKROMASOL Presentación PDFdante67% (3)
- MargaritaDokumen124 halamanMargaritaGustavo OrtegaBelum ada peringkat
- Ruptura de La ViscosidadDokumen2 halamanRuptura de La ViscosidadJose VillalvaBelum ada peringkat
- Acabados Modernos en Construccion de ViviendaDokumen27 halamanAcabados Modernos en Construccion de ViviendaAlian Urbano CochachinBelum ada peringkat
- Informe de AlgasDokumen17 halamanInforme de AlgasLeidy Cely CastilloBelum ada peringkat
- Tag10 - FideosDokumen52 halamanTag10 - FideosNicolas Amos Rueda Pajuelo100% (1)
- Preparación y Valoración de Nitrato de Plata 0Dokumen3 halamanPreparación y Valoración de Nitrato de Plata 0Edd de La ComarcaBelum ada peringkat
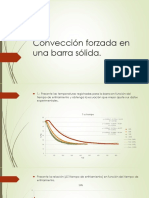
- Convección forzada en barra sólida: coeficiente de transferencia de energíaDokumen12 halamanConvección forzada en barra sólida: coeficiente de transferencia de energíaKarliita LomBelum ada peringkat
- ABC Petroleo y Gas ANEXODokumen10 halamanABC Petroleo y Gas ANEXOEuge CovoBelum ada peringkat
- Enzimas y factores que afectan su actividadDokumen2 halamanEnzimas y factores que afectan su actividadIsabel Fernandez RiveraBelum ada peringkat
- 4 Parcial UBA XXI PDFDokumen5 halaman4 Parcial UBA XXI PDFMaria VillarBelum ada peringkat
- Principios Basicos de Higiene Ocupacional Ing. AraqueDokumen209 halamanPrincipios Basicos de Higiene Ocupacional Ing. AraqueJonathan Jesus Ramon RojasBelum ada peringkat
- El Agua en Materiales RocososDokumen13 halamanEl Agua en Materiales RocososEncarna Caballero AfanBelum ada peringkat
- Cómo preparar germinados en casa para aumentar su valor nutricionalDokumen4 halamanCómo preparar germinados en casa para aumentar su valor nutricionalKnesebeck Huerto UrbanoBelum ada peringkat
- Fallas BuhjiasDokumen15 halamanFallas BuhjiasDavid TipanBelum ada peringkat
- Los 20 Aminoacidos Mas ImportantesDokumen4 halamanLos 20 Aminoacidos Mas Importantesrmtdla64Belum ada peringkat
- Sustancias ergásticas vegetalesDokumen7 halamanSustancias ergásticas vegetalesaprolabgp100% (1)