Practica 4 Obtencion y Tratamiento de Datos Cineticos
Diunggah oleh
Alvaro Parihuancollo EncinasHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Practica 4 Obtencion y Tratamiento de Datos Cineticos
Diunggah oleh
Alvaro Parihuancollo EncinasHak Cipta:
Format Tersedia
UNIVERSIDAD MAYOR DE SAN SIMON
FACULTAD DE CIENCIAS Y TECNOLOGIA
INGENIERIA QUIMICA
OBTENCIN Y TRATAMIENTO DE DATOS CINTICOS MEDIANTE EL
METODO INTEGRAL Y DIFERENCIAL EMPLEANDO LA REACCIN DE
SAPONIFICACIN DEL ACETATO DE ETILO
INTEGRANTES:
Rodrguez Terceros Gonzalo
Caballero Fiorilo Ana Claudia
Calani Lucas Juan Vicente
Limachi choque Max Oliver
MATERIA: Laboratorio de reactores
GESTION: I/2013
DOCENTE: Lic. Bernardo Lpez Arce
Cochabamba Bolivia
1 Introduccin
Una ecuacin cintica que caracteriza a la velocidad de reaccin y su forma puede provenir de
consideraciones tericas o ser simplemente el resultado de un procedimiento emprico de ajuste
de curvas. En ambos casos, el valor de los coeficientes cinticos de la ecuacin solamente puede
determinarse por va experimental, ya que en la actualidad resultan inadecuados los modelos de
prediccin.
2 Objetivos
Al final de la prctica el estudiante ser capaz de:
Realizar tratamientos de datos cinticos mediante el mtodo integral y mtodo
diferencial empleando como sistema la reaccin de Saponificacin del Acetato de Etilo
Aplicar en el tratamiento de datos experimentales los dos mtodos matemticos
sealados, para la determinacin del orden de reaccin, la constante de velocidad y el
tiempo de vida media.
Definir la exactitud o aproximacin de cada mtodo, mediante la comparacin de los
resultados obtenidos con respecto a los datos tericos existentes.
3. Marco Terico
La cintica qumica estudia la velocidad y el mecanismo por medio de los cuales una
especie qumica se transforma en otra. La velocidad es la masa de un producto formado o
de un reactante consumido por unidad de tiempo. El mecanismo es la secuencia de eventos
qumicos individuales cuyo resultado global produce la reaccin observada. La cintica
qumica considera todos los factores que influyen sobre ella explicando la causa de la
magnitud de esa velocidad de reaccin.
Para poder estudiar la cintica qumica de una reaccin debemos seguir de algunos
mtodos
Mtodos qumicos
En los mtodos qumicos se separa una cantidad de sustancia (alcuota) del reactor para
su anlisis. Para que los mtodos qumicos sean eficaces, deben ser rpidos en relacin
a la reaccin a estudiar, en caso contrario la reaccin de la alcuota se ha de frenar
mientras transcurre el proceso de anlisis. Las formas en las que podemos detener el
avance de la reaccin son diversas, dependiendo de cada sistema: disminuyendo la
temperatura de reaccin, eliminando el catalizador, aadiendo un inhibidor al sistema,
eliminando alguno de los reactivos.
Mtodos Fsicos
En los mtodos fsicos se mide una propiedad fsica de la mezcla que cambie a lo largo
de la reaccin. Son rpidos y evitan tener que sacar muestras del reactor, por lo que en
general son ms indicados para el estudio cintico de una reaccin. Los mtodos fsicos
ms frecuentes son medida de la presin en reacciones gaseosas, mtodos
dilatomtricos (cambio en el volumen, mtodos pticos (polarimetra, ndice de
refraccin, colorimetra, espectrofotometra), mtodos elctricos (conductimetra,
potenciometra, polarografa).
3.1 Mtodo Diferencial
Cuando una reaccin es irreversible, en muchos casos es posible determinar el orden de reaccin
y la constante de velocidad especfica diferenciando numricamente los datos de concentracin
contra el tiempo.
Por ejemplo:
A productos
Expresando la velocidad de reaccin como -r
A
= kC
A
o bien como
o
A
A
kC
dt
dC
=
Sacando logaritmo natural de ambos miembros de la velocidad de reaccin tendremos:
A
A
C k
dt
dC
ln ln ln o + = |
.
|
\
|
La pendiente de una grafica de
|
.
|
\
|
dt
dC
A
ln
en funcin de (ln C
A
) es el orden de reaccin
Para obtener la derivada de dt dC
A
/ , debemos diferenciar los datos de concentracin tiempo,
numricamente o grficamente.
3.2 Mtodo Integral
Para determinar el orden de reaccin por el mtodo integral, conjeturamos el orden reaccin e
integramos la ecuacin diferencial usada. Si el orden que supusimos es correcto, la grafica
apropiada de los datos concentracin-tiempo (determinada a partir de la integracin) ser lineal.
Para el ejemplo A productos, efectuada en un reactor por lotes de un volumen constante, el
balance de moles es:
A
A
r
dt
dC
=
En el caso de una reaccin de orden cero, r
A
= -k, y la ley de velocidad y balance de moles
combinados dan k
dt
dC
A
=
Integrando con C
A
= C
A,o
en t = 0, tenemos kt C C
o A A
=
,
Si el ajuste del grafico C
A
en funcin de tiempo no se ajusta a una aproximacin lineal satisfactorio,
se ensaya con otra ecuacin cintica.
4 Parte Experimental
Se estudiara la reaccin de saponificacin del acetato de etilo
4.1 materiales y reactivos
- Dos matraces aforados de 100 ml
- Una bureta de 25 ml
- Dos vasos precipitados de 250 ml
- Dos matraces Erlenmeyer de 100 ml
- Un cronmetro
4.1.1 Reactivos
- Acido clorhdrico concentrado
- Hidrxido de sodio
- Acetato de etilo
- Fenolftalena (indicador)
- Agua Destilada
- Agua de semapa
4.2 Desarrollo experimental
Preparar 100 ml de solucin 0.03 M de NaOH.
Preparar 100 ml de solucin 0.03 M de acetato de etilo.
Preparar y valorar 100 ml de la solucin de concentracin 0.02M de cido clorhdrico ( HCl)
y aforar en una bureta con la solucin de HCl 0.02 M
Tomar 50mL de acetato de etilo con una probeta y agregarlos a un vaso de precipitados de
250mL que servir como reactor.
Adicionar 2 3 gotas de fenolftalena al vaso de precipitados (reactor).
Adicionar 50mL de NaOH al reactor e inmediatamente proseguir con el siguiente paso.
Tomar una alcuota de 10 ml del sistema, adicionarlos a un matraz Erlenmeyer y titular con
HCl 0.02M.
Repetir el anterior paso cada 3 minutos (tomar 10 lecturas).
Nota: La ltima alcuota probablemente ser de 10 ml, debido al error de medicin.
5. Clculos y Resultados
HCl= 0,002 M
C4O2H8= CA0 = 0,03 M
CNaOH= CB0 = 0,03 M
Alcuotas 6 ml
T ambiente = 24 C
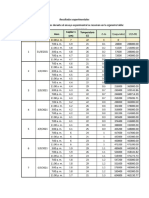
DATOS EXPERIMENTALES
Corrida t (min) VHCl [ml] CNaOH M
1 9 6 0,0020
2 14 5 0,0016
3 16 4,7 0,0015
4 21 3,4 0,0012
5 24 3,4 0,0011
6 27 3,4 0,0011
7 31 3 0,001
8 34 3 0,001
9 37 3 0,001
10 42 2,8 0,00093
11 45 2,3 0,00076
12 48 2 0,00066
13 50 2 0,00066
14 53 1,8 0,0006
La C
NaOH
se clculo de la ecuacin de equilibrio
Calculemos el orden de reaccin por el mtodo integral:
Asumiendo 1er orden: r =KcB
(-d C
B
/dt)= k C
B
Ln C
B
= Ln C
B0
k t
Y = A + BX
t (min) VHCl [ml] CNaOH M lnCNaOH
9 6,1 0,0020 -6,198078
14 4,8 0,0016 -6,437751
16 4,6 0,0015 -6,480311
21 3,4 0,0012 -6,725433
24 3,4 0,0011 -6,782592
27 3,4 0,0011 -6,782592
31 3 0,0010 -6,874965
34 3 0,001 -6,907755
37 3 0,001 -6,907755
42 2,8 0,00093 -6,976748
45 2,3 0,00076 -7,173458
48 2 0,00066 -7,264430
50 2 0,00066 -7,264430
53 1,8 0,0006 -7,418580
Graficando tiempo vs ln CNaOH
Y = 6,098 - 0,0238X
Ln C
B
= Ln C
B0
k t
La constante cintica de velocidad k = 0.0238
La cintica de reaccin r = 0.0238 CB, orden de reaccin = 1
Mtodo diferencial
t (min) CNaOH M LN(CB) LN(C/t)
9 0,0020 -6,1980787 -9,3574332
14 0,0016 -6,4377516 -10,491274
16 0,0015 -6,4803112 -9,6356081
21 0,0012 -6,7254337 -10,474467
-7.6
-7.4
-7.2
-7
-6.8
-6.6
-6.4
-6.2
-6
0 20 40 60
l
n
C
N
a
O
H
tiempo
Series1
Linear (Series1)
24 0,0011 -6,7825921 -11,440354
27 0,0011 -6,7536045 -10,568749
31 0,001 -6,8432167 -11,424094
34 0,001 -6,8749654 -11,437123
37 0,001 -6,9077552 -11,307744
42 0,00093 -6,9767481 -9,5666152
45 0,00076 -7,1734584 -10,743976
48 0,00066 -7,2644302 -10,971640
50 0,00066 -
7,313220387
-
10,7439766
53 0,0006
Graficando
CONCLUSIONES Y RECOMENDACIONES
- El valor calculado de la constante de velocidad a temperatura ambiente fue diferente en
primera instancia a travs de su clculo mediante los mtodos integral y diferencial. Se
valid el resultado obtenido por el mtodo integral, trabajando con un orden de reaccin
parcial respecto al NaOH igual a la unidad y obtenindose un valor semejante al calculado
por el supuesto orden global de reaccin igual a 2.
- Se puede concluir que la reaccin de la saponificacin del acetato de etilo en medio bsico
responde a una cintica de segundo orden global. Aproximndose de manera satisfactoria
a un modelado de primer orden respecto al NaOH y Acetato de etilo.
- Los datos obtenidos experimentalmente solo proporcionan un panorama general del
comportamiento de la reaccin, debido a que no se dispone de informacin en los
-14
-12
-10
-8
-6
-4
-2
0
0 20 40 60
A
x
i
s
T
i
t
l
e
Axis Title
Series1
Linear (Series1)
primeros instantes de la reaccin siendo la causa que sta sucede en un tiempo muy
corto.
- El sistema reaccionante fue alterado en el muestreo, debido a que se produca
turbulenciaen el momento de la extraccin y expulsin de la alcuota, vindose afectada la
velocidad de reaccin. Esto se traduce en un valor de conversin in situ acompaado de
un error experimental aleatorio.
- Se sugiere llevar a cabo el mismo procedimiento experimental a una temperatura inferior,
retardando la reaccin qumica para la facilidad de la toma de muestras, caso contrario la
informacin registrada ser parcial, imposibilitando el estudio adecuado de la reaccin de
saponificacin.
6. BIBLIOGRAFA
Atkins P. N., Fisicoqumica, 3 ed., Addison-Wesley Iberoamericana, Wilmington, 1991.
Cartwright H., Kinetics of the persulfate-iodide clock reaction, Oxford University.
http://ptcl.chem.ox.ac.uk/hmc/tlab/experiments/502.html.
Gormley P, Determination of a rate law, Science Teachers' Resource Center
Anda mungkin juga menyukai
- Saponificacion de Acetato de Etilo Grupo 5Dokumen15 halamanSaponificacion de Acetato de Etilo Grupo 5Vladimir Alex Caspa CopaBelum ada peringkat
- Practica 4Dokumen16 halamanPractica 4AliTha AyalaBelum ada peringkat
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDari EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaPenilaian: 5 dari 5 bintang5/5 (1)
- Informe Descomposición Del Peróxido de HidrógenoDokumen4 halamanInforme Descomposición Del Peróxido de HidrógenoISABELA SOLARTE CASTILLOBelum ada peringkat
- Calculo Del Perfil de Concentraciones para Un Reactor Tubular y Del Volumen Del Reactorcon Solución Numérica Con El Método de RungeDokumen3 halamanCalculo Del Perfil de Concentraciones para Un Reactor Tubular y Del Volumen Del Reactorcon Solución Numérica Con El Método de RungeLemuelMoralesBelum ada peringkat
- Informe Práctica 1Dokumen8 halamanInforme Práctica 1linamendozaBelum ada peringkat
- Reactores SimplesDokumen40 halamanReactores SimplesKimberlyLee100% (1)
- Practica 12 Laboratorio Integral IIDokumen6 halamanPractica 12 Laboratorio Integral IIJACQUELINE VIRGEN LÓPEZBelum ada peringkat
- Informe 2 PDFDokumen25 halamanInforme 2 PDFAlejandroPeñarrietaHerbasBelum ada peringkat
- Practica II Determinacion de Lineas de EquilibrioDokumen17 halamanPractica II Determinacion de Lineas de EquilibrioAdrian Lopez MBelum ada peringkat
- Descomposición Catalítica Del Peróxido de HidrógenoDokumen5 halamanDescomposición Catalítica Del Peróxido de HidrógenoHugo Cruz GalindoBelum ada peringkat
- BUTAMERDokumen3 halamanBUTAMEREduardo Elias CastellanosBelum ada peringkat
- Practica 9 (Sin)Dokumen14 halamanPractica 9 (Sin)Miguel Angel JassoBelum ada peringkat
- Tarea 2Dokumen6 halamanTarea 2Ricky Ocampo0% (1)
- Seminario MTBE y ETBEDokumen25 halamanSeminario MTBE y ETBEcamila soto gonzalez100% (1)
- Tarea 1 CC Ene-Jun2019Dokumen3 halamanTarea 1 CC Ene-Jun2019Edgar adrian reyes carrilloBelum ada peringkat
- Crakeo de AcetonaDokumen1 halamanCrakeo de AcetonaPaulo Sidney Bustinza PereaBelum ada peringkat
- Distribución de Tiempos de Residencia Lab de ReactoresDokumen18 halamanDistribución de Tiempos de Residencia Lab de ReactoresManuel Alejandro Sanabria LiendroBelum ada peringkat
- Extraccion Liquido-LiquidoDokumen24 halamanExtraccion Liquido-LiquidoMax Lewiss Mafaldo DavilaBelum ada peringkat
- LABO DE REA Preinforme 2Dokumen7 halamanLABO DE REA Preinforme 2Adriana RosasBelum ada peringkat
- Taller 6Dokumen12 halamanTaller 6David HenaoBelum ada peringkat
- Informe. Práctica # 5. Peréz, C. - Reverón, C.Dokumen14 halamanInforme. Práctica # 5. Peréz, C. - Reverón, C.carlos perezBelum ada peringkat
- Reactor de Hidrogenación 3Dokumen2 halamanReactor de Hidrogenación 3Kelly RLiBelum ada peringkat
- Diseño de Reactor Trickle Bed 2020aDokumen9 halamanDiseño de Reactor Trickle Bed 2020aRandyBelum ada peringkat
- G3 Miercoles PRE-INFORME 2 Reaccion de Oxidacion Del Ion Yoduro Con Persulfato de AmonioDokumen10 halamanG3 Miercoles PRE-INFORME 2 Reaccion de Oxidacion Del Ion Yoduro Con Persulfato de AmonioLuciana Camila Olivera AguilarBelum ada peringkat
- Practica 9 Distribucion de Tiempos de ResidenciaDokumen17 halamanPractica 9 Distribucion de Tiempos de ResidenciaBruno CintraBelum ada peringkat
- Reporte Torre EmpacadaDokumen17 halamanReporte Torre Empacada___ASCEBelum ada peringkat
- Práctica 11 - Destilación DiferencialDokumen9 halamanPráctica 11 - Destilación DiferencialGracieladeLeónBelum ada peringkat
- Ejercicios Del Punto de Pliegue PDFDokumen2 halamanEjercicios Del Punto de Pliegue PDFGilbert Rodriguez PalmaBelum ada peringkat
- PDF Produccion de Acido Acrilico A Partir de Propileno DDDokumen80 halamanPDF Produccion de Acido Acrilico A Partir de Propileno DDKrugger CossioBelum ada peringkat
- Cinetica QuimicaDokumen23 halamanCinetica QuimicaRonald Alejandro Perez OrtizBelum ada peringkat
- Taller DestilaciónDokumen3 halamanTaller DestilaciónDaniela MontenegroBelum ada peringkat
- Laboratorio Integral II Practica 2Dokumen11 halamanLaboratorio Integral II Practica 2Ian MarBelum ada peringkat
- Investigacion Hidrodesalquilacion de ToluenoDokumen6 halamanInvestigacion Hidrodesalquilacion de ToluenoBetty SantiagoBelum ada peringkat
- Informe 8Dokumen14 halamanInforme 8Ariel Flores OrtuñoBelum ada peringkat
- PERVAPORACIONDokumen27 halamanPERVAPORACIONLuis100% (1)
- Produccion de Acetato de EtiloDokumen8 halamanProduccion de Acetato de EtiloDavid Alendez QuispitupaBelum ada peringkat
- R2 Reactor Por LotesDokumen20 halamanR2 Reactor Por LotesJose Antonio VazquezBelum ada peringkat
- Trabajo 2. Transformada de LaplaceDokumen9 halamanTrabajo 2. Transformada de LaplaceChambi GonxaloBelum ada peringkat
- 1 DE2 - Equipo 4Dokumen22 halaman1 DE2 - Equipo 4Diego Alejandro Morales CortésBelum ada peringkat
- Reporte 4 - Destilacion en Torre EmpacadaDokumen4 halamanReporte 4 - Destilacion en Torre EmpacadaYeremi Teotl Huay0% (1)
- DBP-BM P1 01-12Dokumen16 halamanDBP-BM P1 01-12Fernanda González RochaBelum ada peringkat
- Metodo Grafico de WinkelmannDokumen4 halamanMetodo Grafico de WinkelmannCarmen HernandezBelum ada peringkat
- Intercambiadores de CalorDokumen105 halamanIntercambiadores de CalorGladis tarifaBelum ada peringkat
- Informe Fico II Equilibrio Quimico2Dokumen10 halamanInforme Fico II Equilibrio Quimico2Lesly MitmaBelum ada peringkat
- Practica 6 Reactor Flujo Tubular PistonDokumen10 halamanPractica 6 Reactor Flujo Tubular PistonVirginia Rosales OlmosBelum ada peringkat
- Grupo 1. Informe 2. Reaccion de Oxidacion Del Ion Yoduro Con Persulfato de AmonioDokumen13 halamanGrupo 1. Informe 2. Reaccion de Oxidacion Del Ion Yoduro Con Persulfato de AmonioPriscila SaavedraBelum ada peringkat
- Reporte Torre de PlatosDokumen14 halamanReporte Torre de PlatosLuis RamírezBelum ada peringkat
- PRACTICA #10 ElectroquimicaDokumen9 halamanPRACTICA #10 ElectroquimicaMiriam Vasquez Bravo100% (1)
- Tarea ExposicionDokumen33 halamanTarea ExposicionMartin Chafloque BarriosBelum ada peringkat
- Funcionamiento de Reactores en Serie Cascada de 2 TanquesDokumen6 halamanFuncionamiento de Reactores en Serie Cascada de 2 TanquesCarmen AyalaBelum ada peringkat
- Oxidación Del Yoduro Por PersulfatoDokumen10 halamanOxidación Del Yoduro Por PersulfatoJean Lk100% (1)
- Ecuaciones Ejercicio 7.13 HeleyDokumen11 halamanEcuaciones Ejercicio 7.13 HeleyJose Antonio VazquezBelum ada peringkat
- Cinetica QuimicaDokumen45 halamanCinetica QuimicaarmynboliviaBelum ada peringkat
- Reactor So3Dokumen50 halamanReactor So3williamyc7Belum ada peringkat
- Destilacion FlashDokumen3 halamanDestilacion FlashAndrei Sheldon Raul Garibay ValadezBelum ada peringkat
- 14 Seguridad y Control - RunawayDokumen16 halaman14 Seguridad y Control - RunawayavgunioviBelum ada peringkat
- Tarea 1 - Analisis de ProcesosDokumen4 halamanTarea 1 - Analisis de ProcesosmarisanBelum ada peringkat
- Equilibrio de fases: Un enfoque basado en competenciasDari EverandEquilibrio de fases: Un enfoque basado en competenciasBelum ada peringkat
- Pre Informe 4Dokumen8 halamanPre Informe 4carlos balderramaBelum ada peringkat
- SeparadoresDokumen1 halamanSeparadoresAlvaro Parihuancollo EncinasBelum ada peringkat
- La AmistadDokumen1 halamanLa AmistadAlvaro Parihuancollo EncinasBelum ada peringkat
- Diseño de Separador FlashDokumen6 halamanDiseño de Separador Flashdj_marcoBelum ada peringkat
- El Fin Del MundoDokumen1 halamanEl Fin Del MundoAlvaro Parihuancollo EncinasBelum ada peringkat
- Separ AdoresDokumen1 halamanSepar AdoresAlvaro Parihuancollo EncinasBelum ada peringkat
- Venteo ManualDokumen1 halamanVenteo ManualAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- AspemDokumen1 halamanAspemAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- Valvulas de AlivioDokumen1 halamanValvulas de AlivioAlvaro Parihuancollo EncinasBelum ada peringkat
- SeparadoresDokumen1 halamanSeparadoresAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- Material de Hysys 1Dokumen1 halamanMaterial de Hysys 1Alvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- Material de Hysys 1Dokumen1 halamanMaterial de Hysys 1Alvaro Parihuancollo EncinasBelum ada peringkat
- Material de Hysys 1Dokumen1 halamanMaterial de Hysys 1Alvaro Parihuancollo EncinasBelum ada peringkat
- DisenhoDokumen1 halamanDisenhoAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- ProcessDokumen1 halamanProcessAlvaro Parihuancollo EncinasBelum ada peringkat
- Metodos de AlmacenamientoDokumen1 halamanMetodos de AlmacenamientoAlvaro Parihuancollo EncinasBelum ada peringkat
- IngenieriaDokumen1 halamanIngenieriaAlvaro Parihuancollo EncinasBelum ada peringkat
- Saludos AmigosDokumen1 halamanSaludos AmigosAlvaro Parihuancollo EncinasBelum ada peringkat
- Metodos de AlmacenamientoDokumen1 halamanMetodos de AlmacenamientoAlvaro Parihuancollo EncinasBelum ada peringkat
- Metodos de AlmacenamientoDokumen1 halamanMetodos de AlmacenamientoAlvaro Parihuancollo EncinasBelum ada peringkat
- Trabajo de Lenguaje y ComunicacionDokumen9 halamanTrabajo de Lenguaje y ComunicacionCáceres YoirelisBelum ada peringkat
- F7 MANUAL YASKAWA - EspañolDokumen243 halamanF7 MANUAL YASKAWA - Españolalperda73% (11)
- El Análisis de FactibilidadDokumen3 halamanEl Análisis de Factibilidadwences lunarBelum ada peringkat
- MAGNETISMO Primera Edicion 2007Dokumen15 halamanMAGNETISMO Primera Edicion 2007nicolas dionisio ordonez barruetaBelum ada peringkat
- Evaluación Porcentajes OficialDokumen4 halamanEvaluación Porcentajes OficialPamela Katherine Palma CastroBelum ada peringkat
- DiodosDokumen47 halamanDiodosOscar PaulBelum ada peringkat
- Cromatografia de Liquidos de Alta ResolucionDokumen19 halamanCromatografia de Liquidos de Alta ResolucionRafael GonzálezBelum ada peringkat
- Manual Pickit 3Dokumen19 halamanManual Pickit 3alvaroBelum ada peringkat
- Apuntes - de - Obras - Hidraulica 003Dokumen23 halamanApuntes - de - Obras - Hidraulica 003sergio enriquezBelum ada peringkat
- Instrumentación Biomédica: Alvarez Lopez Alma Cristina Grupo: 1101Dokumen12 halamanInstrumentación Biomédica: Alvarez Lopez Alma Cristina Grupo: 1101Alma Cristina Alvarez LopezBelum ada peringkat
- Segundo Examen Ciclo EspecialDokumen41 halamanSegundo Examen Ciclo EspecialJorge Cesar Rojas Ramos0% (1)
- Ejm Coordenadas Geograficas A UtmDokumen9 halamanEjm Coordenadas Geograficas A UtmVictor Andres Sicus ChampiBelum ada peringkat
- La Membrana Celular y Los TransportesDokumen9 halamanLa Membrana Celular y Los TransportesMaru VeronicaBelum ada peringkat
- TEMA 1 ARITMÉTICA NIVEL AVANZADO Radicales IDokumen3 halamanTEMA 1 ARITMÉTICA NIVEL AVANZADO Radicales IJorge Luis Huaman TelloBelum ada peringkat
- Grupo Numero 3 Propiedades y EstiloDokumen12 halamanGrupo Numero 3 Propiedades y EstiloStephany Nicolle Ordoñez vasquezBelum ada peringkat
- Prácticas EPC 3-6 2do IntercicloDokumen26 halamanPrácticas EPC 3-6 2do IntercicloDiego Andres TrafiickBelum ada peringkat
- Unidad Didactica Cuaderno 2 PDFDokumen23 halamanUnidad Didactica Cuaderno 2 PDFmelito91Belum ada peringkat
- GRUPO 2 Aglomerantes y PlasticosDokumen75 halamanGRUPO 2 Aglomerantes y PlasticosIan Daniel Mauricio HerhuayBelum ada peringkat
- 05 Desafios ENE 2018Dokumen18 halaman05 Desafios ENE 2018Felipe Almada OrtegaBelum ada peringkat
- Evaluacion Avanzada 6Dokumen3 halamanEvaluacion Avanzada 6Ampa CordubaBelum ada peringkat
- U2 - S5 - Ejercicios para Actividad VirtualDokumen2 halamanU2 - S5 - Ejercicios para Actividad VirtualWilliam A. Salazar Carrasco50% (2)
- Quimica-Fisica Nivel III Semana 11-12Dokumen5 halamanQuimica-Fisica Nivel III Semana 11-12Rikardo Murcia50% (2)
- Cementado, Templado y Revenido AISI 1018Dokumen31 halamanCementado, Templado y Revenido AISI 1018Ronaldo100% (1)
- Clasificación de Los Ángulos para Quinto de PrimariaDokumen4 halamanClasificación de Los Ángulos para Quinto de PrimariaLourdes BasantesBelum ada peringkat
- EstratificacionDokumen9 halamanEstratificacionBrayan Pandal SaenzBelum ada peringkat
- Fundamentos de ArrancadoresDokumen16 halamanFundamentos de ArrancadoresLeonard KevBelum ada peringkat
- Unidad 02 - Noción y Operaciones Con FraccionesDokumen29 halamanUnidad 02 - Noción y Operaciones Con FraccionesYerlinRodriguez0% (3)
- Actividad Caida Libre Realizada.Dokumen3 halamanActividad Caida Libre Realizada.Dorina CardenasBelum ada peringkat
- PEREZ GOMEZ, Estructura Formal de MedeaDokumen34 halamanPEREZ GOMEZ, Estructura Formal de MedeaSasha StefkoBelum ada peringkat
- Tercer Examen de FísicaDokumen9 halamanTercer Examen de FísicaDayana ArqueBelum ada peringkat