Dureza Del Agua-1
Diunggah oleh
Nathalia Alvarez OrtizHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Dureza Del Agua-1
Diunggah oleh
Nathalia Alvarez OrtizHak Cipta:
Format Tersedia
1 DUREZA DEL AGUA Identificacin, Clasificacin, Cuantificacin y Eliminacin
OBJETIVO Que el alumno aprenda a: ! Reconocer un agua dura mediante el test de la Solucin Jabonosa. ! Identificar las principales especies qumicas que confieren dureza al agua mediante el test de la Solucin Jabonosa. !.Clasificar un agua dura segn su origen teniendo en cuenta datos de solubilidad de sales. !.Cuantificar la dureza total de un agua mediante la t cnica de !aloracin con "ersenato disdico. !.#liminar la dureza del agua mediante los m todos de la Cal$Sosa % de las Resinas de Intercambio Inico. ! Construir nue!os conceptos sobre la base de otros pre!ios %a !istos en la materia. !.Relacionar aspectos terico$pr&cticos acad micos con 'ec'os rele!antes de la !ida diaria
I"TRODUCCI#" #l agua es sin lugar a duda una de las sustancias m&s usadas en la !ida diaria % en particular en un laboratorio de qumica. #n este ltimo caso( esto es as( dado que la misma puede ser necesaria como medio de limpieza( medio de calefaccin o bien como reacti!o qumico o medio de sustento para lle!ar a cabo reacciones qumicas. )e esta !ariedad de posibilidades( la idea de este traba*o pr&ctico es focalizar la atencin en los dos primeros aspectos +limpieza % calefaccin,( donde el t rmino agua tiene el significado que se le da cotidianamente( esto es( entender el -agua. como una solucin acuosa de sustancias disueltas % no como la especie qumicamente pura formulada /01. #l agua en general es un buen disol!ente de muc'as sustancias que son incorporadas por el paso de aquella a tra! s del aire o de la tierra. #stas sustancias simples o compuestas pueden ser de ndole org&nica( inorg&nica2 ser gaseosas o slidas. #n particular se dar& importancia a la presencia de ciertas sales inorg&nicas con el ob*eto de estudiar las caractersticas % las consecuencias que las mismas le confieren al agua.
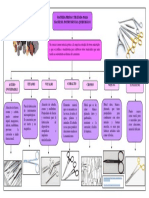
2 $ATERIALE % REACTIVO &U'$ICO 3ateriales: 4 5rascos goteros 4 6radilla para tubos de ensa%o 4 7ubos de ensa%o con tapn 4 8ureta 4 #mbudo 4 #rlenme%er 4 8olpipeta Reacti!os Qumicos 4 9gua de canilla % agua smil agua de napa 4 Solucin Jabonosa 4 Soluciones de: cloruro de sodio( cloruro de calcio( sulfato de sodio % sulfato de magnesio 4 Solucin de "ersenato disdico +:a0/0"er, 4 Solucin reguladora de p/ ; <= +:/ >?:/@Cl, 4 Solucin de :egro de #riocromo 7 +:#7,
A( IDE"TI)ICACI#" DE U" AGUA DURA *Test de la +lucin Ja,+n+sa( #l agua como medio de limpieza #n dos tubos de ensa%o colocar aproAimadamente > cm de altura de: agua de la canilla en uno % agua smil agua de napa en el otro. 9dicionar luego en ambos tubos de ensa%o <= gotas de solucin *abonosa( tapar % agitar. 1bser!ar. CUE TIO"ARIO a, #Aplicar lo obser!ado b, BQu incon!eniente trae apare*ado el uso de un agua smil napa como medio de limpiezaC #l agua como medio de calefaccin #n la !ida cotidiana( a medida que pasa el tiempo( se puede obser!ar que el fondo de los utensillos de cocina usados para calentar agua se !a cubriendo de un depsito blanquecino. #sta situacin puede ocurrir tambi n a ni!el industrial en los equipos destinados a producir agua caliente o !apor de agua +calderas,( los cuales traba*an a ele!adas tem-e.atu.a y -.esin. 8&sicamente( esto se produce por la accin del calor sobre las sustancias disueltas en el agua que es usada como
3 alimentacin. Do eApuesto anteriormente puede !erse refle*ado en las siguientes fotografas: <, 5ondos de pa!as con presencia de depsitos
0, )epsitos eAtrados de una caldera
>, 7ubos de una caldera con depsito en su interior
CUE TIO"ARIO a, BQu nombre reciben los depsitos blanquecinosC b,.BQu incon!enientes pueden ocasionar estos depsitos en una caldera industrialC c, BCmo se denominan las aguas que pro!ocan los incon!enientes anteriormente mencionadosC BE las que no los pro!ocanC
4 B( IDE"TI)ICACI#" DE LA /RI"CI/ALE E /ECIE &UI$ICA CO")IERE" DUREZA AL AGUA *Test de la +lucin Ja,+n+sa( &UE
#n cuatro tubos de ensa%o colocar aproAimadamente > cm de altura de las siguientes soluciones acuosas: cloruro de sodio( sulfato de sodio( cloruro de calcio % sulfato de magnesio. 9dicionar luego( a cada uno de ellos( <= gotas de Solucin Jabonosa( tapar % agitar. 1bser!ar. CUE TIO"ARIO a, Con lo obser!ado completar el siguiente cuadro: Sal disuelta Catin 9nin 5ormacin de turbidez blanquecinaFF 5ormacin de espuma FF 4
FF #n caso afirmati!o indicar con el signo m&s +G,( en caso negati!o indicar con el signo menos +$, 4 #l resultado de la formacin de espuma ser& C13H9R97I"1. #sto es en caso de muc'a formacin de espuma +G, en caso contrario( poca formacin de espuma +$,. b, Sobre la base de la tabla anterior % a lo respondido en 9, +agua como medio de limpieza, indicar qu tubos de ensa%o se pueden asociar a un agua dura % cu&les son las principales especies qumicas causantes de la dureza del agua. c, Sabiendo que la Solucin Jabonosa es una solucin acuosa de estearato de sodio +:aC/>+C/0,<IC11, escribir una ecuacin qumica que eAplique la formacin de turbidez. d, #Aplicar bre!emente la accin de limpieza e*ercida por la solucin *abonosa. BHor qu se dice que un agua dura -corta el *abn.C C( CLA I)ICACI#" DE U" AGUA DURA EG0" U ORIGE" 9gua dura Carbonatada % :o Carbonata Da presencia de determinadas sales disueltas en el seno de una corriente acuosa depende b&sicamente de la composicin del terreno por donde flu%e la !ena lquida % de la correspondiente solubilidad de las sustancias presentes. 9 modo de e*emplo se usan datos de sales de calcio
5 CUE TIO"ARIO a, #scribir equilibrios qumicos que refle*en la solubilidad de las siguientes sustancias: carbonato de calcio % sulfato de calcio en agua pura % carbonato de calcio en agua conteniendo diAido de carbono. b, 7eniendo en cuenta los siguientes datos de solubilidad en el rango 0J K >= LC( indicar ba*o que forma se solubilizan preferentemente las sales mencionadas. #n agua pura +g de sal?<==mD de agua,: S carbonato de calcio ; <(@= <=$> S sulfato de calcio ; 0=M <=$> #n agua m&s C10 +g de sal?<== mD de agua G C10,: S carbonato de calcio ; <>= <=$> c, Sobre la base de la respuesta del tem anterior indicar qu se entiende por un agua dura Carbonatada % una :o Carbonatada. d, )escribir bre!emente cmo se formaran estos tipos de dureza en la naturaleza. #fectuar un dibu*o simple. e, Qu accin e*ercer& el aporte de calor sobre un agua dura Carbonatada % sobre una agua dura :o CarbonatadaC B9 partir de esta respuesta cmo se puede subclasificar un agua duraC f, BCu&l de los equilibrios qumicos escritos en a, eAplica el fenmeno de la naturaleza que se obser!a en la fotografa siguienteC. #fectuar un comentario bre!e sobre el mismo
D( CUA"TI)ICACI#" DE LA DUREZA TOTAL *Ca1!2 $312( Da titulacin de la dureza total mediante la t cnica del !ersenato disdico es una de las posibles maneras de determinar la dureza con*unta de calcio % magnesio +de aqu en m&s 30G,. Da misma se lle!a a cabo a p/ ; <= lo que asegura colores definidos % un cambio ntido de los mismos en el punto final de la titulacin. #n este caso del color ro*o !inoso al color azul.
6 9gente titulante: "ersenato disdico +:a0/0"er, +comercializado como #)79, 9gente titulado: 9gua de la canilla Indicador: :egro de #ricromo 7 +:#7, Solucin reguladora de p/ ; <= +:/>?:/@Cl, Cuando se agrega la solucin reguladora % el indicador a una muestra de agua con dureza de calcio % magnesio el sistema se torna de color ro*o !inoso el cual se eAplica por la formacin de la especie qumica N3+:#7,O 0G +donde 3 ; 3g0G,. )urante la titulacin el !ersenato disdico reacciona con los iones calcio % luego lo 'ace con los iones magnesio que se encuentran ba*o la forma N3+:#7,O 0G2 en el punto final se tiene entonces: N3+:#7,O0G G Ro*o !inoso /0"er0$ N3+/0"er,O G :#7 azul
Como se puede !er en la ecuacin anterior la reaccin es( no solo equi!alente a equi!alente +como toda reaccin qumica,( sino tambi n por su estequiometra mol a mol. #n el punto de equi!alencia puede plantearse entonces: n "ersenato disdico ; n 30G donde n ; nmero de moles 9qu 30G representa la suma de iones calcio m&s magnesio. Da eApresin anterior puede reescribirse en t rminos de molaridades % !olmenes como: 3 "ersenato disdico " "ersenato disdico ; 7 cnica 1peratoria Cargar una bureta con solucin de !ersenato disdico <= $> 3 +#)79,. #nrasar. Hor otro lado( colocar en un erlenme%er 0= mD medidos con a%uda de una bolpipeta a los cuales se adicionan 0= mD de agua desmineralizada % 0 gotas de solucin de &cido clor'drico +/Cl, al J=P masa?!olumen( se agita % se lle!a a ebullicin por J segundos. Se de*a que el sistema tome temperatura ambiente. 9dicionar luego 0= gotas de solucin reguladora de p/ ; <= % @ gotas de indicador :#7( agitar sua!emente % proceder a titular 'asta obser!ar el !ira*e de color ro*o$ !inoso a color azul. Deer el !olumen de !ersenato disdico gastado +#)79,. CUE TIO"ARIO a, Calcular la dureza total del agua de la canilla eApresando el resultado en molaridad( ppm % L5 3 30G " muestra de agua
E( ELI$I"ACI#" &U'$ICA DE LA DUREZA DEL AGUA 3 todo de la CalKSosa #n este m todo se elimina la dureza del agua usando como reacti!os qumicos 'idrAido de calcio +cal apagada, % carbonado de sodio +Soda Sosa, CUE TIO"ARIO a, #scribir ecuaciones qumicas que refle*en la accin de cada reacti!o empleado en el m todo. b, BSobre qu tipo de dureza acta cada uno de ellosC 3 todo de la Resina de Intercambio Inico #Aisten sustancias qumicas capaces de intercambiar iones +cationes o aniones, con el medio lquido circundante. #l -alma. de estos intercambiadores de iones es una estructura org&nica que cuenta con puntos acti!os +-iones., que son los encargados de efectuar el intercambio. 9lgunos e*emplos se pueden formular simblicamente como: /R( :aR( R1/( +donde R es la estructura org&nica % /( :a % 1/ se pueden liberar como /G( :aG % 1/$ atrapando la resina los cationes o aniones del medio lquido eAterno,. CUE TIO"ARIO a, #scribir una ecuacin qumica que refle*e la eliminacin de 3 0G +donde 30G ; Ca0G o 3g0G, si se usara una resina del tipo :aR. b, 9dem&s de producir agua blanda por este medio( eAplicar( cmo usando alguna combinacin de este tipo de resinas se puede obtener agua desmineralizada. c, Comentar bre!emente !enta*as % des!enta*as de los m todos mencionados. BIBLIOGRA)IA =< Qumica General Reactividad Qumica. Compuestos Inorgnicos y Orgnicos. R. /. Hetrucci( Q. S. /arRood( 5. 6. /errin' Sa #d "ol II Hrentice /all 0==0 =0 Quimica Inorgnica. Introduccin a la qumica de coordinacin, del estado slido y descriptiva 6len # Rodgers 3c 6raR$/ill( <MMJ => Qumica Ra%mond C'ang @ta #d +Hrimera en espaTol, 3c 6raR$/ill( <MM0
=@ Qumica General U. Q. Q'itten( U. ). 6aile% 3c6raR /ill <MSM =J Gua de Tra a!o de "a oratorio# Tema $% & 'gua()eterminacin de la )ure*a y 'lcalinidad 1. )elgado( 3 Castiglioni Vni!ersidad 7ecnolgica :acional$Regional Santa 5e( 0==> =I Guas de Tra a!os de "a oratorio. +aterial didctico ela orado en el marco del proyecto C'I ,) -.nse/an*a .0perimental de Qumica Inorgnica# $iveles +edio, 1uperior y 1uperior 'plicado2 Hablo DW9rgentiere( )omingo Diprandi( 1rlando Rein'eimer( Jos Haredes 5acultad de Ingeniera Qumica$ Vni!ersidad :acional del Ditoral( <MMI
Anda mungkin juga menyukai
- 11 - Procedimiento para Instalación de Water StopDokumen8 halaman11 - Procedimiento para Instalación de Water Stopstintaya10% (1)
- Biess Presupuesto Cronograma y Flujo ValoradoDokumen6 halamanBiess Presupuesto Cronograma y Flujo ValoradoJessica Alomoto100% (4)
- Voladura I: Explosivos y sus propiedadesDokumen57 halamanVoladura I: Explosivos y sus propiedadesJuan Carlos Berrocal CuleBelum ada peringkat
- Gavion Caja 10x12 PBZ 2.7x3.4Dokumen6 halamanGavion Caja 10x12 PBZ 2.7x3.4Jaime ReyesBelum ada peringkat
- Libro AutomotoresDokumen88 halamanLibro AutomotoresMarcela Villalba100% (1)
- Concepciones de Desarrollo y Aprendizaje para Una Educación CientificaDokumen8 halamanConcepciones de Desarrollo y Aprendizaje para Una Educación CientificaNathalia Alvarez OrtizBelum ada peringkat
- Taller Ciencia Integrada IDokumen4 halamanTaller Ciencia Integrada INathalia Alvarez OrtizBelum ada peringkat
- Características de La QuímicaDokumen1 halamanCaracterísticas de La QuímicaNathalia Alvarez OrtizBelum ada peringkat
- Reflexion T PackDokumen2 halamanReflexion T PackNathalia Alvarez OrtizBelum ada peringkat
- Obtencion de Acetileno y Propiedades de Alquinos y Alcanos 1Dokumen5 halamanObtencion de Acetileno y Propiedades de Alquinos y Alcanos 1Nathalia Alvarez OrtizBelum ada peringkat
- PETSDokumen13 halamanPETSGrecia Dayana Ponce ChavezBelum ada peringkat
- Mod I Gestión MineraDokumen50 halamanMod I Gestión MineraReymOnd BeCerra CabreraBelum ada peringkat
- Laboratorio Química General - Práctica #4Dokumen3 halamanLaboratorio Química General - Práctica #4Freddy AbarulloBelum ada peringkat
- Geometria MolecularDokumen2 halamanGeometria MolecularHéctor A. SaldivarBelum ada peringkat
- HOJA DE SEGURIDAD. Anti Incrustante Osmosis InversaDokumen6 halamanHOJA DE SEGURIDAD. Anti Incrustante Osmosis InversaAlejandro MoralesBelum ada peringkat
- Oxisales: Sales formadas por metales y ácidos oxoDokumen2 halamanOxisales: Sales formadas por metales y ácidos oxoajrespinaBelum ada peringkat
- Tubería de rebose con detalles constructivosDokumen1 halamanTubería de rebose con detalles constructivosmoreno chinchayBelum ada peringkat
- Tipos de BateriasDokumen8 halamanTipos de BateriasJamy AntonioBelum ada peringkat
- Unidad 1 Tecnologia ElectricaDokumen10 halamanUnidad 1 Tecnologia ElectricaYork OcantoBelum ada peringkat
- ELECTROGRAVIMETRIA-CULOMBIMETRIADokumen15 halamanELECTROGRAVIMETRIA-CULOMBIMETRIACristian DiazBelum ada peringkat
- PT Bob SignedDokumen2 halamanPT Bob SignedEdison TequizBelum ada peringkat
- Efecto de Las Fibras de Polipropileno para ConcretosDokumen151 halamanEfecto de Las Fibras de Polipropileno para ConcretosLuis Ricardo Ramirez ChavezBelum ada peringkat
- Mapa Conceptual Aleaciones 3Dokumen1 halamanMapa Conceptual Aleaciones 3api-560164281100% (1)
- Fluidos de PerforacionDokumen9 halamanFluidos de Perforacionkeiner fernandezBelum ada peringkat
- Tema 1.1 - Química - Mapa ConceptualDokumen1 halamanTema 1.1 - Química - Mapa ConceptualAngelica OlivaresBelum ada peringkat
- Triptico Del ResicladoDokumen2 halamanTriptico Del Resicladoanon_559754Belum ada peringkat
- E.mai 502 0204Dokumen13 halamanE.mai 502 0204RESIDENTE CALIDAD CAÑO SURBelum ada peringkat
- Geología MineraDokumen21 halamanGeología MineraEber Samuel ChBelum ada peringkat
- Guia 3 AnalisisDokumen4 halamanGuia 3 AnalisisMaria VargasBelum ada peringkat
- Cotizacion PolicarbonatoDokumen1 halamanCotizacion PolicarbonatoRoberto Churqui AquinoBelum ada peringkat
- Yellow GreaseDokumen8 halamanYellow GreasealvaroBelum ada peringkat
- Cuestionario Previo El Ciclo Del Sulfato de Cobre PentahidratadoDokumen2 halamanCuestionario Previo El Ciclo Del Sulfato de Cobre PentahidratadoLaura Marquez100% (1)
- Triptico Aiees TextilDokumen2 halamanTriptico Aiees TextilSheyeneLeonBelum ada peringkat
- RehervidoresDokumen38 halamanRehervidoresmnbcc MartinezBelum ada peringkat
- Equipos para MetalmecanicaDokumen20 halamanEquipos para MetalmecanicaRonald Ismael Guzman OchoaBelum ada peringkat