Interações atômicas e moleculares
Diunggah oleh
Fernando Freitas AlvesJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Interações atômicas e moleculares
Diunggah oleh
Fernando Freitas AlvesHak Cipta:
Format Tersedia
BC0104: Int.
Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
1.
Use a teoria de ligao de valncia para sugerir o ngulo de enlace na molcula da gua (2 ). Determine o momento de dipolo esperado considerando o ngulo obtido. De acordo com a teoria de ligao de valncia, uma ligao intermolecular se d pela sobreposio dos orbitais atmicos de menor energia (valncia) de cada tomo. Nessa sobreposio, dois eltrons de cada tomo ocupam parte do mesmo espao de seus orbitais com spins opostos. Em uma molcula de gua, o tomo de oxignio possui dois orbitais degenerados de
1 1 menor energia semipreenchidos: 2 e 2 ; em sua configurao eletrnica completa: 2 1 2 2 2 2 . Esses dois orbitais possuem, cada um, um eltron. Eles podem se
sobrepor sobre outros orbitais contendo um eltron cada de forma que fiquem desemparelhados (spins opostos), formando ento um aglomerado energtico nico de menor energia potencial que d forma molcula. Na molcula de gua, esses outros orbitais vm dos tomos de hidrognio. Cada um possuindo um orbital 11 de um nico eltron que ocupar uma posio de superposio em cada um dos orbitais da molcula de oxignio descritos. Esses orbitais 2 e 2 possuem uma simetria com 2 de forma que cada um ocupe um eixo tridimensional espacial para que estejam o mais distantes uns dos outros. Essa disposio faz com que cada orbital 2 possua 90 de angulao entre si.
1 Dessa forma, como o orbital 2 do tomo de oxignio se sobrepusera com o orbital 1 11 de um dos tomos de hidrognio enquanto o outro orbital 2 do tomo de oxignio
se sobrepusera com o orbital 11 do outro tomo de hidrognio, a angulao entre os tomos de hidrognio ser de 90. Logo, o momento de dipolo pode ser calculado por: 2 cos(90/2) 2 | | 2 (3,5 2,2) 1,8
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 1/22
BC0104: Int. Atmicas e Moleculares 2.
UFABC
Resoluo da Lista 04 (Geral) v0.20
A configurao do estado fundamental do tomo de carbono ( ) sugere que este tomo seria capaz de formar somente duas ligaes pela teoria de ligao de valncia. Contudo, o carbono tetravalente, como no caso da molcula de metano 4 . Explique como isso possvel (a tetravalncia do carbono)? A capacidade do carbono formar quatro ligaes explicada pela teoria da hibridizao. Nela, os orbitais de valncias 2 se sobrepe com o orbital de energia promovida 2 formando quatro orbitais hbridos degenerados que sero preenchidos pelas ligaes tetravalentes do carbono.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 2/22
BC0104: Int. Atmicas e Moleculares 3.
UFABC
Resoluo da Lista 04 (Geral) v0.20
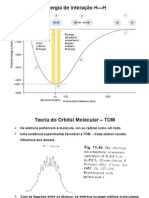
Usando a teoria do orbital molecular, explique por que observado o fenmeno mostrado na figura abaixo, ou seja, por que o nitrognio (2 ) lquido no sente o efeito do campo magntico e por que o oxignio (2 ) liquefeito afetado pelo campo magntico. Se a + mesma experincia fosse realizada com o on de nitrognio (2 ), o que voc esperaria que ocorresse? Explique sua resposta.
2 lquido S N S N
2 lquido
(a) ims
(b)
O efeito acontece devido a orientao magntica dos eltrons que preenchem parcialmente os orbitais de valncia. Como os orbitais de menor energia da molcula de 2 no esto totalmente preenchidos, seus eltrons degenerados que as preenchem parcialmente esto com seus spins no desemparelhados, fazendo com que, ao passar pelo campo eletromagntico do im, sejam realinhados em sua direo forando uma interligao dipolo induzido - dipolo induzido. O mesmo pode se esperar da molcula de
+ 2 , onde a fala de um eltron deixa uma um orbital semipreenchido. J a molcula de 2
possui todos os seus orbitais totalmente preenchidos. Logo, todos os seus eltrons possuem spins desemparelhados, o que faz com que a molcula no seja interferida pela campo eletromagntico.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 3/22
BC0104: Int. Atmicas e Moleculares 4.
UFABC
Resoluo da Lista 04 (Geral) v0.20
Identifique a ordem de ligao e coloque em ordem crescente de comprimento de ligao + 2 as seguintes espcies: 2 , 2 , 2 , 2 . Quanto maior a ordem de ligao entre dois tomos, maior a fora entre estes tomos. Assim, maior ser a sua energia de dissociao e menor ser o seu comprimento da ligao. Logo, basta calcular a ordem de ligao entre os dois tomos para estipular o comprimento da ligao. Uma ordem ligao com coeficiente dada por 1 = ( ) , 2 onde a quantidade de orbitais ligantes e antiligantes presentes na ligao. Sabendo que e so orbitais ligantes enquanto que e so orbitais antiligantes (rapidamente visto pela quantidade de ns presentes no orbital molecular)
ligante
antiligante
temos que, em ordem crescente de comprimento de ligao: 1 + 2 2 4 2 1 2 1 1 1 2 1 = [(2 + 4 + 2) (2 + 1)] = 2,5 2 1 2 2 4 2 2 2 1 1 1 2 1 = [(2 + 4 + 2) (2 + 2)] = 2 2 1 2 2 4 2 3 2 1 1 1 2 1 = [(2 + 4 + 2) (2 + 3)] = 1,5 2 1 2 2 2 4 2 4 2 1 1 1 2 1 = [(2 + 4 + 2) (2 + 4)] = 1 2 Fernando Freitas Alves fernando.freitas@aluno.ufabc.edu.br 23/06/13 pg. 4/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
5.
Duas molculas diatmicas que so importantes para o bem-estar da humanidade so o e o 2 ; a primeira um poluente e um neurotransmissor, e a ltima fonte de nitrognio das protenas e de outras biomolculas. Use as configuraes de e do 2 para prever qual destas molculas provvel que tenha o comprimento de ligao menor. Argumente a sua resposta.
2 2 4 2 1 A molcula de possui uma configurao 1 1 1 2 1 com uma ordem de
ligao: 1 1 = ( ) = [(2 + 4 + 2) (2 + 1)] = 2,5 2 2 Uma ordem de ligao 2,5 corresponde a uma ligao entre dupla e tripla.
2 2 4 2 Por outro lado, a molcula de 2 possui uma configurao 1 1 1 2 com uma
ordem de ligao: 1 1 2 = ( ) = [(2 + 4 + 2) 2] = 3 2 2 Uma ordem de ligao 3 corresponde a uma ligao tripla. Logo, como sabemos que quanto maior a ordem de ligao entre dois tomos, maior a fora entre estes tomos. Temos que, quanto maior ser a sua energia de dissociao e consequentemente menor ser o seu comprimento da ligao. Portanto, a molcula de 2 possui um comprimento de ligao menor que a molcula de .
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 5/22
BC0104: Int. Atmicas e Moleculares 6.
UFABC
Resoluo da Lista 04 (Geral) v0.20
Derive o limite assinttico da interao dipolo-dipolo e carga-dipolo. Escolha uma orientao conveniente. Dada a disposio de uma interao carga-dipolo:
tomando uma orientao entre as molculas onde = 0, temos:
= [
(+1 )(+2 ) (1 )(+2 ) ]+[ ] 40 ( + /2) 40 ( /2) 1 2 1 1 ( ) 40 + /2 /2
= =
1 2 1 1 ( ) 40 1 + /2 1 /2
Quando , temos que = /2 1. Com a expanso de Taylor em = 0: 1 () (0) ( ) = 1 + 2 + = 1 + !
=0
Mas 1 implica que 0 quando > 1. Assim, por aproximao: 1 1 1 1 2 [(1 ) (1 + )] 40 2 2 1 2 ( ) 40 (1 )2 40 2 1 2 40 2
Como a definio de momento de dipolo = 1 , terminamos com: () Nos limites assintticos, temos: = 0 () 0 2 lim 2 = () 0 lim Fernando Freitas Alves fernando.freitas@aluno.ufabc.edu.br 23/06/13 pg. 6/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
Dada a disposio de uma interao dipolo-dipolo:
analogamente, tomando a mesma orientao entre as molculas onde = 0, temos: = [ +[ (+1 )(+2 ) (1 )(+2 ) ]+[ ] 40 ( + 1 /2 2 /2) 40 ( 1 /2 2 /2)
(+1 )(2 ) (1 )(2 ) ]+[ ] 40 ( + 1 /2 + 2 /2) 40 ( 1 /2 + 2 /2) 1 2 1 2 1 2 1 2 ][ ][ ]+[ ] 40 40 ( ) 40 ( + ) 40 = 1 2 1 1 ( + 2) 40 1 / 1 + / 21 2 1 ( 1) 40 1 2 / 2
Quando 1 2 , temos: = [
Quando , temos que = 2 / 2 1. Com a expanso de Taylor em = 0: 1 2 1 + 1 2 / 2 2 () () 21 2 2 ( ) 40 2
2(1 )(2 ) 40 3 21 2 40 3
() Nos limites assintticos, temos:
= 0 () 0 3 lim = () 0 3 lim
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 7/22
BC0104: Int. Atmicas e Moleculares 7.
UFABC
Resoluo da Lista 04 (Geral) v0.20
O potencial de Lennard-Jones para energia de interao entre dois tomos dado por: () = + 12 6
nde e so constantes e a distncia entre os tomos. Determine a distncia de equilbrio (mnimo de energia) entre os tomos (0 ). Minimizando a funo, temos: () = 6 ( 7 ) 12 ( 13 ) = 0
6 2 0 =
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 8/22
BC0104: Int. Atmicas e Moleculares 8.
UFABC
Resoluo da Lista 04 (Geral) v0.20
Explique como o momento de dipolo permanente e a polarizabilidade de uma molcula surgem e explique como eles dependem da estrutura da molcula. Apresente exemplos para ilustrar sua explicao. Em uma molcula heteronuclear, percebe-se a diferena de eletronegatividade entre os tomos formando um momento de dipolo permanente, j que na maioria dos casos os orbitais (e ento os eltrons) estaro em uma regio mais prxima ao elemento mais eletronegativo. Desse modo, ocorrer a polarizabilidade da molcula, como ocorre, por exemplo, com HF:
onde a densidade de carga (eltron) estaro mais primas ao tomo de flor. As molculas interagiro na forma:
Porm, mesmo para molculas heteronucleares, quando h uma grande simetria, o momento de dipolo pode ser nulo. Por exemplo, a configurao cis polar e a trans apolar:
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 9/22
BC0104: Int. Atmicas e Moleculares 9.
UFABC
Resoluo da Lista 04 (Geral) v0.20
Para encontrarmos a polarizao de uma amostra, temos que calcular a mdia trmica das orientaes dos momentos de dipolo da mesma. Escreva e justifique a expresso que temos que calcular para alcanar nosso objetivo. Se considerarmos a interao entre molculas polares movendo-se em um fludo termodinmico, ao efetuarmos todos os clculos relativos a todas as orientaes de igual probabilidade possveis, s orientaes favorveis e no-favorveis e mdia de interao sendo zero, chegaremos seguinte expresso de energia potencial entre duas molculas: () =
2 2 21 = 6, 2 6 3(40 )
assim como esperado por uma interao de Van der Waals, que onde devemos chegar.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 10/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
10. Discuta se as seguintes molculas so polares ou apolares. Em caso de serem polares, determine o momento de dipolo eltrico (vetor) associado a cada molcula. (a) 2 (b) 3 (a) 2 : gua possui orbitais que, por simetria para manter a energia mnima (c) 2 (d) (e) 4
do sistema, sua geometria possui momento de dipolo como mostra a figura abaixo:
(b) 3 : Amonaco possui geometria similar gua, mas dessa vez os trs orbitais
so sobrepostos pelos orbitais dos hidrognios. Seu momento de dipolo segue como na figura abaixo:
(c) 2 : Dixido de carbono possui uma simetria de tal forma que o momento de dipolo resultante nulo.
(d) : Monofluoreto de cloro possui momento de dipolo de acordo com a
eletronegatividade dos tomos. Pelo flor ser mais eletronegativo que o cloro, o momento de dipolo segue como na imagem abaixo:
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 11/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
(e) 4 : Tetracloreto de carbono possui simetria de um tetraedro. Como todos os tomos so iguais, possuem mesma eletronegatividade e portanto seu momento de dipolo resultante nulo.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 12/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
11. Calcule a energia molar necessria para inverter a posio de uma molcula de agua localizada a: (a) 150 de um on de + (b) 350 de um on de + Considere o momento de dipolo da gua como 1,85 . Pela equao de interaes de momento de dipolo: ( 1) = (a) Logo, para = 150 , temos: (1,85 3,336 1030 ) (2 1,602 1019 ) cos 180 (6,022 1023 ) 4 8,854 1012 (150 1012 )2
1 476
1 2 cos 40 2
(b) E, para = 350 , temos: 150 1012 = ) ( 350 1012 = 87,4 1
2
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 13/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
12. Um estudante pretende fazer uma soluo usando um solvente polar. Ele tem a disposio dois solventes: metanol (3 ) e tolueno (6 5 3 ). Qual deles voc escolheria? Justifique a sua resposta.
Metanol
Tolueno
A melhor escolha o metanol, pois ele uma molcula dipolo-permanente enquanto que a carga residual do tolueno nula dada pela simetria das ligaes. Logo, o metanol atuar como um solvente polar mais eficaz, uma vez que as foras de interao dos dipolos-permanentes presentes em tal soluo seriam mais fortes s foras de interao presentes nas molculas apolares de uma soluo de tolueno, que so chamadas de foras de Van der Walls, conhecidas pela sua baixa intensidade onde apresenta momentos de dipolo eltrico instantneos e temporrios.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 14/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
13. D exemplos de sistemas soluto-solvente que interagem via carga-dipolo, dipolo-dipolo, dipolo dipolo induzido, dipolo induzido dipolo induzido. Em que situao voc espera uma alta solubilidade Carga-dipolo: gua (2 ) + sal (como ) e qualquer tipo de solvatao, onde est presente a alta solubilidade devido interao intensa. Dipolo-dipolo: gua (2 ) + sacarose (12 22 11 ). Dipolo dipolo induzido: gua (2 ) + iodeto (2 ). Dipolo induzido dipolo induzido: substncias apolares, como 2 , 2 , 2 , 4 , etc.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 15/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
14. Descreva a formao de uma ligao de hidrognio em termos de: (a) interaes eletrostticas e (b) orbitais moleculares. Como voc identificaria o melhor modelo? (a) Quando um tomo de hidrognio faz uma ligao intramolecular, a molcula tente a obter uma carga parcial eletrnica positiva naquele ponto (caso o momento de dipolo no a anule). Dessa forma, quando um tomo eletronicamente negativo se aproxima da parte polarizada positivamente da molcula pelo tomo de hidrognio, uma ligao se forma devido atrao eletroesttica da diferena de carga existente.
(b) Quando um tomo de hidrognio faz uma ligao intramolecular com um tomo , os eltrons dos orbitais de valncia de ambos os tomos se sobrepe parcialmente (de acordo com a teoria do orbital de valncia). Quando outro tomo se aproxima do hidrognio, seus orbitais tambm se sobrepe parcialmente. Logo, os estados de energia possveis dessa ligao contm estados ligantes, antiligantes e quaseantiligantes, de forma que a ligao se formar apenas se o estado quase-antiligante estiver h uma diferena favorvel de energia do estado antiligante, pois no estado quase-antiligante no h ligao entre os tomos e . Esse tipo de ligao pode acontecer, a priori, com qualquer tomo . No entanto, apenas tomos como flor, oxignio, nitrognio e, em alguns casos, enxofre (conhecidos como o grupo ) possuem essa diferena de energia suficiente entre os estados quase-antiligante e antiligante.
O melhor modelo uma unio dos dois descritos de tal forma que a carncia do primeiro em indicar quais tomos poderiam interagir desta forma e a carncia do segundo em indicar qual carga poderia formar a ligao so suprimidas por cada um.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 16/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
15. D exemplos de sistemas que interagem majoritariamente por interaes de disperso e por pontes de hidrognio. Considere uma estrutura modelo de DNA. Indique os locais em que temos majoritariamente interaes de disperso, carga-solvente, ligaes de hidrognio. Polmeros e protenas geralmente se interligam por interaes de disperso devido s suas grandes cadeias que muitas vezes so apolares. Como essas cadeias polimricas possuem muitos tomos de hidrognio, algumas ligaes intermoleculares se do por pontes de hidrognio quando interagem com tomos muito eletronegativos. Uma estrutura modelo de DNA formada por uma base nitrogenada se liga com uma pentose e um grupo fosfato, formando uma desoxirribose. Ligaes de hidrognio se do entre as bases nitrogenadas, interligando os tomos de nitrognio com os tomos de hidrognio de ambas as bases correspondentes. Esse emparelhamento d ao conjunto o carter helicoidal do DNA. Como o DNA formado por diversas desoxirribose interligadas por interaes carga-solvente, sua estrutura se torna em cadeias muito longas. Como h um movimento espacial da estrutura, essa cadeia acaba interagindo com ela mesma atravs de foras de disperso, criando um enovelamento da estrutura que d forma, em grande escala, outras estruturas, como demonstrado na figura abaixo. Interaes do tipo carga-solvente acontece no meio em que o DNA est imerso.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 17/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
16. A polarizabilidade por volume da gua de 1,48 1024 3. Calcule o momento de dipolo induzido nesta molcula quando aplicamos um campo de 1 /1 . Pela definio de momento de dipolo sob um campo eletromagntico, temos: , = o vetor do campo eltrico local. onde a polarizabilidade molecular e Tambm podemos utilizar a relao entre polarizabilidade molecular e polarizabilidade molecular por volume , onde: = 40 Logo, temos: = 40 , = 4 8,85 1012 1,48 1024 (102 )3 = 1,65 1035 = 4,93 106 1 103 102
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 18/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
17. Explique o efeito hidrofbico e discuta as suas ocorrncias. D pelo menos um exemplo que pode ser observado no dia-a-dia. Quando molculas apolares (com momento de dipolo nulo) so imersas em um sistema de molculas polares (com momento de dipolo no nulo), no h interaes interatmicas suficientes para torn-las miscveis. As nicas interaes que acontecem entre essas molculas so interaes fracas. Logo, mais vivel energeticamente ao sistema que essas molculas apolares tenham averso s outras polares, como gua. A este efeito denominamos de hidrofbico. Um exemplo deste efeito que podemos tomar no cotidiano a imiscibilidade da maioria dos compostos orgnicos, como leo, em gua.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 19/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
18. Mostre que a interao mdia entre molculas de dimetro interagindo via a forma 6 / 6 dado por
2 2 6 3 3
, onde o volume onde a molcula esta confinada. Mostre
como podemos relacionar a partir da equao de o parmetro de e o 6 da expresso acima (dica, use ( ) =
2 2
, onde o nmero de mols do gs).
19. Que interaes moleculares contribuem para a formao, estabilidade trmica e resistncia mecnica de um material polimrico? Todas as foras de interao fracas esto envolvidas em um polmero. Dente elas destaca-se a interao dipolo-dipolo para pequenas partes das cadeias de muitos polmeros. J que muitos so formados por cadeias grandes, predomina as foras de London ou curtos momentos de dipolo induzido em pores da cadeia e foras de disperso, onde se tornam fortes devido ao tamanho geralmente grande das molculas do polmero. No entanto, muitos polmeros tambm possuem interaes intermoleculares que se do por ligaes de hidrognio devido grande quantidade de tomos de hidrognio e oxignio geralmente presentes, principalmente quando esto em soluo.
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 20/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
20. Em um experimento para a determinao da tenso superficial do metanol ( = 791 3 a 298 ) verificou-se que ele acendeu a uma altura de 5,8 em um tubo de dimetro interno igual a 0,20 . Qual a tenso superficial a temperatura de 298 ? De acordo com a equao de Laplace: = + pela figura abaixo: 2
temos que: = = 2 2
1 = 2 = 1 0,20 103 791 9,98 5,8 102 2 2 = 2,29 102 1
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 21/22
BC0104: Int. Atmicas e Moleculares
UFABC
Resoluo da Lista 04 (Geral) v0.20
21. Com base nos modelos de interao molecular, explique o conceito de viscosidade e d exemplos. O modelo de viscosidade explica que materiais muito viscosos possuem uma interao intermolecular forte com entropia de sistema baixa, enquanto materiais com pouca viscosidade ou nenhuma teria interaes intermoleculares fracas com entropia de sistema alta. Logo, o comportamento de arrasto sobre camadas desses materiais esto diretamente ligados com a interao e a energia entre as molculas do sistema. Materiais como os polimricos, por exemplo, que possuem grandes cadeias formando grandes molculas acabam tendo uma grande interao entre si (em grande parte, interaes de disperso).
Fernando Freitas Alves
fernando.freitas@aluno.ufabc.edu.br
23/06/13 pg. 22/22
Anda mungkin juga menyukai
- Aprendendo a mecânica quântica: equação de Schrödinger em 1DDari EverandAprendendo a mecânica quântica: equação de Schrödinger em 1DBelum ada peringkat
- Quatro Temperamentos Antroposofia SteinerDokumen172 halamanQuatro Temperamentos Antroposofia SteinerJuarez De Fausto Prestupa100% (3)
- NBR 12216 92 - Projeto de Estação de Tratamento de Água paraDokumen18 halamanNBR 12216 92 - Projeto de Estação de Tratamento de Água paraMarcos Vinicius Dell'Armelina100% (1)
- NBR 14300Dokumen3 halamanNBR 14300Alex GobbatoBelum ada peringkat
- Tecnologia CRFS da Brasilit: uma alternativa segura ao amianto em telhasDokumen20 halamanTecnologia CRFS da Brasilit: uma alternativa segura ao amianto em telhasAdriano Almeida50% (2)
- Entendendo B+ e C+Dokumen6 halamanEntendendo B+ e C+bigdrsmithBelum ada peringkat
- Exercícios de fluxo de solo e barragensDokumen5 halamanExercícios de fluxo de solo e barragensDouglas Alves100% (1)
- Quimica Geral Exercicios Resolvidos Ligacoes Quimicas PDFDokumen16 halamanQuimica Geral Exercicios Resolvidos Ligacoes Quimicas PDFamydylanBelum ada peringkat
- ResoluçõesDokumen6 halamanResoluçõesfrançan_2100% (1)
- Análise Combinatória (Revisão)Dokumen3 halamanAnálise Combinatória (Revisão)georgechrist100% (1)
- Protetores SolaresDokumen15 halamanProtetores SolaresEduardo Santos100% (1)
- CVTDokumen196 halamanCVTAnonymous tydWh360% (5)
- Planilha de Estudo de R&RDokumen14 halamanPlanilha de Estudo de R&RErlon PereiraBelum ada peringkat
- AtividadeDokumen4 halamanAtividadeEmanoel Frazão100% (4)
- Espectro Eletronico MolecularDokumen65 halamanEspectro Eletronico MolecularAnaCarolinaLongoni0% (1)
- Aula 4 de Introdução À Física Atômica e Molecular - Átomo de HélioDokumen14 halamanAula 4 de Introdução À Física Atômica e Molecular - Átomo de HélioDanilo Lessa BernardineliBelum ada peringkat
- Ligações Covalentes - TomDokumen64 halamanLigações Covalentes - TomMarcus Vinicius100% (1)
- Apostila - Mecanica Quantica IIDokumen51 halamanApostila - Mecanica Quantica IIIbilcemBelum ada peringkat
- Gabarito AD1 Inorgânica I 2022.1Dokumen4 halamanGabarito AD1 Inorgânica I 2022.1yury ferreiraBelum ada peringkat
- Aula 5 - Ligações Químicas Parte IIDokumen60 halamanAula 5 - Ligações Químicas Parte IIGustavo Carvalho SilvaBelum ada peringkat
- Cap. 2 - Ligações AtômicasDokumen21 halamanCap. 2 - Ligações AtômicasLucas RafaelBelum ada peringkat
- Lista de Exercícios de Química InogânicaDokumen13 halamanLista de Exercícios de Química InogânicaVinicius Gomes PiresBelum ada peringkat
- Teoria da Ligação de Valência em ComplexosDokumen12 halamanTeoria da Ligação de Valência em ComplexosRita DelicBelum ada peringkat
- Lista 01 - Revisão de Física QuânticaDokumen17 halamanLista 01 - Revisão de Física QuânticaGiovanni ScatagliaBelum ada peringkat
- Lista - Números Quânticos e DistribuiçãoDokumen3 halamanLista - Números Quânticos e DistribuiçãoMauricio TorresBelum ada peringkat
- QUI102 Ex 01 Lucas Paceli Cap1 2 3 4Dokumen26 halamanQUI102 Ex 01 Lucas Paceli Cap1 2 3 4Lucas PaceliBelum ada peringkat
- Físico-Química I 1º Ano 1º Semestre: Aula T4Dokumen37 halamanFísico-Química I 1º Ano 1º Semestre: Aula T4Susan CuevaBelum ada peringkat
- Análise da cor de carotenóidesDokumen13 halamanAnálise da cor de carotenóidesStefânya de Paula FreitasBelum ada peringkat
- Un02-Ligacoes-v4.2 EADDokumen70 halamanUn02-Ligacoes-v4.2 EADHugo Caetano CostaBelum ada peringkat
- eletroquimica-finalDokumen50 halamaneletroquimica-finalJoao Victor de Mello Marinho AmaralBelum ada peringkat
- Distribuição Eletrônica (PDF - Io)Dokumen13 halamanDistribuição Eletrônica (PDF - Io)Eduarda De Oliveira MorenoBelum ada peringkat
- Revisão sobre tabela periódica e números quânticosDokumen5 halamanRevisão sobre tabela periódica e números quânticosVictor MirandaBelum ada peringkat
- QG LEC 2022 - 23 Aula 1. Estrutura Electrónica Dos ÁtomosDokumen50 halamanQG LEC 2022 - 23 Aula 1. Estrutura Electrónica Dos ÁtomosAdriano BalaiaBelum ada peringkat
- 04-Carga Nuclear Efetiva SlaterDokumen23 halaman04-Carga Nuclear Efetiva SlaterMarianna Duarte100% (1)
- Es CAP1 2020Dokumen20 halamanEs CAP1 2020annonBelum ada peringkat
- Complexos Tetraédricos + Jahn-TellerDokumen2 halamanComplexos Tetraédricos + Jahn-TellerPaula CarolinaBelum ada peringkat
- TOM explica cores de moléculas orgânicasDokumen10 halamanTOM explica cores de moléculas orgânicasromezioh7716Belum ada peringkat
- MSP Aula 2 3Q2023 Estrutura Atômica e Ligações QuímicasDokumen50 halamanMSP Aula 2 3Q2023 Estrutura Atômica e Ligações QuímicasMaicon BatistaBelum ada peringkat
- Relat Rio IX ExpVDokumen10 halamanRelat Rio IX ExpVBruno XavierBelum ada peringkat
- Teoria do Campo Autoconsistente (SCFDokumen17 halamanTeoria do Campo Autoconsistente (SCFBenjamim1990Belum ada peringkat
- Teoria dos orbitais moleculares explica diferença de energia de ligação entre N2 e F2Dokumen11 halamanTeoria dos orbitais moleculares explica diferença de energia de ligação entre N2 e F2Frederico Augusto FloresBelum ada peringkat
- Modelo do gás de elétrons livres em sólidosDokumen39 halamanModelo do gás de elétrons livres em sólidosFernando Henrique PavoniBelum ada peringkat
- Relatório 3 - QI543 - Espectros Eletrônicos de Absorção Na Região Do UV-VisDokumen15 halamanRelatório 3 - QI543 - Espectros Eletrônicos de Absorção Na Região Do UV-VisTalitha OrtizBelum ada peringkat
- Lista 3 com estrutura eletrônica de átomos e reações químicasDokumen6 halamanLista 3 com estrutura eletrônica de átomos e reações químicasVinicius GobiBelum ada peringkat
- RPECV e geometria molecularDokumen43 halamanRPECV e geometria molecularGuilherme RodriguesBelum ada peringkat
- Modelo atômico e distribuição eletrônicaDokumen50 halamanModelo atômico e distribuição eletrônicamatheus mgaBelum ada peringkat
- Ligações Químicas Iônicas e CovalentesDokumen8 halamanLigações Químicas Iônicas e CovalentesPaulo Gombo100% (1)
- Teoria da ligação de valência e hibridização em complexos octaédricosDokumen4 halamanTeoria da ligação de valência e hibridização em complexos octaédricosBruna Giovana LocatelliBelum ada peringkat
- 1-Carga Eletrica e Campo EletricoDokumen14 halaman1-Carga Eletrica e Campo EletricomgteslaBelum ada peringkat
- Aula03 - Ligações QuímicasDokumen39 halamanAula03 - Ligações QuímicastalissaBelum ada peringkat
- Como Obter Os Diagramas Moleculares 2 - CorrigidoDokumen17 halamanComo Obter Os Diagramas Moleculares 2 - CorrigidoAndré LuizBelum ada peringkat
- Interações na Matéria CondensadaDokumen55 halamanInterações na Matéria CondensadaLuciana FariasBelum ada peringkat
- QCoordParte2Dokumen56 halamanQCoordParte2Edjaine Carriel RosaBelum ada peringkat
- Cloreto de HexamincobaltoIIIDokumen13 halamanCloreto de HexamincobaltoIIIYuri GomesBelum ada peringkat
- Aula 02 - Ligações Químicas Nos Complexos de Metais de TransiçãoDokumen56 halamanAula 02 - Ligações Químicas Nos Complexos de Metais de TransiçãoRaiana Canzian Lima100% (2)
- Tópico 9 - Listas e Provas - RevDokumen6 halamanTópico 9 - Listas e Provas - RevJulia GonçalvesBelum ada peringkat
- Atomos PolieletrônicosDokumen8 halamanAtomos PolieletrônicosEraclitoSL100% (1)
- Geometria Molecular e Teoria das LigaçõesDokumen70 halamanGeometria Molecular e Teoria das LigaçõesjnfjjuniorBelum ada peringkat
- Espectros Eletrônicos de NiquelDokumen4 halamanEspectros Eletrônicos de NiquelproftononBelum ada peringkat
- Mecanica QuanticaDokumen8 halamanMecanica QuanticaagrapacanatejugaBelum ada peringkat
- Orbitais Atômicos e MolecularesDokumen42 halamanOrbitais Atômicos e MolecularesRebecaBelum ada peringkat
- IAM Lista 01 Respostas PDFDokumen30 halamanIAM Lista 01 Respostas PDFgilliardBelum ada peringkat
- Curso Técnico em QuímicaDokumen37 halamanCurso Técnico em QuímicaMaycon ContildesBelum ada peringkat
- Trabalho Inorganica1Dokumen12 halamanTrabalho Inorganica1Lorena GuimarãesBelum ada peringkat
- (UFABC) (Fotônica) Formulário P1Dokumen2 halaman(UFABC) (Fotônica) Formulário P1Fernando Freitas AlvesBelum ada peringkat
- FT - 2012 - Roteiro 4 - Calorimetria - Parte 2 - FinalDokumen7 halamanFT - 2012 - Roteiro 4 - Calorimetria - Parte 2 - FinalPaulo Cesar Menegon CastroBelum ada peringkat
- IEEE UFABC Ata Da Reunião (2014-07-17)Dokumen6 halamanIEEE UFABC Ata Da Reunião (2014-07-17)Fernando Freitas AlvesBelum ada peringkat
- (UFABC) (MECFLU) (Damiani) Exercícios Da Aula 03Dokumen5 halaman(UFABC) (MECFLU) (Damiani) Exercícios Da Aula 03Fernando Freitas AlvesBelum ada peringkat
- STL 3D desenvolvimentoDokumen24 halamanSTL 3D desenvolvimentoFernando Freitas Alves100% (1)
- Alto FornoDokumen3 halamanAlto FornolipedalanBelum ada peringkat
- Fórmulas ÓpticasDokumen2 halamanFórmulas ÓpticasFernando Freitas AlvesBelum ada peringkat
- (UFABC) (Circuitos Elétricos II (EN2705) ) (Listas de Exercícios) (Carlos Eduardo Capovilla) (2015.1) (Resoluções) 02. Transformada de LaplaceDokumen7 halaman(UFABC) (Circuitos Elétricos II (EN2705) ) (Listas de Exercícios) (Carlos Eduardo Capovilla) (2015.1) (Resoluções) 02. Transformada de LaplaceFernando Freitas AlvesBelum ada peringkat
- Lista 02 PDFDokumen10 halamanLista 02 PDFFernando Freitas AlvesBelum ada peringkat
- TecnologiDokumen51 halamanTecnologiJose Orlando Pereira PereiraBelum ada peringkat
- Introdução aos processos de fabricaçãoDokumen4 halamanIntrodução aos processos de fabricaçãoFernando Freitas AlvesBelum ada peringkat
- Diagrama de Bode (Em Branco)Dokumen1 halamanDiagrama de Bode (Em Branco)Fernando Freitas AlvesBelum ada peringkat
- Iluminação de Sala de Museu PDFDokumen1 halamanIluminação de Sala de Museu PDFFernando Freitas AlvesBelum ada peringkat
- Aula 01 - Exercícios PDFDokumen3 halamanAula 01 - Exercícios PDFFernando Freitas AlvesBelum ada peringkat
- Aula 02 PDFDokumen5 halamanAula 02 PDFFernando Freitas AlvesBelum ada peringkat
- Aula 01 - Exercícios PDFDokumen3 halamanAula 01 - Exercícios PDFFernando Freitas AlvesBelum ada peringkat
- Aula 01 PDFDokumen2 halamanAula 01 PDFFernando Freitas AlvesBelum ada peringkat
- Turmas, Salas e Docentes (SA) 2014.2Dokumen705 halamanTurmas, Salas e Docentes (SA) 2014.2Fernando Freitas AlvesBelum ada peringkat
- Turmas, Salas e Docentes (SA) 2014.2Dokumen58 halamanTurmas, Salas e Docentes (SA) 2014.2Fernando Freitas AlvesBelum ada peringkat
- Lista 01 e 02 PDFDokumen22 halamanLista 01 e 02 PDFFernando Freitas AlvesBelum ada peringkat
- (De) Relatório 02Dokumen9 halaman(De) Relatório 02Fernando Freitas AlvesBelum ada peringkat
- Syllabus 2014 PDFDokumen6 halamanSyllabus 2014 PDFFernando Freitas AlvesBelum ada peringkat
- Edital 2014.1 PDFDokumen13 halamanEdital 2014.1 PDFFernando Freitas AlvesBelum ada peringkat
- (De) Relatório 02Dokumen9 halaman(De) Relatório 02Fernando Freitas AlvesBelum ada peringkat
- Docentes Da IARDokumen2 halamanDocentes Da IARFernando Freitas AlvesBelum ada peringkat
- Monitoria 2014 - EditalDokumen15 halamanMonitoria 2014 - EditalFernando Freitas AlvesBelum ada peringkat
- Manual Do Aluno 2013Dokumen125 halamanManual Do Aluno 2013Fernando Freitas AlvesBelum ada peringkat
- Produção painéis compensados sarrafeados e laminados unidirecionais LVLDokumen26 halamanProdução painéis compensados sarrafeados e laminados unidirecionais LVLMagno BernardoBelum ada peringkat
- Manual do Dinamizador Denise 10-50Dokumen4 halamanManual do Dinamizador Denise 10-50EDson JantschBelum ada peringkat
- Teoria Do ProdutorDokumen31 halamanTeoria Do Produtorhmvunge100% (1)
- QUEDAS EM ALTURA (Proteccao ColectivaDokumen149 halamanQUEDAS EM ALTURA (Proteccao ColectivaCláudia RosaBelum ada peringkat
- Tratamento Radioterapico Braquiterapia MarliDokumen21 halamanTratamento Radioterapico Braquiterapia MarliFabiana SoutoBelum ada peringkat
- Preparação e padronização de solução de H2SO4Dokumen3 halamanPreparação e padronização de solução de H2SO4Deise FoggiattoBelum ada peringkat
- Locuções conjuntivas: conjunções ou advérbios juntivosDokumen6 halamanLocuções conjuntivas: conjunções ou advérbios juntivosAnielle OliveiraBelum ada peringkat
- Princípio de BernoulliDokumen14 halamanPrincípio de BernoulliFernandoSilvaBelum ada peringkat
- Reabilitação de Caixilharias do Séc. XIXDokumen136 halamanReabilitação de Caixilharias do Séc. XIXAna Cristina DionisioBelum ada peringkat
- Descobrindo a assimetria de distribuiçõesDokumen5 halamanDescobrindo a assimetria de distribuiçõesCristiane Faria XavierBelum ada peringkat
- Ferramentas de corte: ângulos de incidência, cunha e saídaDokumen4 halamanFerramentas de corte: ângulos de incidência, cunha e saídahajisameBelum ada peringkat
- Manual depurador instruçõesDokumen2 halamanManual depurador instruçõesClaudete VedorBelum ada peringkat
- Projeto de fundações e estruturas de concretoDokumen12 halamanProjeto de fundações e estruturas de concretoMatheus RianBelum ada peringkat
- Relatório de atividade experimental de fundição e processos siderúrgicosDokumen15 halamanRelatório de atividade experimental de fundição e processos siderúrgicosmarcelo_shinitiBelum ada peringkat
- Síntese Da DibenzalacetonaDokumen2 halamanSíntese Da DibenzalacetonaJoão Pedroso100% (1)
- Comando acionador manual especificaçõesDokumen24 halamanComando acionador manual especificaçõesMilena CastroBelum ada peringkat
- Artigo de HidráulicaDokumen39 halamanArtigo de HidráulicaJonatas PrandiniBelum ada peringkat
- RACIOCÍNIO LÓGICO PARA MATRIZESDokumen68 halamanRACIOCÍNIO LÓGICO PARA MATRIZESmarquinhocadBelum ada peringkat
- Manuais escolares 10o ano Ciências e TecnologiasDokumen1 halamanManuais escolares 10o ano Ciências e TecnologiasMariana CostaBelum ada peringkat
- Manual do Operador DF-140Dokumen30 halamanManual do Operador DF-140Polaco Sovierzoski100% (1)