Analisis
Diunggah oleh
Jose Rojas0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
18 tayangan11 halamanJudul Asli
analisis
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
18 tayangan11 halamanAnalisis
Diunggah oleh
Jose RojasHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 11
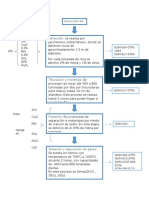
Anlisis volumtrico
Titulacin redirige aqu. Para otras acepciones, vase Titulacin (desambiguacin).
Proceso de titulacin. El valorante cae desde la pipeta en la solucin de analito contenida en
el erlenmeyer. Un indicador presente en la solucin cambia permanentemente de color al
alcanzar el punto final de la valoracin.
La valoracin o titulacin es un mtodo corriente de anlisis qumico cuantitativo en el
laboratorio, que se utiliza para determinar la concentracin desconocida de un reactivo
conocido. Debido a que las medidas de volumen juegan un papel fundamental en las
titulaciones, se le conoce tambin como anlisis volumtrico.
Un reactivo llamado valorante o titulador,
1
de volumen y concentracin conocida (una
solucin estndar o solucin patrn) se utiliza para que reaccione con una solucin del
analito,
2
de concentracin desconocida. Utilizando una bureta calibrada para aadir el
valorante es posible determinar la cantidad exacta que se ha consumido cuando se alcanza
el punto final. El punto final es el punto en el que finaliza la valoracin, y se determina
mediante el uso de un indicador. Idealmente es el mismo volumen que en el punto de
equivalenciael nmero de moles de valorante aadido es igual al nmero de moles de
analito, algn mltiplo del mismo (como en los cidos poliprticos). En la valoracin
clsica cido fuerte-base fuerte, el punto final de la valoracin es el punto en el que el pH
del reactante es exactamente 7, y a menudo la solucin cambia en este momento de color de
forma permanente debido a un indicador. Sin embargo, existen muchos tipos diferentes de
valoraciones (ver ms adelante). Pueden usarse muchos mtodos para indicar el punto final
de una reaccin: a menudo se usan indicadores visuales (cambian de color). En una
titulacin o valoracin cido-base simple, puede usarse un indicador de pH, como la
fenolftalena, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o
mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo en medio cido y
amarillo en disoluciones bsicas. No todas las titulaciones requieren un indicador. En
algunos casos, o bien los reactivos o los productos son fuertemente coloreados y pueden
servir como "indicador". Por ejemplo, una titulacin o valoracin redox que utiliza
permanganato de potasio como disolucin estndar (rosa/violeta) no requiere indicador
porque sufre un cambio de color fcil de detectar pues queda incolora al reducirse el
permanganato. Despus del punto de equivalencia, hay un exceso de la disolucin titulante
(permanganato) y persiste un color rosado dbil que no desaparece.
Bureta de Mohr
Debido a la naturaleza logartmica de la curva de pH, las transiciones en el punto final son
muy rpidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y
provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de
color del indicador y el punto de equivalencia de la titulacin o valoracin. Este error se
denomina error del indicador. Por este motivo es aconsejable efectuar determinaciones en
blanco con el indicador y restarle el resultado al volumen gastado en la valoracin.
ndice
1 Historia y etimologa
2 Preparacin de una muestra para titulacin o valoracin
3 Procedimiento
4 Curvas de valoracin
5 Tipos de valoraciones
o 5.1 Valoracin cido-base
o 5.2 Valoracin redox
o 5.3 Valoracin complexomtrica
o 5.4 Valoracin de potencial Zeta
6 Medida del punto final de una titulacin o valoracin
o 6.1 Valoracin por retroceso
7 Algunos usos particulares
o 7.1 Algunas valoraciones aplicables a lpidos
8 Referencias
9 Enlaces externos
Historia y etimologa
La palabra "titulacin" viene del vocablo latino titulus, que significa inscripcin o ttulo. La
palabra francesa titre, del mismo origen, significa rango o grado. La titulacin es el
procedimiento utilizado para determinar el volumen de una solucin que es necesario para
reaccionar con una cierta cantidad de otra sustancia. Las relaciones establecidas son
equilibrio homogneo o de neutralizacin entre iones que se producen al estar en contacto
con un acido o con una base para posteriormente obtener una sal. Una valoracin cido-
base(tambin llamada volumetra cido-base, titulacin cido-base o valoracin de
neutralizacin) es una tcnica o procedimiento de anlisis cuantitativo muy usada, que
permite conocer la concentracin desconocida de una disolucin de una sustancia que
pueda actuar como cido o base, neutralizndolo con una base o cido de concentracin
conocida. Una titulacin o valoracin es, por definicin, la determinacin del grado o
concentracin de una disolucin con respecto a agua con pH 7 (que es el pH del H
2
O pura
en condiciones estndar). Los orgenes del anlisis volumtrico estn en Francia en la
qumica de finales del siglo XVII. Franois Antoine Henri Descroizilles desarroll la
primera bureta (con aspecto de un cilindro graduado) en 1791. Joseph Louis Gay-Lussac
desarroll una versin mejorada de la bureta que inclua un brazo lateral, y acu los
trminos "pipeta" y "bureta" en un artculo de 1824 sobre la estandarizacin de disoluciones
de ndigo. Un gran paso adelante en la metodologa y popularizacin del anlisis
volumtrico se debe a Karl Friedrich Mohr, que redise la bureta colocando un cierre con
pinza y una cnula de vertido en el extremo inferior, y escribi el primer libro sobre su uso,
con el ttulo Lehrbuch der chemisch-analytischen Titrirmethode (Manual sobre mtodos de
titulacin en Qumica Analtica), publicado en 1855.
3
Preparacin de una muestra para titulacin o valoracin
En una titulacin o valoracin, tanto la sustancia patrn como el analito deben estar en fase
lquida (o en disolucin). Si la muestra no es un lquido o una disolucin, debe ser disuelta.
Si el analito est muy concentrado en la muestra a analizar, suele diluirse. Aunque la
amplia mayora de las titulaciones se llevan a cabo en disolucin acuosa, pueden usarse
otros disolventes como cido actico o etanol con igual finalidad, para determinados
anlisis. Una cantidad medida de muestra se coloca en un frasco donde se disuelve y se
diluye si es necesario. El resultado matemtico de la valoracin puede calcularse
directamente mediante la cantidad de valorante medida. Cuando la muestra ha sido disuelta
o diluida previamente a la valoracin, la cantidad de disolvente utilizado para disolver o
diluir debe ser bien conocida (generalmente es un coeficiente entero) para poder
considerarlo en el resultado matemtico de la valoracin de la muestra original. Muchas
valoraciones requieren un cierto control del pH de la reaccin. Para ello, se usan
disoluciones amortiguadoras aadidas en el frasco de la disolucin a analizar para mantener
el pH de la solucin. En otros casos se debe enmascarar un cierto ion: esto es necesario
cuando hay dos reactivos en la muestra que pueden reaccionar con la sustancia patrn y
solo queremos valorar uno de ellos, o bien cuando la reaccin puede ser inhibida o alterada
por la presencia de ese ion. Se procede aadiendo otra disolucin a la muestra para
enmascarar o secuestrar el ion no deseado, mediante la formacin de un enlace dbil con l
o incluso formando una sustancia insoluble. Algunas reacciones redox pueden requerir
calentar la disolucin con la muestra y valorar mientras est todava caliente (para
incrementar la velocidad de reaccin). Por ejemplo, la oxidacin de ciertas soluciones de
oxalato requiere calentar la solucin hasta unos 60 grados centgrados para mantener una
adecuada velocidad de reaccin.
Procedimiento
Una titulacin o valoracin comienza con un vaso de precipitados o matraz Erlenmeyer
conteniendo un volumen preciso del reactivo a analizar y una pequea cantidad de
indicador, colocado debajo de una bureta que contiene la disolucin estndar. Controlando
cuidadosamente la cantidad aadida, es posible detectar el punto en el que el indicador
cambia de color. Si el indicador ha sido elegido correctamente, este debera ser tambin el
punto de neutralizacin de los dos reactivos. Leyendo en la escala de la bureta sabremos
con precisin el volumen de disolucin aadida. Como la concentracin de la disolucin
estndar y el volumen aadido son conocidos, podemos calcular el nmero de moles de esa
sustancia (ya que ). Luego, a partir de la ecuacin
qumica que representa el proceso que tiene lugar, podremos calcular el nmero de moles
de la sustancia a analizar presentes en la muestra. Finalmente, dividiendo el nmero de
moles de reactivo por su volumen, conoceremos la concentracin buscada.
Curvas de valoracin
Una curva tpica de valoracin de un cido diprtico, cido oxlico, titulado con una base
fuerte, hidrxido de sodio. Son visibles los dos puntos de equivalencia, a 15 y 30 mL
Las valoraciones se representan mediante curvas de valoracin, en las que suele
representarse como variable independiente el volumen aadido de disolucin estndar,
titulante o patrn, mientras la variable dependiente es la concentracin del analito en la
etapa correspondiente de valoracin (en una valoracin cido-base es generalmente el pH
de la disolucin, que cambia segn la composicin de las dos disoluciones). En el caso de
las valoraciones cido-base, las curvas de valoracin reflejan la fuerza del cido y de la
base correspondientes. Por ejemplo, en una valoracin de cido fuerte con una base dbil,
la curva de valoracin ser relativamente lisa, aunque muy escarpado para puntos cerca el
punto de equivalencia de la valoracin. En este caso, pequeos cambios en el volumen del
valorante producen cambios grandes del pH cerca del punto de equivalencia. En este caso,
una amplia gama de indicadores sera apropiada (por ejemplo el tornasol, la fenolftalena o
el azul de bromotimol). Por otro lado, si uno de los componentes de una valoracin cido-
base es un cido dbil o una base dbil, y el otro es un cido fuerte o una base fuerte, la
curva de valoracin es claramente irregular cerca del punto de equivalencia (y el pH no
cambia "tanto" con la adicin de pequeos volmenes de valorante). Como ejemplo, la
curva de valoracin del cido oxlico (un cido dbil) con hidrxido de sodio (una base
fuerte) se ha representado en la imagen anterior. Aqu, el punto de equivalencia ocurre a un
pH entre 8 y 10, y as el analito es bsico en el punto de equivalencia (con ms precisin, el
ion hidrxido experimenta una reaccin de hidrlisis en el agua produciendo iones
hidrxido). Un indicador como la fenolftalena sera apropiado para esta valoracin en
particular. La curva de valoracin correspondiente a una valoracin de una base dbil con
un cido fuerte se comporta de modo anlogo, obtenindose una disolucin cida en el
punto de equivalencia. En este caso, indicadores como el naranja de metilo o el azul de
bromotimol se utilizan habitualmente. Por otro lado, las valoraciones cido-base en las que
los componentes son una base y un cido dbil, son de naturaleza bastante irregular. Debido
a la naturaleza de tales valoraciones, no hay ningn indicador qumico apropiado, y por ello
a menudo se utiliza el pHmetro.
Tipos de valoraciones
Las valoraciones se clasifican por el tipo de objeto a analizar:
Valoraciones cido-base: basadas en la reaccin de neutralizacin entre el analito y
una disolucin de cido o base que sirve de referencia. Para determinar el punto
final, usan un indicador de pH, un pH-metro, o un medidor de conductancia.
Valoraciones redox: basadas en la reaccin de oxidacin-reduccin o reaccin redox
entre el analito y una disolucin de oxidante o reductor que sirve de referencia. Para
determinar el punto final, usan un potencimetro o un indicador redox aunque a
veces o bien la sustancia a analizar o la disolucin estndar de referencia tienen un
color suficientemente intenso para que no sea necesario un indicador adicional.
Valoraciones de formacin de complejos o complexometras: basadas en la reaccin
de formacin de un complejo entre el analito y la sustancia valorante. El agente
quelante EDTA es muy usado para titular iones metlicos en disolucin. Estas
valoraciones generalmente requieren indicadores especializados que forman
complejos ms dbiles con el analito. Un ejemplo es Negro de Eriocromo T para
valoracin de iones calcio, magnesio o cobre (II).
Valoraciones de precipitacin: Son aquellas basadas en las reacciones de
precipitacin.Uno de los tipos ms habituales son las Argentometras: precipitacin
de aniones como los halgenos ( F
-
, Cl
-
, Br
-
, I
-
) y el tiocianato (SCN
-
) con el ion
plata. Ag
+
. Esta titulacin est limitada por la falta de indicadores apropiados.
4
NaX
(ac)
+ AgNO
3(ac)
AgX
(s)
+ NaNO
3(ac)
donde X = F
-
, Cl
-
, Br
-
, I
-
,
SCN
-
Valoracin cido-base
Artculo principal: Valoracin cido-base
Indicador
Color en medio
cido
Rango de cambio de
color
Color en medio
bsico
Violeta de metilo Amarillo 0.0 - 1.6 Violeta
Azul de bromofenol Amarillo 3.0 - 4.6 Azul
Naranja de metilo Rojo 3.1 - 4.4 Amarillo
Rojo de metilo Rojo 4.4 - 6.2 Amarillo
Tornasol Rojo 5.0 - 8.0 Azul
Azul de bromotimol Amarillo 6.0 - 7.6 Azul
Fenolftalena Incolora 8.3 - 10.0 Rosa
Amarillo de
alizarina
Amarillo 10.1 - 12.0 Rojo
Estas valoraciones estn basadas en la reaccin de neutralizacin que ocurre entre un cido
y una base, cuando se mezclan en solucin. El cido (o la base) se aade a una bureta
previamente lavada con el mismo cido (o base) antes de esta adicin. La base (o el cido)
se aade a un matraz Erlenmeyer previamente lavado con agua destilada antes de la
adicin. La solucin en el matraz es a menudo una solucin estndar; cuya concentracin es
exactamente conocida. La solucin en la bureta es la solucin cuya concentracin debe ser
determinada por la valoracin. El indicador usado para la valoracin cido-base a menudo
depende de la naturaleza de los componentes como se ha descrito en la seccin anterior.
Los indicadores ms comunes, sus colores, y el rango de pH del cambio de color se
muestran en la tabla anterior. Cuando se requieren resultados ms exactos, o cuando los
componentes de la valoracin son un cido y una base dbil, se utiliza un pHmetro o un
medidor de conductancia.
Valoracin redox
Artculo principal: Valoracin redox
Estas valoraciones estn basadas en una reaccin de redox entre un agente oxidante y un
agente reductor. El agente oxidante (o el agente reductor) se aade en la bureta previamente
lavada con el mismo agente oxidante. El reductor (o el agente oxidante) se aade en el
matraz erlenmeyer, previamente lavado con agua destilada. Como en una valoracin cido-
base, la solucin estndar es la que se coloca a menudo en el matraz, y la solucin cuya
concentracin debe ser determinada se coloca en la bureta. El procedimiento para realizar
las valoraciones redox es similar al requerido para realizar las valoraciones cido-base.
La mayora de las veces se utiliza un el potencimetro o un indicador redox para determinar
el punto final de la valoracin. Por ejemplo, cuando uno de los componentes de la
valoracin es el agente oxidante dicromato de potasio, el cambio de color de la solucin de
naranja a verde no es definido y se utiliza un indicador como la difenilamina. El anlisis de
vinos para determinar su contenido de dixido de azufre requiere el empleo de yodo como
un agente oxidante. En este caso, se utiliza almidn como indicador; un complejo de
almidn-yodo azul se forma en el momento en que un exceso de yodo est presente,
sealando as el punto final de la valoracin.
Por otro lado, algunas valoraciones redox no requieren un indicador, debido al color intenso
de alguno de los componentes. Por ejemplo, en una valoracin donde est presente el
agente oxidante permanganato de potasio, un color rosado que persiste seala el punto final
de la valoracin, y por lo tanto no se requiere ningn indicador particular.
Valoracin complexomtrica
Artculo principal: Equilibrio de complejos
Estas valoraciones estn basadas en la formacin de un complejo entre el analito y el
valorante. El agente quelatante EDTA se utiliza muy frecuentemente para valorar iones
metlicos en solucin. Estas valoraciones generalmente requieren un indicador
especializado que forma complejos ms dbiles con el analito. Un ejemplo comn es el
Negro de Eriocromo T para la valoracin de los iones de calcio y magnesio.
Valoracin de potencial Zeta
Artculo principal: Valoracin de potencial Zeta
Estas valoraciones son caractersticas de sistemas heterogneos, como los coloides. El
potencial Zeta juega el papel de indicador. Uno de los objetivos es la determinacin del
punto isoelctrico cuando la carga superficial se hace 0. Esto se puede alcanzar cambiando
el pH o aadiendo surfactante. Otro objetivo es la determinacin de la dosis ptima de
sustancia qumica para la floculacin o la estabilizacin.
Medida del punto final de una titulacin o valoracin
Artculo principal: Punto de equivalencia
Hay diferentes mtodos para determinar el punto final o punto de equivalencia:
Indicadores: Son sustancias que cambian de color en respuesta a un cambio
qumico.
o Indicador de pH o indicador cido-base: Un indicador cido-base (como la
fenolftalena) cambia de color dependiendo del pH del medio.
o Indicador Redox. Una gota de disolucin de indicador es aadida al
principio de la titulacin o valoracin; cuando el color cambia, se ha
alcanzado el punto final.
Potencimetro y dosificador de la marca Metrohm.
Potencimetro: Son instrumentos que miden el potencial de electrodo de la
disolucin. Se usan para valoraciones redox; el potencial del electrodo de trabajo
cambiar bruscamente en el punto final.
Medidor de pH o pH-metros: Son potencimetros que usan un electrodo cuyo
potencial depende de la cantidad de ion H+ presente en la disolucin. Es un ejemplo
de un electrodo de ion selectivo que permite medir el pH de la disolucin a lo largo
de la valoracin. En el punto final, cambiar bruscamente el pH medido. Puede ser
un mtodo ms preciso que el uso de indicadores, y es fcil de automatizar.
Conductancia: La conductividad de una disolucin depende de los iones presentes
en ella. Durante muchas titulaciones, la conductividad cambia de modo
significativo. Por ejemplo, durante una valoracin cido-base, los iones H
+
y OH
-
formando agua neutra, H
2
O. Esto cambia la conductividad de la disolucin. La
conductancia total de la disolucin depende tambin de los otros iones presentes en
la disolucin (como los contraiones). No todos ellos contribuyen de igual manera a
la conductividad que tambin depender de la movilidad de cada ion y de la
concentracin total de iones (fuerza inica). Luego, predecir el cambio en la
conductividad es ms difcil que medirla.
Cambio de color: En algunas reacciones, la disolucin cambia de color sin presencia
de indicador. Es frecuente en valoraciones redox, por ejemplo, cuando los diferentes
estados de oxidacin de productos y reactivos poseen diferentes colores.
Precipitacin: Si se forma un slido en la reaccin, y luego precipita. Un ejemplo es
la reaccin entre Ag
+
y Cl
-
que forma una sal muy insoluble, AgCl. Esto dificulta
determinar con precisin el punto final. Por ello, a veces se prefiere hacer una
titulacin inversa.
Una valoracin calorimtrica o titulacin isotrmica usa el calor producido o
consumido en la reaccin para determinar el punto final. Es un mtodo importante
en bioqumica, como en la determinacin de qu substratos se enlazan a las
enzimas.
Titulacin termomtrica es una tcnica muy verstil. Se diferencia de la anterior por
el hecho de que no se determina un aumento o cada de temperatura como indicativo
del punto final, sino que se mide la velocidad de cambio de la temperatura.
Titulacin con determinacin del punto final por cambio de color
Espectroscopa: Puede usarse para medir la absorcin de luz por la disolucin
durante la valoracin, y si el espectro del reactivo, sustancia patrn o producto es
conocido, podra medirse su evolucin con cantidades bastante pequeas que
permitiran conocer el punto final.
Amperometra o valoracin amperomtrica: Se usa como tcnica de deteccin
analizando la corriente elctrica debida a la oxidacin o reduccin de los reactivos o
productos en un electrodo de trabajo que depender de la concentracin de las
especies en disolucin. El punto final se detecta por un cambio en la corriente. Este
mtodo es el ms til cuando hay que reducir un exceso de la sustancia valorante
(valoracin por retroceso), como es el caso de la valoracin de haluros con Ag
+
.
Valoracin por retroceso
El mtodo de valoracin por retroceso se usa cuando se invierte el sentido de la
valoracin, cambiando la sustancia a valorar. En vez de valorar el analito original se aade
un exceso conocido de reactivo estndar a la disolucin, y luego se valora el exceso. Este
mtodo es til si el punto final de la valoracin por retroceso es ms fcil de identificar que
el punto final de la valoracin normal. Se usa tambin si la reaccin entre el analito y la
sustancia titulante es muy lenta.
Algunos usos particulares
La valoracin de biocombustible es el acto de determinar la acidez de una muestra
de combustible de origen vegetal mediante la adicin de una base a la muestra
mientras se comprueba con papel indicador que el pH final es 7. Sabiendo cunta
base neutraliza una cantidad de biocombustible, conoceremos cuanta base en total
aadiremos al lote completo.
La valoracin en petroqumica o en la industria alimentaria se usa para definir las
propiedades de aceites, grasas y substancias similares.
5
Algunas valoraciones aplicables a lpidos
Nmero cido: Determina el nivel de cidos grasos libres presentes en un
biocombustible. El nmero cido total es la cantidad de base, expresada en
miligramos de hidrxido de potasio que se requiere para neutralizar todos los
componentes acdicos presentes en un gramo de muestra.
Grado de acidez: Se realiza una titulacin cido-base con indicador de cambio de
color para determinar el contenido de cido graso libre en una muestra y comprobar
as su acidez.
Nmero de iodo o ndice de yodo: Es una medida del grado de insaturacin de los
componentes de una grasa. Ser tanto mayor cuanto mayor sea el nmero de dobles
enlaces C=C por unidad de grasa, utilizndose por ello para comprobar la pureza y
la identidad de las grasas. Es la cantidad (gramos) de yodo absorbidos por 100
gramos de grasa.
El nmero de yodo oscila entre 0 (cidos grasos saturados) a 350. Una valoracin redox con
cambio de color permite indicar la cantidad de cido graso insaturado libre en una muestra.
6
Nmero de saponificacin: La saponificacin consiste en una hidrlisis alcalina de
una muestra grasa (con KOH o NaOH). Los lpidos derivados de cidos grasos
(cidos monocarboxlicos de cadena larga) dan lugar a sales alcalinas (jabones) y
alcohol, que son fcilmente extrables en medio acuoso.
El nmero de saponificacin no es ms que los miligramos de KOH necesarios para
saponificar 1 gramo de materia grasa. Esta prueba es otra prueba cualitativa que podemos
aplicar a los lpidos. Esta nos permite ver si el tipo de lpido es saponificable (contiene
cidos grasos) o no (no contiene cidos grasos). Se realiza una valoracin cido-base por
retroceso con indicador de cambio de color o valoracin potenciomtrica para obtener una
idea de la longitud media de la cadena de cidos grasos en una grasa.
Anda mungkin juga menyukai
- Examen de Diagnostico 3 GradoDokumen3 halamanExamen de Diagnostico 3 GradoAbigail Castillo GuajardoBelum ada peringkat
- 4003Dokumen10 halaman4003Kevin A. FernandezBelum ada peringkat
- Hidraulica de Tuberias y CanalesDokumen538 halamanHidraulica de Tuberias y Canalesjonnathan guillermo reategui aguilar100% (1)
- Helix Ultra Professional Ag 5w30 Pure Plus TechnologyDokumen3 halamanHelix Ultra Professional Ag 5w30 Pure Plus TechnologyJose RojasBelum ada peringkat
- Instalaciones Gas LPDokumen299 halamanInstalaciones Gas LPLuis Sabino Segura SilvaBelum ada peringkat
- Villegas, Victor - 100 Pasatiempos y Habilidades PDFDokumen31 halamanVillegas, Victor - 100 Pasatiempos y Habilidades PDFAlex Come CocosBelum ada peringkat
- BecasnapDokumen66 halamanBecasnapcucumbiaBelum ada peringkat
- pdf1179 PDFDokumen7 halamanpdf1179 PDFXime0599Belum ada peringkat
- HTTPSWWW - Anh.gob - boinsideFilesDocumentosDocumentos Id 257 150120 0744 0 PDFDokumen151 halamanHTTPSWWW - Anh.gob - boinsideFilesDocumentosDocumentos Id 257 150120 0744 0 PDFJose RojasBelum ada peringkat
- Leccion10df PDFDokumen24 halamanLeccion10df PDFkarenBelum ada peringkat
- Leccion10df PDFDokumen24 halamanLeccion10df PDFkarenBelum ada peringkat
- Bo L 2027Dokumen33 halamanBo L 2027Jose RojasBelum ada peringkat
- Capitulo 2 CombustiblesDokumen19 halamanCapitulo 2 CombustiblesEve García AlvarezBelum ada peringkat
- Capitulo 2 CombustiblesDokumen19 halamanCapitulo 2 CombustiblesEve García AlvarezBelum ada peringkat
- Bo L 2027Dokumen33 halamanBo L 2027Jose RojasBelum ada peringkat
- Catalogo Caldera Pirotubular - JmayciaDokumen4 halamanCatalogo Caldera Pirotubular - JmayciaDïego Andrés NBelum ada peringkat
- Big BangDokumen2 halamanBig BangJose RojasBelum ada peringkat
- Catalogo Caldera Pirotubular - JmayciaDokumen4 halamanCatalogo Caldera Pirotubular - JmayciaDïego Andrés NBelum ada peringkat
- Catalogo Caldera Pirotubular - JmayciaDokumen4 halamanCatalogo Caldera Pirotubular - JmayciaDïego Andrés NBelum ada peringkat
- BMW MotorsDokumen6 halamanBMW MotorsJose RojasBelum ada peringkat
- ProducciónDokumen3 halamanProducciónJose RojasBelum ada peringkat
- Dimensionado de Las Instalaciones Comerciales y MultifamiliaresDokumen15 halamanDimensionado de Las Instalaciones Comerciales y MultifamiliaresJose RojasBelum ada peringkat
- AudiDokumen5 halamanAudiJose RojasBelum ada peringkat
- Introduccion Al Tratamiento de Gas NaturalDokumen1 halamanIntroduccion Al Tratamiento de Gas NaturalJose RojasBelum ada peringkat
- BMW WikipediaDokumen8 halamanBMW WikipediaJose RojasBelum ada peringkat
- ProducciónDokumen3 halamanProducciónJose RojasBelum ada peringkat
- HistoDokumen9 halamanHistoJose RojasBelum ada peringkat
- TonoDokumen7 halamanTonoJose RojasBelum ada peringkat
- TierraDokumen6 halamanTierraJose RojasBelum ada peringkat
- ProducciónDokumen3 halamanProducciónJose RojasBelum ada peringkat
- TonoDokumen7 halamanTonoJose RojasBelum ada peringkat
- HistoDokumen9 halamanHistoJose RojasBelum ada peringkat
- Densidad de Sólidos y LíquidosDokumen5 halamanDensidad de Sólidos y LíquidosJuan Pablo Barahona CastroBelum ada peringkat
- Formulario 2Dokumen6 halamanFormulario 2Nataly MichelleBelum ada peringkat
- Ejercicios de Quimica AnaliticaDokumen2 halamanEjercicios de Quimica AnaliticaFatima Sanchez YesquenBelum ada peringkat
- Reporte Estufa SolarDokumen4 halamanReporte Estufa Solarangel jesusBelum ada peringkat
- Guia InecuacionesDokumen8 halamanGuia InecuacionesKMILA PALTABelum ada peringkat
- Actividad 3 - Unidades y Patrones de MedidaDokumen11 halamanActividad 3 - Unidades y Patrones de MedidaDAVID JIMENEZ ORTIZBelum ada peringkat
- Taller Distribución MuestralDokumen2 halamanTaller Distribución Muestraljuan david patiño zambronoBelum ada peringkat
- Pract. 09 - Raz. MatematicoDokumen5 halamanPract. 09 - Raz. MatematicoMblaq Sandhrita GutierrezBelum ada peringkat
- Metodo Gauss Jordan - InversaDokumen3 halamanMetodo Gauss Jordan - InversaJhonny CahuayaBelum ada peringkat
- Ejercicios Resueltos Leyes de Newton - ResueltosDokumen8 halamanEjercicios Resueltos Leyes de Newton - ResueltosKJheoselyn EscribaBelum ada peringkat
- Reconocimiento de TerrenoDokumen31 halamanReconocimiento de TerrenoJuan Ludeña100% (1)
- Medicion de RugosidadDokumen9 halamanMedicion de RugosidadElda Mondragon CastroBelum ada peringkat
- Comunicación - Eficaz - Escucha ActivaDokumen16 halamanComunicación - Eficaz - Escucha ActivajonashBelum ada peringkat
- Introduccion A Los Sistemas de Pesaje NTC 2031Dokumen38 halamanIntroduccion A Los Sistemas de Pesaje NTC 2031jesusdaniel18Belum ada peringkat
- Tea Ko Drum T-MBD-101Dokumen19 halamanTea Ko Drum T-MBD-101carloslimasanchezBelum ada peringkat
- AngerKit ZoomOutCards-ES 648e7196e0fcdDokumen14 halamanAngerKit ZoomOutCards-ES 648e7196e0fcdCristy VelviBelum ada peringkat
- Informe Activacion de InyectorDokumen4 halamanInforme Activacion de InyectorHéctor CangásBelum ada peringkat
- Informe de Laboratorio PH VinagreDokumen15 halamanInforme de Laboratorio PH VinagreEdith HMBelum ada peringkat
- Características Del MagnetismoDokumen8 halamanCaracterísticas Del MagnetismoSorusama22Belum ada peringkat
- Horario 5to Año-3er LapsoDokumen2 halamanHorario 5to Año-3er LapsoDpto de Evaluación Laura VicuñaBelum ada peringkat
- Mineria 2018Dokumen94 halamanMineria 2018Luis Carlomagno Beltran MendiguriBelum ada peringkat
- Relaciones Gravimétricas Y Volumétricas Del SueloDokumen43 halamanRelaciones Gravimétricas Y Volumétricas Del SueloCarlos Alberto Gago CuevaBelum ada peringkat
- Registros en Agujeros EntubadoDokumen15 halamanRegistros en Agujeros EntubadoangelBelum ada peringkat
- Extraccion Zinc y CupritaDokumen5 halamanExtraccion Zinc y Cupritacoreano63Belum ada peringkat
- Proyecto de GamificaciónDokumen7 halamanProyecto de GamificaciónOscar Gibran García RosalesBelum ada peringkat
- Sustentacion Trabajo Colaborativo - Escenario 7 Segundo Bloque-Ciencias Basicas - Calculo I - (Grupo b05)Dokumen7 halamanSustentacion Trabajo Colaborativo - Escenario 7 Segundo Bloque-Ciencias Basicas - Calculo I - (Grupo b05)Robinson MolinBelum ada peringkat
- Cap 3, Sec 3.8, Metodo de NewtonDokumen26 halamanCap 3, Sec 3.8, Metodo de Newtonjose2182100% (1)
- Ejercicios Resueltos de Tiro y Caida (Movimientos Relativos en El Plano)Dokumen2 halamanEjercicios Resueltos de Tiro y Caida (Movimientos Relativos en El Plano)Cecilia LaimeBelum ada peringkat