Impurezas en medicamentos: definiciones, regulaciones y requisitos de pureza
Diunggah oleh
maraperezlindoDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Impurezas en medicamentos: definiciones, regulaciones y requisitos de pureza
Diunggah oleh
maraperezlindoHak Cipta:
Format Tersedia
Tema: Impurezas en Productos
de Inters Farmacutico
Garanta de Calidad de Medicamentos
rea Anlisis de Medicamentos - FCByF-UNR
Preparado por la Dra. Patricia M. Castellano
~ Ao 2014 ~
1-DEFINICIONES
No existe una definicin precisa en la ciencia Farmacutica sobre
impureza.
Sepuededefinir impurezacomoalgoqueestimpuro.
Satinder AhujaCualquier material queafectalapurezadel material
deinters.
Desde el punto de vista del uso un principio activo est
comprometido en trminos de pureza cuando contiene otra sustancia
cuyas propiedades son superiores farmacolgicamente o
toxicolgicamente.
Impureza (medicamento) cualquier componente del medicamento
quenosealaentidadqumicadefinidacomofrmacoo excipiente.
1-DEFINICIONES
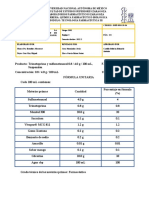
CLORURO DE SODIO
USO CALIDAD PUREZA COSTO
Sal de roca (materia prima) Industrial 95,0% 1,0
Sal de cocina (alimenticio) Puro 99,0% 2,5
Cloruro de sodio (teraputico) Farmacopeico 99,5% 20,0
Cloruro de sodio (analtico) Pro-anlisis 99,9% 96,0
2-TERMINOLOGA
2.1-Trminos usados frecuentemente
Intermediarios: Compuestos producidos durante la sntesis aislados y
caracterizados.
Penltimo intermediario: ltimo compuesto antes del producto
principal, cuando el producto final es unasal no sedebeconsiderar ala
baseoal cidolibreel penltimointermediario.
Subproductos: Compuestos no esperados en la reaccin, se puede
teorizar onosobrelosmismos.
Transformacin de productos: Pueden ser tericos o no, similar al
anterior perosesuponeunmayor conocimientodelosmismos.
Productos que interaccionan: Lainteraccinpuedeocurrir involucrando
variosqumicosintencionalmenteono.
Productos relacionados: Sugierequelaimpurezaes similar al principio
activo, puedetener similar estructurayactividadbiolgica.
Productos de degradacin: Compuestosproducidospor descomposicin
del principioactivo.
2-TERMINOLOGA
2.2-Terminologa utilizada por las Farmacopeas
Las Farmacopeas reconocen que el concepto sobre pureza es un
trmino dinmico susceptible de cambios e ntimamente
relacionadoconel desarrollodelaqumicaanaltica.
La USP tiene distintas secciones donde se trata el tema de las
impurezas
Impurezasenartculosoficiales
Impurezascomunes
Impurezasorgnicasvoltiles
2.2-Terminologa utilizada por las Farmacopeas
USPutilizadistintostrminosparadescribir impurezas:
Sustancias extraas: Materiales introducidos por contaminacin o
adulteracinynocomoconsecuenciadelasntesisopreparacin.
Impurezas txicas: Estas impurezas tienen un significado efecto
biolgico no deseable, requieren de ensayos especficos de
identificacinycuantificacin.
Sustancias concomitantes: Son caractersticas demuchas principios
activos, noseconsideranimpurezasenel sentidofarmacopeico.
Impureza seal: Se distinguen de las impurezas ordinarias porque
requieren pruebas especficas de identificacin y cuantificacin.
Incluyenimpurezasrelacionadasyproductosdedegradacin.
Impurezas ordinarias: Son inocuas y no tienen efectos indeseables
desdeel puntodevistadelaactividadbiolgica.
Impurezas orgnicas voltiles: Se refiere a solventes residuales
provenientesdelasntesis.
2-TERMINOLOGA
2-TERMINOLOGA
2.3-Impurezasquirales
Compuestos que tienen similar estructura qumica pero diferente
orientacinespacial presentanuncomportamientodiferentefrente
alaluz polarizadadandolugar alo queseconocecomo ismeros
pticos. Los ismeros pticos son considerados impurezas
quirales por ejemplo el d-ismero de un compuesto puede tener
diferenteactividadfarmacolgicaytoxicolgicaqueel l-ismero.
2.4-Impurezasvarias
Sustanciaspresentesenmaterialesdepartida.
Impurezasenexcipientes.
3-REGULACIONES Y REQUERIMIENTOS
Existenrazones morales, econmicas y competitivas paracontrolar las
impurezasenlosmedicamentos.
Generalmentelasfarmacopeasdelosdistintospasesdanlasnormasal
respecto a excepcin de los Estados Unidos, donde la FDA (Federal
Food, DrugandCosmetic) es quienfijalos requerimientos atravs de
IND (Noticeof ClaimedInvestigational Exemptionfor aNewDrug) y
NDA (NewDrugApplication).
Como consecuencia que las regulaciones entre un pas y otro pueden
diferir seelaboraronguasICH quecontemplanel temadelapurezade
lasdrogasfarmacuticas.
Podemosclasificar lasregulacionesentresgrandesgrupos
RequerimientosFarmacopeicos
RequerimientosIndustriales
GuasICH
3-REGULACIONES Y REQUERIMIENTOS
3.1-Requerimientos farmacopeicos
Uno de los objetivos primarios de USP es asegurar que en sus
monografasseencuentrenlosrequerimientosdeidentidad, potencia,
calidad y pureza. Sin embargo, es imposible incluir en cada
monografa una prueba para cada impureza, contaminante o
adulterante que pueda estar presente, incluyendo contaminacin
microbiolgica.
LassiguientepruebasparaimpurezassonincluidosenUSP
ImpurezasySustanciasExtraas
Otrasimpurezas
3-REGULACIONES Y REQUERIMIENTOS
3.1-Requerimientos Farmacopeicos
ImpurezasySustanciasExtraas
Sustancias extraas: La presencia de sustancias extraas que no son
reveladas por las pruebas de las monografas pueden ser determinadas
por mtodosnooficiales.
Impurezas txicas: Estas impurezas tienen un efecto no deseable,
actividadbiolgicay requierenidentificacinycuantificacinindividual
por pruebas especficas. Pueden provenir de la sntesis, preparacin o
degradacin.
Sustancias concomitantes: No sonconsideradas impurezas enel sentido
farmacopeico. Lmites de contenidos, o rangos especficos o mezclas
definidas son especificadas por USP. Dentro de esta categora se
encuentranismerospticosyantibiticosquesonmezcla.
Impureza seal: Se distinguen de las impurezas ordinarias porque
requierenpruebasespecficasparaidentificacinycuantificacin.
3-REGULACIONES Y REQUERIMIENTOS
3.1-RequerimientosFarmacopeicos
ImpurezasySustanciasExtraas
Impurezas ordinarias: Estas impurezas son consideradas inocuas.
Puedenprovenir delasntesis, preparacino productos dedegradacin.
Ensayos para sustancias relacionadas o pureza cromatogrfica pueden
usarseparasu control. Un lmitegeneral del 2,0%seadoptacuando no
hayotraespecificacin.
Impurezas orgnicas voltiles: Se denominan de esta forma los
solventesresiduales.
IMPUREZA ORGNICA VOLTIL LMITE (ppm)
Acetonitrilo 50
Benceno 100
1,2-Dicloroetano 50
1,2-Dioxano 100
Clorurodemetileno 500
Piridina 100
Tricloroetileno 100
3-REGULACIONES Y REQUERIMIENTOS
3.1-RequerimientosFarmacopeicos
OtrasImpurezas
Lapresenciadeunaimpurezano identificadasi superael 0,1%debe
analizarse.
Lasumadetodasnodebeexceder el 0,2%.
Las siguientes categoras son excluidas de Otras Impurezas: productos
de fermentacin, radiofarmacuticos, derivados biolgicos y
biotecnolgicos, pptidos y productos crudos de origen vegetal o animal.
Impurezas txicas no deben ser listadas bajo otras impurezas,
requierendeensayosespecficosdentrodelamonografa.
464monografas contienenel ensayo depurezacromatogrficaconel
propsitoderevisar loquesedenominaotrasimpurezas.
3-REGULACIONES Y REQUERIMIENTOS
3.2-RequerimientosIndustriales
La industria farmacutica reconoce que es su responsabilidad asegurar
queel productodisponibleal pblicoseacuidadosoyeficaz.
El cuidado y eficaciadeun principio activo solo puedeser garantizado
por un estricto control de los productos de partida, manufactura y
estudiosclnicosytoxicolgicosdiseadosyejecutadoscientficamente.
Unestudio racional debeser partedel trabajo. Es necesario conocer las
identificables y las no identificables. Paraestablecer los lmites sedebe
considerar
a)TOXICOLOGA DE LA IMPUREZA
b)VA DEADMINISTRACIN
c)DOSISDIARIAADMINISTRADA
d)EDADDE LA POBLACIN
e)FARMACOLOGA DE LA IMPUREZA
f)ORIGENDEL PRINCIPIOACTIVO(sinttico, natural, biotecnolgico)
g)DURACINDE LA TERAPIA
h)FACTIBILIDAD DE FABRICAR UN PRODUCTO DE GRAN CALIDAD A UN
PRECIORAZONABLE.
3-REGULACIONES Y REQUERIMIENTOS
3.2-RequerimientosIndustriales
Dostrminosseusanenlaindustriaparadescribir impurezas
Sustanciasrelacionadas: Sustanciasestructuralmenterelacionadascon
el principio activo. Provienen deproductos dedegradacin, procesos
demanufacturaodel almacenamiento, puedenser identificadasono.
Contaminantes del proceso: Incluyen reactivos, inorgnicas (metales
pesados, cloruros, sulfatos, etc.), materialesdepartidaysolventes, los
cualespuedenser introducidosduranteel proceso.
3-REGULACIONES Y REQUERIMIENTOS
3.2-RequerimientosIndustriales
IND(Investigational New Drug)
Enesteetapalanaturalezaqumicadelasustanciahasido definiday el
proceso de manufactura se encuentra en un primer estadio (escala
laboratorio). No es necesario disponer de patrones de referencia y los
lmitesdeimpurezasseestablecendelasiguientemanera:
A-Lmitessonsobreel total deimpurezas
B-Sedocumentanlosperfilesdepureza
C-Los lmites parasolventes residuales sebasan sobrelatoxicologade
losmismos
D-Contaminantes inorgnicos son determinados por prueba lmite de
metalespesadosopor residuodeignicin.
E-Seestablecenlmitesapropiadosparaimpurezastxicas
F-Si fuesenecesariosecontrolapurezaenantiomrica
3-REGULACIONES Y REQUERIMIENTOS
3.2-RequerimientosIndustriales
NDA (New Drug Application)
Durante esta etapa un material de referencia de pureza definida debe
estar disponible, los mtodos analticos son validados, las impurezas y
perfilesdedegradacinsonconocidosy lapurezaenantiomricahasido
evaluada.
Comopuntosmsrelevantesdeesteestudiopodemosmencionar:
a)Laconsistenciadel perfil depurezadeladrogahasidoestablecida
b)Los lmites propuestos en IND son revisados y ajustados sobre la
experienciadefabricacinylosdatostoxicolgicos
c)Impurezas presentes en cantidades significativas son identificadas y
lmitesindividualessoncolocados
d)Los perfiles de pureza de los lotes para produccin no deben diferir
significativamentedeloslotesdeestudiosclnicosytoxicolgicos
e)Lmitesparasolventesresiduales
f)Lmitesparacontaminantesinorgnicos
3-REGULACIONES Y REQUERIMIENTOS
3.3-GuasICH
Contenido y calificacin de impurezas en un nuevo principio activo
obtenidopor vasinttica.
Lasimpurezasseevalandesdedosperspectivas
Qumica: Incluyeclasificacin, identificacin, elaboracinderegistros,
conjuntodeespecificacionesydiscusindel mtodoanalticoaplicado.
Riesgo biolgico: Calificacindeimpurezas.
3-REGULACIONES Y REQUERIMIENTOS
3.3-GuasICH
Qumica
Clasificacindeimpurezas
Lasclasificaentrescategoras
Impurezas Orgnicas
Impurezas Inorgnicas
Solventes Residuales
Impurezas Orgnicas: pueden atribuirseal proceso demanufacturao la
estabilidad del principio activo, son identificables o no, voltiles o no
voltiles eincluyen materiales departida, subproductos, intermediarios,
productos de degradacin y varios (reactivos, ligandos, catalizadores).
Todasaqullasmayoresde0,1% debenser identificadasaexcepcinde
lastxicas.
3-REGULACIONES Y REQUERIMIENTOS
3.3-GuasICH(Q3A yQ3B)
Qumica
Clasificacindeimpurezas
Impurezas Inorgnicas: Generalmente son conocidas e identificadas
incluyen: metales pesados, sales inorgnicas y otros materiales. Los
lmitessonbasadosenlasFarmacopeas.
Solventesresiduales: Sonlquidosorgnicosusadosdurantelasntesis.
Sondetoxicidadconociday seagrupanentres clases. Los deClase o
Tipo I que son los que deben evitarse por ser muy txicos o ser
peligrosos parael medio ambiente; los deClase o Tipo II quepueden
ser utilizadoslimitandosuconcentracinsegnloespecificadoencada
caso; losdeClase oTipo III queseutilizansegnlasBuenasPrcticas
deFabricaciny Control (BPFC) y por ltimohay ungrupoenel cual
latoxicidadnohasidodemostrada.
Seexcluyendeestaguapolimorfoseimpurezasenantiomricas.
3-REGULACIONES Y REQUERIMIENTOS
3.3-GuasICH
Qumica
Registroencadabatch
Identidaddel batchytamao
Fechadefabricacin, lugar defabricacinyprocesodefabricacin
Contenidodeimpurezas, total eindividual
Referenciadel procedimientoanalticousado
Especificacionessobreloslmitesdeimpurezas
El nuevoprincipioactivodeberaincluir lmitespara:
Cadaimpurezaidentificada
Cadaimpurezanoidentificadamayor del 0,1%
Cualquier impurezainespecficaconunlmitemayor al 0,1%
Impurezastotales
Solventesresiduales
Impurezasinorgnicas
3-REGULACIONES Y REQUERIMIENTOS
3.3-GuasICH
Calificacin de Impurezas
Proceso de adquisicin y evaluacin de datos que establecen la
seguridad biolgicadeun producto dedegradacin o un perfil dado a
l olosnivelesespecificados.
El solicitante debe proporcionar la razn para la seleccin de los
lmitesbasadaenconsideracionesdeseguridadbiolgica.
Si el nivel se encontr seguro con los estudios, se considera
calificada.
Si es un metabolito puede no necesitar calificacin y se puede
justificar sunivel.
Los estudios dependen de : la poblacin, dosis diaria y la va y
duracindelaadministracin.
4-PELIGROS Y DESVENTAJ AS DE LAS IMPUREZAS
Cada impureza de una droga requiere un estudio especial y un juicio
equilibradoantesdedecidir laspruebasparasucontrol.
4.1-Impurezas Txicas
Son las impurezas que se controlan con ms rigurosidad porque
puedenproducir intoxicacionesagudasocrnicas.
Elementos txicos metlicos como el arsnico, antimonio, metales
pesados como plomo, cadmio y mercurio, son potentes venenos
nerviosos.
Elementosnometlicos: boroyselenio.
Compuestosorgnicostxicosqueacompaanalosprincipiosactivos
como contaminantes originales en el proceso de manufactura o son
productosdedegradacin.
Se aplican pruebas cuantitativas, particularmente para aqullos
compuestos que son administrados durante mucho tiempo al paciente
como por ejemplo: antireumticos, estimulantes cardacos,
antihipertensivos, etc.
4-PELIGROS Y DESVENTAJ AS DE LAS IMPUREZAS
4.2-Impurezas que generan alteraciones
Impurezas que actan como agentes activos en procesos de
degradacincomo:
Agua reaccionesdehidrlisis.
ImpurezasmetlicascomoFe, Cu, etc.- catalizadores.
4.3-Impurezas que producen incompatibilidades
Estasimpurezasgeneranincompatibilidadesfarmacotcnicascomopor
ejemplo: agua deficientemente destilada o deionizada; otro caso es la
cesindesilicatossolublescuandoseutilizanenlosenvasesvidriosno
neutroscuyaalcalinidadpuedeprovocar diversasreaccionessobretodo
eninyectables.
5-ORIGEN DE LAS IMPUREZAS EN PRODUCTOS
FARMACUTICOS
5.1-Impurezas relacionadas con la sntesis
Es la mayor fuente de impurezas y es deseable que los mtodos sean
rigurososyfactiblesdeser aplicados, sepuedenmencionar:
Materialesdepartida
Solventes
Intermediarios
Penltimointermediario
Subproductos
5.2-Impurezas relacionadas con la formulacin
Excipientes
Condicionesdelaformulacin
Soluciones y suspensiones puedendar lugar areacciones dehidrlisis
ysolvlisis.
Reaccionesenestadoslido(comprimidosycpsulas)
Reaccionesdeoxidacinyfotosensibilizacin
5-ORIGEN DE LAS IMPUREZAS EN PRODUCTOS
FARMACUTICOS
5.3-Impurezas relacionadas con la estabilidad
Estabilidad intrnseca del principio activo como reacciones
hidrolticas, deoxidacin, fotoqumicas, etc.
Estabilidaddel envase
Estabilidadenel transporte
Estabilidadenmanosdel paciente
5.4-Impurezas provenientes del envase
5.5-Otras fuentes de impurezas
ContaminacincruzadadebidaalanoaplicacindelasBPFC
6-AISLAMIENTO Y CARACTERIZACIN DE
IMPUREZAS
6.1-Impurezas extrables
Pueden ser extradas teniendo en cuenta su acidez, basicidad o
neutralidad
Laextraccininvolucraunaextraccinlquido-lquido dondeunafase
es acuosa y la otra es orgnica. Por ejemplo una impureza bsica la
tengo en faseacuosacidaantes queen lafaseorgnicay viceversa, lo
que permitira ajustando el pH separar las impurezas de acuerdo a su
naturaleza
6.2-Impurezas cromatografiables
La separacin se basa en propiedades tales como adsorcin, particin,
intercambioinicootamaomolecular.
CCD es lafavoritacomo tcnicacualitativapor susimplicidady bajo
costo. Es difcil obtener una buena precisin (RSD <2%). Su mayor
utilidadesenel anlisissemicuantitativo
6-AISLAMIENTO Y CARACTERIZACIN DE
IMPUREZAS
6.2-Impurezas cromatografiables
CG es paracompuestos voltiles, puedenderivatizarsepero
noeslorecomendableparael anlisisfarmacutico
CLAE es una tcnica excelente para separar y cuantificar
impurezas. Puede ser utilizada en fase normal o en fase
reversa. til paracompuestosnovoltilesytermolbiles
CE es una tcnica relativamente nueva para el anlisis
farmacutico de impurezas. No se encuentra en las
monografasdelasnormasoficiales
7-CLASIFICACIN DE IMPUREZAS
Los criterios de clasificacin se pueden basar en la frecuencia de
aparicinosegnlastcnicasdecaracterizacin.
En el caso de la frecuencia de aparicin se pueden clasificar en
impurezas comunes o especficas.
Impurezas comunes
Suelen estar presentes en un gran nmero de principios activos
diferentes. Por ejemplo: cloruros, sulfatos, metales pesados, arsnico,
sustanciasfcilmentecarbonizables, etc.
Impurezas especficas
Son aqullas propias o exclusivas de un determinado producto. Por
ejemplo: glicerina en glicerofosfatos, (+) adrenalina en (-) adrenalina,
cido saliclico en cido acetilsaliclico, 5-hidroximetilfurfural en
glucosa, etc.
7-CLASIFICACIN DE IMPUREZAS
Segn las tcnicas de caracterizacin se dividen en impurezas
determinadas o indeterminadas.
Impurezas determinadas
Son aqullas que representan una determinada especie qumica. Por
ejemplo: arsnico, plomo, agua, cido saliclico en aspirina, 5-
hidroximetilfurfural englucosa, etc.
Impurezas indeterminadas
Son aqullas que se investigan globalmente sin interesar su
composicin. Por ejemplo: cenizas, residuos solubles o insolubles,
sustanciasfcilmentecarbonizables, etc.
8-CRITERIOS PARA CUANTIFICAR IMPUREZAS
Criterio cualitativo
Esel queseaplicaalasreaccionesopruebasdetodoonada, dondela
ausenciao presenciadelaimpurezasern evaluados nicamentepor la
sensibilidad del ensayo. Estas tcnicas suelen llamarse ensayos en los
quenohayraznvisible.
Unresultadonegativonoimplicaausenciacompletadeimpurezaspor lo
tantonosonmuyutilizadosenlasfarmacopeas.
Criterio semicuantitativo (mtodos de comparacin)
Las pruebas deestetipo requierenunpatrnquecontengaunacantidad
definida de impureza para ser sometido al mismo tiempo y en las
mismas condiciones de la prueba. Son las ms comunes en las
Farmacopeas.
Criterio cuantitativo
Son aplicados en circunstancias especiales. El mtodo es utilizado en
muchosensayoslmitesdeimpurezasindeterminadascomopor ejemplo:
residuodeignicin, materiainsoluble, etc.
Anda mungkin juga menyukai
- Unidad 6 - Sistema de Agua Calidad FarmacéuticaDokumen70 halamanUnidad 6 - Sistema de Agua Calidad Farmacéuticamaraperezlindo100% (3)
- Guía para Tener Mejor Disciplina - Aprende InstituteDokumen14 halamanGuía para Tener Mejor Disciplina - Aprende InstituteMauricio DavidBelum ada peringkat
- Necronomicon PDFDokumen95 halamanNecronomicon PDFFenrir Rock100% (1)
- Cur So 20130416Dokumen188 halamanCur So 20130416Clausha1606100% (2)
- Síntesis y propiedades de la metenamina como agente antimicrobianoDokumen5 halamanSíntesis y propiedades de la metenamina como agente antimicrobianoBRAYAN ALEXÁNDER CERON CRUZBelum ada peringkat
- Instalacion Aire ComprimidoDokumen17 halamanInstalacion Aire Comprimidomavi sanchez100% (2)
- Calibración QuímicaDokumen139 halamanCalibración Químicamaraperezlindo60% (5)
- PNO MGA 0041 Determinación Agua Por Karl FischerDokumen10 halamanPNO MGA 0041 Determinación Agua Por Karl FischerJude LizowskyBelum ada peringkat
- In-Pqc-13 Determinación de Color Total para Colorantes Solubles y LacasDokumen8 halamanIn-Pqc-13 Determinación de Color Total para Colorantes Solubles y Lacascesar quinteroBelum ada peringkat
- Norma de Aceites y Grasas PDFDokumen10 halamanNorma de Aceites y Grasas PDFjosue alvarez vargasBelum ada peringkat
- Nube Minera Planificacion Open Pit Seleccion Del Metodo de ExplotacionDokumen61 halamanNube Minera Planificacion Open Pit Seleccion Del Metodo de ExplotacionRodrigo Sánchez FazioBelum ada peringkat
- Manual CompresorDokumen33 halamanManual CompresorSebastian Rodrigo Contreras Gamboa100% (1)
- Validación de Un Método Por RP-HPLC para La Determinación de Tiocolchicósido en TabletasDokumen7 halamanValidación de Un Método Por RP-HPLC para La Determinación de Tiocolchicósido en TabletasVarinia ZubiletaBelum ada peringkat
- IE - Medicamentos - FiscalizaciónDokumen64 halamanIE - Medicamentos - Fiscalizaciónvito12elunicoBelum ada peringkat
- Calculos Isotonicidad 2019-2Dokumen1 halamanCalculos Isotonicidad 2019-2Mily SisalimaBelum ada peringkat
- TC - Informe 6 Pomadas Lab de Farmaceutica IiDokumen7 halamanTC - Informe 6 Pomadas Lab de Farmaceutica IiTamara VeraBelum ada peringkat
- Biorremediación Con Pseudomonas SPPDokumen10 halamanBiorremediación Con Pseudomonas SPPAdriian PortilloBelum ada peringkat
- Aguacate para prevenir el envejecimiento prematuro de la pielDokumen61 halamanAguacate para prevenir el envejecimiento prematuro de la pielwilberBelum ada peringkat
- Guia de Ejercicios Farmacia IndustrialDokumen5 halamanGuia de Ejercicios Farmacia IndustrialFlorent TobarBelum ada peringkat
- Control de CalidadDokumen14 halamanControl de CalidadMarcia CV100% (1)
- Elaboración Jarabe SimpleDokumen3 halamanElaboración Jarabe Simplecvs1019Belum ada peringkat
- Determinacion de La Cafeina y TeobrominaDokumen8 halamanDeterminacion de La Cafeina y TeobrominaAntonioBelum ada peringkat
- Taller 1 FisicoquimicaDokumen14 halamanTaller 1 FisicoquimicaJefferson MolanoBelum ada peringkat
- 0299 Uniformidad de DosisDokumen8 halaman0299 Uniformidad de DosisEdwinBelum ada peringkat
- Control de Calidad de Medicamentos - MinilabDokumen49 halamanControl de Calidad de Medicamentos - MinilabHernan OrtegaBelum ada peringkat
- Cuadro ComparativoDokumen2 halamanCuadro Comparativokaren michel ramirez carmonaBelum ada peringkat
- 51 Pruebas de Eficacia AntimicrobianaDokumen4 halaman51 Pruebas de Eficacia Antimicrobianatania zenaida oviedo latorreBelum ada peringkat
- Desarrollo de Formas Farmacéuticas Parenterales: Clorhidrato de Ciprofloxacino 10mg/ml IntravenosaDokumen12 halamanDesarrollo de Formas Farmacéuticas Parenterales: Clorhidrato de Ciprofloxacino 10mg/ml IntravenosaCristian PintaBelum ada peringkat
- Terbutil HidroquinonaDokumen13 halamanTerbutil HidroquinonatenoriomezuBelum ada peringkat
- Proyecto de Investigacion CapsulasDokumen7 halamanProyecto de Investigacion CapsulasJhon ChávezBelum ada peringkat
- Norma Calidad Farmacia HospitalariaDokumen47 halamanNorma Calidad Farmacia HospitalariaDavid Esteban Giraldo MinaBelum ada peringkat
- Industria 4Dokumen5 halamanIndustria 4Ivan CLBelum ada peringkat
- Nom 039 Ssa1 1993Dokumen4 halamanNom 039 Ssa1 1993ramiro0013404Belum ada peringkat
- Informe #9 - CafeínaDokumen5 halamanInforme #9 - CafeínaGeovanny Javier100% (1)
- Manual de Diseño y Estabilidad v-2013-EnE-01-1Dokumen26 halamanManual de Diseño y Estabilidad v-2013-EnE-01-1Dante MustaineBelum ada peringkat
- DisolucionesDokumen6 halamanDisolucionespaulinaBelum ada peringkat
- Procedimiento Subproductos - PropuestaECDokumen27 halamanProcedimiento Subproductos - PropuestaECKarla Marie Manrique VasquezBelum ada peringkat
- Validación cromatografía tableta Aciclovir 200 mgDokumen9 halamanValidación cromatografía tableta Aciclovir 200 mgJose OlveraBelum ada peringkat
- Mmmdeterminación de Paracetamol HPLCDokumen8 halamanMmmdeterminación de Paracetamol HPLCLUISA BERTHA ADUVIRI CORDOVABelum ada peringkat
- Tesis Sobre Industria Farmaceutica PDFDokumen181 halamanTesis Sobre Industria Farmaceutica PDFRenato Rios SBelum ada peringkat
- Estudio de Estabilidad de Losartan PotasicoDokumen16 halamanEstudio de Estabilidad de Losartan PotasicoChristian GonzalesBelum ada peringkat
- VALIDACIÓN UV-VIS PARA DETERMINAR TRAZAS DE RANITIDINA Y AMLODIPINODokumen9 halamanVALIDACIÓN UV-VIS PARA DETERMINAR TRAZAS DE RANITIDINA Y AMLODIPINOSebiitas Lpz Porras LiveBelum ada peringkat
- Protocolo BiodisponibilidadDokumen13 halamanProtocolo BiodisponibilidadSaúl de JesúsBelum ada peringkat
- Protocolo Orac - Red Cornucopia 2013Dokumen6 halamanProtocolo Orac - Red Cornucopia 2013Michael Bracamonte RomeroBelum ada peringkat
- Clase 6, Comprimidos 1 202320Dokumen40 halamanClase 6, Comprimidos 1 202320Michi AravenaBelum ada peringkat
- Casos Clinicos Finales 2021Dokumen5 halamanCasos Clinicos Finales 2021Chris L RGBelum ada peringkat
- Usp 2021Dokumen2 halamanUsp 2021Asistente LaboratorioBelum ada peringkat
- Syllabus FarmacognosiaDokumen57 halamanSyllabus Farmacognosiafreddyelmen100% (1)
- Practica 02 Normalidad y MolaridadDokumen5 halamanPractica 02 Normalidad y MolaridadDiego Parra TaipeBelum ada peringkat
- Guía Lab #3 CafeinaDokumen12 halamanGuía Lab #3 CafeinaGenesis Gamero GarciaBelum ada peringkat
- Evaluación calidad alimentosDokumen16 halamanEvaluación calidad alimentosJefry Jose González LopezBelum ada peringkat
- Orden Maestra de Fabricacion Trimetoprima y SulfametoxazolDokumen9 halamanOrden Maestra de Fabricacion Trimetoprima y SulfametoxazolEduardo A. Castillo BeltránBelum ada peringkat
- Disolucion SilimarinaDokumen97 halamanDisolucion SilimarinaStuard Montoya VizueteBelum ada peringkat
- Pruebas de DisoluciónDokumen19 halamanPruebas de DisoluciónaniluBelum ada peringkat
- Practica de LaboratorioDokumen5 halamanPractica de LaboratorioBryan De AllbaBelum ada peringkat
- Ensayo de Eficacia de ConservantesDokumen6 halamanEnsayo de Eficacia de Conservantesroberto cchBelum ada peringkat
- Protocolo para El Estudio de Estabilidad Del AcetaminofenDokumen6 halamanProtocolo para El Estudio de Estabilidad Del AcetaminofenHarold Betancourt PerezBelum ada peringkat
- Inspecciones farmacéuticas: nuevas estrategias y desafíos regulatoriosDokumen75 halamanInspecciones farmacéuticas: nuevas estrategias y desafíos regulatoriosarjom01Belum ada peringkat
- Determinación de glutamato monosódico en alimentos mediante titulación potenciométrica y biosensorDokumen9 halamanDeterminación de glutamato monosódico en alimentos mediante titulación potenciométrica y biosensorAngélica JiménezBelum ada peringkat
- Volumetría ácido-base no acuosaDokumen42 halamanVolumetría ácido-base no acuosaMelissa GomezBelum ada peringkat
- Determinación Del Porcentaje de Carboxihemoglobina Presente en Sangre Expuesta A Monóxido de Carbono Por Técnica EspectrofotométricaDokumen6 halamanDeterminación Del Porcentaje de Carboxihemoglobina Presente en Sangre Expuesta A Monóxido de Carbono Por Técnica EspectrofotométricaJosé Miguel Asmad QuintanaBelum ada peringkat
- Reporte SupositoriosDokumen25 halamanReporte SupositoriosEduardo Romero CanoBelum ada peringkat
- Ensayo Práctica 9Dokumen13 halamanEnsayo Práctica 9Gibran Meza CastrejonBelum ada peringkat
- Análisis Del Contenido de Proteínas en Los AlimentosDokumen31 halamanAnálisis Del Contenido de Proteínas en Los AlimentosÁlvaro YisusBelum ada peringkat
- Galenica IDokumen9 halamanGalenica IPrudenBelum ada peringkat
- Antisépticos urinarios NitrofurantoinaDokumen12 halamanAntisépticos urinarios NitrofurantoinaAmiel Carreon100% (1)
- Práctica 1Dokumen8 halamanPráctica 1Andrea Cordova CedilloBelum ada peringkat
- Impurezas en MedicamentosDokumen20 halamanImpurezas en MedicamentosCamilo Andres Pulgarin RestrepoBelum ada peringkat
- Ejemplo - Urs Iq Oq Equipo 2021Dokumen5 halamanEjemplo - Urs Iq Oq Equipo 2021maraperezlindoBelum ada peringkat
- Unidad 8 - Generalidades de Calificación y Validación 2021Dokumen37 halamanUnidad 8 - Generalidades de Calificación y Validación 2021maraperezlindoBelum ada peringkat
- Unidad 7 - Sistemas de AireDokumen66 halamanUnidad 7 - Sistemas de AiremaraperezlindoBelum ada peringkat
- Seminario Buenas Prácticas de Fabricación para La Producción Pública de MedicamentosDokumen2 halamanSeminario Buenas Prácticas de Fabricación para La Producción Pública de MedicamentosmaraperezlindoBelum ada peringkat
- Unidad 5 - Control de Calidad - FOPEVISADokumen58 halamanUnidad 5 - Control de Calidad - FOPEVISAmaraperezlindoBelum ada peringkat
- Unidad 3 - Generalidades de Instalaciones 2021Dokumen49 halamanUnidad 3 - Generalidades de Instalaciones 2021maraperezlindoBelum ada peringkat
- Unidad 4 - Productos No Estériles - NOVI21Dokumen47 halamanUnidad 4 - Productos No Estériles - NOVI21maraperezlindoBelum ada peringkat
- Transporte de PolvoDokumen43 halamanTransporte de PolvoLuis Daniel Rodriguez AbantoBelum ada peringkat
- Unidad 2 - Batch Record - OCT21Dokumen66 halamanUnidad 2 - Batch Record - OCT21maraperezlindoBelum ada peringkat
- Construir El Diagrama de Pareto en ExcelDokumen7 halamanConstruir El Diagrama de Pareto en Excelgmr79Belum ada peringkat
- Introduccion CalidadDokumen48 halamanIntroduccion CalidadRodrigo MayBelum ada peringkat
- Cali Brac I OnesDokumen32 halamanCali Brac I OnesIvan Alex EscobarBelum ada peringkat
- OEE: Cómo medir la eficiencia de maquinaria industrialDokumen5 halamanOEE: Cómo medir la eficiencia de maquinaria industrialbohormitaBelum ada peringkat
- Catalizadores Enzimas PDFDokumen22 halamanCatalizadores Enzimas PDFmaraperezlindoBelum ada peringkat
- Documentacion de Los S de GestionDokumen9 halamanDocumentacion de Los S de GestionChepy PiedraBelum ada peringkat
- OEE: Cómo medir la eficiencia de maquinaria industrialDokumen5 halamanOEE: Cómo medir la eficiencia de maquinaria industrialbohormitaBelum ada peringkat
- Procesos SubprocesosDokumen28 halamanProcesos SubprocesosLaura Camila PradaBelum ada peringkat
- TrazabilidadDokumen33 halamanTrazabilidadJulieth Rodríguez100% (1)
- Especificación DataloggerDokumen1 halamanEspecificación DataloggermaraperezlindoBelum ada peringkat
- A-TecPin I A VDokumen250 halamanA-TecPin I A VCamila HonoratoBelum ada peringkat
- TrazabilidadDokumen33 halamanTrazabilidadJulieth Rodríguez100% (1)
- Introduccion CalidadDokumen48 halamanIntroduccion CalidadRodrigo MayBelum ada peringkat
- Gestión Cal Ind FarmDokumen32 halamanGestión Cal Ind FarmmaraperezlindoBelum ada peringkat
- Procesos SubprocesosDokumen28 halamanProcesos SubprocesosLaura Camila PradaBelum ada peringkat
- Termohigr Metro Tfa 30 5010Dokumen1 halamanTermohigr Metro Tfa 30 5010maraperezlindoBelum ada peringkat
- Recibo de Pago de Nómina: EmisorDokumen1 halamanRecibo de Pago de Nómina: EmisorLuis Alberto SEquera FloresBelum ada peringkat
- Mantenimiento de La Fauna en CautiverioDokumen21 halamanMantenimiento de La Fauna en CautiverioHelena VillegasBelum ada peringkat
- Lqui U2 A1 JocmDokumen4 halamanLqui U2 A1 JocmJoSuE CrUz MeRiNo100% (2)
- Aplicación Del Enfoque Modular-Transformacional Al Análisis de Lars, en La Película Lars y Una Chica RealDokumen50 halamanAplicación Del Enfoque Modular-Transformacional Al Análisis de Lars, en La Película Lars y Una Chica RealAsspounder100% (1)
- Brochure ELCOPE 2020 Web PDFDokumen18 halamanBrochure ELCOPE 2020 Web PDFKaren Selene Manrique RetoBelum ada peringkat
- Examen Parcial Unidad I 2022-2Dokumen2 halamanExamen Parcial Unidad I 2022-2lesli atencioBelum ada peringkat
- Diseño de Muros de Albañileria ConfinadaDokumen204 halamanDiseño de Muros de Albañileria Confinadaaron chigneBelum ada peringkat
- Contrato de Cesion Alejandro Minero Tres XXX Con CorreccionDokumen5 halamanContrato de Cesion Alejandro Minero Tres XXX Con CorreccionPedroBelum ada peringkat
- Conpes 155-1Dokumen1 halamanConpes 155-1leidy100% (1)
- Dolor RadicularDokumen13 halamanDolor RadicularchareutreraBelum ada peringkat
- Caso de Estudio Segregación de Residuos PeligrososDokumen13 halamanCaso de Estudio Segregación de Residuos PeligrososCamilo ValenciaBelum ada peringkat
- El Tratamiento Endodóntico Desde La Óptica de La Odontología Restauradora 910-3516-1-PB PDFDokumen16 halamanEl Tratamiento Endodóntico Desde La Óptica de La Odontología Restauradora 910-3516-1-PB PDFgcanovas20072367Belum ada peringkat
- Monografia PDFDokumen81 halamanMonografia PDFzulyleonardoBelum ada peringkat
- Anexo D. Plan Manejo Residuos Solidos PDFDokumen53 halamanAnexo D. Plan Manejo Residuos Solidos PDFRøSy Alvaradø CBelum ada peringkat
- Tipos y características de volcanesDokumen8 halamanTipos y características de volcanesFiorella Melisa Vilela LozadaBelum ada peringkat
- Motivaciones para Investigar en El Campo de La Salud. Conocimiento e Innovación. Reflexiones CríticasDokumen11 halamanMotivaciones para Investigar en El Campo de La Salud. Conocimiento e Innovación. Reflexiones CríticasJulieta PryszlakBelum ada peringkat
- Estructura Organizativa y Funcional Institucional (Senasag)Dokumen8 halamanEstructura Organizativa y Funcional Institucional (Senasag)RogerBelum ada peringkat
- Infografia Desarrollo SostenibleDokumen1 halamanInfografia Desarrollo SostenibleHarold Molina AriasBelum ada peringkat
- Codornices Alimentadas Con LarvasDokumen46 halamanCodornices Alimentadas Con LarvasJorge OrtizBelum ada peringkat
- Teoría de GinzbergDokumen20 halamanTeoría de GinzbergOtto José Lizardo50% (2)
- Generalidades de HongosDokumen1 halamanGeneralidades de HongosBarajas Vargas Kathia BeatrizBelum ada peringkat
- Tabla Nutricional Pimentón PDFDokumen6 halamanTabla Nutricional Pimentón PDFJonathan MolinaBelum ada peringkat
- Instrucciones Autoinyeccion Sayana PressDokumen5 halamanInstrucciones Autoinyeccion Sayana PressNeyda GuevaraBelum ada peringkat
- Transducción hormonal y señalización celularDokumen19 halamanTransducción hormonal y señalización celularMARCOS VARGASBelum ada peringkat
- FarmacoDokumen3 halamanFarmacoSara RiveraBelum ada peringkat
- PARASHA 14 VAER - para Ni - Os de 6-10 A - OsDokumen10 halamanPARASHA 14 VAER - para Ni - Os de 6-10 A - OsMario KoganBelum ada peringkat
- Enlace Covalente 2013 BreveDokumen57 halamanEnlace Covalente 2013 BreveLópez Vázquez Carlos YaelBelum ada peringkat