I. Tabulacion de Datos Y Resultados
Diunggah oleh
Mario Salas Pastor0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
59 tayangan15 halamanEste documento presenta los resultados de un experimento para determinar cómo varía la solubilidad del ácido benzoico con la temperatura. Se midieron las molalidades a 20°C y 25°C y se calculó el calor diferencial de disolución teórico y experimental. El valor teórico fue de 25.23 kJ/mol y el experimental fue de 22.08 kJ/mol, con un error del 12.5%. El experimento confirma que la solubilidad de un sólido aumenta con la temperatura.
Deskripsi Asli:
Judul Asli
11
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOC, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniEste documento presenta los resultados de un experimento para determinar cómo varía la solubilidad del ácido benzoico con la temperatura. Se midieron las molalidades a 20°C y 25°C y se calculó el calor diferencial de disolución teórico y experimental. El valor teórico fue de 25.23 kJ/mol y el experimental fue de 22.08 kJ/mol, con un error del 12.5%. El experimento confirma que la solubilidad de un sólido aumenta con la temperatura.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
59 tayangan15 halamanI. Tabulacion de Datos Y Resultados
Diunggah oleh
Mario Salas PastorEste documento presenta los resultados de un experimento para determinar cómo varía la solubilidad del ácido benzoico con la temperatura. Se midieron las molalidades a 20°C y 25°C y se calculó el calor diferencial de disolución teórico y experimental. El valor teórico fue de 25.23 kJ/mol y el experimental fue de 22.08 kJ/mol, con un error del 12.5%. El experimento confirma que la solubilidad de un sólido aumenta con la temperatura.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 15
Universidad Nacional Mayor de San Marcos
I.TABULACION DE DATOS Y RESULTADOS.
CONDICIONES DE LABORATORIO
PRESION 756 mmHg
TEMPERATURA 23 C
% HUMEDAD 96 %
Tabla1: Pesos Moleculares de los Compuestos Utilizados y
Normalidad Terica del NaOH.
PM Biftalato de Potasio. 204.23 g/mol
PM cido benzoico 122.12 g/mol
Normalidad Teo. del NaOH 0.1 N
Tabla 2: Calculo de la Normalidad del NaOH Valorado con el
Biftalato de Potasio.
W Biftalato de Potasio 0.300 g
Volumen del Biftalato 0.01 L
Volumen Gastado de NaOH 0.118 L
Normalidad corregida de NaOH 0.1245 N
Tabla 3: Datos Obtenidos en el Experimento.
T C W Erlenmeyer
Vacio
W Erlenmeyer +
Solucin
Volumen gastado
deNaOH
20 77.9046 g 87.7492 g 2.10 ml
20 74.2779 g 84.7810 g 2.20 ml
25 83.2235 g 93.1078 g 2.55 ml
25 92.4380 g 102.2946 g 2.30 ml
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura1
Universidad Nacional Mayor de San Marcos
Tabla 4: Determinacin del Peso de la Solucin, el Numero
de Equivalentes y el peso del cido Benzoico, para cada
Temperatura.
T C W Sol= (W Erlenmeyer + Sol)
(W Erlenmeyer Vacio)
#Eq cido
Benzoico
W cido
Benzoico
20 9.8446 g 0.0002615 0.03193 g
20 10.5031 g 0.0002739 0.03345 g
25 9.8843 g 0.0003175 0.03877 g
25 9.8566 g 0.0002864 0.03498 g
Tabla 5: Determinacin del Peso del Agua en la Solucin y la
Concentracin molal del cido Benzoico.
W Agua = W Sol W Ac Benzoico Molalidad del Ac Benzoico
9.813 g 0.026645 m
10.47 g 0.026162 m
9.846 g 0.032244 m
9.822 g 0.029163 m
Tabla 6: Datos tericos de Molalidad y temperatura para
Construir el grafco Ln
ms
Vs 1/T y encontrar el H (Calor
Diferencial de Disolucin Terico)
TC T K 1/T Molalidad Ln
ms
20 293.15 0.003411 0.048 -3.03655
25 298.15 0.003354 0.057 -2.86470
H Calor Diferencial de Disolucin Terico
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura2
Universidad Nacional Mayor de San Marcos
6029.82 cal/mol <> 25.23 KJ/mol
Tabla 7: Datos Experimentales de la Molalidad y
Temperatura para Construir el grafco Ln
ms
Vs 1/T y
encontrar el H (Calor Diferencial de Disolucin
Experimental)
T C T K 1/T Molalidad Prom. Ln
ms
20 293.15 0.003411 0.0264035 -3.63426
25 298.15 0.003354 0.030705 -3.48333
H Calor Diferencial de disolucin Experimental
5276.72 cal/mol <> 22.08 KJ/mol
Tabla 8: Calculo del porcentaje de error del Calor Diferencial
de Disolucin ( H )
Error Experimental ( E
ex %
)
12.5 %
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura3
Universidad Nacional Mayor de San Marcos
II.EJEMPLO DE CALCULOS.
Se Trabajo la solucin de cido benzoico a 20C y 25C y se
tomaron dos muestras a una sola temperatura por lo tanto en
los clculos para grafcar la molalidad se tomo el promedio de
estas dos (ver tabla 5 y 7) y se realizaron los clculos a estas
temperaturas.
1) Calculo de la Normalidad Corregida del NaOH.
Para hallar la normalidad corregida valoramos la solucin de
NaOH con biftalato de Potasio, usando fenolftaleina como
indicador.
Datos Tericos:
PM de Biftalato de Potasio = 204,23 g/mol
Normalidad terica del NaOH = 0.1 N
P.Eq-Biftalato de Potasio =204.23 g/Eq
P.Eq- Ac Benzoico = 122.12 g/Eq
Datos Experimentales:
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura4
Universidad Nacional Mayor de San Marcos
W Biftalato de potasio = 0.300 g
Volumen Gastado del NaOH = 11.8 ml = 0.0118 L
Sabemos que:
# Eq - g NaOH = # Eq - g Biftalato de potasio
V NaOH x N
corre
NaOH = W biftalato de K / P Eq-Biftalato de K
Reemplazando:
N
corre
NaOH = 0.300/204.23 x 0.0118
= 0.1245 N
2) Calculo del peso de la Solucin, el Numero de
Equivalentes y el Peso del Ac cido Benzoico, para cada
Temperatura.
Calculo del Peso de la Solucin de Ac Benzoico a 20C.
W1 Erlenmeyer vacio. = 77.9046 g
W1 Erlenmeyer + Sol. = 87.7492 g
W2 Erelnmeyer Vacio = 74.2779 g
W2 Erlenmeyer +Sol. = 84.7810 g
W Sol= W Erlenmeyer + Sol - W Erlenmeyer vacio
W1 Sol = 87.7492 77.9046 g
W1 Sol = 9.8446 g
W2 Sol = 84.7810 74.2779 g
W2 Sol = 10.5031 g
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura5
Universidad Nacional Mayor de San Marcos
Calculo del Numero de Equivalentes del Ac Benzoico a
20C.
V1 gastado de NaOH= 2.10 ml =0.0021 L
V2 gastado de NaOH = 2.20 ml =0.0022 L
Se obtiene de la siguiente igualdad:
# Eq.- g. Ac. Benzoico = # Eq.- g. NaOH
# Eq.- g. HBZ = N
corre
NaOH x Vgastado NaOH
# Eq1.- g. HBZ= 0.1245 N x 0.0021 L
# Eq1.- g. HBZ= 0.0002615 Eq-g
# Eq2.-g HBZ = 0.1245 N x 0.0022 L
# Eq2.-g HBZ = 0.0002739 Eq-g
Calculo del peso de cido Benzoico a 20C
Sabemos que:
# Eq.- g. Ac Benzoico = W HBZ / P. eq. HBZ
Despejando tenemos que:
W HBZ = # Eq - g HBZ x P. eq. - HBZ
W1HBZ = 0.0002615 eq x 122.12 g /eq
W1HBZ = 0.03193 g
W2 HBZ = 0.0002739 eq x 122.12 g/eq
W2 HBZ = 0.03345 g
3) Calculo del Peso del Agua en la Solucin y la molalidad
del Ac. Benzoico.
Calculo del Peso del Agua de la Solucin a 20C
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura6
Universidad Nacional Mayor de San Marcos
Se determina por:
W H
2
O = W Sol - W HBZ
W1 H
2
O = (9.8446 - 0.03193) g
W1H
2
O = 9.813 g. = 0.009813 kg
W2H2O = (10.5031-0.03345) g
W2H2O = 10.47 g = 0.01047kg
Calculo del Numero de moles de cido Benzoico a 20C.
Sabemos que:
Moles HBZ = W HBZ / P.M HBZ
moles1 HBZ = 0.03193 g / 122.12 g/mol
moles1HBZ = 0.0002615 mol
moles2HBZ = 0.03345 g / 122.12 g/mol
moles2HBZ = 0.000274 mol
Calculo de la molalidad (m) del cido Benzoico a 20C.
Sabemos que:
m = moles HBZ /Peso en Kg de H
2
O
m1 = 0.0002615 mol / 0.009813Kg
m1 = 0.026645 mol / kg
m2 = 0.000274 mol / 0.01047kg
m2 = 0.026162 mol/kg
De la misma manera se realiza los clculos para la temperatura
de 25C y los resultados obtenidos se observan en las tablas.
4) Calculo del Calor Diferencial de la Disolucin (H),
(Terico y Experimental), y el Porcentaje de Error.
Sabemos que:
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura7
C
T R
H
Ln
ds
ms
+
=
1
Universidad Nacional Mayor de San Marcos
Donde:
H
ds
= Calor diferencial de la disolucin.
R = 2 cal/ mol K.
Ln
ms
= Logaritmo natural de la molaliddad de la disolucin.
1/T = inversa de la temperatura en grados absolutos (K).
C = Constante.
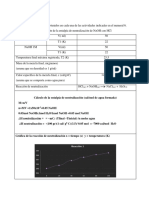
Al construir la grfca Ln
ms
Vs 1/T, podemos aproximarla
mediante una ecuacin lineal de la forma:
Entonces comparando se tiene que:
B= -H
ds
/ R A= C = cte.
Calculo de la Pendiente y el H
ds
con los Datos Tericos.
1/T Ln
ms
0.003411 -3.03655
0.003354 -2.86470
Entonces:
B= -3014.91 = -H
ds
/ 2 cal/mol K
Se Obtiene:
H
ds Teorica
= 6029.82 cal/mol (4.184 J/cal) (1KJ/1000 J) =
25.23 KJ/mol
Calculo de la Pendiente y el H
ds
con los Datos
experimentales.
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura8
A Bx y + =
Universidad Nacional Mayor de San Marcos
Como tomamos dos muestras a la misma temperatura tomamos
el promedio de estas para poder grafcarlas.
Molalidad del Ac Benzoico
0.026645 m
0.026162 m
0.032244 m
0.029163 m
Las molalidades resultante fueron:
0.0264035 y 0.030705 que al tomarles su logaritmo natural se
obtienen los datos de la siguiente tabla
1/T Ln
ms
0.003411 -3.63426
0.003354 -3.48333
Entonces:
B= -2638.36 = -H
ds
/ 2 cal/mol K
Se Obtiene:
H
ds experiemntal
= 5276.72 cal/mol (4.184 J/cal) (1KJ/1000 J) =
22.08 KJ/mol
Calculo del Error Experimental:
(Valor Terico Valor Experimental / Valor Terico) X 100
Reemplazando:
(25.23 22.08) / 25.23 = 12.5 %
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura9
Universidad Nacional Mayor de San Marcos
III.DISCUSION DE RESULTADOS.
Al Hallar la normalidad corregida del NaOH, se obtuvo un
valor muy cercano al valor terico, lo cual nos indica que
esta en un rango apreciable.
Con la normalidad corregida se calculo el numero de
equivalentes y con este dato el peso de cido benzoico
presente en la solucin a las diferentes temperaturas
respectivamente. Se puede observar que conforme disminuye
la temperatura el peso de cido benzoico disminuye en la
solucin esto se debe a que el cido benzoico es mas soluble
a una temperatura elevada.
Este experimento afrma lo que tericamente se ha estudiado
En la mayora de los casos, aunque no en todos la solubilidad
de una sustancia slida aumenta con la temperatura.
Los errores cometidos, se pueden deber a diversos factores
como la mala pesada en las muestras slidas y en los
erlenmeyer, al momento de pipetear la solucin de cido
benzoico se pudieron absorber cristales a pesar del fltro
colocado en la pipeta, otro motivo pudo haber sido que al
empezar a disolver el cido benzoico agitndose la solucin
con una bagueta, perdi un poco de muestra la cual se
adhiri a las paredes de la bagueta. Pero estos errores
cometidos pueden superarse a travs de la experiencia.
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura10
Universidad Nacional Mayor de San Marcos
El valor terico de H obtenido con las molalidades tericas a
las temperaturas ya conocidas es parecida al encontrado
experimentalmente variando en un mnimo porcentaje.
IV.COCLUSIONES.
En la mayora de los casos, pero no en todos, la solubilidad
de una sustancia slida aumenta con la temperatura.
Los slidos apreciablemente se disuelven solo en solventes
polares, particularmente el agua.
La solubilidad de un slido en un liquido es siempre limitada
y el limite para un mismo solvente es diferente segn las
distintas sustancias dependiendo fundamentalmente de la
temperatura.
En general la solubilidad es la concentracin de soluto en
una disolucin saturada.
Se comprob experimentalmente que a medida que la
temperatura disminuye la solubilidad tambin disminuye en
el cido benzoico.
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura11
Universidad Nacional Mayor de San Marcos
V.RECOMENDACIONES.
Lavar y secar en la estufa todo el material de vidrio.
Evitar las perdida de reactivo (Ac Benzoico) ya sea en las
paredes del erlenmeyer o al momento disolverlo
introduciendo la bagueta.
Cuando el slido se ha disuelto totalmente para no perder
tiempo esperando que baje la temperatura y medir la
solubilidad se recomienda llevar el erlenmeyer a baos de
agua fra, observndose siempre la temperatura a la cual
quieres probar la solubilidad.
Al momento de pipetear la solucin es aconsejable cambiar el
algodn del fltro que se encuentra en la pipeta para evitar
que el slido se acumule en este.
El cido benzoico se debe disolver en agua destilada
previamente calentada, ya que la solubilidad de este es mayor
en caliente.
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura12
Universidad Nacional Mayor de San Marcos
VI.APENDICE.
1.-Defna solucin Saturada.
Se denomina as a la mxima cantidad de soluto que puede ser
disuelta en una cantidad determinada de disolvente (solvente).
2.- Que relacin existe entre el calor diferencial de
disolucin, la temperatura y las caractersticas de la
sustancia?
El calor diferencial es el cambio de calor asociado al proceso de
dilucin. Si cierto proceso de dilucin es endotrmico y la
solucin se diluye con posterioridad, la misma solucin absorbe
mas calor de los alrededores. Lo contrario ocurre en un proceso
exotrmico de disolucin: se libera mas calor si se agrega mas
disolvente, para diluir la disolucin.
3.- En la ecuacin que relaciona la concentracin de la
solucin saturada con la temperatura. Fundamente el uso
de la concentracin molal.
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura13
Universidad Nacional Mayor de San Marcos
Se usa la concentracin molal ya que es la nica formula que
nos relaciona ala ves el numero de moles del soluto y el peso
del solvente (H
2
O) en kilogramos.
Esta relacin se adecua mas en los problemas de solubilidades
por relacionar soluto y solvente a la ves.
VII.BIBLIOGRAFIA
Fisicoqumica Ponz Muzzo, Gaston
Sexta edicin
Editorial Universo
Fundamentos de Fisicoqumica Maron - Prutton
Editorial Limusa
Mxico - 1984
Tratado de Qumica Fsica Samuel Glasstone,
Editorial Madrid
SptimaEdicin - 1979
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura14
Universidad Nacional Mayor de San Marcos
Laboratorio de Fisicoqumica II Variacin de la
Solubilidad con la Temperatura15
Anda mungkin juga menyukai
- Laboratorio Numero 11Dokumen15 halamanLaboratorio Numero 11Anonymous fPGiYHFYBelum ada peringkat
- Informe 3 Lab de Fiqui - Variación de La Solubilidad Con La TemperaturaDokumen6 halamanInforme 3 Lab de Fiqui - Variación de La Solubilidad Con La TemperaturaPIERO MATIAS HERRERA SUAREZBelum ada peringkat
- Calor NeutDokumen10 halamanCalor NeutLaura Bustamante CalleBelum ada peringkat
- Determinación de Bicarbonato en AlkaDokumen4 halamanDeterminación de Bicarbonato en AlkaJavier QuirogaBelum ada peringkat
- Solubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Dokumen10 halamanSolubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Oscar Portillo100% (1)
- Calordeneutralizaci N 2Dokumen9 halamanCalordeneutralizaci N 2Laura Bustamante CalleBelum ada peringkat
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDokumen19 halamanTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoBelum ada peringkat
- Conclusiones, Recomendaciones y Cuestionario - Laboratorio 2 de FisicoquímicaDokumen8 halamanConclusiones, Recomendaciones y Cuestionario - Laboratorio 2 de FisicoquímicaMaria AlessandraBelum ada peringkat
- Equilibrio-Químico MejoradoDokumen8 halamanEquilibrio-Químico MejoradoJhoel Ivan Diaz PaucarBelum ada peringkat
- Calores de Neutralizacion y SolucionDokumen6 halamanCalores de Neutralizacion y SolucionANA MARIA GONZALEZ BARRIOSBelum ada peringkat
- Práctica 2. Calor Diferencial de Disolución.Dokumen4 halamanPráctica 2. Calor Diferencial de Disolución.Karen CarrilloBelum ada peringkat
- Informe 8 - Termoquimica y TermodinamicaDokumen5 halamanInforme 8 - Termoquimica y TermodinamicaJeremy Solis Fonseca0% (2)
- Lab de Termodinamica 3Dokumen5 halamanLab de Termodinamica 3Daniel Alejandro Salamanca SantiagoBelum ada peringkat
- DETERMINACIÓN DE KSPDokumen5 halamanDETERMINACIÓN DE KSPAngela aponteBelum ada peringkat
- Laboratorio Nº1 Fisicoquimica I (Plancha 2)Dokumen13 halamanLaboratorio Nº1 Fisicoquimica I (Plancha 2)Jose FernandezBelum ada peringkat
- Titulación de Ácidos Fuertes Con Bases FuertesDokumen6 halamanTitulación de Ácidos Fuertes Con Bases FuertesAmaya Pazdelavega QuirozBelum ada peringkat
- LAboratorio 1 Quimica Industrial FinalDokumen17 halamanLAboratorio 1 Quimica Industrial FinalXiomiBellQuispeRiveraBelum ada peringkat
- Laboratorio Calor de NeutralizacionDokumen5 halamanLaboratorio Calor de NeutralizacionJavierBelum ada peringkat
- Informe 8 Termoquimica y Termodinamica PDFDokumen5 halamanInforme 8 Termoquimica y Termodinamica PDFJuan Arias100% (1)
- Calor de NeutralizacionDokumen10 halamanCalor de NeutralizacionEduardo J Dugarte GBelum ada peringkat
- Determinación Del Calor de Reacción de Una Reacción ÁcidoDokumen6 halamanDeterminación Del Calor de Reacción de Una Reacción ÁcidoJuanMiguel Arratia ValderramaBelum ada peringkat
- Informe 2 Calor-CombustiónDokumen11 halamanInforme 2 Calor-CombustiónCATHERINE MARQUEZ TILANOBelum ada peringkat
- Solubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónDokumen13 halamanSolubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónHector Jesus Roca LoaizaBelum ada peringkat
- PRACTICA de Calorimetria IIIDokumen6 halamanPRACTICA de Calorimetria IIIalexander ruelas zapata0% (1)
- Laboratorio 6. Calor Diferencial de SoluciónDokumen11 halamanLaboratorio 6. Calor Diferencial de SoluciónDIAM 57Belum ada peringkat
- Calor de NeutralizaciónDokumen8 halamanCalor de NeutralizaciónESTEFANIE MORALESBelum ada peringkat
- Prueba Parcial Termodinámica 2022 10 NRC 25200Dokumen2 halamanPrueba Parcial Termodinámica 2022 10 NRC 25200JOSE LUIS QUISPE GARAYBelum ada peringkat
- Acido-Acetico Imprimir NocheDokumen8 halamanAcido-Acetico Imprimir NocheAbby VásquezBelum ada peringkat
- Informe Fisicoquimik CALOR DE NEUTRALIZACIÓNDokumen13 halamanInforme Fisicoquimik CALOR DE NEUTRALIZACIÓNCristian DiazBelum ada peringkat
- Constante de Equilibrio. Disolución Del Kno3.Dokumen12 halamanConstante de Equilibrio. Disolución Del Kno3.Jesús Alejandro100% (1)
- Práctica y Reporte 6Dokumen10 halamanPráctica y Reporte 6Laura PerezBelum ada peringkat
- Calor de Neutralizacion Informe de FisicoquimicaDokumen8 halamanCalor de Neutralizacion Informe de FisicoquimicaDavid Fernando CipamochaBelum ada peringkat
- Informe Calores de Neutralización y SoluciónDokumen4 halamanInforme Calores de Neutralización y SoluciónPaula Ramirez100% (1)
- Calor DeNeutralizacionDokumen7 halamanCalor DeNeutralizacionYuranny MendozaBelum ada peringkat
- Practica. Calor de Neutralizacion 1 1Dokumen9 halamanPractica. Calor de Neutralizacion 1 1Ana Maria RiveraBelum ada peringkat
- Calor de Disolucion ABDokumen2 halamanCalor de Disolucion ABJHOZSUEBelum ada peringkat
- B 3 AlkaseltzerDokumen5 halamanB 3 AlkaseltzerJavier CastilloBelum ada peringkat
- Calor de NeutralizaciónDokumen8 halamanCalor de NeutralizaciónWilly SalcedoBelum ada peringkat
- Informe 3 QG Invierno PDFDokumen15 halamanInforme 3 QG Invierno PDFDiana Rita Pomez QuirozBelum ada peringkat
- SERIE 3 (2018) Prop ColigDokumen5 halamanSERIE 3 (2018) Prop ColigEdu LeivaBelum ada peringkat
- Calor de NeutralizacionDokumen16 halamanCalor de NeutralizacionFiorella Juarez ArevaloBelum ada peringkat
- Ejercicio 1anggie MendezDokumen22 halamanEjercicio 1anggie MendezAnggie MendezBelum ada peringkat
- Calor de Combustión PDFDokumen6 halamanCalor de Combustión PDFAlexandra ArboledaBelum ada peringkat
- Calor de Neutralizacion y de Solucion 1Dokumen8 halamanCalor de Neutralizacion y de Solucion 1Paola SolórzanoBelum ada peringkat
- Problemas Resueltos FisicoquímicaDokumen26 halamanProblemas Resueltos FisicoquímicatmuzzioBelum ada peringkat
- INFORME 7 QuímicaDokumen11 halamanINFORME 7 QuímicaCielomarycris VargasBelum ada peringkat
- Reporte Práctica 3. CalorimetriaDokumen4 halamanReporte Práctica 3. CalorimetriaSebastianBelum ada peringkat
- Determinacion Crioscopica Del Peso Molecular FinalDokumen13 halamanDeterminacion Crioscopica Del Peso Molecular FinalPier Navarro100% (1)
- Volumetria Acido BaseDokumen12 halamanVolumetria Acido BaseLeonardo Fabian LamasBelum ada peringkat
- Práctica N3Dokumen5 halamanPráctica N3María Paula Carvajal NaviaBelum ada peringkat
- Informe de Laboratorio - Laboratorio 12. TermodinámicaDokumen6 halamanInforme de Laboratorio - Laboratorio 12. TermodinámicaGrettel paola Castro GBelum ada peringkat
- Calor de NeutralizacionDokumen11 halamanCalor de NeutralizacionErik Anchivilca ZavaletaBelum ada peringkat
- Sonia ProyDokumen17 halamanSonia ProyGary RamosBelum ada peringkat
- Solubilidad Acido BenzoicoDokumen13 halamanSolubilidad Acido BenzoicoKamila MartinezBelum ada peringkat
- Taller TermodinámicaDokumen1 halamanTaller TermodinámicaAlejandro PerezBelum ada peringkat
- INFORME-7Dokumen7 halamanINFORME-7AnaisBriggitJacintoChavezBelum ada peringkat
- PRACTICA 2 FisicoquimicaDokumen16 halamanPRACTICA 2 FisicoquimicaCarlos Jhair Rodriguez83% (6)
- Ingeniería química. Soluciones a los problemas del tomo IDari EverandIngeniería química. Soluciones a los problemas del tomo IBelum ada peringkat
- Curso Práctico de Química GeneralDari EverandCurso Práctico de Química GeneralPenilaian: 4 dari 5 bintang4/5 (4)
- Problemas resueltos de Hidráulica de CanalesDari EverandProblemas resueltos de Hidráulica de CanalesPenilaian: 4.5 dari 5 bintang4.5/5 (7)
- HIDROSTÁTICA - InformeDokumen20 halamanHIDROSTÁTICA - InformeCarlos Roder RamirezBelum ada peringkat
- 1S-2014 EXAMEN RECUPERACION FISICA (08h30) PDFDokumen8 halaman1S-2014 EXAMEN RECUPERACION FISICA (08h30) PDFWalter CambaBelum ada peringkat
- Propiedades Magnéticas de Los MaterialesDokumen18 halamanPropiedades Magnéticas de Los MaterialesTatianaValentinaOrdoñezBelum ada peringkat
- 08 - Flujo de Los Fluidos - Ejercicios de Continuidad PDFDokumen9 halaman08 - Flujo de Los Fluidos - Ejercicios de Continuidad PDFDiana MontoyaBelum ada peringkat
- MDRPIM2011034Dokumen126 halamanMDRPIM2011034Sergio Parra BasurtoBelum ada peringkat
- T02 - Aguilar Hidrogo Manuel AlejandroDokumen8 halamanT02 - Aguilar Hidrogo Manuel AlejandroManuel AlejandroBelum ada peringkat
- Fenomenos Químicos-FisicosDokumen4 halamanFenomenos Químicos-FisicosMarvin RosalesBelum ada peringkat
- PRÁCTICA DE LABORATORIO 4 ELECTROSTÁTICA Campo Eléctrico PDFDokumen6 halamanPRÁCTICA DE LABORATORIO 4 ELECTROSTÁTICA Campo Eléctrico PDFPaul PorrasBelum ada peringkat
- Taller en ClasesDokumen2 halamanTaller en ClasesLuis Santiago Castro JaimesBelum ada peringkat
- Cremacion y AguaDokumen2 halamanCremacion y AguaKesia Zamora VillegasBelum ada peringkat
- Balanza y Densidad en Picnometro..Dokumen38 halamanBalanza y Densidad en Picnometro..Rossanita Roman NoleBelum ada peringkat
- Volumetria de Cu PracticaDokumen6 halamanVolumetria de Cu PracticaJosemir Sanchez SurihuayllaBelum ada peringkat
- Cambios de Fase Resuelta. WordDokumen4 halamanCambios de Fase Resuelta. WordJuan Almonacid GallardoBelum ada peringkat
- Estado Del Agujero de La Capa de Ozono: ESTUDIANTE: Marcelo Larco Meza PROFESOR: Carlos CornelioDokumen6 halamanEstado Del Agujero de La Capa de Ozono: ESTUDIANTE: Marcelo Larco Meza PROFESOR: Carlos CorneliocheloBelum ada peringkat
- Informe - Creacion de Un JabonDokumen4 halamanInforme - Creacion de Un JabonAxl Alxander ArcayaBelum ada peringkat
- Meteorizacion y SuelosDokumen4 halamanMeteorizacion y SuelosLuis ReyesBelum ada peringkat
- La Conferencia Perdida de Feynman - David L GoodsteinDokumen156 halamanLa Conferencia Perdida de Feynman - David L GoodsteinWilliam David Becerra ChaconBelum ada peringkat
- TRABAJO #01 - ClimatologiaDokumen31 halamanTRABAJO #01 - ClimatologiaEdwar Vidal Sanca PacoriBelum ada peringkat
- Calderas de Gas Sime RXDokumen4 halamanCalderas de Gas Sime RXerwin_alejandroBelum ada peringkat
- Práctica 5 SecundariaDokumen1 halamanPráctica 5 SecundariaGiuliana Churano TinocoBelum ada peringkat
- Solucionario CienciasDokumen14 halamanSolucionario CienciasJainer RadaBelum ada peringkat
- EutrofizacionDokumen16 halamanEutrofizacionElva DanaeBelum ada peringkat
- 15 Sistemas Electricos y Automotrices 1 - 094703Dokumen39 halaman15 Sistemas Electricos y Automotrices 1 - 094703Antonio GamboaBelum ada peringkat
- Vocabulario T.1 y 2Dokumen3 halamanVocabulario T.1 y 2Irene PalmeroBelum ada peringkat
- Fluidos Hidrotermales Acecig ImprimirDokumen52 halamanFluidos Hidrotermales Acecig ImprimirDajhanna Grados AlvaradoBelum ada peringkat
- Teoria Cinetica InformeDokumen17 halamanTeoria Cinetica InformeSebastián Tovar BravoBelum ada peringkat
- Tratamiento Terciario de Aguas ResidualesDokumen9 halamanTratamiento Terciario de Aguas ResidualesVictor Santa cruzBelum ada peringkat
- Movimiento VerticalDokumen40 halamanMovimiento VerticalLex B Cast57% (7)
- Electricidad Automotriz BásicaDokumen24 halamanElectricidad Automotriz BásicaGustavo RivasBelum ada peringkat