Repet Ida
Diunggah oleh
Z Garcia CervantesHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Repet Ida
Diunggah oleh
Z Garcia CervantesHak Cipta:
Format Tersedia
ESPECTROSCOPA DE ABSORCIN ATMICA
Introduccin
Fotometra de llama
Espectrofotometra de absorcin atmica
Instrumentacin
Funcin y condiciones de las llamas
Fenmenos que tienen lugar en la llama
Introduccin
Mientras que la mayora de las tcnicas espectroscpicas se utilizan para el estudio y caracterizacin de
molculas o iones en su entorno cristalino, la espectroscopa de emisin y absorcin atmica se usa casi
exclusivamente para el anlisis de tomos. Por consiguiente, la tcnica resulta casi insuperable como mtodo de
anlisis elemental de metales. En principio, la espectroscopa de emisin puede utilizarse para la identificacin y
para la determinacin cuantitativa de todos los elementos de la tabla peridica.
Cuando la transicin se produce desde el estado fundamental hasta un estado excitado del tomo mediante
la absorcin de radiacin de una determinada frecuencia (caracterstica para cada tomo), estamos en el caso
de las tcnicas de absorcin. En el caso en que los tomos se lleven previamente a un estado excitado y se mide
la intensidad de la radiacin emitida a la frecuencia caracterstica correspondiente a la transicin desde el
estado excitado al estado fundamental, hablamos de tcnicas espectrofotomtricas de emisin. A continuacin
se tratan las tcnicas espectrofotomtricas de absorcin atmica, de fotometra de llama y de emisin por
plasma.
Pueden identificarse tres clases diferentes de procesos de emisin que difieren en cmo la sustancia
alcanza el estado excitado previo a la emisin.
a) Emisin a partir de una excitacin electromagntica.
b) Emisin a partir de excitacin trmica.
c) Emisin a partir de excitacin elctrica.
Los tipos ms importantes de espectros de emisin se basan en la utilizacin de energa no electromagntica
para llevar a un tomo o a una molcula al estado excitado, a partir del cual se miden las emisiones de radiacin.
El proceso puede describirse segn:
X + (energa elctrica o trmica) X* (excitacin)
X* X + hv (emisin)
Fotometra de llama
Es una tcnica de emisin que utiliza una llama como fuente de excitacin y un fotodetector electrnico
como dispositivo de medida. Se trata principalmente de un mtodo de anlisis cuantitativo y es uno de los
mtodos ms sencillos y precisos para el anlisis de metales alcalinos, la mayor parte de los metales
alcalinotrreos y algn otro elemento metlico. Tambin es posible realizar un anlisis cualitativo examinando
todas las longitudes de onda del espectro de emisin (espectrofotometra de llama o fotometra de llama). Su
aplicacin es limitada si se compara con la espectroscopa de emisin ordinaria, ya que la energa de la llama
permite excitar nicamente de 30 a 50 elementos, siendo este nmero funcin del tipo de llama utilizada. La
muestra debe estar disuelta.
Espectrofotometra de absorcin atmica
Es una tcnica muy relacionada con la fotometra de llama ya que se utiliza una llama para atomizar la
disolucin de la muestra de modo que los elementos a analizar se encuentran en forma de vapor de tomos.
Ahora bien, en absorcin atmica existe una fuente independiente de luz monocromtica, especfica para cada
elemento a analizar y que se hace pasar a travs del vapor de tomos, midindose posteriormente la radiacin
absorbida.
En la siguiente figura se compara un esquema de espectrofotmetro de emisin de llama (a) y l de
absorcin atmica (b).
Dada la estrecha relacin existente entre absorcin atmica y fotometra de llama es inmediata una
comparacin entre ellas. En fotometra de llama la sensibilidad es proporcional al nmero de tomos que se han
excitado, mientras que, en absorcin atmica la sensibilidad depende del nmero de tomos que se encuentran
en el estado fundamental. Normalmente, tan slo un pequeo porcentaje de tomos se encuentran en estado
excitado en la llama. Por lo tanto, la absorcin atmica da lugar, en general, a una mayor sensibilidad que la
fotometra de llama para un gran nmero de elementos.
Adems, la absorcin atmica es una tcnica que presenta menos interferencias y es ms simple que la
fotometra de llama, lo que explica el espectacular desarrollo de la tcnica en los ltimos aos. Hay que sealar
que a pesar de ello, la absorcin atmica no ha eliminado el uso de la fotometra, sino que ambos mtodos deben
considerarse complementarios, siendo la sensibilidad de cada uno de ellos superior a la del otro para
determinados elementos.
Las ventajas fundamentales de la utilizacin de la llama como fuente de excitacin son que los espectros son
muy sencillos y que los resultados cuantitativos tienden a ser ms reproducibles. Los espectros son sencillos
debido a la baja energa de excitacin de la llama que da lugar a pocas lneas de emisin. Este hecho hace
disminuir el problema de las interferencias espectrales a partir de lneas y bandas de otros elementos y
adems no implica la necesidad de un monocromador de elevada resolucin. La mayor reproducibilidad de estos
mtodos se debe al mejor control de las variables en una excitacin por llama.
Las dos desventajas ms importantes de los mtodos de emisin en llama son que la energa de excitacin es
demasiado baja para la mayora de los elementos y que la muestra debe estar disuelta. En absorcin atmica la
baja energa no es una desventaja tan importante ya que la misin de la llama, en ese caso, es nicamente
atomizar la muestra y formar un vapor de tomos sin excitar; por esta razn es aplicable a un mayor nmero de
elementos que la fotometra de llama.
Instrumentacin
La diferencia entre fotometra de llama y absorcin atmica radica principalmente en los distintos mtodos
de medida de las seales.
Un espectrofotmetro de absorcin atmica es bsicamente un espectrofotmetro de llama al que se le ha
aadido una fuente de radiacin. Para conseguir eliminar la seal de fotometra de llama y recoger nicamente
la de absorcin se modula la fuente de ctodo hueco.
a) Fotmetros de llama
Existe una gran variedad de equipos que van desde los fotmetros de filtro de haz nico a los
espectrofotmetros de multicanal con correccin automtica del ruido de fondo.
b) Espectrofotmetros de absorcin atmica
En los ltimos aos se han desarrollado a gran velocidad los espectrofotmetros de absorcin atmica y en
el mercado existen desde los instrumentos muy sencillos de haz simple hasta diseos complejos automatizados.
La mayora de los instrumentos se disean de modo que puedan utilizarse en fotometra de llama. En la siguiente
figura se recoge el diagrama de bloques de espectrofotmetros de absorcin atmica.
Funcin y condiciones de las llamas
La llama tiene tres funciones bsicas: permite pasar la muestra a analizar del estado lquido a estado
gaseoso; descompone los compuestos moleculares del elemento de inters en tomos individuales o en molculas
sencillas y excita estos tomos o molculas.
Las condiciones que debe cumplir una llama para considerarla satisfactoria es que tenga la temperatura
adecuada y que en ella se forme un ambiente gaseoso que permita las funciones mencionadas. Adems, el ruido
de fondo de la llama no debe interferir las observaciones a efectuar.
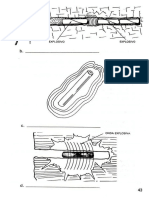
Una llama tpica consta de: cono interno, cono externo y zona entre conos como podemos observar en la
siguiente figura.
El cono interno es la zona en que tiene lugar, generalmente, una combustin parcial, es decir sin equilibrio
trmico. Esta zona se calienta por conduccin y radiacin a partir de la regin ms caliente que se encuentra
sobre ella. En ella se forman los productos de oxidacin intermedios, se produce una gran emisin de luz (a
partir del combustible y no de la muestra), una elevada ionizacin y una gran concentracin de radicales libres.
Es muy poco utilizada para trabajo analtico.
Inmediatamente encima de la regin del cono interno se encuentra la zona interconal Es la llamada parte
caliente de la llama y en ella tiene lugar una combustin completa y se alcanza casi un equilibrio termodinmico.
Esta llama es la que se utiliza prcticamente en anlisis por fotometra de llama y espectroscopa de absorcin
atmica. La altura de esta zona sobre el quemador vara considerablemente con el tipo de quemador, la
naturaleza de los gases utilizados y su velocidad de flujo.
La regin del cono externo es una zona de combustin secundaria en la que los productos parcialmente
oxidados como el monxido de carbono pueden completar su combustin. Esta regin se enfra por el aire
circundante y es, en general, una regin poco til.
Fenmenos que tienen lugar en la llama
1. - Se evapora el agua o los otros disolventes dejando como residuo diminutas partculas de sal seca.
2. - La sal seca se vaporiza, es decir, pasa al estado gaseoso.
3. - Las molculas gaseosas, o una parte de ellas, se disocian progresivamente dando lugar a tomos neutros
o radicales. Estos tomos neutros son las especies absorbentes en espectroscopa de absorcin atmica y son
las especies emisoras en fotometra de llama.
4. - Parte de los tomos neutros se excitan trmicamente o se ionizan. La fraccin excitada trmicamente
es importante en anlisis por fotometra de llama ya que el retorno al estado fundamental de los electrones
excitados es el responsable de la emisin de la luz que se mide.
5. - Parte de los tomos neutros o de los radicales que se encuentran en la llama pueden combinarse para
formar nuevos compuestos gaseosos. La formacin de estos compuestos reduce la poblacin de los tomos
neutros en las llamas y constituye las llamadas interferencias qumicas que se presentan en los mtodos de
anlisis que utilizan llamas.
La eficacia con que las llamas producen tomos neutros tiene mucha importancia. La llama de xido nitroso-
acetileno, que es ms caliente que la de aire acetileno, parece ser ms efectiva para la formacin de tomos
neutros. Los metales alcalinos son una excepcin, probablemente debido a que la ionizacin es apreciable en la
llama caliente. En cualquier caso, estos dos tipos de llama son los ms adecuados para fotometra de llama y
absorcin atmica.
A las temperaturas ordinarias de llamas es relativamente baja la fraccin de tomos del estado fundamental
que se excita. nicamente si la temperatura de la llama es muy elevada la fraccin de tomos excitados
empieza a ser apreciable. Este hecho pone de manifiesto la necesidad de controlar la temperatura de la llama
cuidadosamente para fotometra de emisin. Por el contrario, la fraccin de tomos en el estado fundamental
es muy elevada y, por lo tanto, pequeas fluctuaciones en la temperatura de la llama no son importantes para el
anlisis por absorcin atmica.
La ionizacin que tiene lugar en las llamas produce normalmente la prdida de un slo electrn y se puede
representar:
A A
+
+ e
-
A = tomo neutro
A
+
= su ion positivo
e
-
= electrn libre
Este proceso de disociacin depende de la concentracin o de la presin, ya que una especie se disocia en
dos. Al aumentar la presin parcial de los tomos en la llama, el porcentaje de ionizacin disminuye tal como
debe esperarse de la aplicacin de la ley de Le Chtelier.
A la temperatura de la llama acetileno-oxgeno la mayor parte de los elementos se encuentran
apreciablemente ionizados. El grado de ionizacin del elemento a analizar puede disminuirse por adicin de una
elevada concentracin de otro elemento que sea ms fcilmente ionizable (tampn de radiacin o supresor de
ionizacin).
Es preferible, por lo general, suprimir de este modo la ionizacin a utilizar temperaturas de llama ms bajas
que hacen aumentar las interferencias qumicas.
Volver a inicio
Alba Moure Pelez
Francisco Javier Prez Martos
Jose Manuel Gonzlez Durn
Marta Muoz Romn
Maurici Hublard Nogueras
I.E.S Merc Rodoreda
Curs 2003-2004
ICP
ESPECTROSCOPA DE EMISIN DE PLASMA ACOPLADA INDUCTIVAMENTE
IES MERC RODOREDA RAL BAOS
GRUPO A/C JORDI NOLLA
CURSO 2002-03 FRANCISCO REGAA
MIGUEL NGEL SERRANO
EXPLICACIN Y FOTOS APLICACIONES VENTAJAS e INCONVENIENTES
ICP:
La espectroscopa de emisin ptica de plasma acoplado inductivamente (ICP-OES) se basa en la vaporizacin, disociacin,
ionizacin y excitacin de los diferentes elementos qumicos de una muestra en el interior de un plasma.
Durante el proceso de desexcitacin de los tomos neutros e iones en el interior de un plasma, se producen las emisiones de
radiacin electromagntica en la zona del UV-visible. Estas radiaciones, caractersticas de cada elemento, se separan en funcin
de su longitud de onda y finalmente se mide su intensidad. La seleccin de la longitud de onda nos permite determinar el metal
cualitativamente, mientras que la intensidad de la radiacin emitida nos proporcionar la informacin para poder cuantificarlo.
Qu es un plasma? Un plasma es un gas ionizado, elctricamente neutro y confinado en un tubo de descarga. Es un estado de
equilibrio entre partculas cargadas y neutras de un gas ionizado. Las temperaturas alcanzadas son notablemente superiores a la
de la absorcin atmica (AAS).
Un sistema tpico de anlisis elemental por espectroscopa con un plasma con fuente de excitacin y atomizacin est constituido
por:
El plama: que deber reunir ciertas condiciones de temperatura, confinamiento, etc.
El generador elctrico: que aportar la energa externa al plasma que la disipar en forma trmica y radiante.
El sistema de introduccin de la muestra: que deber permitir un eficaz aporte de la muestra al conjunto.
El sistema de alimentacin de gas: que asegure el funcionamiento del plasma, el transporte de la muestra, la formacin del
aerosol con la muestra, la purga del sistema ptico y la refrigeracin de la antorcha.
El sistema ptico: que permitir analizar el espectro emitido por el plasma.
El sistema de tratamiento de la seal: que permitir anlisis cualitativo y cuantitativo a partir de las radiaciones emitidas.
Antorcha de cuarzo
Esquema del plasma generado en un instrumento ICP-OES donde se indican las diferentes zonas y temperaturas:
Llama y bobina:
volver arriba
Aplicaciones:
Las peculiares caractersticas del sistema de excitacin por plasma hacen de esta tcnica una valiosa herramienta universal para
el anlisis de elementos de la tabla peridica.
Excitacin de las lineas ms sensibles para casi todos los elementos.
Linealidad en un rango de 6 rdenes
Rango analtico que comprende constituyentes mayoritarios, minoritarios, trazas y ultratrazas. La adopcin del
espectrmetro de masas como detector posibilita la cuantificacin de determinados elementos a niveles de picogramo/litro
(ppq).
Mnimos efectos matriz.
Posibilidad de correccin de interferencias.
Alta reproducibilidad y precisin
Para calibrar se utiliza el mtodo de la recta de calibraje externa, la adicin estandar o el patrn interno.
volver arriba
Ventajas del ICP-OES con respecto a la AAS:
Posibilidad de determinar no metales (Cl, Br, S, I).
Posibilidad de analizar de manera simultnea todos los elementos.
No es necesario el uso de lmparas.
Inconvenientes del ICP-OES con respecto a la AAS:
Necesidad de un volumen de muestra mayor.
Menor sensibilidad
Espectroscopa molecular UV-Vis (Ultravioleta-Visible)
Treball realitzat per:
Marina Bottino
M Jos Gonzlez
Lali Mateu
Lourdes Ortiz
Mdul B - CFGS Qumica Ambiental
IES MERC RODOREDA - 2002/03
s una tcnica analtica que mesura la absorci de la lum, dependent de les longituds dona, en la
regi visible o ultravioleta. Es molt til per a la caracterizaci de una varietat de materials, com
per exemple les anilines.
Una mostra en soluci s irradiada en el rang del UV-Visible. Certes longituds dona sn
selectivament absorbides per la mostra produint un patr espectral caracterstic, el qual pot ajudar
a identificar el material.
Lespectroscopia UV-VIS s una extensi de la colorimetria ja que permet determinar la absorci
de llum en una mostra, en linterval de longituds dona comprs entre 190 y 700 nm. Per la
determinaci en la regi ultravioleta s necessari emprar portamostras de quarz que no absorbeixi
en aquesta zona del espectre.
Els components bsics dels espectrofotmetres sn similars als dun colormetre per amb millores
i ampliacions que els permetin una major precisi en les mesures.
Es distingeixen dos tipus fonamentals: els de raig simple i els de raig doble. Aquests ltims sn ms
prctics ja que permeten obtenir directament la absorci relativa de la mostra respecte la
referncia en tot l'intrval de longituds.
La colorimetria es un mtode ptic que permet la determinaci de la concentraci duna substncia
que estigui present en una mostra en continguts inferiors a l1%. La substncia a determinar ha de
ser susceptible a generar una espcie amb color a partir de laddici duns reactius coneguts com
reactius cromognics. La intensitat de la coloraci ha destar relacionada linealment amb la
concentraci danalit dins dun interval determinat.
Caracterstiques de la tcnica
Amplia aplicabilitat: s apta per determinar una gran quantitat danalits directament o
transformant-los (afegint un reactiu cromognic per que generi color) per poder-los determinar.
Elevada sensibilitat: lmit de detecci traces o ultrataces.
Selectivitat moderada/alta: es pot trobar sovint una longitud dona on noms absorbeix lanalit
sent innecessria la separaci previa.
Bona exactitut: error relatiu 1-5%.
Facilitat i comoditat.
Fonament de la tcnica
Quan un feix de llum travessa una dissoluci amb un solut absorbent, la intensitat daquest feix es
disminueix a causa de labsorci duna part de lenergia radiant duna freqncia caracterstica per
part de molcules o dions del solut quan sexciten a nivells energtics superiors. En general podem
dir que:
Io= Ia +It +Ir
On Io s la intensitat de llum incident, Ia s la intensitat de llum absorbida, It s la intensitat de la
llum transmesa i Ir pot ser eliminada.
Els nostres ulls detecten longituds dona de la llum visible no absorbida, es a dir, la llum que
transmesa. Les mesures de la quantitat de llum transmesa es poden fer amb un instrument
anomenat colorimetre, un esquema del qual es mostra a la figura i que consta fonamentalment duna
font de llum, un selector de longitud dona, una cubeta de material transparent a la radiaci i un
detector.
Espectrofotmetre
Labsorbncia (A) de la substncia es relaciona amb la intensitat de la llum incident i de la llum
transmesa segons lequaci coneguda com a llei de Bouger-Lambert-Beer:
A = -log T = -log It/Io = l c
On:
A = absorbncia
T = transmitncia
= absortivitat molar; s una constant de proporcionalitat que depn de la substncia i de la
longitud dona. (unitats: mol
1
)
It = intensitat de la llum transmesa
Io = intensitat de llum incident
l = cam ptic recorregut per la llum dins la dissoluci (unitats: cm)
c = concentraci de la substncia que absorbeix (unitats: mol
1
)
Llei de Bouger-Lambert-Beer: Llei que permet de calcular la disminuci de la intensitat dun raig de
llum, o duna radiaci electromagntica semblant, desprs dhaver travessat una soluci.
La determinaci quantitativa de substncies per espectroscpia dabsorci o absorciometria es basa
en aquesta llei. Aquesta llei va ser formulada inicialmentper Bouger i Lambert, i posteriorment
ampliada per Beer. Segons aquesta llei, la quantitat de radiaci monocromtica absorbida per una
capa transparent duna substncia s proporcional a la quantitat de radiaci incident en aquella capa
(Bouger- Lambert) i, en el cas duna soluci, la radiaci absorbida s tamb proporcional a la
concentraci de la substncia absorbent (Beer).
Designem per Io la intensitat de la radiaci monocromtica incident i suposem que val 100. Suposem
que la meitat daquesta radiaci s absorbida en travessar la primera capa, per tant, la intensitat de
la radiaci emergent, designada per I1, ser de 50. No s difcil deduir que la radiaci emergent de
la segona capa tindr una intensitat I2 =25 i aix successivament. Aquest procs de disminuci de la
intensitat de la radiaci sanomena absorci. Lexpressi matemtica daquesta dependncia s:
I = Io 10
-k
. l
Io s la intensitat de la radiaci incident
I s la intensitat de la radiaci emergent
k s una constant de proporcionalitat
l s el gruix de la capa de material absorbent
En aquesta figura sha representat duna forma esquemtica la variaci de labsorci amb la
concentraci; s obvi que labsorci a la cubeta inferior, amb una concentraci doble, s la mateixa
que la de dues cubetes com la de la part superior collocades una darrera laltra. Es dedueix, doncs,
que la constant k s proporcional a la concentraci, s a dir, k= a c, on c s la concentraci i a el
coeficient de proporcionalitat. En conseqncia la llei de Bouger-Lambert-Beer pren la forma:
I = Io 10
-abc
On b s el cam ptic.
La constant a sanomena absorbitat i el seu valor depn de la capacitat de cada substncia per
absorbir radiaci a cada longitud dona.
A la prctica lanterior expressi no s del tot convenient ja que la concentraci apareix a
lexponent. Aplicant logaritmes sobt la segent equaci que s molt ms cmoda i s mpliament
utilitzada en el treball prctic.
A = log (Io /I) = a b c
On A = log (Io/I) sanomena absorbncia i s directament proporcional a la concentraci (en una
srie de mesures a i b sn constants). El tant per u de la concentraci transmesa, I/Io, rep el nom
de transmitncia i es designa per T. En conseqncia l absorbncia es pot expressar en funci de la
transmitncia com:
A = -log T
Quan la concentraci sexpressa en mol/L, aleshores labsortivitat rep el nom dabsortivitat molar i
es designa per . En aquest cas lexpressi matemtica de la llei de Beer adopta la forma:
A = b c
Aplicacions analtiques de lespectrofotometria: fer clic aqu
Per anar a linici de pgina fer clic aqu
Anda mungkin juga menyukai
- Informe Movimiento Rectilineo Uniformemente AceleradoDokumen7 halamanInforme Movimiento Rectilineo Uniformemente AceleradoZ Garcia CervantesBelum ada peringkat
- Manual MineriaDokumen290 halamanManual Mineriadfmejiay100% (4)
- Explosivos m1 - ViDokumen10 halamanExplosivos m1 - ViZ Garcia CervantesBelum ada peringkat
- Métodos Espectrocópicos de AnálisisDokumen233 halamanMétodos Espectrocópicos de AnálisisJesi RiosBelum ada peringkat
- 4 Métodos de AnálisisDokumen6 halaman4 Métodos de AnálisisZ Garcia CervantesBelum ada peringkat
- 2 Validación de Métodos Fisicoqcos RelabsaDokumen88 halaman2 Validación de Métodos Fisicoqcos RelabsaZ Garcia CervantesBelum ada peringkat
- 4Dokumen272 halaman4Z Garcia CervantesBelum ada peringkat
- Cargar Este ArchivoDokumen15 halamanCargar Este ArchivoZ Garcia CervantesBelum ada peringkat
- Curso Completo de Topografia - SENCICO PDFDokumen289 halamanCurso Completo de Topografia - SENCICO PDFaqueltipo91% (11)
- Curso Completo de Topografia - SENCICO PDFDokumen289 halamanCurso Completo de Topografia - SENCICO PDFaqueltipo91% (11)
- Nociones de TopografiaDokumen83 halamanNociones de TopografiaJorge Manuel Reyes SerranoBelum ada peringkat
- Manual Basico de Civil 3D 2010Dokumen77 halamanManual Basico de Civil 3D 2010Cristhian JP100% (1)
- Costos - GeneralDokumen14 halamanCostos - GeneralLuci Bardales ChacónBelum ada peringkat
- Estaciones de Rastreo PermanenteDokumen60 halamanEstaciones de Rastreo PermanenteLlazato Maya100% (1)
- Apunte Resistencia de Materiales Parte IIDokumen19 halamanApunte Resistencia de Materiales Parte IIelchinchosoBelum ada peringkat
- Est CortanteDokumen5 halamanEst CortanteEric PerezBelum ada peringkat
- Tanques ElevadosDokumen40 halamanTanques ElevadosERIKREAD81% (26)
- GemasDokumen6 halamanGemasZ Garcia CervantesBelum ada peringkat
- Presentacion PeruDokumen30 halamanPresentacion PeruZ Garcia CervantesBelum ada peringkat
- Parrafos !!!Dokumen7 halamanParrafos !!!Z Garcia CervantesBelum ada peringkat
- Pasos S10Dokumen17 halamanPasos S10Z Garcia CervantesBelum ada peringkat
- Informe Inmediato Espectroscopía de Fluorescencia de Rayos XDokumen6 halamanInforme Inmediato Espectroscopía de Fluorescencia de Rayos XCarlos GonzálezBelum ada peringkat
- DIAMANTE Estudio Realizado Por IBERHOMEDokumen35 halamanDIAMANTE Estudio Realizado Por IBERHOMERoberto N. PiñolBelum ada peringkat
- Libro Quimica BachloeDokumen117 halamanLibro Quimica BachloeMaría López GonzálezBelum ada peringkat
- EspectroscopíaDokumen2 halamanEspectroscopíamaydpdcBelum ada peringkat
- Estudio de Las Transciones Electronicas Del Azuleno Con Diferentes Grupos Sustituyentes Utilizando DFT y Hartree-FockDokumen4 halamanEstudio de Las Transciones Electronicas Del Azuleno Con Diferentes Grupos Sustituyentes Utilizando DFT y Hartree-Fockalex_mf789Belum ada peringkat
- Analítica Práctica 10. Determinación de Cromo y ManganesoDokumen14 halamanAnalítica Práctica 10. Determinación de Cromo y Manganesomiriam100% (1)
- Practica Nâº1 Ensayo A La LlamaDokumen7 halamanPractica Nâº1 Ensayo A La LlamaPedro IvanBelum ada peringkat
- ToxicoDokumen43 halamanToxicoAnnie YaganquiBelum ada peringkat
- Introducción A La EspectrometriaDokumen12 halamanIntroducción A La EspectrometriaHIBelum ada peringkat
- AbadDokumen7 halamanAbadedgarBelum ada peringkat
- Unidad 7Dokumen84 halamanUnidad 7lara saldaña reañoBelum ada peringkat
- Series de BalmerDokumen8 halamanSeries de BalmerrodrihanBelum ada peringkat
- Introducción A La EspectrosDokumen43 halamanIntroducción A La EspectrosJairo Viloria EspitiaBelum ada peringkat
- Manual de Instrucciones Espectofotometro Uv-Vis I8Dokumen23 halamanManual de Instrucciones Espectofotometro Uv-Vis I8SelmaBelum ada peringkat
- Informe Instrumental (1) 2020Dokumen17 halamanInforme Instrumental (1) 2020Luis Espinoza PortuguezBelum ada peringkat
- FSQ Web PDFDokumen231 halamanFSQ Web PDFerikaBelum ada peringkat
- LB Quimica 04Dokumen11 halamanLB Quimica 04arlet100% (1)
- Informe N-5 de Quimica GeneralDokumen9 halamanInforme N-5 de Quimica GeneralJhon Paul QHBelum ada peringkat
- Medios de Trasmision No GuiadosDokumen7 halamanMedios de Trasmision No GuiadosmakibenBelum ada peringkat
- Resonancia Magnética Nuclear: FundamentoDokumen3 halamanResonancia Magnética Nuclear: FundamentoyahareBelum ada peringkat
- Historia y Ley de KirchhoffDokumen7 halamanHistoria y Ley de KirchhoffJose InzunzaBelum ada peringkat
- Espectroscopia Dielectrica TransformadoresDokumen65 halamanEspectroscopia Dielectrica TransformadoresAlex CampianBelum ada peringkat
- AcoplamientosDokumen14 halamanAcoplamientosZamarripa Eduardo RobertoBelum ada peringkat
- Práctica - Control de Calidad Instrumental// Análisis InstrumentalDokumen10 halamanPráctica - Control de Calidad Instrumental// Análisis InstrumentalRosmaira MartínezBelum ada peringkat
- QCE GradoQuimica Apuntes Tema14Dokumen41 halamanQCE GradoQuimica Apuntes Tema14Aldair Orozco UlloaBelum ada peringkat
- Laboratorio de Quimica para Ingenieros S PDFDokumen57 halamanLaboratorio de Quimica para Ingenieros S PDFJesus OcampoBelum ada peringkat
- Guía de Quimica Grado Séptimo P II de 2021Dokumen12 halamanGuía de Quimica Grado Séptimo P II de 2021Jose MoraBelum ada peringkat
- Espectroscopia Atómica, de Emisión y AbsorciónDokumen41 halamanEspectroscopia Atómica, de Emisión y AbsorciónAlejandro De la RosaBelum ada peringkat
- Tqan U4 A1.1 VemnDokumen8 halamanTqan U4 A1.1 Vemnanon_49562316Belum ada peringkat