Resumen Termo
Diunggah oleh
Mery Gutierrez0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
33 tayangan21 halamanJudul Asli
resumen termo
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
33 tayangan21 halamanResumen Termo
Diunggah oleh
Mery GutierrezHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 21
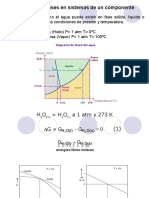
COMPORTAMIENTO DE FASE
Comenzaremos estudiando la presin de vapor y el desarrollo de la definicin del punto critico. Se
analizar en detalle los efectos de la presin y la temperatura en una de las propiedades intensivas
de especial inters para nosotros como ingenieros de petrleo, el volumen especfico.
El termino fase define cualquier parte homegenea y fsicamente distinta de un sistema. Que es
separada de otras partes del sistema, por las superficies de delimitacin definidas. Por ejempo
hielo, agua y vapor son tres fases. Cada una es fsicamente distinta y homogenia y hay limites
definidos entre el hielo y el agua, entre el hielo y el vapor y entre el agua y el vapor, asi vemos que
tenemos un sistema de tres fases, solido liquido y gas. Una fase en particular no necesita ser
continua, por instante el hielo puede existir en varios trozos en el agua
La definicin de fase puede ir mas alla. Dependiendo de la temperatura y la presin los solidos
pueden tomar una forma cristalina diferente. Esto constituye fases separadas. En ingeneria de
petrleos normamente no se le da importancia a la forma cristalina del solido. Por lo tanto
nosotros le daremos importancia solo a tres fases gas, liquido y solido.
Sabemos que las propiedades fsicas pueden ser intensivas o extensivas, las propiedades
intensivas son independientes de la cantidad de materia presente, desidad, volumen especifico y
factor de comprensibilidad son algunos ejemplos, propiedades tal como el volumen y la masa son
denominadas extensivas, sus valores son determinados por el total de materia presente.
La manera en que los hidrocarburos se comportan cuando la presin y la temperatura son
cambiados es explicado mejor por una consideracin de comportamiento individual de las
molculas. 3 factores son importantes en el comportamiendo fsico de las molculas, presin,
temperatura y atraccin y repulsin molculas. La presin es un reflejo del numero de molecular
presentes y su movimiento, temperatura, es un reflejo de la energa cinetica de las molculas. La
presin y la atraccin molecular tienden a confinar las molculas y unirlas, La temperatura y
repulsin molecular tienden a separarlas las molculas.
Cuando el material parece estar en reposo esto implica que no cambie el volumen ni la fase. La
fuerzas que confinan las molculas estn en equilibrio, con fuerzas que tienden a apartarlas.
Cuando el material no esta en reposo, en el caso del agua hirviendo por ejemplo las fuerzas no
estn en equilibrio y el material cambia, entonces estas fuerzas pueden recuperar su equilibrio.
Temperatura: es una simple medida fsica de la energa cinetica promedio de las molculas del
material, cuando al material se le suministra calor, la energa cinetica de las molculas incrementa.
Este incremento de la energa causa un incremento en el movimiento molecular, resultando asi la
separacin de las molculas.
Presion: es un reflejo de la cantidad de tiempo que las molculas de gas golpean las paredes de su
contenedor, si las molculas son forzadas a permanecer juntas, incrementa la presin.
Fuerzas intermoleculares: son las fuerzas de atraccin y repulsin entre las molecula. Estas fuerzas
cambian a medida que cambian las distancias entre las molculas, las fuerzas de atraccin
incrementa a medida que las distancias entre las molculas decrece. Hasta que las molculas estn
tan juntas que sus campos electrnicos se super ponen. Cualquier disminucin adicional de la
distancia entre las molculas causara una fuerza de repulsin entre estas. Esta fuerza de repulsin
incrementa, a medida que las molculas son forzadas a estar ms juntas.
En los gases, en que las molculas estn relativamente apartadas, tienen una distancia de
atraccin entre las molculas a medida que las distancias entre estas disminuyen, sin embargo en
un lquido en que las molculas estn mas cercanas hay fuerzas de repulsin entre las molculas
que causan que el lquido resista a una compresin adicional.
Mezcla de dos componentes.
Como futuros ingenieros de petrleo normalmente no trabajaremos con sistemas de dos
componentes, casi siempre trabajaremos con mezclas que constan de muchos mas componentes.
Sin embargo, es instructivo observas las diferencias de los comportamientos de fase entre
sustancias puras y sistemas compuestos por dos componentes.
DIAGRAMAS DE FASE DE MEZCLA DE DOS COMPONENTES
El comportamiento de una mezcla de dos componentes no es tan simple como el comportamiento
de una sustancia pura. En vez de una sola lnea la cual representa la curva de presin de vapor en
las sustancias puras, en el sistema de dos componentes es una amplia regin en la cual coexisten
dos fases. Esta regin es llamada envolvente de saturacin, envolvente de fase o regin de dos
fases.
forma tpica del diagrama de fases de una mezcla de dos componentes con expansin isotrmica,
(el envolvente de fases del diagrama de fases es limitado en un lado por la lnea del punto de
burbuja y en otro lado por la lnea del punto de roco. Las dos lneas se unen en el punto crtico.)
PUNTO DE BURBUJA Y PUNTO DE ROCIO
Considere la temperatura constante de expansin ilustrada en la figura
por la lnea 1-2. En la presin p1 la mezcla es lquida. Cuando la presin
decrece el lquido se expande hasta que la presin alcanza un punto en el
cual unas pocas molculas son capaces de formar una pequea burbuja
de gas. Este es el punto de burbuja. La presin a las cual se forma el
primer gas es la presin del punto de burbuja, Pb.
Cuando la presin decrece por debajo de la presin del punto de burbuja,
adicionalmente aparece algo de gas. Finalmente, solo queda una pequea
cantidad de restos de lquido. Este es el punto de roco. La presin en este
punto es conocida como la presin del punto de roco Pd. Una mayor
reduccin de presin del punto 2 simplemente causara una expansin de
gas.
PUNTO CRTICO
La definicin de punto crtico es aplicada a sustancias puras pero no es aplicada a mezcla de dos
componentes. En una mezcla de dos componentes, el lquido y el gas pueden coexistir a
temperaturas y presiones por encima del punto crtico. Ntese que la envolvente de saturacin
existe a temperaturas ms altas que la temperatura crtica y a presiones ms altas que la presin
critica. Ahora vemos que la definicin de punto crtico es simplemente el punto en el cual la lnea
de punto de burbuja y la lnea de punto de roco se unen. Una definicin ms rigurosa del punto
crtico es que este es el punto en el cual todas las propiedades del lquido y del gas llegan a ser
idnticas.
Diagrama tpico de mezclas de dos componentes con
lnea de presin de vapor de dos componentes puros
La figura anterior muestra las lneas de presin de vapor de dos componentes de una mezcla
superpuestas en el diagrama de fase de la mezcla. La envolvente de saturacin de la mezcla se
encuentra entre las lneas de presin de vapor de los dos componentes. La temperatura crtica de
la mezcla se encuentra entre las temperaturas crticas de los dos componentes puros. Sin embargo
la presin crtica de la mezcla est por encima de la presin crtica de ambos componentes. La
presin crtica de la mezcla de dos componentes usualmente ser ms alta que la presin critica
de cualquiera de los dos componentes.
Ejemplo 1
Diagrama de fase de mezclas de metano-etano
La figura muestra los datos de fase para cada una de las mezclas de metano y etano. A lo largo de
la lnea de presin de vapor para metano puro y para el etano puro. De nuevo, se observa que el
envolvente de saturacin de cada una de las mezclas se encuentra entre las lneas de presin de
vapor de las dos sustancias puras y que la presin critica de las mezclas se encuentran muy por
encima de las presiones crticas de los componentes puros.
Ejemplo
Determine la temperatura crtica y la presin crtica de una mezcla de porcentaje de 50,02 moles
de metano y 49.08 moles de etano. Tambin determine la presin del punto de burbuja y la
presin del punto de roca de esta mezcla a -20F.
Solucion: Tc 15F, Pc 975psia, Pb842psia, Pd 339psia a los -20F
La composicin del sistema binario de un hidrocarburo parafinico normal es mostrada en la figura
anterior. Obviamente las presines criticas son ms altas que las presiones crticas de los
componentes de la mezcla. De hecho, una gran diferencia en el tamao molecular de los
componentes causan que la mezclas tengan una presin crtica muy grande.
PUNTO CRICONDETERMICO Y PUNTO CRICONDEBARICO
La temperatura ms alta en el envolvente de saturacin es llamada cricondetermica. La presin
ms alta en el envolvente de saturacin es llamada cricondebarica. Estas condiciones son
ilustradas en la siguiente figura
Diagrama de fase tpico de la mezcla de dos componentes
con definiciones de cricondetermica y cricondebarica.
Ejemplo:
Determine la temperatura cricondetermica y la presin cricondebarica de una mezcla de 50,02
porcentaje molar de metano y 49,98 de porcentaje molar de etano.
Solucin: T cricondetermica 24F y P cricondebarica 975 psia (figura de mezclas de etano y metano)
CONDENSACIN RETROGRADA
Sabemos que para una sustancia pura una disminucin en la presin causa un cambio de fase de
lquido a gas en la lnea de presin de vapor. Igualmente, en el caso del sistema de dos
componentes una disminucin en la presin causa un cambio de fase de lquido a gas a
temperatura por debajo de la temperatura crtica.
Un ejemplo es el proceso 1-2 de la siguiente figura
Sin embargo, consideremos el decrecimiento isotrmico de la presin ilustrado en la lnea 123 del
siguiente diagrama
Cuando la presin decrece desde el punto 1, la lnea del punto de rocio es cruzada y el lquido
comienza a formarse. En la posicin indicada por el punto 2 el sistema es 25 porciento volumen de
lquido y 75 porciento gas. Una disminucin en la presin ha causado un cambio de gas a lquido.
Esto es exactamente lo contrario del comportamiento que uno esperara, de ah el nombre
condensacin retrograda. La presin decrece el punto 2 hacia el punto 3, la cantidad de lquido
disminuye, la lnea de punto de roco es cruzada por segunda vez y el sistema nuevamente llega a
ser gas.
Note que un punto de roco superior y un punto de roco inferior existen. El punto de rocio
superior algunas veces es llamado punto de rocio retrogrado (punto de condensacin retrograda).
La regin de condensacin retrograda ocurre a temperaturas entre la temperatura crtica y la
cricondetermica. Una situacin similar de condensacin retrograda ocurre cuando la temperatura
es cambiada a presin constante entre la presin crtica y la cricondebarica.
- Ejemplo:
Determine el rango de temperatura en el cual la condensacin retrogrda ocurrir para una mezcla
de 50,02 porcentaje molar de metano y 49,98 porcentaje molar de etano.
Solucion:
La condensacin retrograda ocurrir a temperaturas entre la temperatura critica de 15F y la
cricondetermica de 24F.
DIAGRAMA DE PRESION VS VOLUMEN PARA UNA MEZCLA DE DOS COMPONENTES
Un diagrama tpico de presin -
volumen de una mezcla de dos
componentes, muestra una isoterma
debajo de la temperatura crtica.
La figura anterior nos muestra una nica isoterma en el diagrama de presin vs volumen de la
mezcla de dos componentes con una composicin general constante. Las caractersticas que se
distinguen en este diagrama es que la presin disminuye ya que el proceso pasa del punto de
burbuja al punto de rocio. La lnea del punto de burbuja a la lnea del punto de rocio no es
horizontal y no es necesariamente recta. La disminucin en la presin es causada por los cambios
en la composion del liquido y del gas a medida que el proceso pasa a travs de la regin de dos
fases. En el punto de burbuja, la composicion del liquido es esencialmente igual a las composicin
general de la mezcla, pero la cantidad infinitesimal de gas es rico en el componente mas voltil.
Asimismo, en el punto de rocio la composicin del vapor es esencialmente igual a la composicin
general del sistema y la cantidad infinitesimal de liquido es mas rico en los componentes menos
voltiles. Los cambios en la pendiente de la lnea de punto de burbuja y el punto de rocio no son
tan agudos como para las sustancias puras.
Diagrama de presin
volumen de una mezcla de
47,6 porcentaje en peso de
una mezcla de n-pentano y
52,4 porcentaje en peso de
n-heptano.
La figura figura anterior nos da el diagrama de presin volumen para una mezcla de pentano y
n-heptano mostrando varias isotermas en el envolvente de saturacin. Note que a bajas
temperaturas el cambio en la pendiente de las isotermas en el punto de rocio son casi
inexistentes. Tambien note que el punto crtico no est en lo ms alto del envolvente de
saturacin como pasaba para las sustancias puras.
Ejemplo:
Basndonos en el diagrama anterior. Consideremos una mezcla de 47,6 porcentaje en peso de n-
pentano y 52,4 porcentaje en peso de n-heptano. Estime el volumen especfico del lquido en el
punto de burbuja a 400F. Tambin estime el volumen especfico del gas en el punto de rocio a
400F.
Solucin:
v del lquido en el punto de burbuja a 400F y 332 psia = 0.036 ft/lb, v del gas en el punto de rocio a
400F 275 Psia = 0.249 ft/lb
DIAGRAMAS DE COMPOSICIN
Una serie de experimentos de laboratorio con una sustancia pura nos arrojan datos para presin,
temperatura y volumen. Una serie de experimentos similares con un sistema de dos componentes
dar lugar a datos para variables adicionales. La composicin de una mezcla, en general, la
composicin de lquido en equilibrio y la composicin del gas en equilibrio son todas importantes.
Por lo tanto, adems de hacer un grafico combinando temperatura, presin y volumen, se hacen
grficos adicionales combinado estas variables vs la composicin siempre y cuando sea posible
PRESION VS COMPOSICION PARA MEZCLA DE DOS COMPONENTES
.
El diagrama anterior nos da un diagrama tpico de presin composicin para una mezcla de dos
componentes a una sola temperatura. Combinaciones de composicin y presiones que estn por
encima del envolvente indican las condiciones a las cuales la mezcla es completamente lquida.
Combinaciones de composicin y presin que estn por debajo del envolvente indican las
condiciones a las cuales la mezcla es gas. Cualquier combinacin de presin y composicin que
este dentro del evolvente indica que la mezcla exista en dos fases, gas y lquido. EL punto de
burbuja y el punto de roco tienen la misma definicin anteriormente discutida.
La lnea del punto de burbuja es tambin el lugar de composiciones del lquido cuando las dos
fases coexisten. La lnea del punto de roco es el lugar de composiciones del gas cuando el gas y el
lquido estn en equilibrio. La lnea a la que est ligada la composicin del lquido con la
composicin del gas en equilibrio es conocida como equilibrio de lneas de enlace. Las lneas de
enlace son siempre horizontales para la mezcla de dos componentes.
Considere que una mezcla de composicin representada por el punto 1 es trada a equilibrio a la
presin indicada y la temperatura del diagrama. La composicin del lquido en equilibrio es
indicada en el punto 2 y la composicin del gas en equilibrio es dada por el punto 3. La lnea de
enlace tambin puede ser usada para determinar las cantidades de lquido y gas presentes en el
punto 1. La longitud de la lnea 12 dividida por la longitud de la lnea de enlace 23, es la proporcin
de moles de gas a moles totales de la mezcla. La longitud de la lnea 13 dividida por 23 es la
proporcin de moles de lquido a moles totales de la mezcla.
La figura nos da los diagramas de presin-
composicin para mezclas de metano y etano. Estos
son cuatro envolventes de saturacin
correspondientes a cuatro temperaturas diferentes.
los bordes del diagrama que marcan 100 por ciento en moles de metano representan las presiones
de vapor del metano. Los borde del diagrama que marcan cero por ciento en moles de metano nos
dan la presin de vapor del etano.
Cuando la temperatura excede la temperatura critica de un componente, el envolvente de
saturacin no va todo el camino a travs del diagrama; ms bien, las lneas de punto de roci y de
punto de burbuja se unen en el punto crtico. Por ejemplo, cuando la temperatura critica de una
mezcla de metano y etano es menor a 100F, la presin crtica es 750 psia, y la composicin de la
mezcla critica es 95 por ciento en moles de metano y 5 por ciento en moles de etano. Veamos
que el lugar de los puntos crticos conectan la presion critica del etano, 708 psia, a la presion
critica del metano, 668 psia. Cuando la temperatura excede la temperatura critica de ambos
componentes, nos es posible para cualquier mezcla de dos componentes tener dos fases.
Ejemplo
Determine las composiciones y las cantidades de gas y liquido formados cuando 3 lb-moles de
mezcla de 70 por ciento en moles de metano y 30 por ciento en moles de etano son tradas a
equilibrio a -100F y 400 psia.
Solucion
Primero, trazar 70 por ciento en moles de metano y 400 psia en -100F en el envolvente de
saturacin, figura 2-22. Segundo, dibujar la lnea de enlace (ver figura 2-23) y leer la composicin
del liquido en equilibrio en la lnea de punto de burbuja y la composicin del gas en equilibrio en la
lnea de punto de rocio.
Componente Composicion de liquido,
porcentaje en moles
Composicion del gas,
porcentaje en moles
metano 52,2 91,8
etano 47,8 8,2
Tercero, calcule las fracciones de gas y liquido para la longitud de la lnea de enlace.
Fraccion de gas= 70-52,2/91,8-52,2=0,45 lb-mol de gas/ lb-mol total.
Fraccion de liquido= 91,8-70/ 91,8-52,2=0,55 lb-mol de liquido/ lb-mol total
Cantidad de gas= (0,45)(3lb-mol)= 1,35 lb-mol de gas
Cantidad de liquido= (a,55)(3lb-mol)= 1,65 lb-mol de liquido
DIAGRAMA DE TEMPERATURA-COMPOSICION PARA LA MEZCLAS DE DOS COMPONENTES
Los diagramas de temperatura-composicion para mezclas de metano y etano en la siguiente figura
Seis envolventes de saturacin corresponden a seis presiones diferentes mostradas.
La lnea inferior del envolvente de saturacin es la lnea del punto de burbuja y la lnea superior es
la lnea del punto de rocio. Las condiciones de composicin-temperatura trazadas por debajo del
envuelto de saturacin indican que la mezcla es completamente liquida.
Cuando la presion es menor que la presion critica de ambos componentes, las lineas de punto de
burbuja y de punto de rocio se unen en la presion de vapor de los componentes puros en cada
lado del diagrama. Cuando la presion excede la presion critica de alguno de los componentes la
lnea de punto de burbuja y la lnea de punto de rocio se unen en el punto critico. Por ejemplo,
una mezcla de 98 por ciento en moles de metano y 2 por ciento en moles de etano tienen una
temperatura critica de menos de 110F a una presion critica de 700 psia.
Cuando la presion de inters excede la presion critica de ambos componentes, el envolvente de
fase expone dos puntos crticos. Por ejemplo, mezcla de metano y etano expone un punto critico a
900 psia y menos de 62F y uno a 900 psia y 46 F.
Las lneas de enlace que estn dando las composicones de liquido y gas en equilibrio son
nuevamente horizontales. La lneas de punto de burbuja dan la composicin del liquido en
equilibrio y las lneas del punto de rocio dan la composicin del gas en equilibrio. La longitud de las
lneas de enlace representan las cantidades de gas y liquido en equilibrio en la misma forma como
para el diagrama de presin- composicin.
MEZCLA DE TRES COMPONENTES
EL diagrama de fase composicional para mezclas de tres componentes se representar de tal
manera que las composiciones de todos los tres componentes puedan ser mostradas. Los
diagramas formados por tringulos equilteros son convenientes para este propsito. Estos son
llamados diagramas ternarios.
DIAGRAMAS TERNARIOS
La figura anterior nos muestra un diagrama ternario. Cada vrtice del triangulo corresponde al
100 por ciento de un solo componente. La convencin usual es trazar el componente mas ligero en
la cima y el componente mas pesado debajo en la izquierda. Cada lado del triangulo representa
mezcla de dos componentes. Por ejemplo, el lado izquierdo del triangulo representa todas las
posibles mezclas de componentes pesados y livianos. Los puntos dentro del tirangulo representan
la mezcla de los tres componentes. La composicin es usualmente trazada en trminos de fraccin
molar o procentaje molar. Para un solo diagrama, ambas presiones y temperaturas son
constantes, solo la composcion cambia.
El punto 1 en la figura representa el componente puro B. El punto 2 representa una mezcla de 30
por ciento en moles del componente A y 70 por ciento en moles del componente C. EL punto 3
repesenta una mezcla la cual consiste de 50 por ciento en moles de A, 30 por ciento en moles de B
y 20 por ciento en moles de C. La composicin de la mezcla representada es determinada mejor
imaginando tres lneas para el punto 3 perpendiculares a los lados del diagrama triangular. La
longitud de la lnea 43 representa la composicin del componente A en la mezcla. La longitud de la
lnea 53 representa la composicin del componente B y la longitud de la lnea 63 representa la
composicin del componente C.
La lnea 21 nos representa un proceso de inters como futuros ingenieros de petrleo. Como
hemos visto, el punto 2 representa la composicin de una mezcla de un componente A y un
componente C con B no presente. La liena 12 rerpesenta las comprosiciones de todas las mezclas
formadas por la adicion del componente B a la mezcla original de los componentes A y C. Por
ejemplo, el punto 7 representa una mezcla de partes iguales de la mezcla original de A y C con la
componente B. La composicion es 50 por ciento del componente B, 15 por ciento del
componente A y 35 por ceinto del componente C. La razn de componentes de A a C, 15:35, es la
misma razn de A a C en la mezcla original, 30:70
DIAGRAMAS DE FASE DE TRES COMPONENTES
Diagrama ternario de una
mezcla de metano propano y N- propano a 500 psia y 160 F, en equilibrio con lneas de enlace
La figura anterior no muestra un diagrama de fase tpico de tres componentes. El metano es el
componente mas liviano y es trazado en la cima. De este modo, la lnea de punto de rocio se
encuentra a lo largo de la cima del envolvente de saturacin y la lnea de punto de burbuja a lo
largo del fondo. Este diagrama es para una sola temperatura y una sola presion. Las lneas de
enlace son rectas pero no horizontales, como era el caso para el diagrama de composiciones de
dos componentes. En el caso de la mezcla de tres componentes las lneas de enlace deben ser
determinadas experimentalmente y dadas en el diagrama.
El punto 1 representa una mezcla de metano, propano y n-pentano, las cuales muestran equilibrio
de gas y liquido a la temperatura y presion indicada por el diagrama. El punto 2 representa la
composicin en equilibrio de gas y el punto 3 representa la composicion en equilibrio de liquido.
La cantidad de gas en fraccin de moles totales de la mezcla general, es representado por la
longitud de la lnea 13 dividida por la longitud de la lnea 23. La cantidad de liquido en trminos de
la fracion de moles totales de la mezcla general es representado por la longitud de la lnea 12
dividida por la lnea 23.
- Ejemplo
Determine las composiciones y cantidades en equilibrio de gas y liquido cuando 6 lb-mol de una
mezcla de 50 por ciento en moles de metano, 15 por ciento en moles de propano y 35 por ciento
en moles de n-pentano estn llevando a equilibro a 160F y 500 psia.
Solucion
- Primero, trace la composicin de la mezcla en el diagrama ternario para la presion y
temperatura dada, (mirar la figura, punto 1).
- Segundo, leer la composicin de equilibrio de gas en el punto donde la lnea de enlace a
travs del punto 1 se conecta con la lnea del punto de rocio. Mirar el punto 2.
14 por ciento moles de propano
12 por ciento moles de n-pentano
100 por cinto moles
- Tercero, leer la composicin del liquido en equilibrio en el punto donde la lnea de enlace
a travs del punto 1 conecta con la lnea del punto de burbuja.
13 por ciento moles de metano
17 por ciento moles de propano
70 por ciento moles de n-pentano
100 por ciento moles
- Cuarto, calcular la fraccin de mezcla que es de gas
Fraccion de gas= 0,65 in/1,07in= 0,607 lb-mol de gas / lb-mol total
Y la cantidad de gas= (0,607)(6lb-mol)= 3,6lb-mol
- Quinto, calcular la fraccin de mezcla que es liquido
Fraccion de liquido= 0,42 in/ 1,07 in= 0,393 lb-mol de liquido/ lb-mol total
Y la cantidad de liquido= (0,393)(6lb-mol)= 2,4 lb-mol
Comparando el diagrama anterior con el siguiente:
el cual nos da el envolvente de saturacin para mezclas de metano, propano y n-pentano a la
misma temperatura del anterior pero a una presion ms alta. Las lneas de punto de burbuja y de
punto de rocio se unen en el punto critico. EL punto cririco nos da la composicin de la mezcla, la
cual tiene una presion critica de 1500 psia y una temperatura critica de 160F.
La figura siguiente nos muestra las variadas posiciones que el envolvente de saturacin de
mezclas de metano, propano y n-pentano puede tomar a 160F cuando la presion aumenta de la
atmosfrica a 2350 psia.
primera figura
segunda figura
Al analizar las graficas anteriores a presion atmosfrica, todas las mezclas de estos componentes
sern gas. La temperatura esta por encima de la temperatura critica del metano y la presion
atmosfrica estar por debajo de las presiones de vapor del propano y el n-pentano a 160F.
Considere una presion por encima de la presion de vapor del n-pentano y debajo de la presion de
vapor del propano, por ejemplo, 200 psia. Miraremos el punto 2 y en la primera figura la parte(2).
Todas las mezclas de metano y propano son gas. Las mezclas binarias de metano y n-pentano y de
propano y n-pentano estn ambas en la regin de dos fases. Su composicin en el punto de
burbuja y en el punto de rocio aparace a lo largo de los lados del diagrama ternario como los
finales de las lneas de punto de burbuja y punto de rocio de mezclas ternarias.
A la presion de vapor del propano, 380 psia a esta temperatura, las lneas de punto de burbuja y
punto de rocio del envolvente de saturacin convergen a 100 por ciento propano. Miremos el
punto 3 y en la primera figura la parte (3). La mezcla es solo binaria la cual muestra dos
comportamientos de fase que son de metano y n-pentano.
La presion por encima de la presion de vapor de propano y menor el punto crtico de las mezclas
de metano y n-pentano, por ejemplo 500 psia, punto 4, las mezclas metano-propano y metano-n-
pentano muestran dos comportamientos de fase, y las mezclas de propano y n-pentano son todas
liquidas. Asi, el envolvente de saturacin aparece como en la primera figura anterior parte (4).
El punto critico de una mezcla especifica de metano y propano ocurre a 1040 psia a esta
temperatura, punto 5 (segunda figura). Las lneas de punto de rocio y punto de burbuja del
ternario cruzan el lado metano-porpano del diagrama en la composicin de este punto critico.
Por debajo de esta presion, punto 6(segunda figura), todas las mezclas de metano y propano son
una sola fase, de esta forma, solo el metano y n-pentano binarios tienen comportamiento de dos
fases. Y solo el metano-n-pentano del lado ternario del diagrama puede mostrar el punto de
burbuja y el punto de rocio. Las lneas de punto de burbuja y de punto de rocio del envolvente de
saturacin no hace intercepcin con otro lado del diagrama, ms bien las dos lneas se unen un
punto critico, i.e., la composicin de la mezcla de tres componentes que tiene una presion critica
de 1500 psia a 160F.
Cuando la presion decrece, el tamao de la regin de dos fases decrece, hasta que la presion
critica de la mezcla de metano-n-pentano logra 1350 psia a esta temperatura, punto 8. A esta
presion y a todas las altas presiones, todas las mezclas de metano, propano y n-pentano son una
sola fase.
USOS DE LOS DIAGRAMAS TERNARIOS
Un uso comn de los digramas de fase de tres componentes es en el anlisis del despazamiento
miscible. Por ejemplo, en la siguiente figura
nos da el envolvente de fase de una mezcla de aceite con dixido de carbono. El aceite es trazado
como una mezcla artificial de dos componentes, con metano como un componente y todos los
otros constituyentes aadidos juntos como el otro componente.
Otra tcnica de separar el aceite en dos p-seudo componentes. Una contiene todos los
compuestos de atomos de 12 carbonos o menos. El otro contiene todos los componentes de
atomos de 13 corbonos o mas. EL doxido de carbono es el tercer componente del diagrama.
Ejemplo:
El aceite crudo de la figura 2-30 contiene 35 por ciento moles de metano. Todas las mezclas de
este aceite y dixido de carbono sern una sola fase (miscible)?
Solucion
No, una lnea recta desde el punto 35 por ciento en moles de metano, 65 por ciento en moles de
etano hasta el vertice en dixido de carbono puro pasa a travs de la envolvente de dos fases.
Anda mungkin juga menyukai
- Phase BehaviorDokumen46 halamanPhase BehaviorAndy AldahirBelum ada peringkat
- Diagrama de FasesDokumen15 halamanDiagrama de FasesOzwa Garcia Juarez100% (3)
- Fenomeno Crit - Grupo 5Dokumen24 halamanFenomeno Crit - Grupo 5Marcelo TorresBelum ada peringkat
- Hernandez Estefania App Tarea 3 4PV8Dokumen43 halamanHernandez Estefania App Tarea 3 4PV8Estefania BernardoBelum ada peringkat
- C2 ASPEN Con Soluciones PDFDokumen18 halamanC2 ASPEN Con Soluciones PDFalabastrinoBelum ada peringkat
- Propiedades sustancias purasDokumen31 halamanPropiedades sustancias purasJavier Enrique Bermudez Daza100% (1)
- Antecedentes TermoDokumen14 halamanAntecedentes TermoErik GutiérrezBelum ada peringkat
- Sustancias PurasDokumen54 halamanSustancias PurasMayra Leal92% (13)
- Termodinamica2 Final PDFDokumen6 halamanTermodinamica2 Final PDFHl ObBelum ada peringkat
- RESUMENcastellan Cap1Dokumen9 halamanRESUMENcastellan Cap1Anahy CHBelum ada peringkat
- Propiedades Criticas PDFDokumen14 halamanPropiedades Criticas PDFMaria Trinidad CastroBelum ada peringkat
- Diagramas de FaseeDokumen28 halamanDiagramas de FaseeCristian RodriguezBelum ada peringkat
- Tarea 1 de Tecnologia de Los Materiales 1Dokumen36 halamanTarea 1 de Tecnologia de Los Materiales 1Danny Carrasquedo Muñoz100% (2)
- Sustancias PurasDokumen5 halamanSustancias PurasardillasnetBelum ada peringkat
- Equilibrio vapor-líquido etanol-aguaDokumen26 halamanEquilibrio vapor-líquido etanol-aguaHildreth JadiraBelum ada peringkat
- PRACTICA 3 Cambio de Fase de Un Sustancia pura-1953550-IMA-BR305Dokumen9 halamanPRACTICA 3 Cambio de Fase de Un Sustancia pura-1953550-IMA-BR305Abdiel MoralesBelum ada peringkat
- Apuntes_Química_2023_Tema3-Liquidos(1)Dokumen10 halamanApuntes_Química_2023_Tema3-Liquidos(1)Iñigo CamachoBelum ada peringkat
- Sistema Benceno ExposiciónDokumen5 halamanSistema Benceno ExposiciónPablo Vargas100% (1)
- Determinacion Del Punto Triple de Una Sustancia PuraDokumen11 halamanDeterminacion Del Punto Triple de Una Sustancia PuraGerardo Rodríguez RodríguezBelum ada peringkat
- Determinación del punto tripleDokumen11 halamanDeterminación del punto tripleFacultad De Quimica UaqBelum ada peringkat
- Usfx Lab de Termo Inf 2Dokumen6 halamanUsfx Lab de Termo Inf 2Desmond BelmontBelum ada peringkat
- Apunte - Vapor de AguaDokumen7 halamanApunte - Vapor de AguaJuan Pablo IglesiasBelum ada peringkat
- Antecedentes DESTILACIÓN SIMPLE Y FRACCIONADADokumen6 halamanAntecedentes DESTILACIÓN SIMPLE Y FRACCIONADACinti Gómez MBelum ada peringkat
- Critico Lo Nesesario de SaberDokumen6 halamanCritico Lo Nesesario de Saberfreddy noya plataBelum ada peringkat
- TermodinamicaDokumen74 halamanTermodinamicaKvnMndBelum ada peringkat
- Punto CríticoDokumen8 halamanPunto CríticoSoscyre RiveraBelum ada peringkat
- Regla de la Palanca y Diagramas de Fases BinariasDokumen10 halamanRegla de la Palanca y Diagramas de Fases BinariasBrian PérezBelum ada peringkat
- Ensayo de Comportamiento de Fase de Los HidrocarburosDokumen16 halamanEnsayo de Comportamiento de Fase de Los HidrocarburosLuis CulebroBelum ada peringkat
- Diagrama de Fases de Una Sustancia PuraDokumen10 halamanDiagrama de Fases de Una Sustancia PuraOliver ParedesBelum ada peringkat
- Equilibrio Liquido VaporDokumen27 halamanEquilibrio Liquido VaporJohan VazquezBelum ada peringkat
- 3 Comportamiento de FasesDokumen26 halaman3 Comportamiento de FasesMiguel VelazcoBelum ada peringkat
- Densidad de la materia y estados físicosDokumen12 halamanDensidad de la materia y estados físicosCyn ParedesBelum ada peringkat
- Nomograma de PriesterDokumen56 halamanNomograma de PriesterdanifexBelum ada peringkat
- Transformación estructural y diagramas de fases en acerosDokumen14 halamanTransformación estructural y diagramas de fases en acerosAlex Garcia UlloaBelum ada peringkat
- Sistema BifasicoDokumen143 halamanSistema Bifasicogladiadores21Belum ada peringkat
- Líquidos y SolucionesDokumen7 halamanLíquidos y Solucionesandrea rieraBelum ada peringkat
- Euaciones de EstadoDokumen12 halamanEuaciones de EstadoEsther Ramos GonzalezBelum ada peringkat
- Prueba de SeparadoresDokumen10 halamanPrueba de SeparadoresZubenelgenubi Wilson Jimenez0% (1)
- Informe 2-Mezcla MulticomponentesDokumen19 halamanInforme 2-Mezcla MulticomponentesSalustria Cabezas SánchezBelum ada peringkat
- Influencia de La Temperatura en La Presion de Vapor 1Dokumen13 halamanInfluencia de La Temperatura en La Presion de Vapor 1Sandy Vanessa CardenasBelum ada peringkat
- Diagrama de Fases Co2Dokumen8 halamanDiagrama de Fases Co2Clarisabel RuizBelum ada peringkat
- Capitulo 3 (Propiedades de Solidos y Liquidos)Dokumen33 halamanCapitulo 3 (Propiedades de Solidos y Liquidos)july 507Belum ada peringkat
- Unidad 5. - Tranformación EstructuralDokumen14 halamanUnidad 5. - Tranformación EstructuralAlex Garcia Ulloa100% (1)
- Termodinamica-Jose AlfonsoDokumen15 halamanTermodinamica-Jose AlfonsoBersainBelum ada peringkat
- Equilbrio de FasesDokumen4 halamanEquilbrio de FasesRosalba González MéndezBelum ada peringkat
- Emilio MontillaDokumen33 halamanEmilio MontillaSAIA MARACAIBOBelum ada peringkat
- Termodinámica de procesos IIDokumen24 halamanTermodinámica de procesos IIPaul Ruiz BaldeonBelum ada peringkat
- Comportamiento de FasesDokumen35 halamanComportamiento de FasesDroite RonaldoBelum ada peringkat
- Practica 1 ESIME ZACDokumen9 halamanPractica 1 ESIME ZACeduardoBelum ada peringkat
- Práctica 4Dokumen8 halamanPráctica 4Abril De la FuenteBelum ada peringkat
- Termodinámica AplicadaDokumen23 halamanTermodinámica AplicadaChristina Lynn Roger's GrossBelum ada peringkat
- Propiedades de los fluidos: tensión superficial, viscosidad y presión atmosféricaDokumen9 halamanPropiedades de los fluidos: tensión superficial, viscosidad y presión atmosféricaDinel MolinaBelum ada peringkat
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDari EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesBelum ada peringkat
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDari EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSPenilaian: 4.5 dari 5 bintang4.5/5 (7)
- Formulación-y-Valoración-de-Ideas-de-NegocioDokumen3 halamanFormulación-y-Valoración-de-Ideas-de-NegocioMery GutierrezBelum ada peringkat
- Tipos-de-Sociedades-en-ColombiaDokumen5 halamanTipos-de-Sociedades-en-ColombiaMery GutierrezBelum ada peringkat
- Estructura-OrganizacionalDokumen2 halamanEstructura-OrganizacionalMery GutierrezBelum ada peringkat
- Fundamentos de Ingenieria de Yacimientos-Fredy EscobarDokumen331 halamanFundamentos de Ingenieria de Yacimientos-Fredy Escobarwilsonandreszabala100% (14)
- Identificando-su-Equipo-de-TrabajoDokumen1 halamanIdentificando-su-Equipo-de-TrabajoMery GutierrezBelum ada peringkat
- Definir-el-MercadoDokumen3 halamanDefinir-el-MercadoMery GutierrezBelum ada peringkat
- Análisis-de-Viabilidad-del-NegocioDokumen4 halamanAnálisis-de-Viabilidad-del-NegocioMery GutierrezBelum ada peringkat
- Entidades de Apoyo Al EmprendimientoDokumen5 halamanEntidades de Apoyo Al EmprendimientoMery GutierrezBelum ada peringkat
- Ejercicio-Mi-Mercado-ObjetivoDokumen2 halamanEjercicio-Mi-Mercado-ObjetivoMery GutierrezBelum ada peringkat
- Análisis-de-Viabilidad-FinancieraDokumen2 halamanAnálisis-de-Viabilidad-FinancieraMery GutierrezBelum ada peringkat
- Ejercicio-Evalúe-su-Mercado-ObjetivoDokumen2 halamanEjercicio-Evalúe-su-Mercado-ObjetivoMery GutierrezBelum ada peringkat
- Identificando-su-Equipo-de-TrabajoDokumen1 halamanIdentificando-su-Equipo-de-TrabajoMery GutierrezBelum ada peringkat
- 6 Lectura Recopilaci N de Informaci N PDFDokumen5 halaman6 Lectura Recopilaci N de Informaci N PDFJohn Fredy Garzón PérezBelum ada peringkat
- Poemas Retiro MindfulnessDokumen4 halamanPoemas Retiro MindfulnessMery GutierrezBelum ada peringkat
- Redes-Digitales-lowDokumen12 halamanRedes-Digitales-lowMery GutierrezBelum ada peringkat
- Los-HeadhuntersDokumen1 halamanLos-HeadhuntersMery GutierrezBelum ada peringkat
- Laboratorio 4 (2014-2)Dokumen1 halamanLaboratorio 4 (2014-2)Mery GutierrezBelum ada peringkat
- Ejercicio Su Mercado ObjetivoDokumen1 halamanEjercicio Su Mercado Objetivohensan2010Belum ada peringkat
- Cadena Del Petroleo 2013Dokumen207 halamanCadena Del Petroleo 2013Manuel Ernesto Zabala DuvalBelum ada peringkat
- Laboratorio 5 (2014-2)Dokumen2 halamanLaboratorio 5 (2014-2)Mery GutierrezBelum ada peringkat
- Laboratorio 4 (2014-2) PDFDokumen1 halamanLaboratorio 4 (2014-2) PDFMery GutierrezBelum ada peringkat
- Laboratorio 2 (2014-2)Dokumen2 halamanLaboratorio 2 (2014-2)Mery GutierrezBelum ada peringkat
- Mezcla de Dos ComponentesDokumen13 halamanMezcla de Dos ComponentesMery Gutierrez100% (1)
- Laboratorio 2 (2014-2)Dokumen2 halamanLaboratorio 2 (2014-2)Mery GutierrezBelum ada peringkat
- Laboratorio 5 (2014-2)Dokumen2 halamanLaboratorio 5 (2014-2)Mery GutierrezBelum ada peringkat
- Laboratorio 6 (2014-2)Dokumen1 halamanLaboratorio 6 (2014-2)Mery GutierrezBelum ada peringkat
- Laboratorio No 3 PDFDokumen6 halamanLaboratorio No 3 PDFMery GutierrezBelum ada peringkat
- AGUASDokumen59 halamanAGUASMery GutierrezBelum ada peringkat
- Diapositivas de Balance de Energia145Dokumen26 halamanDiapositivas de Balance de Energia145Mery GutierrezBelum ada peringkat
- ReaccionesDokumen35 halamanReaccionesMery Gutierrez100% (1)
- Diagrama de FasesDokumen16 halamanDiagrama de FasesMiriam Cantón Reyes100% (1)
- Revisión Documental Sobre Diagramas de FasesDokumen8 halamanRevisión Documental Sobre Diagramas de Fasesmichaelbalderrabano1Belum ada peringkat
- Diagrama de FasesDokumen5 halamanDiagrama de Faseslincecita100% (1)
- Serie 3 MateDokumen6 halamanSerie 3 MateLiz FernandoBelum ada peringkat
- Práctica 4 Equilibrio Entre Fases. Construcción Del Diagrama de Fases Del Ciclohexano.Dokumen9 halamanPráctica 4 Equilibrio Entre Fases. Construcción Del Diagrama de Fases Del Ciclohexano.KazuyaUedaTatsuyaBelum ada peringkat
- Diagramas de Fases BinlollllariosDokumen76 halamanDiagramas de Fases BinlollllariosEsteban Muñoz SalazarBelum ada peringkat
- Infome Diagrama de FasesDokumen32 halamanInfome Diagrama de FasesKatherin SalasBelum ada peringkat
- Apuntes Semana 7Dokumen31 halamanApuntes Semana 7Elda ColochoBelum ada peringkat
- Analisis de Fluidos Del ReservorioDokumen4 halamanAnalisis de Fluidos Del Reservoriohenguz100% (1)
- Diagrama de fases del aguaDokumen41 halamanDiagrama de fases del aguaRobert Soberón Espinoza0% (1)
- Termodinamica Aplicada A La Ingenieria Petrolera PDFDokumen28 halamanTermodinamica Aplicada A La Ingenieria Petrolera PDFTiffany JohnsonBelum ada peringkat
- Diagrama de fases de líquidos parcialmente misciblesDokumen8 halamanDiagrama de fases de líquidos parcialmente misciblesJuan Luis Hernandez Briones100% (1)
- Cambios de estado sustancias purasDokumen2 halamanCambios de estado sustancias purasManuelVeigaDíazBelum ada peringkat
- 3 Act Diagramas EquilibrioDokumen14 halaman3 Act Diagramas EquilibrioDalilaBelum ada peringkat
- Estados agregación materiaDokumen18 halamanEstados agregación materiaCesar Yahir Ramirez PizoBelum ada peringkat
- Migración de grasa en chocolateDokumen5 halamanMigración de grasa en chocolateSherlin Almanza ObregonBelum ada peringkat
- Diagrama fase materialesDokumen8 halamanDiagrama fase materialesJENNIFER DANIELA TOAPANTA CAMACHOBelum ada peringkat
- Vapor IndustrialDokumen16 halamanVapor Industriallorena MedinaBelum ada peringkat
- Informe N°10 de Fisicoquímica AIIDokumen19 halamanInforme N°10 de Fisicoquímica AIIConstanza Coronado RiveraBelum ada peringkat
- Infografia. Equilibrio de Fases Unidad 4.Dokumen1 halamanInfografia. Equilibrio de Fases Unidad 4.Flare SonicoBelum ada peringkat
- Diagrama de FluidosDokumen9 halamanDiagrama de FluidosKarla CarranzaBelum ada peringkat
- Apuntes de Fisicoquimica IIDokumen110 halamanApuntes de Fisicoquimica IIMary Espinosa100% (3)
- Comportamiento de FasesDokumen35 halamanComportamiento de FasesDroite RonaldoBelum ada peringkat
- Termodinámica de Equilibrio de FasesDokumen57 halamanTermodinámica de Equilibrio de FasesDaniel Ivan Sanchez FernandezBelum ada peringkat
- Informe Fisicoquimica 6Dokumen3 halamanInforme Fisicoquimica 6BastosZayasJoseBelum ada peringkat
- Diagramas de Equilibrio de FasesDokumen17 halamanDiagramas de Equilibrio de Fasesalexandra Fernández NietoBelum ada peringkat
- Práctica. Determinación Del Equilibrio Solido-LiquidoDokumen6 halamanPráctica. Determinación Del Equilibrio Solido-LiquidoOscar A. LuévanoBelum ada peringkat
- LIOFILIZACION - TermodinamicaDokumen68 halamanLIOFILIZACION - TermodinamicaWillian Baldeon77% (13)
- Diagramas TernariosDokumen2 halamanDiagramas TernariosSebastián Jara ContrerasBelum ada peringkat
- Guia 3 - Diagramas de FaseDokumen5 halamanGuia 3 - Diagramas de FaseSofi BelloBelum ada peringkat