Giacomo Rizzolatti - Lezioni Di Fisiologia Del Sistema Nervoso
Diunggah oleh
Massimo OmeriHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Giacomo Rizzolatti - Lezioni Di Fisiologia Del Sistema Nervoso
Diunggah oleh
Massimo OmeriHak Cipta:
Format Tersedia
INDICE GENERALE
Prefazione............................................................................................ 1
Parte Prima
II neurone Le sinapsi I riflessi
1. Tecniche fondamentali per lo studio del sistema nervoso.............5
2. Osservazioni elettrofisiologiche elementari ......................... 11
3. Il potenziale di riposo.............................................................. 23
4. Il potenziale d'azione............................................................... 33
5. I riflessi del midollo spinale........................................................47
6. I riflessi evocati da stimoli naturali .......................................... 61
I riflessi flessori.....................................................................................62
Il riflesso da grattamento..................................................................63
I riflessi da stiramento..........................................................................64
Recettori dei riflessi da stiramento...................................................66
Recettori tendini e riflessi tendinei ..................................................70
Riassunto dei riflessi mediati delle fibre Ia, Ib e IIa........................72
Fibre gamma e regolazione del fuso neuromuscolare....................73
7. Trasmissione sinaptica...........................................................79
Sinapsi neuromuscolare........................................................................79
8. Trasmissione sinaptica nel sistema nervoso centrale.................89
Trasmissione sinaptica elettrica........................................................91
Trasmissione sinaptica chimica........................................................93
Potenziali postsinaptici eccitatori .....................................................95
Potenziali postsinaptici inibitori ......................................................97
Inibizione presinaptica......................................................................98
Nascita dei potenziali d'azione nei neuroni centrali ................... 100
9. Organizzazione del midollo spinale................................................ 105
Vie discendenti ............................................................................ 110
Vie propriospinali........................................................................ 112
Vie ascendenti ........................................................................ 113
Disturbi conseguenti alla sezione completa del midollo spinale. 114
III
IV
Parte Seconda
I recettori La sensibilit somatica II talamo
La corteccia cerebrale
1. Introduzione alle funzioni di senso........................................ 123
2. Organizzazione dei sistemi sensoriali .................................... 127
3. Il processo di trasduzione.................................................. 131
4. La sensibilit somatica................................................... 141
5. Tatto-pressione e senso di posizione: capacit discriminative
nell'uomo....................................................................................
145
6. I meccanocettori .......................................................... 151
7. Vie afferenti pretalamiche della sensibilit somatica.............. 159
Sistema dorsale e lemnico mediale................................................ 159
Sistema cervicale laterale.......................................................... 164
Sistema antero-laterale.............................................................. 166
Sistema trigeminale....................................................................... 168
8. I l tal amo............................................................ 173
Nuclei talamici aspecifici .......................................................... 175
Nuclei talamici specifici ............................................................... 180
Nuclei talamici associati alle vie sensoriali ................................ 182
Nuclei talamici associati alle vie con funzioni motorie.............. 186
Nuclei talamici associati a funzioni emozionali e percettive
complesse..................................................................................
187
9. Corteccia cerebrale...................................................................... 189
Aree della sensibilit somatica..................................................... 201
Area somatica sensoriale principale........................................... 202
Area somatica sensoriale II ............................................................. 205
10. Lesioni delle vie e dei centri del sistema somatosensoriale......... 209
Deficit conseguenti a lesioni dei cordoni dorsali ......................... 209
Deficit conseguenti a lesioni dei cordoni anterolaterali............... 210
Sindromi da emisezione del midollo spinale, da lesione delle
corna grigie posteriori e da lesione della sostanza grigia
centrale del midollo spinale..........................................................
211
Deficit conseguenti a lesioni del complesso ventrobasale del
talamo e dell'area somatica principale della corteccia
cerebrale....................................................................................
212
PREFAZIONE
Questo nuovo volume non una nuova edizione dei due precedenti
volumetti che raccoglievano le mie lezioni sul sistema nervoso. solo
una loro ristampa.
L'idea dell'Editore era che io aggiornassi il materiale gi pubblicato e
aggiungessi il sistema motorio che nei libri di testo trattato, in genere,
in modo piuttosto superficiale. Purtroppo non ho avuto tempo n per la
revisione n per l'aggiunta.
Mi auguro che questo volume abbia vita breve, di due tre anni al
massimo, e che venga poi sostituito da una nuova edizione aggiornata.
Spero di trovare il tempo di farlo. Non mi sento tuttavia particolarmente
in colpa per le inadeguatezze del volume in quanto a chi viene a lezione
viene segnalato dove il volume superato e dove studiare per integrarne
il contenuto.
Come avevo scritto nelle prefazioni precedenti, scopo di questi appunti
solo di dare una traccia semplice da seguire per capire i meccanismi di
base della fisiologia del sistema nervoso. Per una buona preparazione
questi appunti devono essere integrati con le lezioni e con capitoli da
studiare su altri testi.
Giacomo Rizzolatti
PARTE PRIMA
Il neurone Le sinapsi
I riflessi
1) TECNICHE FONDAMENTALI PER LO STUDIO
DEL SISTEMA NERVOSO
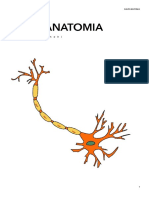
L'unit funzionale del sistema nervoso il neurone. Dal punto
di vista istologico il neurone tipo consta di tre parti principali: il
corpo cellulare o soma, i dendriti, e l'assone o neurite. L'assone ,
in genere, un lungo prolungamento che termina in contatto con al-
tri neuroni. La regione di contatto tra l'assone ed i neuroni prende
il nome di sinapsi.
I neuroni nell'uomo sono circa 25 miliardi e formano grazie
alle loro connessioni una complessa ed intricata rete. La rete ner-
vosa, dal punto di vista funzionale, non omogenea; ma alcune
parti di essa sono responsabili di certe funzioni, altre parti di altre
funzioni. Compito della fisiologia di stabilire quali funzioni hanno
le diverse parti della rete nervosa e di scoprire come i neuroni ed i
circuiti neuronali riescano a svolgere queste funzioni.
Le tecniche sperimentali usate per lo studio del sistema nervo-
sso sono fondamentalmente tre: la tecnica dell'ablazione, la tecnica
della registrazione, la tecnica della stimolazione. Vediamo in-
nanzitutto in cosa queste tecniche consistono e quali risultati pos-
sano dare.
La tecnica dell'ablazione consiste nell'asportazione chirurgica
di parti, anatomicamente ben precisate, del sistema nervoso. Ci si
prefigge di capire qual' la funzione della parte asportata esami-
nando il comportamento dell'animale dopo la lesione e paragonan-
dolo a quello di un animale integro. Se asportiamo, ad esempio,
l'area citoarchitettonica 4 della corteccia cerebrale, vediamo che
l'animale diventa paretico. Evidentemente la funzione dell'area 4
5
6 7
in qualche modo connessa colla motilit. Se invece asportiamo le
aree citoarchitettoniche 17, 18, 19 vediamo che compare un gra-
ve deficit della visione. Possiamo concludere che queste ultime
aree c'entrino in qualche maniera con la funzione visiva. Ecco che
abbiamo stabilito che due aree corticali diverse hanno funzioni
diverse e abbiamo dedotto dai sintomi che l'animale presentava,
quale possa essere la loro funzione.
I risultati ottenuti con la tecnica dell'ablazione possono essere
considerati sotto due punti di vista: l'utilit pratica ed il valore
teorico. Dal punto di vista pratico il loro interesse enorme. Cono-
scendo quali sono i sintomi che compaiono dopo lesione di una
certa parte del sistema nervoso il neurologo riesce a fare diagnosi
di sede. Sa cio pur ignorando ancora la causa della malattia, do-
ve la lesione e quindi pu eseguire indagini per accertarne anche
la causa. Se si considerano i processi patologici che colpiscono il si-
stema nervoso (traumi, infiammazioni, degenerazioni, tumori) si
vede subito che tutti essi imitano l'esperimento dell'ablazione del-
la neurologia sperimentale ed i disturbi che causano sono fonda-
mentalmente sovrapponibili a quelli che si hanno come conseguenza
dell'ablazione della regione colpita.
Dal punto di vista teorico gli esperimenti di ablazione presenta-
no il fianco a parecchie critiche. Innanzitutto il sistema nervoso
formato da una serie di aree o di centri collegati in serie l'uno con
l'altro. Pertanto se si distrugge un determinato centro nervoso i di-
sturbi conseguenti possono essere dovuti o alla mancanza del cen-
tro distrutto (e della sua funzione) o al fatto che stata interrotta
la via ai centri superiori (sindrome da disconnessione).
I mmaginiamo ad esempio di avere distrutto un'area corticale
ed il soggetto non capisce pi le parole. Possiamo concludere che
quell'area specifica per il linguaggio? Certamente no, perch la
lesione potrebbe essere semplicemente in un'area acustica o nelle
vie che congiungono l'area acustica ad un'area del linguaggio e
l'incapacit di capire il linguaggio potrebbe essere quindi dovuta
alla mancanza di afferenze ai centri specifici per esso. Questo
esempio pu sembrare banale, ma il problema di decidere quale sia
la funzione di un centro nervoso spesso complicata dal problema
della disconnessione che la lesione provoca.
Ancora non affatto detto che un solo centro nervoso sia re-
sponsabile di una certa funzione o almeno delle funzioni che ven-
gono esaminate nei vari tests che si applicano ai pazienti ed agli
animali. Ad esempio stato dimostrato che animali privati dell'a-
rea visiva corticale primaria (area 17) hanno ancora notevoli capa-
cit visive. Si deve da questo dedurre che quest'area corticale su-
perflua? Certamente no. Semplicemente la sua funzione visiva
diversa e pi complessa di quella che viene saggiata nei tests che
si applicano tradizionalmente per esaminare le capacit visive.
Un'ulteriore difficolt nell'interpretazione degli esperimenti di
ablazione costituita dal fatto che centri nervosi in grado di svol-
gere una loro attivit autonoma sono controllati dai centri superio-
ri. Se si distruggono i centri superiori, quelli inferiori, anatomi-
camente integri, cessano di funzionare per un certo periodo. Que-
sto deficit transitorio prende il nome di diaschisi. Conseguenza del-
la diaschisi che la sintomatologia iniziale di una lesione dovuta,
in parte alla mancanza della funzione del centro leso, in parte al
cattivo funzionamento dei centri sottostanti. Poich quando questi
ricuperano, la loro attivit non identica a quella precedente la le-
sione mancando il normale controllo esercitato su essi dal centro
superiore, l'interpretazione della funzione precisa del centro supe-
riore leso diventa molto difficile.
Con tutto questo le tecniche di ablazione restano la base delle
nostre conoscenze di neurologia clinica e sperimentale. Tuttavia esse
sono insufficienti a dare una risposta definitiva sulla funzione di un
centro nervoso e non dicono nulla sui meccanismi neuronali
responsabili della funzione.
Le tecniche di registrazione e stimolazione sono tecniche rela-
tivamente recenti e si basano sul fatto che l'attivit del sistema ner-
voso dipende da fenomeni elettrici. Di esse verr trattato ampia-
mente nei prossimi capitoli, per cui su di esse verranno presentati
qui solo alcuni cenni.
Quando si parla di registrazione dal sistema nervoso bisogna
8 9
avere chiaro che tipo di registrazione viene fatto. Si distinguono in-
fatti tre tipi di registrazione che danno informazioni su aspetti di-
versi dell'attivit del sistema nervoso: a) registrazione macroelet-
trodica; b) registrazione con microelettrodi extracellulari; c) regi-
strazione con microelettrodi intracellulari.
La registrazione macroelettrodica una registrazione che viene
fatta da popolazioni di cellule nervose, di fibre nervose, o di
cellule e fibre nervose. Come dice la parola si usano macroelettrodi,
cio elettrodi di diametro relativamente grande, nell'ordine dei
millimetri o anche dei centimetri. Un esempio di registrazione
macroelettrodica l'elettroencefalogramma. In questo caso si
applicano sulla cute della testa delle placchette di sostanza
conduttrice, bene a contatto colla pelle, e si registra la differenza di
potenziale tra coppie di elettrodi. Questo metodo non ci dice nulla
sul linguaggio con cui le cellule comunicano tra di loro ma, a
secondo del tipo di attivit elettrica presente, ci indica se una
certa zona della corteccia sana o affetta da processi patologici.
Un altro esempio di registrazione macroelettrodica il
neurogramma, la registrazione cio dell'attivit elettrica di un
nervo. Del neurogramma verr parlato a lungo nel capitolo
seguente.
Pi raffinato il metodo di registrazione con microelettrodi
extracellulari. In questo caso si usano come elettrodi degli aghi me-
tallici sottilissimi, completamente isolati tranne che in punta (dia-
metro 1-3 p) o delle micropipette di vetro riempite con una solu-
zione di NaCl. Questi elettrodi vengono introdotti nel centro ner-
voso che si vuole studiare e fatti avanzare usando dei micromani-
polatori, degli strumenti cio che permettono l'avanzamento del-
l'elettrodo di uno o pochi micron per volti. Grazie a questa tecnica
si riesce ad isolare l'attivit elettrica di un singolo neurone o di una
singola fibra nervosa.
Come studieremo pi avanti, ogni neurone in grado di gene-
rare diversi tipi di segnali elettrici, ma v' un solo tipo di segnale, il
potenziale d'azione, che viene trasmesso lungo l'assone e poi da un
arsone al neurone successivo. Questo potenziale il maggiore per
'
registrato con la tecnica di registrazione extracellulare. Caratteri-
stica dei potenziali d'azione quella di essere tutti della medesima
ampiezza. Cos se si pone un microelettrodo in prossimit di una
fibra o di una cellula si vede una serie di potenziali l'uno uguale
all'altro, ma la frequenza con cui si succedono cambia. Ci sono dei
momenti in cui i potenziali d'azione sono rari, altri in cui sono
frequenti. In altre parole il sistema nervoso parla un linguaggio che
si basa sulle modificazioni della frequenza di scarica dei neuroni.
Per capire la genesi dei potenziali d'azione e, pi in generale,
dei fenomeni elettrici alla base dell'attivit nervosa occorre usare
una tecnica ancora pi raffinata, quella della registrazione intracel-
lulare. Si usano elettrodi finissimi dalla punta minore di 1 . Si
tratta di micropipette riempite di una soluzione di KCl che vengo-
no infilate nell'interno della cellula o della fibra nervosa attraverso
la membrana cellulare. Usando questa tecnica si scoperto che, in
condizioni di riposo, c' una differenza di potenziale tra l'esterno e
l'interno del neurone (potenziale di riposo) e che, oltre ai potenzia-
li di azione, i neuroni generano altri potenziali di ampiezza minore,
i potenziali postsinaptici. Questi potenziali non si trasmettono lungo
l'assone, ma sono alla base della nascita dei potenziali d'azione.
La terza tecnica fondamentale usata nella fisiologia del sistema
nervoso la tecnica della stimolazione. Essa consiste nell'applica-
zione di correnti elettriche al sistema nervoso. Le correnti elettri-
che possono essere applicate usando macroelettrodi e cos interes-
sare moltissimi neuroni o essere applicate attraverso microelettro-
di extracellulari eccitando gruppi ristretti di cellule nervose. In ge-
nere negli esperimenti di stimolazione si usano correnti sufficienti
ad evocare nei neuroni dei potenziali d'azione. Si studia quindi
l'effetto che l'eccitazione di un certo gruppo di neuroni ha sul
comportamento del soggetto stimolato. Ad es. la stimolazione
dell'area corticale 4, la cui ablazione provoca come abbiamo visto
una paresi, determina delle contrazioni muscolari. La stimolazione
delle aree 17, 18, 19 la cui ablazione causa disturbi visivi porta alla
comparsa di sensazioni visive. Da questi esempi si vede come il
metodo della stimolazione sotto molti aspetti speculare a quello
10 11
dell'ablazione.
Bisogna tenere presente che gli effetti che si ottengono me-
diante stimolazione dei centri del sistema nervoso imitano molto
grossolanamente la loro funzione. Infatti la stimolazione interessa
contemporaneamente molti neuroni adiacenti, che in condizioni
normali non entrano in funzione simultaneamente, e viceversa la
stimolazione non eccita neuroni localizzati lontano dall'elettrodo
stimolante nel centro studiato o in altri centri che in condizioni
fisiologiche collaborano nel determinare una certa attivit funzio-
nale. Pur con questi limiti la tecnica della stimolazione ha dato
risultati di grande valore, come ad esempio la scoperta dell'esisten-
za di aree corticali con funzioni motorie. Infine in certi esperimen-
ti la stimolazione viene fatta con elettrodi introdotti nell'interno
delle cellule o delle fibre nervose (stimolazione intracellulare). Dei
parametri della corrente elettrica usati in questi e negli altri esperi-
menti di stimolazione (quelli extracellulari) si parler nei capitoli
successivi.
2) OSSERVAZIONI ELETTROFISIOLOGICHE
ELEMENTARI
Prima di studiare in dettaglio i meccanismi che sono alla base
delle propriet elettriche del sistema nervoso, esaminiamo alcuni e-
sperimenti elementari che ci permetteranno di chiarire cosa ci dob-
biamo spiegare.
Immaginiamo di avere chirurgicamente isolato dalla zampa di
una rana un muscolo ed il suo nervo, ad es. lo sciatico ed il gastroc-
nemio. Abbiamo il cosiddetto preparato nervo-muscolo isolato.
Questo preparato se trattato opportunamente sopravvive per mol-
te ore, anche se non connesso pi coll'organismo. Poniamo ora una
coppia di elettrodi stimolanti sul muscolo e facciamo passare della
corrente. Vedremo che il muscolo si contrae. Ci dovuto al fatto
che la stimolazione ha provocato la nascita, nelle fibre muscolari,
di potenziali d'azione e che questi, mediante un complesso mecca-
nismo, hanno causato la contrazione del muscolo.
Poniamo ora i due elettrodi stimolanti sul nervo e facciamo
passare la corrente. Vedremo che il muscolo si contrae anche que-
sta volta. Cosa successo? La stimolazione del nervo ha determina-
to la nascita di potenziali d'azioni che questa volta non sono nati
nel muscolo, ma si sono originati nel nervo e poi si sono propagati
al muscolo lungo il nervo, causandone infine la contrazione. Co-
me facciamo ad essere sicuri che il muscolo si contratto perch i
potenziali d'azione del nervo si sono trasmessi al muscolo e non
per diffusione di corrente o per qualche altro artefatto? Basta se-
zionare il nervo. Si vedr che pur lasciando i due tronconi a con-
tatto la stimolazione di quello non connesso al muscolo non deter-
miner la contrazione.
12
13
Nell'esperimento precedente la contrazione del muscolo stata
usata come indicatore che il nervo in grado di generare e condur-
re dei potenziali elettrici. Andiamo ora avanti nel nostro esperi-
mento e cerchiamo di vedere in cosa questi potenziali elettrici con-
sistano. Poniamo quindi sul nervo accanto ai due elettrodi stimo-
lanti un'altra coppia di elettrodi che serviranno per registrare gli e-
venti elettrici. La situazione sperimentale illustrata nella Fig. 2-1
in alto a sinistra.
elettrodi stimolanti elettrodi registranti
Fig. 2-1 - Soglia d'eccitamento per il nervo.
(Da B. Katz, Nerve, muscle,and synapse, New York, McGraw-Hill, 1966).
Se ora colleghiamo i due elettrodi registranti con un oscillosco-
pio vediamo che in assenza di stimolazione i due elettrodi sono iso-
potenziali cio tra di loro non v' alcuna differenza di potenziale.
Applichiamo ora uno stimolo elettrico debole al nervo, vedremo
che sul tracciato compare una deflessione praticamente istantanea
alla stimolazione (Fig. 2-l, primi due tracciati a sinistra). Questa
deflessione non dovuta ad un fenomeno biologico, essa rappre-
senta un artefatto dovuta a diffusione di corrente. Aumentiamo
progressivamente l'intensit dello stimolo, vediamo che oltre all'ar-
tefatto che progressivamente aumenta, compare un'onda che an-
ch'essa aumenta. Quest'onda un fenomeno biologico ed dovuta
ai potenziali d'azione che si propagano lungo il nervo. L'onda bi-
fasica, la prima fase (pi grande) negativa, la seconda minore posi-
tiva. (Le onde negative in questa figura, come d'altronde spesso in
fisiologia, sono rivolte verso l'alto, le positive verso il basso).
Perch l'onda bifasica? Questo dovuto alla maniera con cui
la registrazione stata fatta nell'esperimento. Infatti nell'esperi-
mento della figura 2-1 sono stati posti due elettrodi registranti en-
trambi sul nervo. I potenziali d'azione originano in corrispondenza
degli elettrodi stimolanti e poi si propagano verso quelli registranti.
Nel propagarsi essi incontrano prima un elettrodo, poi l'altro.
L'onda formata dai potenziali d'azione negativa e pertanto non
appena essa raggiunge l'elettrodo registrante pi vicino alla coppia
di elettrodi stimolanti, questo diventa negativo rispetto all'altro.
Successivamente l'onda formata dai potenziali d'azione raggiunge
anche l'elettrodo pi lontano. A questo punto non v' pi diffe-
renza di potenziale tra gli elettrodi in quanto entrambi sono egual-
mente negativi. Poi l'onda si allontana e solo l'elettrodo pi lonta-
no dagli elettrodi stimolanti registra l'onda negativa. L'elettrodo
pi vicino in rapporto al pi lontano diventa positivo. Ecco quindi
che nel tracciato compare un'onda positiva. La positivit dovuta
al fatto che la registrazione bipolare (entrambi gli elettrodi "ve-
dono" l'evento elettrico) e l'elettrodo di riferimento per la lettura
l'elettrodo pi vicino agli elettrodi stimolanti.
La dimostrazione che l'onda formata dai potenziali d'azione
negativa si ha registrando monopolarmente. Nella registrazione
monopolare un solo elettrodo "vede" l'evento elettrico biologico,
l'altro posto su una struttura che non viene interessata dal feno-
meno. Nell'esperimento della Fig. 2-l l'elettrodo distale, affinch
non registri i potenziali d'azione, viene spostato sulla porzione
nervo
14 15
estrema, uccisa, del nervo. In questo caso, come si pu vedere dal
tracciato in basso a destra della figura (linea continua) si ha un'onda
monofasica, negativa. L'onda tratteggiata rappresenta la stessa onda,
ma registrata bipolarmente.
A questo punto pu sembrare che ci sia una contraddizione tra
l'asserzione che i potenziali d'azione sono eventi rapidi e tutti
eguali per ampiezza l'uno all'altro ed il fatto che le onde registrate
dal nervo sono lente e aumentano d'ampiezza con l'aumentare
d'intensit dello stimolo. I n realt non v' nessuna contraddizio-
ne. Quando si registra da un nervo globalmente, si registra contem-
poraneamente da molte delle fibre nervose che lo compongono.
Aumentando l'intensit dello stimolo pi fibre vengono interessate
ed ognuna di esse genera un potenziale d'azione. Quello che si vede
sui tracciati un'onda formata dalla somma di molti potenziali
d'azione; pi fibre eccitate, maggiore l'ampiezza dell'onda. Bisogna
sempre fare attenzione al tipo di registrazione. Se si registra da pi
fibre (ad es. da un nervo) si vedranno delle onde (registrazione con
macroelettrodi), se si registra da una singola fibra o da poche fibre
si vedranno potenziali d'azione (registrazione con microelettrodi).
Nell'esperimento esaminato prima si visto che l'onda formata
dai potenziali d'azione compare quando l'intensit della corrente ap-
plicata al nervo raggiunge un certo valore. Si parla di intensit so-
glia quando l'intensit della corrente applicata al nervo la minima
necessaria per far nascere i potenziali d'azione. Si parla di corrente
sotto soglia o di stimoli sotto soglia quando la loro intensit in-
sufficiente perch nascano dei potenziali d'azione. Quando si vuole
determinare lo stimolo soglia per eccitare un nervo altri due para-
metri, oltre l'intensit della corrente, devono essere presi in consi-
derazione: la durata della corrente e la velocit con cui la corrente
aumenta (di/dt, cio la derivata intensit/tempo). Se l'aumento
d'intensit di corrente pressoch immediato, come ad es. nelle
onde quadre dei moderni stimolatori, e la durata della corrente
infinita il solo fattore che determina la soglia l'intensit di cor-
rente. Questa intensit di corrente soglia chiamata reobase.
Quando la durata dello stimolo breve l'intensit della corrente in
dispensabile per l'eccitamento del nervo aumenta. Facendo oppor-
tuni esperimenti si trova che per ogni intensit di corrente esiste
una durata soglia, questa durata soglia viene chiamata tempo utile.
Si possono quindi costruire per i vari nervi delle curve che rifletto-
no l'importanza reciproca della durata e della intensit di corrente.
Queste curve, che hanno una importanza pratica in quanto sono
modificate da affezioni patologiche dei nervi, sono chiamate curve
intensit-dura. La Fig. 2-2 mostra una tipica curva intensit-durata.
Fig. 2-2 - Curva d'intensit-durata.
(Da T.C. Ruch e J.F. Fulton, Medical Physiology and Biophysics, Philadelphia,
W.B. Saunders, 1960).
In questa curva il tempo utile espresso in funzione dell'inten-
sit dello stimolo. Dal punto di vista pratico un valore importante
che si ricava da queste curve la cronassia. Per cronassia si intende
l tempo utile per un'intensit doppia della reobase. La cronassia
il valore che pi frequentemente viene ricercato in neurologia
quando si sospetta la malattia di un nervo.
Torniamo ora di nuovo alla situazione sperimentale della Fig.
2-l, ma stimoliamo il nervo non pi con un singolo stimolo, ma
16 17
bens con due shocks applicati uno dopo l'altro. Se dopo il primo
stimolo ne applichiamo un secondo prima che sia trascorso 1 msec
vediamo che questo, nonostante che sia soprasoglia, non provoca
alcuna risposta. Il nervo "refrattario" alla stimolazione. Se il se-
condo shock applicato dopo 2-3 msec, per ottenere una risposta
bisogna aumentare l'intensit della corrente, ed anche in questo ca-
so l'ampiezza dell'onda evocata sar minore di quella causata dal
primo stimolo. Allontanando nel tempo il secondo stimolo si vede
che solo con un intervallo di circa 5 msec l'onda evocata da un se-
condo stimolo di pari intensit al primo pari anche di ampiezza
all'onda evocata dal primo.
Cosa significano questi dati? Significano che una volta genera-
to un potenziale d'azione il nervo ha bisogno di un periodo di ricu-
pero. V' una prima fase in cui esso non in grado di generare as-
solutamente potenziali d'azione. Questa prima fase chiamata
"periodo refrattario assoluto". V' poi una seconda fase in cui il
nervo ricupera le sue capacit di generare potenziali d'azione, ma
solo parzialmente. La sua soglia in tale periodo molto elevata.
Questo periodo il `periodo refrattario relativo ". Il periodo re-
frattario rappresenta una importantissima propriet delle cellule
nervose. In conseguenza a tale propriet un potenziale d'azione
un evento la cui frequenza limitata. Ci significa che il codice
con cui le fibre nervose trasmettono le informazioni si basa su se-
gnali discontinui, discreti e che questi possono succedersi ad una
frequenza massima fissata dal periodo refrattario.
Nell'esperimento della Fig. 2-1 abbiamo visto che la stimola-
zione adeguata di un nervo determina la comparsa di un'onda ne-
gativa formata dai potenziali d'azione delle singole fibre costi-
tuenti il nervo. Prendiamo ora un nervo e poniamo gli elettrodi
registranti ad alcuni centimetri da quelli stimolanti. Applichiamo
ad esso uno shock massimale, uno shock cio che evoca la risposta
massima possibile; vedremo che sul tracciato compaiono pi onde.
Un esempio mostrato nella Fig. 2-3. In questa figura si vede dopo
l'artefatto dello stimolo un'onda precoce di grande ampiezza, onda
a, e una onda pi piccola tardiva, onda S. Le onde sono negative
monofasiche perch la registrazione monopolare.
Fig. 2-3 - Neurogramma del nervo safeno di gatto.
(Da T.C. Ruch e J.F. Fulton, Medical Physiology and Biophysics; Philadelphia
W.B. Saunders, 1960).
Come mai vi sono due onde? Vi sono due possibilit teoriche:
la prima che un singolo shock sia in grado di generare pi poten-
ziali d'azione in tempi diversi, una scarica cio ripetitiva; la secon-
da che fibre di calibro diverso, sempre presenti in un nervo, con-
ducano a velocit diversa. Quindi se si registra ad una certa distan-
za dagli elettrodi stimolanti i potenziali d'azione dovuti alle fibre
che conducono pi rapidamente formeranno onde precoci, quelle
che conducono pi lentamente onde tardive. Questa seconda inter-
pretazione quella giusta. Ci si pu dimostrare ponendo due cop-
pie di elettrodi registranti sul nervo a distanze diverse dall'elettro-
do stimolante. Se vera l'ipotesi della risposta ripetitiva ci si deve
aspettare che le due onde si propaghino alla stessa velocit. Infatti
secondo questa ipotesi esse sono solo nate in tempi diversi, quindi
il ritardo dell'onda tardiva da quella precoce dovrebbe restare
18 19
invariata. Se vera l'ipotesi di una diversa velocit di conduzione
l'onda precoce dovrebbe distanziare sempre pi l'onda tardiva
mano a mano che cresce la distanza tra punto d'origine delle onde
e luogo di registrazione. Se si fa l'esperimento si trova proprio
questo risultato.
L'esperimento precedente indica quindi che in un nervo esisto-
no fibre che conducono a velocit diversa. Si pu dimostrare usando
stimoli di intensit variabile che le fibre che costituiscono i nervi
hanno anche soglie diverse. Precisamente le fibre a rapida conduzione
sono le fibre a soglia pi bassa. A questo punto c' una domanda
immediata che viene in mente. La diversit di eccitabilit e di
velocit di conduzione delle fibre nervose ha una controparte
nelle loro propriet anatomiche? La risposta si. Studiando infatti
il neurogramma dei vari nervi, cio il numero di onde evocabili, la
loro velocit di conduzione, la loro soglia, ecc. e paragonandolo alla
composizione istologica del nervo (fibre mieliniche, fibre amie-
liniche, diametro delle prime, diametro delle seconde, ecc.) si
trovato che v' una precisa correlazione tra propriet funzionali e
propriet istologiche.
Due autori americani, Erlanger e Gasser, che hanno studiato a
lungo questo problema hanno proposto di suddividere le fibre, a
secondo delle loro propriet, in tre gruppi principali: Fibre A, B e
C.
Fibre A: sono fibre mieliniche del sistema somatico, afferenti ed
efferenti. (Quando si parla di fibre afferenti si intende sempre
afferenti al midollo o al tronco dell'encefalo e lo stesso riferimento
vale per le efferenti). Il loro diametro compreso tra 1 e 21 p. La
loro velocit di conduzione varia tra 6 m/sec per le fibre pi piccole
a oltre 120 m/sec per quelle pi grandi. V' una relazione tra diame-
tro delle fibre a velocit di conduzione. Precisamente si trovato
che moltiplicando per il coefficiente 6 il diametro delle fibre del
gruppo A (guaina mielinica inclusa) si ha la velocit in metri al se-
condo. (Esempio: fibra del diametro di 10 p, velocit 60 m/sec; fibra
5 p, velocit 30 m/sec; ecc.). Le fibre A sono state ulteriormente
suddivise da Erlanger e Gasser in quattro sottogruppi: a, 0, y, S. Le
fibre pi rapide sono le a, le pi lente le S.
Fibre B: sono fibre mieliniche (preganglionari) del sistema autono-
mo. Il loro diametro inferiore a 3 p. La loro velocit di condu-
zione varia da 3 a 15 m/sec.
Fibre C: sono le fibre amieliniche. Hanno un diametro da 0,3 a circa
2 p. Velocit di conduzione da 0,6 a 2 m/sec. Sono in parte costituite
da fibre efferenti (post-gangliari) del sistema simpatico, in parte da
fibre afferenti amieliniche che si trovano nei nervi periferici e nelle
radici dorsali.
Oltre alla classificazione di Erlanger e Gasser v' un'altra clas-
sificazione delle fibre molto usata in neurofisiologia e che pertanto
indispensabile conoscere. E' la classificazione di Lloyd e Hunt e
concerne le fibre nervose afferenti. Secondo questa classificazione
le fibre si dividono in:
Gruppo I: diametro 12-20 , diametro medio 13 (corrisponde al-
l'A a di Erlanger e Gasser)
Gruppo I I : diametro 6-12 p, diametro medio 9 (corrisponde all'A
a di Erlanger e Gasser)
Gruppo I I I : diametro l-6 p. diametro medio 3 (corrisponde all'A
S di Erlanger e Gasser)
Gruppo IV: fibre amieliniche (corrisponde al gruppo C di Erlanger
e Gasser)
Le fibre Ay, chiamate pi semplicemente fibre y, si trovano so-
lo nei nervi efferenti e nelle radici ventrali; pertanto non hanno
una posizione nella classificazione di Lloyd e Hunt. Il loro diame-
tro varia tra 3 e 7 p; diametro medio 5 p.
Le due classificazioni qui riportate hanno una grande impor-
tanza perch come si vedr in seguito fibre dei diversi gruppi han-
no funzioni diverse.
Gli studi sulle propriet funzionali e morfologiche dei nervi
hanno mostrato che la composizione dei vari nervi costante e che
vi sono importanti differenze tra nervi cutanei e nervi muscolari. I
20
21
nervi cutanei, almeno per quanto riguarda le fibre mieliniche, sono
formati solo da fibre afferenti, da fibre cio che vanno (afferisco-
no) al midollo spinale ed il loro studio non offre particolari diffi-
colt. Pi complesso invece lo studio dei nervi muscolari in quanto
in questo caso nella composizione del nervo accanto a fibre af-
ferenti vi sono fibre efferenti, fibre cio che provengono dal mi-
dollo spinale. Per stabilire da quali fibre afferenti composto il
nervo muscolare occorre eliminare la componente efferente. Ci si
pu fare tagliando le radici ventrali del midollo spinale. Dopo breve
tempo la porzione efferente del nervo, staccato dalle cellule di
origine va incontro a degenerazione (degenerazione secondaria o
Walleriana). Si pu quindi ottenere il neurogramma delle sole fibre
afferenti. Se al contrario si vuole stabilire il neurogramma della
porzione efferente del nervo muscolare si devono tagliare le radici
dorsali distalmente al ganglio spinale. In questa maniera si isolano
dai loro corpi cellulari, che come noto sono posti nei gangli spi-
nali, le fibre che provengono dai muscoli. Come nel caso precedente
le fibre isolate dal loro corpo cellulare degenerano, mentre restano
integre quelle efferenti provenienti dalle radici ventrali. Si potr
quindi stabilire il neurogramma della porzione efferente.
I risultati di questi esperimenti possono essere cos riassunti:
1) Nei nervi cutanei non vi sono fibre del gruppo I; sono presenti
fibre del gruppo II e del gruppo III.
2) Nei nervi muscolari la parte afferente formata da abbondanti
fibre del gruppo I ; sono presenti fibre del gruppo I I e del
gruppo III.
La distribuzione delle fibre afferenti mieliniche, a secondo del
diametro, in un nervo muscolare tipico ed in uno cutaneo sono
mostrate nella Fig. 2-4. La linea marcata indica la distribuzione
del nervo muscolare, la linea sottile quella del nervo cutaneo. Il
grafico che rappresenta la distribuzione delle fibre cutanee
tratteggiato.
Sia nei nervi cutanei che muscolari sono presenti fibre amieli-
niche, non mostrate in figura. Il loro numero in genere non
inferiore a quello delle fibre mieliniche.
Fig. 2-4 - Distribuzione delle fibre afferenti in un nervo muscolare (linea mar-
cata) ed in un nervo cutaneo (area tratteggiata).
Ordinate: numero delle fibre espresso in per cento del totale. Ascisse:diametro
delle fibre.
(Da T.C. Ruche J.F. Fulton, Medical Physiology and Biophysics, Philadelphia,
W.B. Saunders, 1960).
3) Fibre efferenti: nel nervo muscolare privato della componente
afferente vi sono due gruppi di fibre. Il primo con diametro tra
11 e 18 , diametro medio 14 ; il secondo 3-7 , diametro
medio 5 p. Le fibre di calibro maggiore partono dai motoneu-
roni del midollo spinale pi grandi, chiamati motoneuroni a.
Esse innervano i muscoli scheletrici. Le fibre di calibro minori
originano da motoneuroni pi piccoli chiamati motoneuroni y.
Queste fibre, fibre y, innervano particolari strutture recettoria-
li poste nei muscoli: i fusi neuromuscolari.
La conoscenza della composizione, in termini di fibre, del
nervo molto importante. Da una parte serve a capire l'organizza-
22 23
zione dei riflessi spinali e pi in generale dell'organizzazione fun-
zionale delle vie ascendenti nel midollo spinale, dall'altra aiuta a
stabilire, in caso di sospetta lesione di un nervo, se esso real-
mente leso ed eventualmente quale tipo di fibre colpito dalla ma-
lattia.
3) IL POTENZIALE DI RIPOSO
Gli esperimenti precedenti hanno dimostrato che i nervi sono
in grado di generare dei potenziali elettrici e che questi potenziali
si propagano con velocit diversa a seconda del tipo e del diametro
di fibra nervosa. Essi non dicono nulla per sui meccanismi respon-
sabili della nascita e della propagazione di questi potenziali. Per
studiare questi meccanismi si deve usare una tecnica pi complessa
di quella della registrazione con macroelettrodi impiegata negli e-
sperimenti precedenti. Si deve usare una registrazione con elettrodi
inseriti nell'interno della cellula o della fibra nervosa (registrazione
microelettrodica intracellulare).
L'esperimento di base il seguente. Si isola una singola fibra
nervosa (o muscolare) e la si pone in un bagno salino. Nel bagno
viene messa una coppia di elettrodi registranti. Dei due elettrodi
registranti uno resta nel bagno, l'altro - una micropipetta riempita
di KCl con la punta avente un diametro inferiore a 1 - viene mossa
lentamente verso la fibra nervosa. Finch entrambi gli elettrodi si
trovano nel liquido salino essi sono isopotenziali. (Talvolta per
ragioni tecniche v' una piccola differenza di potenziale tra gli
elettrodi, ma un dettaglio che non ci interessa). Ad un certo pun-
to, muovendo l'elettrodo questo penetra nell'interno della fibra
nervosa. Si vede che immediatamente tra l'elettrodo posto nel ba-
gno e l'elettrodo intracellulare compare una differenza di potenziale.
L'interno della cellula negativo. Questa differenza di potenziale
(presente anche se la fibra non eccitata) prende il nome di po-
tenziale di riposo. II potenziale di riposo varia a seconda delle
strutture studiate. Cos ad es. nella fibra muscolare di rana esso si
24 25
aggira sui 90 mV (interno negativo rispetto l'esterno). Nel sistema
nervoso centrale dei mammiferi si accetta come valore standard 70
mV, sempre l'interno negativo rispetto all'esterno.
Il potenziale di riposo in condizioni fisiologiche o durante gli
esperimenti pu venire modificato. Si parla di iperpolarizzazione
quando la differenza di potenziale tra esterno ed interno aumenta.
Si parla di depolarizzazione quando invece la differenza di poten-
ziale diminuisce. Se la depolarizzazione supera un certo livello
inizia un processo per cui la depolarizzazione seguita da un'in-
versione della polarizzazione. L'esterno diventa negativo rispetto
all'interno. Quando questo succede nasce il potenziale d'azione.
Dei fenomeni che modificano il potenziale di riposo ci occupere-
mo in seguito ora ci occuperemo del potenziale di riposo.
Perch c' un potenziale di riposo? Il punto di partenza per ca-
pire il potenziale di riposo l'osservazione che la concentrazione
degli ioni all'interno ed all'esterno delle fibre nervose e delle fibre
muscolari notevolmente diverso. Ad es. nel muscolo di rana, un
preparato che si presta bene a tale tipo di studio, la concentrazione
degli ioni sodio all'esterno delle fibre, nei liquidi extracellulari, di
120 mM/l, mentre di soli 9,2 mM/l all'interno; viceversa la con-
centrazioni di ioni potassio di 2,5 esternamente e di 140 interna-
mente. Per quanto riguarda gli anioni, il Cl- si trova concentrato e-
sternamente - 120 mM/l - molto pi che all'interno - 3 mM/l circa -
mentre i grossi anioni organici sono concentrati all'interno. Uno
squilibrio tra concentrazioni di Na* e K' da una parte e di Cl- e
anioni organici dall'altra si trova anche nelle fibre nervose. Tra
queste particolarmente ben studiati sono stati gli assoni giganti di
calamaro. Questi assoni raggiungono il diametro di 1 mm e quindi
sono molto adatti per le registrazioni intracellulari.
Il punto successivo da chiarire come mai gli ioni intracellulari
ed extracellulari non si mescolano tra di loro. Due ipotesi principali
sono state proposte. La prima che tra l'interno e l'esterno delle
varie fibre nervose e muscolari vi sia una membrana e che questa
impedisca il mescolamento degli ioni; la seconda che nell'interno
delle fibre vi siano dei proteinati polielettrolitici carichi negativa
mente e che gli ioni potassio abbiano affinit chimiche selettive
per essi.
La prima ipotesi oggi quella generalmente accettata. Cruciali
sono stati a tale fine gli esperimenti di Hodgkin e Keynes. Questi
autori hanno studiato la velocit con cui ioni K* marcati si muovo-
no dall'esterno all'interno di un assone gigante di calamaro, la velo-
cit con cui si muovono dall'interno all'esterno ed infine quella
con cui si muovono dentro l'assone medesimo. Essi trovarono che
lo scambio tra K' marcato extra ed intracellulare un processo
lunghissimo che si compie nell'ambito di ore. Questo dato pu es-
sere spiegato sia con la presenza di una membrana che con una
composizione particolare dell'assoplasma. Ma se vera l'ipotesi
della membrana, il K` marcato introdotto dentro l'assone dovreb-
be diffondere all'interno dell'assone con velocit paragonabili
alla diffusione del potassio in una soluzione salina, viceversa se
vera l'ipotesi dei proteinati, il K`, essendo legato ai proteinati, do-
vrebbe diffondere lentamente anche all'interno dell'assone. I
risultati degli esperimenti di Hodgkin e Keynes dimostrarono
che il K* si diffonde all'interno dell'assone alla stessa velocit
approssimativamente con cui si diffonde nell'acqua marina. La
conclusione dell'esperimento che una membrana esiste tra l'in-
terno e l'esterno delle fibre nervose.
Un'ulteriore prova in favore dell'ipotesi della membrana data
dal fatto che si pu sostituire l'assoplasma in una fibra gigante di
calamaro con una soluzione di KCl senza alterarne le propriet
elettriche. Se invece si lede la parte superficiale di un assone il
potenziale di riposo si altera ed in breve tempo si azzera. Anche
questo risultato predetto dall'ipotesi della membrana, ma non da
quella dei proteinati.
Le nostre conoscenze sulla struttura istologica e chimica delle
membrane sono ancora incomplete nonostante i molti progressi
compiuti in questi ultimi anni. Al microscopio elettronico la mem-
brana cellulare appare formata da 3 strati, ciascuno di 25 X di
spessore: gli strati periferici appaiono scuri, quello centrale chiaro.
Dal punto di vista chimico la membrana formata da proteine (cir-
26 27
ca il 55
/o), grassi (35
/o), carboidrati (10
/o). Igrassi sono rappre-
sentati dal colesterolo e soprattutto dai fosfolipidi. Le molecole di
questi ultimi hanno un'estremit carica elettricamente e l'altra co-
stituita da catene di acidi grassi. L'estremit carica elettricamente
viene chiamata estremit polare o idrofila, l'estremit opposta
estremit non polare o idrofoba. Nella membrana cellulare le mole-
cole di fosfolipidi sono disposte in un doppio strato, con le estre-
mit non polari rivolte le une verso le altre e quelle polari orientate,
quella della molecola esterna, verso l'esterno, quella della molecola
interna, verso l'assoplasma. Le proteine si distinguono in proteine
intrinseche e proteine periferiche. Le prime sono inserite
nell'interno della membrana e formano delle colonne proteiche
nell'ossatura fosfolipidica della membrana; le proteine periferiche
sono poste sia alla superficie esterna che interna del duplice strato
molecolare lipidico. Esse sono per in maggior quantit nel versante
rivolto verso l'assoplasma. I glicidi si trovano solo all'esterno
della membrana e sono legati o alle proteine o ai lipidi.
A questo punto sappiamo che i liquidi intracellulari ed extra-
cellulari hanno composizione ionica diversa e che esiste una mem-
brana che separa il mezzo esterno da quello interno. Questi fatti
possono spiegare la differenza di potenziale che esiste a riposo nelle
cellule viventi? Prima di rispondere a questa domanda vediamo
alcuni esempi fisici che ci mostrano come soluzioni di concentra-
zione ionica diversa possano portare a differenze di potenziale elet-
trico.
I mmaginiamo di avere un tubo vuoto di vetro e di versare in
una met dell'acqua, nell'altra una soluzione molto concentrata di
NaCl. Si vedr che in breve tempo compare una differenza di po-
tenziale tra le due met del tubo e precisamente che la parte riem-
pita d'acqua diverr negativa. Questa differenza di potenziale prende
il nome di potenziale di diffusione. La differenza di potenziale
compare in quanto gli ioni CF sono pi mobili degli ioni Na
+
e per-
tanto migrano pi rapidamente nella porzione di tubo piena d'ac-
qua portando con s la loro carica negativa.
Per mobilit di un ione si intende la velocit con cui esso
migra. In genere ci viene stabilito studiando la velocit di migra-
zione in un campo elettrico. Tra gli ioni che ci interessano quelli
pi veloci sono il K
+
ed il Cl- , molto pi lento il Na
+
. Ci pu
sembrare strano in quanto il sodio ha un numero atomico pi pic-
colo del potassio e dovrebbe incontrare quindi, essendo pi piccolo,
una resistenza minore. In realt quello che condiziona la mobilit
ionica non tanto il diametro atomico quando la "nubecola" di
molecole d'acqua con cui lo ione forma legami complessi. Il Na'
attira pi molecole d'acqua del K
+
e pertanto migra pi lentamente.
V' una relazione inversa tra mobilit ed idratazione.
Nell'esempio precedente la differenza di potenziale che si era
instaurato a causa della diversa mobilit degli ioni Na
+
e CF un
fenomeno transitorio. Dopo un po' di tempo gli ioni dei due liqui-
di si mescolano completamente ed il potenziale di diffusione spari-
sce. Vediamo ora cosa succede quando uno degli ioni pu muover-
si liberamente, mentre l'altro ostacolato da una membrana semi-
permeabile.
Riempiamo un tubo per met di KCl molto concentrato e per
l'altra met di KCI poco concentrato. Immaginiamo inoltre che la
membrana ostacoli la migrazione degli ioni CF. Entrambi gli ioni
tendono a muoversi dalla met pi concentrata a quella meno con-
centrata, ma solo il potassio, in conseguenza delle propriet della
membrana, raggiunger la met del tubo dove si trova la soluzione
meno concentrata. Di conseguenza questa si carica positivamente.
Il formarsi per di una differenza di potenziale influenzer l'an-
damento del fenomeno. Infatti la positivit della parte meno con-
centrata tender a respingere gli ioni potassio carichi positivamen-
te. Ad un certo punto verr raggiunta una condizione in cui il gra-
diente osmotico che spinge il K
+
verso la soluzione meno con-
centrata equilibrato dal gradiente elettrico che spinge il K
+
fuori
da questa soluzione. E' stato raggiunto l'equilibrio elettrochimico
in cui il flusso netto degli ioni zero.
Lo stesso fenomeno si avr ovviamente se si hanno due soluzioni
di KCl a diversa concentrazione ma in cui la membrana ostacola la
migrazione degli ioni K
+
. In questo caso diventer negativa la so-
28 29
luzione meno concentrata e la negativit aumenter fino a raggiun-
gere l'equilibrio elettrochimico.
Prende il nome di potenziale d'equilibrio per un determinato
ione quel potenziale di membrana al quale l'equilibrio elettrochi-
mico per quel ione stato raggiunto. Conoscendo le concentrazioni
ioniche si pu calcolare il potenziale d'equilibrio usando l'equazione
di Nernst. Essa dice che E =RT/F In C
e
/Ci; dove R la costante
universale dei gas, T la temperatura assoluta, F la costante di
Faraday (carica elettrica per grammo equivalente di ioni mono-
valenti). RT/F un valore che cambia ovviamente colla temperatu-
ra. Alla temperatura di 30
di circa 25 mV. Per conoscere quindi
il potenziale di equilibrio a quella temperatura basta moltiplicare il
logaritmo del rapporto delle due concentrazioni (C
e
= concentra-
zione esterna; Ci =concentrazione interna) per 25.
Torniamo ora alla membrana cellulare. All'inizio del secolo
Bernstein propose che processi puramente passivi del tipo prece-
dentemente esposto fossero sufficienti per spiegare il potenziale di
riposo. Il Na
+
ed il CF in conseguenza della loro alta concentrazione
all'esterno della membrana tendono ad entrare all'interno della
membrana, il K
+
ed i grossi anioni tendono ad uscire. La membrana
cellulare per, secondo Bernstein, impermeabile ai grossi
anioni intracellulari e agli ioni Na
+
e CI
-
. La membrana invece
permeabile al K
+
. Questo ione migrer quindi all'esterno e creer
una differenza di potenziale esterno positivo. La positivit creata
dal K
+
ad un certo posto bloccher l'ulteriore sua fuoriuscita. Se-
condo Bernstein il potenziale di riposo dipende quindi dalle con-
centrazioni del K
+
intracellulare ed extracellulare. Vedremo che,
nonostante che parecchie modifiche siano state portate alla teoria
di Bernstein, la intuizione centrale della sua teoria, che il potenzia-
le di riposo cio dipende dal potassio, risultata essenzialmente
corretta.
Vediamo ora quali esperimenti provano che il potenziale di ri-
poso dipende dagli ioni potassio. Se si prende un assone gigante di
calamaro e lo si pone in una soluzione in cui il NaC1 viene progres-
sivamente sostituito da KCl si vede che il potenziale di riposo
gradatamente si azzera. Questo dovuto al fatto che la fuoriuscita
del K' che determina normalmente la differenza di potenziale tra
interno ed esterno non avviene pi in quanto il K
+
si trova anche
extracellularmente.
Un esperimento molto convincente anche se pi complesso
quello della eliminazione dell'assoplasma dall'assone di calamaro e
dalla sua sostituzione con soluzioni saline diverse. Nella prima fase
dell'esperimento si introduce nell'interno dell'assone una soluzione
isotonica di KCI. L'assone viene mantenuto in un liquido esterno
dalla composizione simile all'acqua di mare. Si vede che nonostante
l'eliminazione dell'assoplasma il potenziale di riposo rimane entro
valori normali. Sostituiamo ora il KCl interno con una soluzione
isotonica di NaCl. Si vede che la differenza di potenziale sparisce.
Evidentemente senza K
+
non v' polarizzazione della membrana.
Sostituiamo ora il liquido esterno con una soluzione isotonica di
KCI, si vede che la membrana si polarizza, ma con segno inverso
rispetto alla polarizzazione normale. La membrana ora positiva
all'interno in quanto gli ioni K
+
, posti esternamente, tendono a
migrare dentro l'assone. Infine, se invece di modificare le concen-
trazioni interne ed esterne del potassio, si cambiano le concentra-
zioni degli altri ioni si trova che il potenziale di riposo viene modi-
ficato in maniera trascurabile. L'insieme di questi esperimenti di-
mostra che la polarizzazione della membrana a riposo ed il suo se-
gno dipendono dalle concentrazioni del K
+
all'interno ed all'esterno
delle cellule e che il contributo degli altri ioni del tutto secon-
dario.
Un punto centrale della teoria di Bernstein era che la membrana
non fosse permeabile al sodio. Infatti questo assunto permetteva di
spiegare facilmente l'alta concentrazione di Na
+
all'esterno della
membrana. L'uso di sostanze marcate mise in crisi tale idea.
Gli esperimenti con Na
+
marcato dimostrarono infatti che se si
pone del Na
+
all'esterno dell'assone esso dopo un certo tempo si
ritrova anche all'interno e, viceversa, se Na
+
marcato viene introdotto
all'interno dell'assone esso si propaga all'esterno. Ma se la membrana
non impermeabile al Na
+
perch esso non penetra massiva-
30
31
mente dentro le cellule quando sia il suo gradiente di concentrazio-
ne che la polarizzazione della membrana favoriscono la sua entra-
ta? Ancora come fa il Na
+
ad uscire dalle cellule quando le forze
fisiche citate prima tendono a trascinarlo, entrambe, internamen-
te? Hodgkin e Keynes hanno dimostrato che la spiegazione di que-
sti fenomeni sta nel fatto che, oltre che dai fenomeni passivi descrit-
ti prima il potenziale di riposo dipende anche da fenomeni attivi. Per
fenomeni attivi si intendono dei processi che implicano consumo
di energia da parte dell'organismo. Il Na
+
che si trova all'esterno
delle cellule entra in continuazione all'interno per i fenomeni pas-
sivi descritti prima, ma la sua entrata si accompagna ad una espul-
sione attiva fuori dalla cellula. Questo si pu provare usando degli
inibitori metabolici quali il cianuro. Usando il cianuro si pu vedere
che l'afflusso del Na' continua, in quanto questo un fenomeno
passivo, mentre l'espulsione non si ha pi, essendo bloccati i mec-
canismi che forniscono energia per il processo di espulsione. Il con-
cetto di Bernstein di una membrana non permeabile al Na
+
per
ragioni fisiche deve essere quindi modificato con l'introduzione di
un concetto dinamico: espulsione attiva del Na'. Non bisogna pe-
r dimenticare che pur sempre, dal punto di vista passivo, la mem-
brana a riposo molto pi permeabile al K
+
che al Na
+
.
Come avviene l'espulsione del Na
t
? Al giorno d'oggi non vi so-
no dubbi che il trasporto del sodio all'esterno dovuto ad una
pompa a scambio ionico. L'espulsione di un ione Na
+
accompa-
gnata da un'immissione attiva di un ione K
+
dall'esterno all'inter-
no. Dal punto di vista elettrico la pompa sodio-potassio una
pompa neutra e la differenza di potenziale tra esterno ed interno
dovuta alla pi volta citata maggiore permeabilit della membrana
agli ioni K
+
che agli ioni Na
+
.
La presenza della pompa sodio-potassio spiega un dato che la
teoria di Bernstein non riusciva ad accomodare. Infatti il potenziale
di equilibrio del K
+
non coincide con il potenziale di riposo della
membrana, mentre se il potenziale di riposo fosse dovuto esclu-
sivamente alla migrazione passiva di questo ione i due valori do-
vrebbero essere identici. Nelle fibre muscolari di mammiferi il po
tenziale di riposo - 90, ed il potenziale di equilibrio per il K
+
- 97; nei motoneuroni del midollo spinale di gatto, il potenziale di
riposo - 70 mV, il potenziale di equilibrio per il potassio di -90
mV. Questi dati indicano che la differenza di potenziale tra ester-
no ed interno non sufficiente ad impedire che il K
+
(per la sua
concentrazione cellulare) continui ad uscire e che ci deve essere un
altro fattore oltre alla permeabilit della membrana al K
+
a fissare
il valore del potenziale di riposo.
La spiegazione del fenomeno sta nella pompa sodio-potassio. Il
K
+
non raggiunge mai a riposo il suo potenziale di equilibrio per-
ch gli ioni potassio vengono attivamente trasportati all'interno
della cellula e scambiati con gli ioni Na
+
. Solo se questo meccani-
smo non funzionasse il K
+
potrebbe raggiungere il suo potenziale
di equilibrio.
Per quanto riguarda i potenziali d'equilibrio degli altri ioni il
Cl
-
ha un potenziale d'equilibrio che coincide con quello del po-
tenziale di riposo, mentre il Na
+
ha potenziali d'equilibrio positivi:
+ 55 nel motoneurone, + 66 nella fibra muscolare di mammifero.
Abbiamo visto che proprio per spiegare questa positivit Bernstein
era giunto alla conclusione che la membrana cellulare dovesse esse-
re impermeabile al sodio. La spiegazione moderna che la membrana
effettivamente poco permeabile a questo ione ma che il fattore
cruciale nel mantenere il potenziale d'equilibrio del Na
+
la pre-
senza della pompa sodio-potassio. Infine per quanto riguarda il Cl
7
(anche esso in grado di attraversare la membrana a differenza di
quanto pensava Bernstein) questo ione si distribuisce ai due lati
della membrana in accordo con i valori del potenziale di riposo. La
sua tendenza ad entrare nella cellula, dovuto alla maggiore concen-
trazione esterna, ostacolata dalla positivit della membrana, allo
esterno, creata dal K+.
In conclusione il potenziale di riposo dipende dal fatto che la
membrana molto pi permeabile al K
+
che al Na
+
e gli ioni sodio
che penetrano all'interno vengono espulsi dalla pompa sodio-potas-
sio. Il concetto quindi di una membrana impermeabile al Na
+
sta-
to sostituito dal concetto di una impermeabilit dinamica della
membrana a questo ione.
33
4) IL POTENZIALE D'AZIONE
Nel capitolo precedente abbiamo visto che, a riposo, esiste una
differenza di potenziale tra l'interno e l'esterno di una fibra nervo-
sa. Vediamo ora come si modifica questo potenziale quando la fi-
bra viene stimolata. La situazione sperimentale illustrata nella
Fig. 4-l. Si ha una coppia di elettrodi stimolanti ed una coppia di
elettrodi registranti. Quando l'elettrodo registrante penetra nell'in-
terno dell'assone si registra il potenziale di riposo. Stimoliamo ora
la fibra con onde quadre. Finch l'elettrodo stimolante nel bagno
non si vede nulla di interessante. Compaiono sul tracciato due de-
flessioni, l'una all'inizio, l'altra alla fine dello stimolo, che non
rappresentano altro se non degli artefatti dovuti a diffusione di
corrente.
Il quadro cambia quando l'elettrodo penetra nell'assone: la sti-
molazione ora determina delle modificazioni nel potenziale trans-
membrana. Se si stimola con onde negative (deflessioni verso il
basso nel tracciato "impulso di corrente" della figura) la differenza
di potenziale tra esterno ed interno aumenta. A secondo dell'in-
tensit della corrente stimolante essa diventa di 100 mV, 110 mV
e cos via.
Come gi stato detto prima quando la differenza di potenziale
transmembrana maggiore del potenziale di riposo si parla di
iperpolarizzazione. Se si stimola con onde positive (deflessioni ver-
so l'alto nel tracciato della figura) si vede che la differenza di po-
tenziale tra esterno ed interno diminuisce. In questo caso si parla
di depolarizzazione. Se la depolarizzazione modesta, nell'ambito
di 10 - 20 mV il fenomeno del tutto speculare all'iperpolarizza-
lore costante solo dopo un certo tempo che dipende dalla resistenza
e dalla capacit della membrana. Prende il nome di costante di
tempo, il tempo impiegato a raggiungere il 63
/o del valore finale
costante, oppure il tempo impiegato a ridiscendere da tale valore al
37
0
/0 di esso. La figura 4-2 illustra il concetto di costante di tempo.
Nella figura la costante di tempo indicata con T.
impulso di corrente
|---|
mV
m.sec
Fig. 4-2 - La costante di tempo.
|-|-|-|-
tempo msec
Fi g . 4- 1 - Effetti della stimolazione elettrica sul potenziale di membrana
(Da B. Katz, Nerve, muscle and synapse, New York, McGraw-Hill, 1966).
zione e appena cessata la stimolazione il potenziale transmembrana
torna al valore del potenziale di riposo.
Si pu notare che il potenziale di membrana non varia istanta-
neamente all'applicazione dell'onda quadra. Esso raggiunge un va-
Torniamo ora alla Fig. 4-l. Possiamo vedere nella parte finale
di essa che quando la depolarizzazione supera un certo valore criti-
co, essa non torna, cessata la stimolazione, al valore del potenziale
di riposo, appare invece un fenomeno drammatico: la depolarizza-
zione provocata dallo stimolo elettrico perde ogni relazione con lo
stimolo applicato, si autoamplifica ed in breve l'interno diventa
positivo rispetto all'interno. E' nato il potenziale d'azione.
Poniamo ora gli elettrodi stimolanti e registranti non pi adia-
centi l'uno all'altro come nella Fig. 4-l, ma ad una certa distanza
tra loro, ad es. ad 1 mm, e ripetiamo l'esperimento. Alla distanza
di 1 mm le variazioni dovute alla iperpolarizzazione, ed alla depo-
larizzazione sotto soglia (insufficiente cio a determinare la nascita
del potenziale d'azione) hanno una ampiezza pari alla met di
quella registrata alla distanza di 20 p. Le variazioni di potenziale
che si attenuano con la distanza prendono il nome di variazioni
elettrotoniche della polarizzazione della membrana. Questo termi-
34
35
36
37
ne stato spesso criticato come arcaico, tuttavia rende bene l'idea
di un potenziale non "propagato" ed tuttora il pi usato "in
mancanza di una parola migliore" (Katz). Al contrario delle varia-
zioni elettrotoniche di potenziale l'ampiezza del potenziale d'azione
resta invariata sia registrando vicino al punto dove esso origina che
in qualsiasi altro punto della fibra. I l potenziale d'azione quindi
un potenziale che si propaga, intendendo con questo termine un
potenziale che si trasmette lungo la fibra senza modificazioni di
ampiezza.
Da questi esperimenti risulta chiaro che la maniera con cui il si-
stema nervoso trasmette i segnali elettrici diverso da quello im-
piegato comunemente nei sistemi di trasmissione fatti dall'uomo.
Prendiamo come esempio il cavo sottomarino. Esso come il "cavo"
nervoso un conduttore cilindrico circondato da una membrana
che lo isola dal liquido esterno. Ora se noi "stimoliamo" un cavo
sottomarino, applichiamo cio ad esso delle onde quadre simili a
quelle che producono i potenziali elettronici questi segnali si pro-
pagheranno per centinaia e centinaia di Km; gli stessi segnali appli-
cati alla fibra nervosa si trasmettono per pochi mm. Perch queste
differenze? E come avviene la trasmissione di segnali elettrici lungo
il nervo?
In ogni circuito elettrico c' un filo che parte dal generatore di
corrente ed un filo che torna al generatore. Nel circuito elettrico
costituito dalle fibre nervose il filo che parte dal generatore for-
mato dall'assoplasma, il filo di "ritorno" costituito dal liquido in
cui immessa la fibra nervosa ed i due fili sono separati dalla mem-
brana. A differenza del cavo sottomarino la cui "anima" fatta di
filo metallico, cio di un ottimo conduttore di elettricit, l'asso-
plasma del nervo (il filo interno nel nostro esempio), costituito
da una soluzione salina diluita, cio da un cattivo conduttore. Se
prendiamo una fibra mielinica di un certo calibro e ne misuriamo
la resistenza longitudinale - la resistenza cio lungo l'asse della
fibra - vediamo che questa di circa 250 MS2 (milioni di ohm) per
cm di lunghezza. La situazione ancora peggiore per le fibre arnie-
liniche. Quindi una prima differenza tra un cavo elettrico ed un
cavo nervoso che quest'ultimo fatto di materiale poco adatto a
trasmettere i segnali elettrici.
A differenza del filo interno, il filo di ritorno nel circuito co-
stituito dalla fibra nervosa un buon filo. Il liquido interstiziale
attraverso il quale la corrente pu fluire indietro al generatore
ampio. I l filo di ritorno quindi ha un diametro molto grande ed
una resistenza molto piccola. Il circuito nervoso ha per un altro
difetto: la membrana cellulare non un isolante perfetto e di con-
seguenza il circuito del nervo ha delle perdite laterali. Queste per-
dite pi l'altissima resistenza longitudinale sono i due fattori prin-
cipali che differenziano il circuito nervoso da un buon circuito e-
lettrico e spiegano perch i segnali elettrici applicati al nervo si
propagano per distanze molto brevi. (Lo studente interessato pu
trovare Io schema completo del circuito elettrico dell'assone nei li-
bri di testo consigliati. In tale schema la membrana rappresentata
da una serie di resistenze e condensatori in parallelo. Il condensa-
tore indica che v' una separazione di cariche tra interno ed ester-
no della membrana; la resistenza che la membrana non un isolante
perfetto).
La domanda ovvia a questo punto la seguente: come fanno
gli assoni a trasmettere dei segnali elettrici dai recettori alle cellule
dei centri nervosi, dalla corteccia motoria al midollo spinale, dal
midollo spinale ai muscoli, per distanze quindi considerevoli se a
causa della dissipazione della corrente nelle resistenze longitudinali
ed attraverso la membrana i segnali si attenuano vicinissimo alla
loro origine e non si propagano che per distanze molto brevi? La
risposta si ha esaminando i fenomeni che avvengono quando la
membrana depolarizzata sopra soglia.
Nell'esperimento della Fig. 4-1 abbiamo visto che superata una
certa soglia compare nell'assone un processo di amplificazione del
potenziale che si autoalimenta, un processo che, in fisica, viene
chiamato rigenerativo. Un esempio di processo rigenerativo
quello delle modificazioni che avvengono in una miscela esplosiva
quando questa viene scaldata oltre un certo limite. Se la miscela
viene scaldata poco, in maniera insufficiente cio a fare reagire le
38 39
molecole che la compongono, l'aumento di temperatura mantiene
una relazione con il calore somministrato, e non appena il calore
non viene pi fornito la miscela si raffredda e torna alla tempera-
tura ambiente. Se la miscela per ha superato una certa temperatura
(temperatura soglia) le molecole si combinano tra loro, si ha una
reazione chimica esotermica ed il nuovo calore prodotto accelera la
reazione finch tutta la miscela esplosa. Superata cio la soglia il
processo continua indipendentemente dall'energia somministrata.
Prima di esaminare in che cosa consista il processo rigenerativo
che compare nell'assone vediamo quali ne sono le conseguenze. La
prima conseguenza che grazie al processo rigenerativo un piccolo
segnale viene trasformato in un segnale molto maggiore. Questo se-
gnale maggiore - il potenziale d'azione - date le cattive propriet di
cavo del nervo determina anche esso delle variazioni elettrotoniche
che si esauriscono a breve distanza dal punto di origine. Ma poich
il potenziale d'azione ha un'ampiezza considerevole le variazioni e-
lettrotoniche da esso prodotte sono sufficienti a depolarizzare so-
pra soglia la membrana in un punto della fibra limitrofo. Si deter-
mina cos un nuovo processo rigenerativo e nasce quindi un nuovo
potenziale d'azione. Questo a sua volta produce delle variazioni e-
lettrotoniche del potenziale di membrana che supereranno la soglia
in un altro punto adiacente del nervo. Nascer un nuovo potenziale
d'azione e cos via; il processo si propagher lungo l'assone
come una serie di scoppi. E' quindi il processo rigenerativo che ri-
solve il problema posto dalle cattive propriet di cavo del nervo e
permette la conduzione di impulsi nei nervi.
Vediamo ora in cosa consiste il processo rigenerativo che avviene
nell'assone. Il merito di aver chiarito questo problema stato
soprattutto di Hodgkin che ha dimostrato nei suoi studi sugli assoni
giganti di calamaro che la permeabilit per il Na
+
cambia a seconda
della polarizzazione della membrana. Come gi sappiamo la
membrana a riposo assai poco permeabile al Na
+
. Tale permeabi
-
lit per aumenta quando la membrana viene depolarizzata. Au-
mentando la permeabi li t per i l Na
+
, questo ione, dato il suo
potenziale d'equilibrio - +50 mV - tende ad entrare nell'interno
dell'assone. Il processo rigenerativo consiste nel fatto che il Na
.
essendo carico positivamente depolarizza la membrana e la mem-
brana depolarizzandosi diventa pi permeabile al Na
+
. Se la depo-
larizzazione iniziale modesta, l'entrata del Na
+
e la conseguente
depolarizzazione vengono compensati dalla fuoriuscita del K
+
; il
processo quindi rimane sotto soglia. Siamo nella stessa condizione
della miscela di gas in cui la quantit di calore dato insufficiente
ad iniziare il processo rigenerativo. Quando per la depolarizzazione
supera un certo livello, l'aumento della permeabilit per il Na
+
tale
che la depolarizzazione causata dal massiccio ingresso di questi ioni
non pu pi venire compensata. Si crea il circolo vizioso depo-
larizzazione -- entrata di Na` depolarizzazione che termina solo
quando il potenziale di membrana tende ad eguagliare il potenziale
di equilibrio per il Na
+
. La membrana quindi diventa carica positi-
vamente nell'interno. I l circolo vizioso analogo a quello che
porta allo scoppio della miscela esplosiva.
Una delle prove che la nascita del potenziale d'azione dipende
dall'aumento della permeabilit della membrana al sodio fornita
dagli esperimenti in cui questo ione viene sostituito nel mezzo e-
sterno con altri ioni, ad esempio con cloruro di colina. Si vede che
in questa situazione sperimentale la depolarizzazione della mem-
brana non fa nascere il potenziale d'azione. Infatti la permeabilit
della membrana aumenta per gli ioni Na
+
, ma se questi non ci sono
l'inversione di polarit che caratterizza il potenziale d'azione non
pu avvenire.
L'esperimento fondamentale che mostra la dipendenza dal Na
+
del potenziale d'azione e che d'altra parte mette in luce altri im-
portanti meccanismi attivati dalla depolarizzazione della membrana
quello del blocco del voltaggio. Per eseguire il blocco di voltaggio
di membrana si inseriscono due elettrodi longitudinalmente
nell'assoplasma di un assone gigante. Uno di essi serve per registra-
re il potenziale di membrana rispetto ad un elettrodo di riferimen-
to Posto nel mezzo esterno; l'altro collegato ad un generatore di
corrente. La misura delle correnti fatta mediante circuiti che non
40
41
verranno qui descritti. La logica dell'esperimento consiste nel fatto
che la differenza di potenziale tra i due lati della membrana pu
venire mantenuta, mediante il generatore di corrente, per decine di
millisecondi al livello che lo sperimentatore desidera e possono
essere studiati i flussi di corrente ai vari livelli di polarizzazione.
Vediamo ora cosa succede se il potenziale di membrana viene
spostato a O mV dai 90 mV del potenziale di riposo. Si osserva che
dopo una corrente dovuta alla scarica della capacit della membra-
na compare un primo flusso di corrente dall'esterno all'interno di
breve durata (l-2 msec); a questo succede un secondo flusso dallo
interno all'esterno che continua a fluire finch la membrana resta
depolarizzata. Poich la capacit della membrana si scaricata non
appena la differenza di potenziale tra esterno ed interno stata
portata a 0, il primo flusso non pu essere dovuto che o a ioni po-
sitivi che entrano nell'assoplasma o a ioni negativi che ne fuorie-
scono. La seconda componente viceversa ad un flusso di ioni posi-
tivi che escono o a ioni negativi che entrano.
La natura del primo flusso ionico stato stabilito trovando a
quale differenza di potenziale tra esterno ed interno questo flus-
so pu essere bloccato. Si trovato che questo punto 50 mV (in-
terno positivo) corrispondente quindi al potenziale d'equilibrio per
il Na
+
. I l primo flusso quindi dovuto all'entrata nell'assoplasma
del Na
+
. La dimostrazione della natura del secondo flusso ionico
pi difficile. Prove indirette per con K
+
marcato indicano che la
corrente prolungata interno-esterno dovuta ad una fuoriuscita di
questi ioni.
In conclusione una depolarizzazione della membrana causa un
immediato, ma transitorio incremento nella permeabilit della
membrana al Na
+
cui segue una impermeabilit a questo ione (inat-
tivazione della permeabilit al sodio). Infine sfasato nel tempo ri
spetto all'incremento di permeabilit al Na
+
segue un incremento
prolungato nella permeabilit del K. La Fig. 4-3 mostra il decorso
temporale dei fenomeni. Nella figura la depolarizzazione stata di
56 mV. In essa si descrive il fenomeno in termini di conduttanza
invece che di permeabilit. Per quanto questi due termini non siano
sinonimi, nel caso specifico esprimono lo stesso concetto.
msec
Fig. 4-3 - Decorso temporale della conduttanza per il sodio e della
conduttanza per il potassio a seguito di una depolarizzazione di 56 mV.
Le curve continue rappresentano le variazioni della conduttanza per una depo-
larizzazione continuata. Le curve tratteggiate mostrano l'effetto della ripola-
rizzazione della membrana dopo i due intervalli indicati, nel tracciato superio-
re, dalle linee tratteggiate.
(Da Katz B., Nerve, muscle and synapse, New York, McGraw-Hill, 1966).
E' stato dimostrato recentemente che possibile bloccare se-
lettivamente i processi causati dalla depolarizzazione della mem-
brana. Cos la tetrodotossina blocca l'aumento della permeabilit
al Na
+
, il tetraetilammonio blocca quello della permeabilit al K
+
ed infine un enzima proteolitico, la pronasi, fa s che l'aumento di
permeabilit al Na
+
non venga seguito da inattivazione. Questi dati
mostrano che tre meccanismi distinti sono responsabili dell'aumen-
to di permeabilit del Na
+
, del K
+
e dell'inattivazione della permea-
bilit al N
a
*
.
L'esperimento del blocco di voltaggio ha dimostrato anche che
E
U
o
E
E
10
5 -1
0- '
o
T I I I
2 3 4 5
56 mV
conduttanza del sodio
6 7
depolarizzazione
conduttanza
del potassio
I I I
8 9 10
43
42
la permeabilit della membrana dipende anche dagli ioni calcio. In-
fatti se si diminuisce la concentrazione di questo ione (presente
normalmente sia nei liquidi extracellulari che nell'interno delle fi-
bre nervose e muscolari) la depolarizzazione della membrana deter-
mina un aumento molto pi marcato della permeabilit del Na- di
quando il ione calcio presente in concentrazione normale. L'ef-
fetto tale per cui, in carenza di calcio, uno stimolo sotto soglia
pu far nascere dei potenziali d'azione. Questo spiega un dato, no-
to da molti anni in clinica e cio che in soggetti carenti di calcio,
ad es. pazienti affetti da ipoparatiroidismo, compaiono facilmente
contrazioni muscolari (tetania). L'effetto si spiega con un mecca-
nismo competitivo tra calcio e sodio. Entrambi gli ioni userebbero
gli stessi canali per entrare nella cellula. Se il calcio per occupa
un certo numero di canali, il Na
+
entra in minore quantit e quindi
l'aumento di permeabilit prodotta dalla depolarizzazione minore
che in assenza di calcio.
Vediamo ora gli eventi che si succedono durante il potenziale
d'azione. All'inizio aumenta la permeabilit per il Na
+
. Essa vir-
tualmente non accompagnata da nessuna altra variazione della per-
meabilit della membrana. Ci vale fino quasi al picco del poten-
ziale d'azione. A questo punto anche l'aumento della permeabilit
del potassio diventa notevole. Subito dopo la permeabilit per il
Na
+
decade ed infine la permeabilit per questo ione viene inattiva-
ta. Al contrario la permeabilit per il potassio si mantiene alta.
L'aumento della permeabilit al K
+
, assieme all'inattivazione della
permeabilit al Na
+
, sono responsabili della rapida ripolarizzazione
della membrana e del ripristino del potenziale di riposo. I l fatto
che l'aumento della permeabilit al K
+
insorga prima che il poten-
ziale d'azione sia arrivato al suo picco spiega perch il potenziale di
membrana durante il potenziale d'azione tenda al valore del poten-
ziale di equilibrio per il Na
+
, ma in realt non lo raggiunga. La lunga
durata dell'aumento della permeabilit del K
+
responsabile infine
del fatto, sperimentalmente osservato, che, terminato il potenziale
d'azione, la membrana non torna ai valori del potenziale di riposo ma
attraversa per qualche millisecondo un periodo di iperpolarizzazione.
Come abbiamo visto prima la ripolarizzazione legata ad un
aumento della permeabilit del K
+
. Avviene dunque che durante il
ripristino del potenziale di riposo la fibra perda K
+
. Al contrario
durante la nascita del potenziale d'azione essa aveva guadagnato
Na
+
. La normalit non solo elettrica, ma anche chimica viene rista-
bilita dalla pompa sodio-potassio che in quest'ultima fase aumenta
la sua attivit eliminando il Na
+
eccessivo e riprendendo il K
+
dal
mezzo esterno.
Come succede che modificazioni della polarizzazione della
membrana determinano delle modificazioni della sua permeabilit?
L'ipotesi pi probabile che l'orientamento (o la configurazione)
di certe macromolecole muti quando la differenza di potenziale
transmembrana cambia. Queste macromolecole a secondo del loro
orientamento farebbero la membrana pi o meno permeabile ai
di variazione della permeabilit al sodio e al potassio.
o I1
2
msec
Fig. 4-4 - Meccanism
(Da
P.G. Strata).
44 45
vari ioni. Esse rappresenterebbero le "porte" di entrata del Na'
e
del K. La figura 4-4 mostra i meccanismi di variazione della per-
meabilit al sodio ed al potassio durante il potenziale d'azione.
In alto rappresentato il potenziale d'azione, in basso i canali
d'entrata del Na
+
e del K. Si noti che il canale del potassio (dise-
gnato come inferiore nello schema) controllato da una sola "por-
ta", mentre quello del sodio da due. A riposo la "porta" superiore
del Na' pressoch chiusa, mentre l'inferiore aperta. Durante la
fase ascendente del potenziale d'azione la "porta" superiore si apre,
l'inferiore resta aperta. La fase discendente del potenziale d'azione
dovuta alla chiusura della "porta" inferiore (inattivazione della
permeabilit del Na
+
). Successivamente la "porta" superiore si
chiude ed infine colla riapertura della "porta" inferiore si ritorna
alla condizione di riposo. La "porta" superiore del canale del sodio
pu venire bloccata dalla tetrodotossina, quella inferiore influen-
zata dalla pronasi. Le modificazioni della "porta" del potassio illu-
strano graficamente quanto gi stato descritto prima riguardo
alla permeabilit della membrana a questo ione a riposo e durante
il potenziale d'azione. La "porta" del K' viene bloccata dal tetrae-
tilammonio.
I risultati esposti nei paragrafi precedenti permettono di chiari-
re meglio alcuni concetti base dell'elettrofisiologia menzionati nei
capitoli precedenti e precisamente il perch c' una soglia per l'ec-
citamento, il fatto che i potenziali d'azione sono segnali standard
d'ampiezza uguale, i periodi refrattari assoluto e relativo.
L'esistenza di una soglia dovuta al fatto che il potenziale d'a-
zione conseguenza di un processo rigenerativo. L'ingresso a va-
langa del Na
+
scatta solo se si supera un certo livello di depolarizza
-
zione. Il processo rigenerativo anche responsabile dell'ampiezza
standard dei potenziali d'azione. L'ampiezza di questi infatti non
dipende dall'intensit dello stimolo applicato: o lo stimolo sotto-
soglia ed il potenziale d'azione non nasce o soprasoglia ed il po-
tenziale nasce (Legge del tutto o nulla). Non ha nessuna importan
-
za se lo stimolo poco o molto soprasoglia. Una volta che la soglia
stata superata il processo rigenerativo che determina l'ampiezza
del potenziale Infine il periodo refrattario assoluto dovuto al
fatto che durante la fase discendente del potenziale d'azione si ha
l'inattivazione del meccanismo di trasporto del Na
+
ed un'alta per-
meabilit della membrana per il K . Il periodo refrattario relativo
determinato dagli stessi fattori che, al massimo della loro azione,
causano il periodo refrattario assoluto. Durante il periodo refratta-
rio relativo il processo rigenerativo pu essere suscitato, ma solo
applicando stimoli di intensit maggiore di quelli sufficienti in con-
dizioni di eccitabilit normale.
La conduzione dell'impulso nervoso descritto precedentemen-
te riguardava essenzialmente le fibre amieliniche. I principi alla ba-
se della conduzione dell'impulso nervoso nelle fibre mieliniche sono
fondamentalmente gli stessi, tuttavia la presenza della guaina
mielinica responsabile di alcune differenze nella conduzione delle
fibre fornite da questa guaina. La guaina mielinica rappresenta dal
punto di vista elettrico un buon isolante e la sua presenza riduce
grandemente le perdite laterali del flusso di corrente, ponendo cos
rimedio ad uno dei difetti dell'assone come cavo elettrico. Isolando
per bene l'assone dal mezzo esterno la guaina mielinica fa s che
il circuito non possa chiudersi in un punto qualsiasi della fibra come
avviene nella fibra amielinica. Perch ci avvenga occorrono delle
interruzioni nell'isolamento. Queste interruzioni sono rappresentate
dai nodi di Ranvier, punti cio dove la mielina assente. La
differenza fondamentale nella conduzione tra fibre mieliniche ed
amieliniche che in quest'ultime il processo rigenerativo procede da
un punto ad un altro limitrofo, nelle fibre mieliniche il processo
rigenerativo "salta" da un nodo di Ranvier all'altro (conduzione
saltatoria). Il vantaggio che la comparsa della mielina porta quindi
quello di aumentare la velocit di conduzione senza aumentare il
calibro delle fibre nervose. Alcuni animali come le seppie od i
calamari hanno risolto il problema della scarsa velocit di condu-
zione aumentando il diametro delle loro fibre, giocando cio non
s
ull'isolamento, ma sulla resistenza longitudinale della fibra. E' ov-
vio il vantaggio della soluzione "buon isolamento". Infatti con
questo sistema si possono avere molto pi fibre per unit di super-
ficie con grande vantaggio per lo sviluppo di un sistema nervoso
complesso.
47
5) I RIFLESSI DEL MIDOLLO SPINALE
Nel sistema nervoso esistono dei circuiti elementari che mettono
in connessione i recettori con gli effettori. Questi circuiti elementari
prendono il nome di archi riflessi. L'arco riflesso chiamato anche
arco diastaltico formato da una parte (o branca) afferente, da un
centro nervoso e da una parte (o branca) efferente. I termini afferente
ed efferente si riferiscono al centro nervoso e quindi afferenti sono
chiamate le fibre che congiungono i recettori al centro ed efferenti
quelle che vanno dal centro nervoso all'effettore. Data la semplicit
strutturale dell'arco riflesso la probabilit che un potenziale d'azione
originatosi nella branca afferente arrivi all'effettore molto alta,
vicina al 100
/o.
In questo capitolo parleremo dei riflessi del midollo spinale
studiati usando stimoli elettrici, nel successivo usando stimoli
naturali. In analogia con quanto fatto per le propriet delle fibre
nervose studieremo prima i fenomeni nella loro globalit, poi nel
capitolo ottavo, le propriet integrative dei neuroni alla base dei
fenomeni responsabili delle propriet dei riflessi.
Il midollo spinale ha una struttura segmentaria. La suddivisione
in segmenti (mielomeri) si basa sulla presenza delle radici nervose
che connettono il midollo spinale con la periferia. Le radici si
dividono in ventrali e dorsali. Le radici ventrali (o anteriori) sono
formate da fibre che nascono da neuroni posti nelle corna grigie
anteriori, le radici dorsali da neuroni posti nei gangli spinali (o gan-
gli radicolari). Le radici dorsali ed i loro prolungamenti rappresen-
tano la branca afferente dei riflessi. Questo si pu provare stimo-
lando elettricamente le radici dorsali e registrando da quelle ventra-
48 49
li e stimolando le radici ventrali e registrando da quelle dorsali. Si
vede che nel primo caso una risposta compare nelle radici da cui
si registra, nel secondo no. Questo significa che gli impulsi nervosi
passano attraverso il midollo spinale in una sola direzione: dalle
radici dorsali alle radici ventrali e non viceversa. La dottrina che
afferma la natura sensoriale delle radici posteriori e la natura
motori a dell e radi ci anteri ori prende i l nome di l egge di Bel l
e Magendie.
Vediamo ora quali propriet dei riflessi midollari si possono
scoprire stimolando elettricamente le vie afferenti e registrando
dalle vie efferenti. Un esperimento tipico mostrato in Figura 5-l.
DR
VR
Fig. 5-1 - Neurogramma delle radici ventrali in risposta a stimoli di varia inten-
sit applicati alla radice dorsale.
(Da D.P.C. Lloyd, J. Neurophysiol, 6:111, 1943).
Gli elettrodi registranti in questo esperimento sono dei macroelet-
trodi posti sulle radici dorsali. Se si stimola la radice dor- sale con
correnti deboli (tracciati da A a C) non si osserva alcuna risposta; se
la corrente viene aumentata tanto da eccitare circa il 30
0
/o delle
fibre (tracciato D) compare nelle radici ventrali una onda a breve
latenza (l-2 msec), seguita da onde a latenze maggiori. L'onda a
breve latenza la prima a comparire e raggiunge il suo massimo gi
in E, dove il 41
/o delle fibre delle radici dorsali stimolato. Le onde
tardive al contrario continuano a crescere fino a che tutte le fibre
della radice posteriore non sono state reclutate. Il numero di fibre
eccitate nelle radici dorsali, espresso in percentuale, indicato
sopra ciascun tracciato. Esso stato calcolato dal neurogramma
della radice posteriore.
A cosa dovuta la differenza nella latenza tra la prima e le onde
successive? In parte essa dovuta al diverso calibro delle fibre
presenti nelle radici dorsali. Infatti a bassa intensit di corrente
compare solo l'onda precoce e dagli esperimenti del secondo capi-
tolo noi sappiamo che le fibre pi grosse sono quelle a soglia pi
bassa ed a maggiore rapidit di conduzione. Tuttavia questo non
l'unico fattore. Infatti se si riduce al minimo la distanza tra elettrodi
stimolanti e registranti e si tiene conto della diversa velocit di
conduzione delle fibre di grosso e di piccolo diametro, v' pur sem-
pre un ritardo nell'onda tardiva rispetto a quella precoce maggiore
di quello che dovrebbe essere se la velocit di conduzione fosse l'u-
nico fattore responsabile. L'altro fattore responsabile del ritardo
la presenza di sinapsi nel midollo spinale interposte tra la via affe-
rente e la via efferente. L'onda precoce espressione di un riflesso
monosinaptico, le onde tardive sono dovute a riflessi polisinaptici.
Nei riflessi monosinaptici le vie afferenti, originate dal ganglio spi-
nale, terminano direttamente sul motoneurone; nei riflessi polisi-
naptici esse contraggono sinapsi con neuroni intercalati tra la via
afferente ed il motoneurone. Questi neuroni intercalati tra via affe-
rente e motoneuroni prendono il nome di interneuroni.
Come si fa a dimostrare che l'onda precoce dovuta ad un ri-
F
G
I
55.0
71.0
50 51
flesso monosinaptico? Bisogna innanzitutto avere una misura indi-
pendente del ritardo sinaptico e poi calcolare quanto del temp
o
che intercorre tra stimolazione della radice dorsale e comparsa di
potenziali nella radice ventrale dovuta alla conduzione afferen-
te, quanto alla conduzione efferente e quanto al ritardo centrale.
Se il ritardo centrale tale da non essere compatibile con due ri-
tardi sinaptici il riflesso necessariamente monosinaptico.
La Fig. 5-2 mostra l'esperimento mediante il quale Renshaw
stabil la durata approssimativa del ritardo sinaptico. Gli elettrodi
registranti sono posti sulle radici anteriori, gli elettrodi stimolanti
sono infissi nella sostanza grigia intermedia. Qui si trovano fibre af-
ferenti ai motoneuroni ed interneuroni, elementi cio presinaptici
ai motoneuroni (vedi Fig. 5-2B). Se si stimola con debole intensit
la sostanza grigia intermedia, nella radice ventrale compaiono onde
tardive, indicate con la lettera s; se l'intensit dello stimolo au-
menta compare un'onda precoce (onda m) che aumenta di ampiez-
za con l'aumentare della stimolazione. Contemporaneamente l'onda
s diventa pi piccola (tracciati e ed f).
L'interpretazione dell'esperimento la seguente: stimoli debo-
li eccitano direttamente solo gli elementi presinaptici in quanto
questi sono situati vicino agli elettrodi stimolanti (circolo a nella
parte B della Fig. 5-2), la scarica poi si propaga ai motoneuroni per
via sinaptica e d origine all'onda s dei tracciati. Stimoli forti creano
un campo elettrico maggiore che riesce ad eccitare direttamente i
motoneuroni (circolo b nella parte B della Fig. 5-2) dando cos
origine all'onda precoce m dei tracciati. Se gli stimoli sono molto
forti (tracciato f, parte C della figura) molti neuroni sono reclutati.
L'onda m quindi aumenta. L'eccitazione per rende i neuroni che
hanno scaricato refrattari per cui gli impulsi che arrivano per via
sinaptica non riescono ad eccitarli. L'onda s pertanto diminuisce.
La latenza della scarica m dovuta al tempo di conduzione dai
motoneuroni all'elettrodo registrante, la latenza della scarica s al
tempo di conduzione dai motoneuroni all'elettrodo pi il tempo
necessario per eccitare per via sinaptica i motoneuroni. Se si sot-
trae m da s si ha il ritardo sinaptico pi il tempo di conduzione
presinaptico. Poich a causa della brevit della distanza tra gli elet-
trodi quest'ultimo pu essere considerato trascurabile, l'intervallo
m-s d una misura abbastanza precisa del ritardo sinaptico. Questo
nell'esperimento della Fig. 5-2 si aggira sui 0,8 msec. (Sulla misura
del ritardo sinaptico vedi anche il capitolo 8).
Trovato il ritardo sinaptico si pu calcolare se l'onda precoce
dell'esperimento illustrato nella Fig. 5-l sia veramente monosi-
naptica. Renshaw ha misurato i vari tempi di conduzione ponendo
una serie di elettrodi sulle radici dorsali, nel midollo spinale e sulle
radici ventrali. Egli ha trovato che la latenza della risposta registrata
nella radice ventrale dopo stimolazione di quella dorsale era di 1,05
msec; il tempo di conduzione afferente (dall'elettrodo stimo-
A
Fig. 5.2 - Misura del ritardo sinaptico nel midollo spinale.
(Da B. Renshaw, J. Neurophysiol., 3:373, 1940).
52
53
laute all'entrata delle radici dorsali nel midollo spinale) era di 0,3
msec; il tempo di conduzione efferente (dal motoneurone all'elet-
trodo registrante sulle radici ventrali) era di 0,l msec. Sottraend
o
questi due valori dal tempo totale del riflesso (l,05 msec - 0 4
msec) si ha un ritardo centrale di 0,65 msec. Poich il ritardo si-
naptico oscilla tra 0,5 e 0,9 msec, solo una sinapsi poteva essere in-
tercalata tra via afferente ed efferente.
L'esperimento della Fig. 5-l ha dimostrato che i riflessi mono-
sinaptici sono mediati da fibre di calibro maggiore di quelle re-
sponsabili dei riflessi polisinaptici. Le fibre di calibro maggiore (fi-
bre del Gruppo I) si trovano esclusivamente nei nervi muscolari.
Sono esse responsabili dei riflessi monosinaptici? La risposta s.
Solo la stimolazione dei nervi muscolari d origine a risposte mo-
nosinaptiche. La stimolazione dei nervi cutanei d origine esclusi-
vamente a risposte polisinaptiche.
Quando si registra dalle radici ventrali, come negli esperimenti
esposti fin'ora, non si pu avere alcuna indicazione sulla distribu-
zione ai vari muscoli della scarica evocata dalla stimolazione. Que-
sta indicazione si pu avere invece registrando dai nervi periferici.
Se si stimola un nervo muscolare e si registra da vari nervi
periferici si pu vedere che la distribuzione della scarica
monosinaptica limitata al nervo muscolare che stato stimolato.
In altre parole la scarica monosinaptica "ritorna" al nervo
muscolare (nervo misto) da cui partita. La scarica riflessa
polisinaptica ha al contrario una distribuzione diffusa. Essa pu
essere registrata in vari nervi che si distribuiscono a molti muscoli sia
del lato ipsilaterale che controlaterale a quello del nervo stimolato.
Vi per una sistematicit nella distribuzione della scarica
polisinaptica. Precisamente le scariche polisinaptiche vanno ai
muscoli flessori degli arti ipsilaterali alla stimolazione, mentre esse
si distribuiscono ai muscoli estensori degli arti controlaterali.
Una propriet fondamentale dei riflessi che viene messa in luce
mediante stimolazione elettrica della branca afferente la facilita-
zione. La situazione sperimentale simile a quella degli esperimen
-
ti precedenti. Si stimola la radice dorsale e si registra dalla radice
ventrale. Per invece di stimolare la radice dorsale in toto lai si divi-
de in due porzioni. Quando si stimola la prima porzione si ha una
risposta di una certa ampiezza che chiameremo x, quando si stimola
la seconda porzione si ha una risposta dellampiezza y. Se si
stimolano entrambe le porzioni si vede che la risposta non pari alle
due risposte singole (x + y), ma maggiore. Il fenomeno per cui la
stimolazione di due vie afferenti d una risposta maggiore della somma delle
stimolazioni individuali di ciascuna delle due vie prende il nome di
facilitazione. Il fenomeno si spiega con il fatto che la scarica afferente
al midollo si distribuisce a molti motoneuroni. Alcuni di questi sono
eccitati sopra soglia e danno origine a potenziali d'azione, altri sono
eccitati sotto soglia. Le fibre provenienti da una porzione delle radici
dorsali terminano in parte su gruppi di motoneuroni non innervati
dall'altra porzione, ma in parte convergono sui motoneuroni cui arrivano
anche fibre dall'altra porzione (principio della convergenza). Quando
stimoliamo entrambe le radicole i neuroni che sono innervati da
entrambe le porzioni possono, per il fatto che i potenziali sotto soglia si
sommano, arrivare alla soglia e quindi far nascere i potenziali d'azione.
Come vedremo in seguito i potenziali sotto soglia prendono il nome di
potenziali postinaptici.
In conclusione la scarica registrata dalle radici ventrali e causata
dalla simultanea stimolazione delle due radicali composta dai
potenziali d'azione dei motoneuroni eccitati sopra soglia dalla sti-
molazione della prima radicola, dai potenziali dei motoneuroni ec-
citati sopra soglia dalla stimolazione della seconda radicola ed infine
dai potenziali d'azione dei motoneuroni eccitati sopra soglia dalla
simultanea stimolazione delle due radicole.
La presenza del fenomeno della facilitazione ha permesso di
specificare meglio la distribuzione delle fibre che mediano il riflesso
monosinaptico sui motoneuroni del midollo spinale. Si visto infatti
che le fibre del gruppo I innervano non solo i motoneuroni omonimi, i
motoneuroni cio che mandano fibre ai muscoli da cui le fibre del
gruppo I originano, ma anche i motoneuroni dei muscoli sinergici
diretti, i muscoli cio che agiscono sulla stessa artico-
54 55
lazione e nella stessa maniera come il muscolo da cui le fibre del
gruppo I originano. Sui motoneuroni omonimi l'azione sopra so-
glia, su quelli sinergici sotto soglia, facilitante.
Un'altra propriet fondamentale dei riflessi l'inibizione. L
a
dimostrazione di essa pu essere data stimolando due nervi misti la
cui azione motoria antagonista e registrando da una radice ven-
trale. Stimoliamo ad esempio il nervo del gastrocnemio che provo-
ca una flessione ventrale del piede ed il peroneo profondo che pro-
voca una dorsiflessione del piede. La stimolazione del primo d per
via riflessa una scarica monosinaptica nella prima radice sacrale
ventrale, la stimolazione del secondo nervo non provoca una rispo-
sta in questa radice. Se ora stimoliamo contemporaneamente i due
nervi vedremo che la risposta dovuta al nervo del gastrocnemio
ridotta. Il peroneo profondo ha un'azione inibitoria sui motoneu-
roni eccitati dal nervo del gastrocnemio. La spiegazione di questo
fenomeno simile a quella della facilitazione. Le fibre afferenti del
peroneo profondo terminano in parte sui motoneuroni che deter-
minano la flessione dorsale del piede, in parte sui motoneuroni che
causano la flessione ventrale del piede. Mentre l'azione sui primi
eccitatoria, l'azione sui secondi inibitoria. Poich i motoneuroni
che causano la flessione ventrale del piede sono innervati dal nervo
del gastrocnemio, v' convergenza tra i due nervi sullo stesso gruppo
di motoneuroni, ma l'azione dei due nervi antagonista. Il nervo del
gastrocnemio eccita questi neuroni, il peroneo li inibisce. Ecco che
la stimolazione simultanea di due nervi d una azione minore della
stimolazione del solo nervo del gastrocnemio.
La propriet dell'inibizione ha permesso di specificare con e-
sattezza la distribuzione delle fibre responsabili del riflesso mono-
sinaptico sui motoneuroni. Queste fibre oltre a terminare sui mo-
toneuroni omonimi e sui motoneuroni eteronimi sinergici, inner-
vano anche i motoneuroni antagonisti al muscolo da cui provengo-
no nell'ambito della stessa articolazione. L'azione sui motoneuroni
antagonisti, a differenza di quella sui motoneuroni omonimi e
sinergici di tipo inibitorio.
Stimolando simultaneamente due radicole o due nervi che in
teoria dovrebbero dare una facilitazione si nota talvolta, usando
intensit forti di stimolazione, che la risposta complessiva non
superiore a quella della somma delle due risposte singole. Questo
fenomeno prende il nome di occlusione.
Come si spiega l'occlusione? Esaminiamo la Fig. 5-3.
S S
Fig. 5.3 - II fenomeno dell'occlusione.
(Da T.C. Ruch e H.D. Patton, Physiology and Biophysics, Philadelphia, W.B.
Saunders, 1965).
La stimolazione della prima radicola determina la risposta rap-
presentata in A. Essa dovuta alla scarica di 13 neuroni, indicati
come cerchi neri nel quadrato sottostante; i cerchi vuoti mostrano
che altri 12 neuroni sono stati eccitati, ma sotto soglia. In B si
t m.sec.
57
S,
100
nervo del
bicipite
2 4
msec.
A
e
D
1 msec
56
vede la risposta alla stimolazione della seconda radicola. In questo
caso solo 3 neuroni hanno sparato, altri 22 sono stati eccitati sotto
soglia. La parte destra della figura (C) mostra che la simultanea
stimolazione delle due radicole d una risposta minore della som-
ma della loro risposta. Il rettangolo sottostante spiega il perch di
questo fatto. In grigio scuro mostrata la popolazione di neuroni
eccitati sia dalla prima che dalla seconda radicola. Si pu vedere
che i tre neuroni che sparavano quando si stimolava la seconda
radicola erano eccitati sopra soglia anche dalla stimolazione della
prima radicola. Quindi, per la legge del tutto o nulla, ciascuno di
essi genera un solo potenziale d'azione anche quando entrambe le
radicole sono simultaneamente stimolate. Ancora si vede che uno
solo dei neuroni comuni alle due radicole in basso a destra nella zona
grigio-scura) raggiunge la soglia solo in caso di stimolazione simul-
tanea delle radicole. Se ora si fa la somma dei neuroni eccitati
sopra soglia (cerchi neri) si trova che essa di 14 neuroni e quindi
minore di quella (16 neuroni) che si ottiene stimolando separata-
mente le radicole. Facilitazione e occlusione sono la conseguenza
di un medesimo fenomeno: la convergenza di impulsi eccitatori
sugli stessi motoneuroni. Si ha facilitazione se l'effetto dominante
l'eccitazione sotto soglia, si ha occlusione se l'attivazione preva-
lentemente sopra soglia.
La facilitazione e l'inibizione sono processi che hanno un'evo-
luzione nel tempo. Se si applica un primo stimolo ad una radice o
ad un nervo (stimolo condizionante) e poi ad intervalli di tempo
un secondo stimolo (stimolo test) possiamo studiare questo decorso
temporale e trovare per quanto tempo l'eccitabilit del midollo
spinale modificata dallo stimolo condizionante.
L'esperimento illustrato nella figura 5-4. Lo stimolo condi-
zionante applicato ad un ramo nervoso (S
1
) e lo stimolo test
(S
2
) ad un altro ramo (Fig. 5-4, in alto a sinistra). Lo stimolo con-
dizionante applicato da solo non determina nessuna risposta nella
radice ventrale. Lo stimolo test causa la risposta mostrata in A
(parte inferiore della figura). La simultanea stimolazione di S
l
e
S
2
produce la grande risposta che si vede in B. Sfasando nel tempo
58 59
i due stimoli la risposta progressivamente decresce finch ad un
certo punto (tracciato N) la risposta non diversa da quella senz
a
stimolo condizionante (tracciato O). Il decorso temporale del
fenomeno mostrato a destra in alto della figura.
Nei riflessi monosinaptici, come in quello mostrato in figura, la
facilitazione dura per circa 14 msec: massima quando i due sti-
moli sono applicati contemporaneamente e decade progressiva-
mente. La durata e la curva della facilitazione coincide con l'anda-
mento temporale dei potenziali postsinaptici eccitatori (vedi Ca-
pitolo 8). La scoperta di questi potenziali ha permesso di spiegare
a livello cellulare il fenomeno della facilitazione scoperto da
Sherrington molto prima dell'introduzione delle tecniche di
registrazione intracellulare.
L'inibizione nei riflessi monosinaptici ha una durata ed un de-
corso temporale simile alla facilitazione. E' degno di nota per il
fatto che l'inibizione non si ha quando lo stimolo condizionante e
lo stimolo test coincidono, ma occorre che lo stimolo condizionante
preceda lo stimolo test. Precisamente l'inibizione massima si ha
quando v' un ritardo tra i due stimoli dell'ordine di 0,5 msec. La
ragione pi probabile del fenomeno la presenza di un interneurone
tra la terminazione delle fibre afferenti ed il motoneurone che viene
inibito. In realt quindi le fibre inibitorie dei riflessi monosinaptici
hanno un'azione eccitatoria. Esse eccitano i motoneuroni omonimi e
degli interneuroni. Sono questi ultimi che inibiscono i motoneuroni
antagonisti.
L'evoluzione nel tempo sia della facilitazione che della inibi-
zione nei riflessi polisinaptici assai diversa da quella dei riflessi
monosinaptici. Innanzitutto il processo molto pi prolungato nel
tempo, secondo ha un decorso irregolare. Infatti sia la facilitazione
che l'inibizione crescono irregolarmente, poi decadono, poi au-
mentano ancora, poi decadono e cos via finch progressivamente
l'effetto dello shock condizionante si spegne. Sia il lungo decorso
che l'andamento particolare si spiega con la presenza di catene di
interneuroni interposti tra le fibre afferenti ed i motoneuroni. In
genere seguendo la terminologia di Lorente de N si distinguono
tipi fondamentali di catene di interneuroni: la catena chiusa e
la catena multipla.
Nella catena chiusa la fibra che va al motoneurone (o ad un in-
terneurone) manda una collaterale ad una cellula che a sua volta
innerva il neurone da cui la fibra ha preso origine. Se le connessioni
sono eccitatorie la cellula che manda la fibra al motoneurone si
autoeccita attraverso la cellula intercalata. Nella catena multipla
l'interneurone che innerva il motoneurone manda una collaterale
a
d un altro interneurone che a sua volta manda una fibra al moto-
neurone ed una collaterale ad un interneurone. Questo a sua volta
ha connessioni analoghe. Se le connessioni sono eccitatorie il risul-
tato sar una eccitazione prolungata del motoneurone. La figura
5-5 mostra un esempio di catena chiusa di interneuroni (C) ed uno
di catena multipla (M).
Fig. 5.5 - I due tipi fondamentali di circuiti di neuroni. M: catena multipla; C:
catena chiusa
(Da R. Lorente de N, J . Neurophysiol., 1:207, 1938).
Per concludere opportuno ricordare che la propriet, dimo-
strata per i riflessi monosinaptici, per cui quando certi motoneuroni
(ad es. i flessori) vengono eccitati, i loro antagonisti, (gli estensori),
vengono inibiti vale anche per altri riflessi. Questa propriet che
prende il nome di innervazione reciproca indispensabile per
permettere che i movimenti si svolgano in maniera armoniosa.
L'innervazione reciproca evita un conflitto tra risposte antagoniste
che altrimenti verrebbe risolto alla periferia in termini di forza mu-
scolare con grave danno della precisione ed armonia dei movimenti.
61
6) _ I RIFLESSI EVOCATI DA STIMOLI NATURALI
La classificazione dei riflessi varia a secondo dei criteri che ven-
gono adottati. Una classificazione molto usata quella che si basa
sullo stimolo adeguato ad evocare il riflesso e quindi sul tipo di re-
cettore che viene stimolato. I recettori, secondo la classificazione
di Sherrington possono essere suddivisi in: esterocettori (recettori
cutanei e gustativi), telecettori (vista, udito, olfatto), propriocetto-
ri (recettori muscolari, articolari, tendinei e vestibolari) ed entero-
cettori (recettori viscerali). I riflessi quindi si distingueranno in:
esterocettivi, telecettivi, propriocettivi ed enterocettivi.
I riflessi possono essere classificati a secondo del loro significato
biologico. Konorski, usando questo criterio, ha distinto riflessi
necessari alla conservazione dell'organismo (riflessi conservativi) e
riflessi che sono messi in funzione quando l'organismo affronta un
agente nocivo o pericoloso (riflessi protettivi).
I riflessi conservativi includono tra gli altri:
I) riflessi indispensabili per l'assunzione di materiali necessari alla
sopravvivenza (riflessi inspiratori e digestivi); 2) riflessi indispensabili
per l'eliminazione di cataboliti (riflessi della minzione, defecazione,
riflessi espiratori); 3) riflessi indispensabili per il mantenimento del
tono muscolare e della postura.
I riflessi protettivi includono: l) riflessi che fanno retrarre il
corpo e gli arti da stimoli nocivi; 2) riflessi che allontanano agenti
nocivi dalla superficie o dall'interno del corpo (riflesso di gratta-
mento, riflesso della tosse).
1 riflessi del midollo spinale che verranno studiati in dettaglio
sono i riflessi protettivi che allontanano gli arti dalla causa nociva
62 63
(riflessi flessori) e i riflessi alla base del mantenimento del tono
muscolare e della postura (riflessi miotattici o da stiramento). Cen-
ni verranno dati sul riflesso di grattamento.
I riflessi flessori
Il riflesso flessorio un riflesso esterocettivo. Esso pu essere
evocato da stimoli non nocivi, ad es. tattili, applicati alla cute e
da stimoli dolorosi. Nel primo caso la risposta consiste in genere in
una modica contrazione di pochi muscoli flessori con lieve flessione
dell'arto, nel secondo caso si ha una marcata contrazione dei musco-
li flessori con retrazione dell'arto dalla sorgente del danno; la contra-
zione dei flessori si accompagna ad un'inibizione ipsilaterale dei
motoneuroni estensori.
Il riflesso flessorio presente nell'animale spinale (preparato
spinale), in un animale cio in cui stato isolato, mediante un ta-
glio, il midollo spinale dai centri sovrastanti. La presenza del riflesso
in tale preparato, che paralizzato, indica che il riflesso si svolge
nel midollo spinale in assenza dei centri superiori e che indi-
pendente dalla volont. Lo stimolo esterocettivo che produce il ri-
flesso flessorio causa nell'animale spinale anche l'estensione dell'arto
controlaterale e, per la legge dell'inibizione reciproca, l'inibizione
dei motoneuroni flessori controlaterali. La funzione di questo
riflesso estensorio controlaterale quello di fornire un supporto al
corpo quando l'arto ipsilaterale al lato stimolato stato sollevato.
Per quanto l'applicazione di uno stimolo esterocettivo in qual-
siasi parte di un arto provochi una risposta flessoria, il quadro della
risposta globale varia a secondo della porzione di cute stimolata.
Questa dipendenza pu essere anche dimostrata stimolando elettri-
camente i nervi cutanei. La dipendenza del movimento dell'arto dal-
la regione di cute stimolata prende il nome di segno locale. Grazie
al segno locale la retrazione causata dallo stimolo involve princi-
palmente la parte di arto interessata dallo stimolo.
I l riflesso flessorio, evocato da stimoli naturali, corrispond
e
ai riflessi polisinaptici dimostrati con la stimolazione elettrica. Pa
ragonando le loro propriet si trova infatti che a) entrambi hanno
vasta distribuzione, nel senso che pi muscoli sono interessati nella
risposta; b) in entrambi i riflessi, ipsilateralmente al lato stimolato
sono eccitati i motoneuroni flessori, mentre sono inibiti quelli
estensori; controlateralmente gli estensori sono eccitati i flessori
sono inibiti; c) in entrambi i riflessi, la risposta dura oltre il tempo
di applicazione dello stimolo (scarica postuma); questo fenomeno
dipende dalle catene di interneuroni interposte tra vie afferenti
e motoneuroni. Se si paragonano le finalit biologiche del riflesso
flessorio con le propriet dei riflessi polisinaptici ci si rende conto
come le propriet di questi ultimi sono indispensabili per ottenere
la risposta diffusa e prolungata necessaria per ottenere un effi-
cace allontanamento dell'arto dalla causa nociva.
Il riflesso flessorio anche chiamato riflesso nocicettivo. Que-
sto perch il termine nocicettivo, mentre indica che uno stimolo
che provoca nocumento il pi efficace, non implica il concetto
di sensazione cosciente del dolore. Tale sensazione manca nell'ani-
male spinale, in quanto le afferenze periferiche non arrivano ai
centri superiori responsabili delle sensazioni coscienti. Essa non
necessaria per avere il riflesso.
Il riflesso di grattamento
Un altro riflesso esterocettivo il riflesso di grattamento. Si
tratta di un riflesso protettivo il cui scopo quello di allontanare
un agente nocivo dalla cute. Per quanto esso possa venire evocato
applicando al dorso dell'animale una debole corrente elettrica o
stirando i peli, lo stimolo naturale la puntura di un insetto o pi
in generale il prurito. Nel cane in cui questo riflesso stato ben
studiato la risposta consiste in movimenti alternati di flessione ed
estensione della coscia, gamba e piede. Nonostante la complessit
della risposta motoria il riflesso di grattamento pu essere evocato
nel cane dopo sezione del midollo spinale a livello toracico.
64
I riflessi da stiramento
I riflessi da stiramento sono riflessi propriocettivi che si otten-
gono stirando i muscoli. Lo stiramento pu essere eseguito in ma-
niera brusca, ad es. applicando un colpo di martelletto al tendine
di un muscolo (riflesso da stiramento fasico) o mantenendo il mu-
scolo stirato per un certo periodo di tempo (riflesso da stiramento
tonico o riflesso miotatico). I n entrambi i casi si ha in risposta
allo stiramento una contrazione del muscolo, nel primo caso breve,
fasica; nel secondo continua, tonica.
La latenza del riflesso da stiramento molto breve e nel passato
stato sostenuto che il riflesso da stiramento non fosse un vero
riflesso ma che la contrazione muscolare fosse dovuta alla stimola-
zione diretta del muscolo. L'abolizione della risposta dopo taglio
delle radici anteriori o posteriori prova con certezza che si tratta di
un vero riflesso e non di una risposta idiomuscolare.
I riflessi da stiramento fasici sono presenti sia nei muscoli fles-
sori che nei muscoli estensori. I riflessi miotatici sono chiaramente
evocabili nei muscoli estensori e in quelli a funzione antigravitaria.
Se si paragonano le propriet dei riflessi da stiramento con quelli
dei riflessi monosinaptici si vede come queste coincidano. In entrambi
i casi infatti si tratta di riflessi a brevissima latenza, senza scarica
postuma, con risposte localizzate al muscolo da cui parte il nervo
afferente e con inibizione dei motoneuroni dei muscoli antagonisti
nella stessa articolazione. Attualmente da tutti accettato che i
riflessi da stiramento siano dei riflessi monosinaptici mediati da
fibre di grosso calibro (fibre del gruppo I).
Il riflesso miotatico stato studiato in termini quantitativi da
Sherrington mediante il cosiddetto "tavolo di caduta", un disposi-
tivo che permette di controllare la lunghezza dello stiramento del
muscolo e la velocit con cui il muscolo viene stirato. La figura 6-1
mostra un esperimento con il "tavolo di caduta".
L'esperimento fatto su un gatto decerebrato, un animale in
cui in anestesia stata asportata la porzione del sistema nervoso al
di sopra del mesencefalo. Tale animale non sente alcun dolore ed
Fig. 6.1 - Riflesso da stiramento dimostrato con il "tavolo di caduta".
(Da E.G.T. Liddell e C.S. Sherrington, Proc. roy. Soc., B96:212, 1924).
paralizzato. La figura mostra che l'allungamento di un muscolo di
pochi mm (curva T, scala piccola parallela alle ordinate) produce
una contrazione che si manifesta in un marcato aumento della ten-
sione muscolare (curva M).
La tensione iniziale di oltre 3,5 kg. Mantenendo lo stiramen-
to essa si mantiene sui 3 kg. Questa tensione non per dovuta
tutta ad una contrazione attiva; in parte essa dipende dalle propriet
elastiche del muscolo. Infatti se si denerva il muscolo si vede che
esso ancora sviluppa tensione in risposta allo stiramento, ma in
quantit molto minore (curva P). La differenza tra la tensione to-
tale (M) e la tensione elastica (P) rappresenta la tensione riflessa,
quella cio di cui responsabile il riflesso nervoso.
Usando il "tavolo di caduta" si pu dimostrare che la tensione
riflessa pu essere inibita, mentre ci ovviamente impossibile per
la tensione elastica. L'inibizione pu essere ottenuta in varie ma-
niere. Ad es. mediante lo stiramento di un muscolo antagonista,
oppure stimolando, se si studia un muscolo estensore, i nervi cuta-
65
66 67
nei ipsilaterali. Questi come sappiamo, eccitano i motoneuroni
flessori ed inibiscono quelli estensori. L'inibizione viene detta
totale se la tensione del muscolo, durante la stimolazione inibito-
ria, diventa pari alla sua tensione elastica.
Qual' il significato biologico dei riflessi da stiramento? Essi
rappresentano un sistema di controllo sulla lunghezza del muscolo.
Ogni qualvolta questa aumenta, segnali (potenziali d'azione) sul
cambiamento della lunghezza del muscolo e sulla sua lunghezza i-
stantanea sono inviati ai motoneuroni che entrano immediatamen-
te in funzione facendo contrarre il muscolo ed opponendosi cos al
suo allungamento. Segnali sulla lunghezza del muscolo vengono in-
viati anche ai centri superiori, soprattutto al cervelletto, che inter-
viene con una regolazione pi fine. I riflessi miotatici per sono
dei riflessi spinali, essi permangono anche dopo disconnessione del
midollo spinale dai centri superiori.
Il significato finalistico dei riflessi da stiramento quello di op-
porsi alla forza di gravit, intervenendo nel mantenimento della
postura. Immaginiamo una persona in posizione eretta: per la for-
za di gravit l'articolazione del ginocchio tender a flettersi; questa
flessione per stirer i muscoli estensori che si contrarranno rinfor-
zando l'articolazione ed impedendo la caduta. In termini cibernetici
i riflessi da stiramento sono considerati un sistema di feedback
negativo: un sistema cio in cui il centro di coniando tende a man-
tenere, nonostante le sollecitazioni,lo status quo.
Recettori dei riflessi da stiramento
I recettori dei riflessi da stiramento sono i fusi neuromuscolari.
Si tratta di organuli macroscopici di forma affusata, sparsi nella
parte carnosa dei muscoli. Essi sono costituiti da sottili fibre mu-
scolari particolarmente differenziate che prendono il nome di fibre
intrafusali. Il fuso circondato da una capsula connettivale che
congiunge il fuso alle fibre muscolari normali, chiamate fibre ex-
trafusali, o pi raramente ai tendini. Nel fuso si distingue una re-
gione centrale o equatoriale, espansa, dove la capsula connettivale
separata dalle fibre intrafusali da uno spazio riempito di fluido e
due regioni polari, sottili.
Le estremit polari del fuso hanno struttura simile a quella delle
fibre extrafusali e sono contrattili; la regione centrale ricca di
nuclei e non appare essere contrattile. Nei mammiferi vi sono due
tipi di fibre intrafusali: le fibre a "borsa nucleare" e le fibre a "ca-
tena nucleare". Le fibre a borsa nucleare sono pi lunghe, pi grosse
e nella porzione equatoriale, molto ingrossata, hanno molti nuclei
ammassati l'uno vicino all'altro. Le fibre a catena nucleare, pi piccole
e pi sottili, hanno i nuclei disposti in fila indiana, formanti cos
una specie di catena. Ogni fuso formato da 2 a 12 fibre intrafusali.
Le fibre a catena nucleare sono pi numerose di quelle a borsa
nucleare e la parte terminale delle prime si attacca alle fibre a
borsa nucleare. Un esempio dei due tipi di fibre intrafusali e della
loro innervazione afferente mostrato nella figura 6-2. A sinistra
rappresentata una fibra a catena nucleare, a destra una fibra a
borsa nucleare.
Ogni fuso riceve fibre afferenti (neurone d'origine nel ganglio
spinale) e fibre efferenti (neurone d'origine nelle corna grigie ante-
riori). Le fibre afferenti sono di due tipi: 1) fibre di grosso diame-
tro (gruppo I =12-20 ) che avvolgono a spirale la porzione equa-
toriale. Queste fibre terminano prendendo il nome di terminazioni
primarie o anulospirali; 2) fibre di medio diametro (gruppo II =6-
12 p) che terminano pi distalmente, ma sempre nella parte cen-
trale del fuso. Queste fibre sono chiamate terminazioni secondarie
o a fiorami. Ogni fuso riceve una fibra del gruppo I e da O a 5 fi-
bre del gruppo II. Le terminazioni primarie innervano sia le fibre a
catena nucleare che quelle a borsa nucleare. Quelle secondarie ter-
minano prevalentemente sulle fibre a catena nucleare.
Le fibre efferenti terminano in corrispondenza delle porzioni
polari del fuso. Si tratta di fibre di piccolo diametro (3-7 p) che
prendono il nome di fibre gamma.
Per studiare le propriet funzionali dei fusi neuromuscolari e
pi precisamente come questi segnalano al midollo spinale la lun-
ghezza e le modificazioni di lunghezza del muscolo si registrano i
68 69
fibra gruppo: fibra gruppo
II II I
Fig. 6.2 - Fibre intrafusali e loro innervazione afferente.
(Da R. Granit, The basis of motor control, London and New York, Academic
Press, 1970).
potenziali d'azione delle fibre afferenti provenienti dal fuso. Una
tecnica che ha dato risultati soddisfacenti quella di registrare dalle
radici dorsali, dividendole pazientemente in banderelle fino a
riuscire ad isolare i potenziali d'azione di una singola fibra. Se nello
stesso esperimento si stimolano elettricamente le fibre provenienti
dal muscolo che vanno alla radice studiata si pu stabilire la velocit
di conduzione della fibra da cui si registra e quindi risalire al suo
diametro.
I risultati di questi esperimenti hanno mostrato che lo stira-
mento del muscolo (e quindi del fuso) provoca un aumento nella
frequenza di scarica delle fibre afferenti del fuso e che, aumentan-
do lo stiramento, aumenta anche la frequenza della scarica. Quan-
do si registra contemporaneamente da pi fibre si nota che stiran-
do maggiormente il muscolo aumenta anche il numero di fibre atti-
ve. L'allungamento del fuso provoca quindi due effetti: un aumen-
to nella frequenza dei potenziali d'azione in una singola fibra, un
aumento nel numero delle fibre attive. Sia le fibre del gruppo I che
quelle del gruppo II rispondono allo stiramento del muscolo, que-
st'ultime per hanno una soglia lievemente pi elevata.
Recentemente stata messa in luce un'altra, pi importante
differenza tra le fibre del gruppo I e quelle del gruppo II. Precisa-
mente stato visto che le terminazioni secondarie (fibre del grup-
po II) hanno una frequenza di scarica che funzione della lunghez-
za del muscolo in un dato momento, mentre le terminazioni pri-
marie (fibre del gruppo I) presentano una frequenza di scarica che
dipende sia dalla velocit di stiramento che dalla lunghezza delle
fibre muscolari. Poich le terminazioni secondarie sono in rap-
porto, prevalentemente, colle fibre intrafusali a catena nucleare si
pu come schema generale considerare le fibre intrafusali a borsa
nucleare come i recettori che danno una misura sia della velocit di
allungamento del muscolo che della sua lunghezza (recettori dina-
mici), mentre le fibre a catena nucleare come i recettori che segna-
lano solo la lunghezza istantanea del muscolo (recettori statici).
Negli esperimenti appena descritti si registrava dalle fibre affe-
renti del fuso durante lo stiramento del muscolo. Se, mantenendo
la stessa situazione sperimentale, si applicano degli elettrodi stimo-
lanti al nervo efferente al muscolo e lo si stimola, si pu studiare il
comportamento delle fibre afferenti anche durante la contrazione
del muscolo. Facendo questi esperimenti si trova che le fibre del
gruppo II e molte delle fibre del gruppo I cessano di scaricare du-
rante la contrazione del muscolo da cui provengono. Una parte pe-
r delle fibre del gruppo I non solo non cessa di scaricare durante
la conduzione del muscolo ma addirittura aumenta la propria sca-
70 71
rica. Queste fibre inoltre hanno una soglia allo stiramento di gran
lunga maggiore di quelle che cessano di sparare durante la contra-
zione.
Questo particolare comportamento di una parte delle fibre I
stato chiamato comportamento B e le fibre che lo presentano han-
no preso il nome di fibre I b. Per converso le fibre che cessano di
sparare durante la contrazione del muscolo ed hanno una bassa so-
glia allo stiramento del muscolo vengono chiamate fibre Ia e IIa.
Matthews ha dimostrato che i due tipi di fibre prevengono da
recettori diversi e precisamente le fibre la e IIa dai fusi neuromu-
scolari (chiamati da lui anche recettori A), le fibre Ib dagli organi
tendinei del Golgi (recettori B).
Recettori tendinei e riflessi tendinei
Nei tendini, vicino alla loro origine muscolare, esistono dei
propriocettori comunemente chiamati organi tendinei del Golgi.
L'organo tendineo lungo circa 500 p ed formato dalle termina-
zioni di un gruppo di fibre del gruppo I (fibre Ib) avvolte in una
capsula connettivale e strettamente connesse ai fasci tendinei. Le
fibre nervose entrate dentro la capsula si dividono ripetutamente
dando origine a terminazioni amieliniche. Queste terminazioni si
ramificano ulteriormente e si applicano con un rigonfiamento alle
superfici dei fascicoli tendinei. La distorsione delle terminazioni
lo stimolo adeguato per generare impulsi nelle fibre Ib.
Se si pensa alla posizione anatomica dell'organo tendineo del
Golgi ci si rende conto immediatamente che la distorsione delle
sue terminazioni nervose pu avvenire sia quando il muscolo viene
stirato sia quando il muscolo si contrae. Infatti in entrambi i casi
una tensione viene esercitata sul tendine che si trasmette alle ter-
minazioni nervose, eccitandole.
La disposizione dell'organo tendineo rispetto al muscolo de-
scritta come "in serie", un'analogia passa dai circuiti elettrici che
indica che il recettore ed il muscolo sono disposti l'uno dopo l'al
tro, in fila indiana. Al contrario la disposizione del fuso neuromu-
scolare rispetto al muscolo descritta come "in parallelo" essendo
le fibre intrafusali situate parallelamente rispetto a quelle extrafu-
sali.
La disposizione in serie ed in parallelo dei due recettori rende
ragione del diverso comportamento delle fibre Ia e Ib durante la
contrazione muscolare. In questa condizione il fuso si affloscia e
pertanto le fibre Ia non sono pi stimolate, viceversa il tendine
viene stirato e le fibre Ib sono eccitate. La disposizione in serie ed
in parallelo spiega anche la ragione dell'identico comportamento,
delle fibre Ia e Ib in caso di stiramento del muscolo. In questo caso
infatti sia il tendine che il fuso vengono stirati e sia le fibre Ia che
le fibre Ib eccitate. L'unica differenza consiste in una differenza di
soglia. Questa, come gi detto, molto maggiore per le fibre Ib.
Gli organi tendinei del Golgi rappresentano un sistema che in-
forma l'organismo sullo stato di tensione in cui si trovano i
muscoli. Se si ha una contrazione muscolare con accorciamento del
muscolo ma con scarso sviluppo di tensione gli organi tendinei
vengono poco eccitati, se al contrario il muscolo si contrae quando
stirato e l'accorciamento non ha luogo perch i capi muscolari
sono fissati si ha una scarica molto elevata nelle fibre Ib.
L'osservazione che lo stiramento del muscolo non efficace
nello stimolare le fibre Ib se non quando esso elevato non dovu-
to al fatto che gli organi tendinei sono dei "cattivi" recettori ma al
fatto che essi non sono primariamente dei recettori da stiramento,
dei segnalatori cio della lunghezza del muscolo, ma dei recettori
di tensione. D'altronde il fatto che essi siano in serie con strutture
elastiche come i muscoli che assorbono lo stiramento e impedisco-
no quindi che esso si propaghi al tendine, d una ragione fisica alla
alta soglia allo stiramento delle fibre Ib.
Accanto alla funzione di recettori di tensione gli organi tendi-
nei hanno anche quella di agire come un sistema protettivo contro
una eccessiva contrazione muscolare. Questa funzione diventa evi-
dente in condizioni patologiche come la spasticit, una condizione
caratterizzata da un marcato, patologico aumento del tono musco-
72 73
lare. Quando in un paziente spastico si tenta di flettere un arto si
vede che all'inizio la resistenza alla flessione aumenta. Ci accade
per la comparsa del riflesso da stiramento. Se si continua la mano-
vra aumentando ancora la flessione si vede che ad un certo punto
l'arto cede bruscamente, flettendosi. Sherrington ha dimostrato
che questo brusco cedimento un fenomeno attivo ed dovuto ad
un riflesso inibitorio chiamato "reazione di allungamento". Duran-
te la reazione di allungamento i motoneuroni che innervano il mu-
scolo stirato vengono inibiti mentre si ha una simultanea eccitazione
dei motoneuroni antagonisti. Il riflesso di allungamento anche
chiamato riflesso del "coltello a serramanico" per la somiglianza
dell'andamento del riflesso con la resistenza che la lama di un col-
tello a serramanico offre quando si cerca di estrarla ed il bru-
sco scatto che pone termine all'estrazione.
Esistono varie prove che il riflesso del "coltello a serramanico"
sia dovuto alle fibre Ib. Alcune sono indirette quale l'osservazione
che il riflesso compare quando lo stiramento molto intenso, un
dato in accordo con la soglia elevata dell'organo tendineo allo
stiramento; altre dirette come gli esperimenti che dimostrano che
il riflesso miotatico del quadricipite pu venire inibito stimolando
elettricamente il tendine di questo muscolo, ma non la parte
muscolare.
Riassunto dei riflessi mediati delle fibre Ia, Ib e IIa
Le fibre Ia mediano i riflessi da stiramento. La cellula d'origi-
ne delle fibre nel ganglio spinale. E' una cellula a T di cui un as-
sone d origine alle terminazioni primarie del fuso neuromuscola-
re, l'altro assone termina nelle corna grigia anteriore facendo sinapsi
direttamente coi motoneuroni (motoneuroni a). Precisamente la
fibra la eccita i motoneuroni omonimi, facilita i motoneuroni si-
nergici nella stessa articolazione, inibisce quelli antagonisti.
Le fibre Ib mediano la "reazione di allungamento". La termi-
nazione periferica della fibra va all'organo del Golgi, la terminazione
centrale termina nelle corna grigie anteriori. Esperimenti in cui
si usano stimoli condizionanti applicati alle fibre Ib e stimoli test
alle fibre I a, hanno dimostrato un'azione inibitrice delle fibre I b
sui motoneuroni che innervano il muscolo da cui le fibre Ib pro-
vengono e sui motoneuroni dei muscoli sinergici. Le fibre Ib hanno
anche un'azione facilitatoria sui motoneuroni dei muscoli antago-
nisti rispetto a quelli da cui originano. La misura del ritardo con
cui le fibre Ib inibiscono il riflesso monosinaptico ha permesso di
stabilire che il riflesso mediato da esse disinaptico. Le fibre Ib
terminano pertanto su degli interneuroni. Poich il quadro delle
connessioni centrali delle fibre Ib, a parte la connessione disinaptica
coi motoneuroni, identica a quelle delle fibre Ia, ma di segno
opposto, il riflesso di allungamento anche chiamato "riflesso
miotatico inverso".
Le fibre IIa terminano perifericamente sul fuso come termina-
zioni secondarie o a fiorami. Esperimenti in cui stato usato uno
stimolo elettrico condizionante applicato sulla fibra IIa e uno sti-
molo test applicato sulle fibre Ia hanno dimostrato che le fibre IIa
danno origine ad archi polisinaptici (esse agiscono sui motoneuroni
con ritardi superiori ai 2 msec) e che la loro azione facilitante sui
motoneuroni che innervano i muscoli flessori ed inibitoria su quelli
estensori. Essi mediano quello che viene chiamato "riflesso flessore
da stiramento". I l significato biologico di questo riflesso non
chiaro cos come non chiara la relazione fra questo riflesso ed il
ruolo (vedi sopra) che le fibre IIa hanno nel segnalare il grado di al-
lungamento di un muscolo.
Fibre gamma e regolazione del fuso neuromuscolare
I fusi neuromuscolari oltre a ricevere fibre afferenti sono inner-
vati da fibre efferenti che terminano nelle porzioni polari del fuso.
Le fibre efferenti del fuso (fibre fusimotorie) sono distinguibili per
il loro diametro dalle fibre efferenti che innervano le fibre extrafu-
sali. Le fibre efferenti al fuso sono infatti piccole (3-7 p), mentre
quelle che terminano nel muscolo hanno un diametro maggiore (8
1
3
p). Le fibre efferenti del fuso rappresentano circa il 30
0
/o del
74 75
totale delle fibre efferenti e sono indicate col nome di fibre gamma
(y). Esse prendono origine dai motoneuroni gamma. Le fibre effe-
renti dei muscoli rappresentano il restante 70
0
/o e vengono chia-
mate fibra alfa (a). Esse provengono dai motoneuroni a.
Esistono due tipi di fibre y. Quelle del primo tipo (fibre 71)
terminano su parti circoscritte del fuso, quelle del secondo (fibre
72) terminano in maniera pi diffusa, dalla porzione paracentrale
fino al polo del fuso. Anche se non c' un accordo generale su que-
sto punto vi sono prove che le fibre 71 si distribuiscono soprattut-
to alle fibre intrafusali a borsa nucleare, le 72 alle fibre a catena
nucleare. Le 71 pertanto sono chiamate fibre gamma dinamiche, le
72 fibre gamma statiche. La Fig. 6-3 mostra le terminazioni delle
fibre 71 e 72 rispettivamente su una fibra intrafusale a borsa nu-
cleare e su una fibra a catena nucleare.
Fig. 6.3 - Innervazione dei due tipi di fibre intrafusali.
(Da A. Crowe and P.B.C. Matthews, J. Physiol., 113:298, 1951).
La dimostrazione fisiologica che le fibre gamma non innervano
le fibre extrafusali e pertanto non contribuiscono allo sviluppo della
tensione muscolare data da esperimenti in cui si registra il neuro-
gramma di un nervo di moto e contemporaneamente la tensione svi-
luppata dal muscolo da questo innervato. Si vede che quando l'onda
dovuta alle fibre a ha raggiunto la sua massima ampiezza anche la
tensione muscolare sviluppata massima; un aumento dell'intensit
di stimolazione provoca la comparsa dell'onda dovuta all'eccita-
zione delle fibre y ma non determina ulteriori aumenti della ten-
sione. Viceversa se si blocca in maniera selettiva la conduzione
delle fibre a, si vede che la comparsa dell'onda dovuta alle fibre y
si accompagna ad una risposta muscolare nulla o del tutto trascu-
rabile.
L'attivazione delle fibre y determina la contrazione delle parti
polari del fuso e quindi lo stiramento della parte centrale recetto-
riale del fuso. La procedura sperimentale per dimostrare la funzio-
ne fusimotoria delle fibre y la seguente. Si registrano i potenziali
d'azione di singole fibre afferenti del fuso nelle radici dorsali e si
stimolano elettricamente le fibre 7 che vanno allo stesso fuso. Si
vede che la stimolazione delle fibre y determina un aumento di
scarica nelle fibre Ia e IIa senza che vi sia stato alcun stiramento
del muscolo. Combinando lo stiramento del muscolo e la stimola-
zione delle fibre y si pu osservare come questa potenzi l'efficacia
dello stiramento.
La stimolazione delle fibre 7 pu determinare la scarica nelle
fibre afferenti del fuso anche durante la contrazione del muscolo.
Questo mostrato nella figura 6-4. Nell'esperimento che v' illu-
strato si registrano la tensione del muscolo ed i potenziali d'azione
di una fibra anulospirale. Si vede (tracciato superiore) che lo stira-
mento del muscolo (e quindi del fuso) determina una scarica conti-
nua nella fibra afferente. Nel tracciato di mezzo mostrato l'effetto
della contrazione muscolare sulla scarica della fibra. Si vede che
durante la contrazione muscolare la scarica cessa. Ci avviene per-
che, come mostrato a sinistra del tracciato, durante la contrazione
muscolare il fuso si affloscia. Infine, le fibre gamma vengono sti-
molate. Si vede (tracciato inferiore, a destra) che la fibra anulo-
spirale ora spara nonostante la contrazione muscolare. Ci avviene
in quanto, nonostante l'accorciamento del muscolo, il fuso stira-
to. Infatti la stimolazione delle fibre gamma ha causato una con-
trazione delle sue parti polari stirando la porzione centrale ed
eccitando cos le fibre afferenti.
Qual' il significato funzionale del sistema gamma? Una rispo-
76 77
sa
Fig. 6.4 - Effetto della stimolazione delle fibre gamma sulla scarica delle fibre
fusali afferenti.
(Da C.L. Hunt e S.W. Kuffler,1. PhysioL, 113:298, 1951).
sta precisa a questa domanda difficile alla luce delle nostre attuali
conoscenze. I motoneuroni gamma sono sotto il controllo dei
centri superiori e, prima di tutto, della sostanza reticolare. Appare
quindi logico pensare che essi entrino in funzione in molteplici
condizioni e con funzioni diverse. Premesso questo, una funzione
del sistema gamma appare chiara quando si considera cosa avviene
durante i movimenti. Allorch il muscolo si contrae, il fuso per
l'accorciamento del muscolo si affloscia e la scarica lungo le fibre
afferenti dovrebbe ridursi o cessare del tutto (vedi esperimento
della Fig. 6-4). La presenza del sistema gamma permette al fuso di
funzionare anche quando il muscolo accorciato, mantenendo cos,
mediante le sue fibre afferenti, una scarica nei motoneuroni cui
queste fibre arrivano. E' interessante notare che in animali pi pri-
mitivi dei mammiferi, come ad es. gli anfibi, i motoneuroni che in-
nervano le fibre extrafusali, mandano collaterali anche ai fusi, per
cui, ogni qualvolta il muscolo si contrae, si contrae anche il fuso.
Questo sistema di innervazione dei due tipi di fibre muscolari ha lo
svantaggio di una minore flessibilit rispetto a quello dei mammiferi,
in cui le fibre a e y possono essere attivate indipendentemente, ma
esso indica che il principio di base dei due sistemi una loro
coattivazione. Tale coattivazione stata dimostrata anche nei
mammiferi. Si trovato infatti che la scarica nelle fibre Ia prove-
niente dai muscoli inspiratori non inferiore, durante l'inspirazio-
ne, a quella presente durante l'espirazione. Qualora si blocchi il si-
stema gamma la scarica invece presente solo durante l'espirazio-
ne, quando cio i muscoli inspiratori sono stirati.
79
7) TRASMISSIONE SINAPTICA
Per trasmissione sinaptica si intende il passaggio di segnali da
una cellula nervosa ad un'altra o da una cellula nervosa ad una fi-
bra muscolare. Studieremo inizialmente la tramissione neuromu-
scolare, prendendo come esempio il muscolo striato, e poi la tra-
smissione sinaptica nel sistema nervoso centrale.
Sinapsi neuromuscolare
Dal punto di vista morfologico la struttura della sinapsi neuro-
muscolare o placca motrice consta di una parte presinaptica, di
una parte postsinaptica e di una fessura posta tra le due parti. La
figura 7-1 mostra la sinapsi muscolare a due ingrandimenti diversi.
Nella parte a sinistra della figura si riconoscono i vari componenti
della sinapsi.
La parte presinaptica formata dalle terminazioni degli assoni
dei nervi di moto. Esse prima di raggiungere il muscolo si suddivi-
dono pi volte, perdono la guaina mielinica ed, infine, l'assone
mielinico si innicchia nel sarcoplasma della fibra muscolare dando
luogo ai bottoni sinaptici (fig. 7-1). Nonostante lo stretto contatto
tra fibra nervosa e fibra muscolare le membrane cellulari, nervosa e
muscolare, mantengono la loro identit e sono separate dalla fes-
sura sinaptica, larga da 200 a 500 A. La struttura interna della ter-
minazione nervosa presenta una serie di organuli. Questi sono: mi-
tocondri, neurofilamenti, un reticolo endoplasmatico agranulare e
le cosiddette vescicole sinaptiche. Queste ultime contengono ace-
tilcolina. La parte postsinaptica caratterizzata da una serie di
80 81
Fig. 7.1 - Basi morfologiche della sinapsi neuromuscolare.
(Da S.W. Kuffler and J.G. Nicholls, From neuron to brain; Sunderland, Mas-
sachusetts, 1976).
invaginazioni (Fig. 7-1) della membrana postsinaptica che creano,
aprendosi nella fessura sinaptica, un notevole aumento dello spazio
tra le membrane pre e postsinaptica. Con la tecnica del congela-
mento del materiale istologico e successivo spezzamento del mate-
riale congelato ("freeze-fracturing technique") si potuto appro-
fondire la struttura della membrana postsinaptica. Usando questa
tecnica si riesce a spezzare la membrana postsinaptica in due fo-
glietti di cui l'esterno resta a contatto con la membrana presinapti-
ca, mentre l'interno, esposto, pu venire studiato al microscopio
elettronico. Sulla superficie di questo foglietto si nota un addensa-
mento di particelle che diminuisce mano a mano che si allontana
dalla regione sinaptica. Queste particelle dovrebbero essere i
recettori per l'acetilcolina, cio quelle particelle su cui si fissa
l'acetilcolina liberata dalle vescicole.
Se si registra extracellularmente dal nervo di moto e contem-
poraneamente dalla fibra muscolare si vede che, nei vertebrati, ad
ogni potenziale d'azione nel nervo corrisponde un potenziale d'a-
zione nella fibra muscolare che si propaga in entrambe le direzioni
verso i tendini. La sinapsi neuromuscolare quindi una sinapsi in
cui a differenza di quelle del sistema nervoso centrale non v' un
processo di integrazione (vedi sotto), ma in cui un comando nervo-
so si trasforma in un comando per la contrazione muscolare.
Come f il potenziale d'azione a passare dalla fibra nervosa
alla fibra muscolare? Il processo si svolge con la mediazione di un
processo di secrezione. L'arrivo del potenziale d'azione ai bottoni
terminali libera una sostanza chimica (mediatore), questa si fissa
sulla membrana postsinaptica e determina delle modificazioni nelle
propriet elettrochimiche della membrana postsinaptica che alla fi-
ne causano la nascita di un potenziale d'azione nella fibra muscola-
re.
Il mediatore chimico della sinapsi neuromuscolare l'acetilco-
lina. Le prove di questo fatto sono molteplici e possono essere cos
riassunte: 1) l'acetilcolina presente nelle terminazioni presinapti-
che; 2) l'acetilcolina si trova nel liquido di perfusione dopo stimo-
lazione del nervo di moto. Ci difficile da dimostrare in condi-
zioni fisiologiche, ma diventa relativamente semplice se si blocca
con eserina l'acetilcolinesterasi. Facendo cos si impedisce la degra-
dazione della acetilcolina in colina ed acido acetico e si ottiene un
accumulo del mediatore; 3) l'acetilcolina non un catabolita mu-
scolare. Essa presente nel liquido di perfusione dopo stimolazio-
ne del nervo anche se si impedisce la contrazione del muscolo
usando farmaci paralizzanti come ad esempio il curaro. Viceversa
l'acetilcolina assente nel liquido di perfusione se si fa contrarre,
stimolandolo elettricamente, un muscolo denervato; 4) l'acetilco-
lina determina la contrazione del muscolo quando applicata me-
diante una micropipetta alla placca muscolare. Per applicare l'ace-
tilcolina in un punto localizzato si avvicina la micropipetta, riempi-
ta di acetilcolina, alla membrana e si fa passare attraverso la pipetta
una breve corrente. Questa determina la fuoriuscita di ioni ace-
tilcolina, ioni carichi positivamente.
Tralasciamo per il momento di descrivere il meccanismo di li-
Guaina rnielinica
82
83
berazione dell'acetilcolina e vediamo invece come essa agisce sulla
membrana postsinaptica. L'acetilcolina una volta liberata nella fes-
sura sinaptica, diffonde e si fissa sui recettori della membrana post-
sinaptica. Questi recettori sono delle glicoproteine il cui peso mo-
lecolare si aggira tra 250.000 e 300.000. Essi sono stati isolati
sfruttando l'affinit che hanno per certe sostanze presenti nei veleni
di serpenti come ad es. l'a-bungarotossina. L'a-bungarotossina,
marcata con sostanze radioattive, viene posta in contatto con la si-
napsi e si fissa sui recettori formando un complesso recettore-tossina
assai stabile. Questo complesso pu essere isolato e studiato chi-
micamente.
E' stato dimostrato col metodo della iontoforesi che, in condi-
zioni fisiologiche, i recettori per l'acetilcolina sono localizzati nella
membrana postsinaptica, mentre la membrana muscolare extrasi-
naptica ne virtualmente priva. Se si applica la collagenasi (un en-
zima) alla sinapsi si pu staccare la membrana postsinaptica da
quella presinaptica senza arrecarle alcun danno. Dopo aver scollato
le due membrane si applica l'acetilcolina alla membrana postsinap-
tica ed alla membrana muscolare immediatamente adiacente. Fa-
cendo questo si trova che allontanando la pipetta di soli 2 p dal
bordo sinaptico la risposta elettrica all'acetilcolina inferiore da
50 a 100 volte di quella che si ottiene quando il mediatore viene
applicato sulla membrana sinaptica.
I recettori per l'acetilcolina, oltre all'affinit per i veleni di ser-
pente, hanno affinit anche per altre sostanze. Tra queste impor-
tante ricordare il curaro, una sostanza vegetale, usata come miori-
lassante in chirurgia. Il curaro agisce fissandosi ai recettori ed im-
pedendo cos la fissazione delle molecole di acetilcolina (azione
competitiva).
L'acetilcolina una volta legata ai recettori causa una catena di
fenomeni. I l primo di questi causato direttamente dal mediato-
re, gli altri ne sono una conseguenza. I fenomeni sono: 1) aumento
della permeabilit della membrana postsinaptica agli ioni sodio e
potassio; 2) Nascita di un potenziale elettrico: il potenziale di plac-
ca; 3) Trasmissione elettrotonica di questo potenziale a punti della
membrana adiacenti a quelli chimicamente eccitabili; 4) Aumento
in questi punti della permeabilit della membrana al Na'; 5) Nasci-
ta del potenziale d'azione.
L'aumento della permeabilit della membrana al sodio ed al
potassio un fenomeno di breve durata (circa 2 msec). La sua bre-
vit dovuta al fatto che l'acetilcolina che si fissata ai recettori
se ne stacca rapidamente in quanto la sua concentrazione nella fes-
sura sinaptica diminuisce rapidamente sia per diffusione che per i-
drolisi dovuta all'acetilcolinesterasi. La dimostrazione che l'aumen-
to della permeabilit della membrana riguardo gli ioni Na' e K'
stata data colla metodica del blocco di voltaggio (vedi capitolo 4) e
con la sostituzione degli ioni verosimilmente interessati con altri
ioni. E' stato trovato che, sotto l'azione dell'acetilcolina, il poten-
ziale d'equilibrio della membrana tra - 10 e - 20 mV, grossolana-
mente quindi a met strada tra il potenziale di equilibrio del Ne
e del K
+
(in realt il Ne lievemente favorito).
L'aumento simultaneo della permeabilit per il Ne ed il K' de-
polarizza la membrana, nasce quindi il potenziale di placca. Il po-
tenziale di placca incomincia a registrarsi circa 0,5 msec dopo che
le terminazioni presinaptiche sono state invase dal potenziale d'a-
zione. Questo ritardo il vero ritardo sinaptico ed dovuto al pro-
cesso chimico che interviene tra processi elettrici presinaptici e
postsinaptici. Il potenziale di placca a differenza del potenziale
d'azione non il risultato di un processo rigenerativo. Esso non se-
gue la legge del tutto o nulla, graduabile con un'ampiezza che di-
pende dalla quantit di acetilcolina, si propaga con decremento.
Quando il potenziale di placca depolarizza la membrana a - 50
mV nasce il potenziale d'azione. In condizioni fisiologiche l'am-
piezza del potenziale di placca conseguente ad un singolo impulso
nervoso largamente sufficiente a fare nascere un potenziale d'a-
zione. Ci spiega il rapporto I a 1 tra potenziali d'azione pre- e
postsinaptici nella sinapsi neuromuscolare.
Se si applica alla sinapsi neuromuscolare del curaro si riduce
l'ampiezza del potenziale di placca al di sotto del valore soglia per
il potenziale d'azione. Si pu studiare cos il suo decorso tempora-
84 85
0 5 10 15 20 msec.
Fig. 7.2 - Potenziali di placca registrati a varia distanza dalla sinapsi neuromu-
scolare.
(Da P. Fatt and B. Katz, J. Physiol. 115: 320, 1951).
le e la sua propagazione spaziale. La Fig. 7-2 illustra questo esperi-
mento. In ascissa rappresentato il tempo, in ordinata l'ampiezza
del potenziale. La curva O mostra il potenziale di placca registrato
in corrispondenza della sinapsi. Si vede che il potenziale raggiunge
il suo apice in circa 2 msec (periodo durante il quale l'acetilcolina
fissata ai recettori), e poi decade lentamente per le propriet di
cavo della membrana. Le altre curve mostrano che, a breve distan-
za dalla placca, il potenziale fortemente diminuito. I numeri
sopra le curve indicano la distanza dell'elettrodo registrante dalla
placca in mm. Ci prova che ci troviamo di fronte ad un potenziale
"non-propagato".
Il potenziale di placca non ha periodo refrattario. Se in un ani-
male parzialmente curarizzato un impulso nervoso si succede dopo
breve tempo a uno precedente le due depolarizzazioni si possono
sommare e raggiungere il livello soglia per la nascita del potenziale
d'azione.
Per comprendere come nasce dal potenziale di placca il poten-
ziale di azione occorre avere in mente un modello della membrana
in cui questa divisa in due settori: uno la cui permeabilit con
trollata dalla differenza di potenziale tra esterno ed interno; il se-
condo la cui permeabilit controllata dall'acetilcolina. Una volta
nato il potenziale di placca nel settore controllata dall'acetilcolina
esso si propaga elettrotonicamente al settore sensibile alle varia-
zioni di potenziale e ne causa la depolarizzazione. La depolarizza-
zione aumenta la permeabilit della membrana al Na' e come
conseguenza finale nasce il potenziale d'azione. Questo processo fi-
nale identico a quello descritto nella parte concernente la pro-
pagazione del potenziale d'azione.
Resta da vedere come viene secreta l'acetilcolina. Da quanto
stato detto prima evidente che il processo secretivo avviene con
molta rapidit. Com' possibile questo? La spiegazione sta nel fatto
che il mediatore chimico gi presente nelle terminazioni nervose,
dove avviene la sintesi dell'acetilcolina; esso viene solo liberato
dall'arrivo dell'impulso nervoso.
Fatt e Katz hanno osservato che, a riposo, senza che vi siano
potenziali d'azione si registrano in corrispondenza della membrana
postsinaptica dei potenziali della grandezza di 0,5 mV. Queste
piccole depolarizzazioni chiamate potenziali di placca in miniatura
hanno un decorso temporale simile ai veri potenziali di placca. Essi
compaiono casualmente e non si registrano nella membrana al di
fuori della parte sinaptica.
La figura 7-3 mostra i risultati di una registrazione intracellu-
lare in corrispondenza della placca motrice (A) e a 2 mm dal suo
bordo (B). I tracciati superiori in A mostrano i potenziali di placca
in miniatura. Questi sono assenti in B. I tracciati inferiori (registra-
zioni a pi elevata velocit e minore amplificazione) fanno vedere
il potenziale d'azione. Questo in A preceduto da un potenziale di
placca, in B v' il solo potenziale d'azione. E' chiaro quindi che i
potenziali di placca in miniatura come il potenziale di placca
conseguente all'arrivo di un potenziale d'azione presinaptico, si
registrano solo in corrispondenza della sinapsi.
I potenziali di placca in miniatura sono dovuti a liberazione
spontanea di acetilcolina. Le prove che essi siano dovuti a questi
mediatori sono le segenti: 1) i potenziali di placca in miniatura
86 87
A B
Fig. 7.3 - Potenziali di placca in miniatura.
(Da P. Fatt e B. Katz, J. PhysioL, 117:109, 1952).
non vengono pi osservati dopo taglio e degenerazione dei nervi di
moto; 2) essi sono aboliti se l'animale viene curarizzato; 3) essi
sono potenziati dalla somministrazione di eserina e di altri inibitori
dell'acetilcolinesterasi.
Un fatto che colp Katz ed i suoi collaboratori fu la costanza
dell'ampiezza dei potenziali in miniatura (vedi Fig. 7-3). Occasio-
nalmente si possono osservare anche potenziali di placca in minia-
tura pi grandi, ma essi sono invariabilmente multipli del potenziale
singolo. Questi dati hanno fatto avanzare l'ipotesi della secrezione
quantica dell'acetilcolina. Secondo questa ipotesi l'acetilcolina si
libera nella fessura in quantit fisse, in pacchetti contenenti sempre
la stessa quantit di mediatore. I potenziali in miniatura pi
grandi sono dovuti alla liberazione casuale di pi pacchetti di
quntit fissa. Applicando acetilcolina col metodo iontoforetico si
pu dimostrare che la quantit di acetilcolina necessaria per pro-
durre il potenziale di placca in miniatura oscilla tra i 10.000 ed i
40.000 ioni. Questa anche la quantit di acetilcolina contenuta
in una singola vescicola. I l potenziale in miniatura compare
quando una vescicola urta casualmente contro la membrana presi-
naptica e libera il suo contenuto nella fessura sinaptica.
Cosa succede quando arriva l'impulso nervoso? L'ipotesi pi
accettata che l'impulso nervoso acceleri il processo di secrezione
spontanea di acetilcolina. Invece di una perdita dovuta a movimenti
casuali della vescicola nel tratto terminale si ha una fuoriuscita
simultanea di alcune centinaia di vescicole. In altre parole un po-
tenziale di placca sarebbe la conseguenza di un aumento di per-
meabilit della membrana presinaptica alle vescicole durante la sua
depolarizzazione.
Le prove in favore di un tale meccanismo sono le seguenti: 1)
se si depolarizzano le terminali c' un aumento della secrezione
dell'acetilcolina. Se si usa un assone avvelenato con tetrodotossi-
na, sostanza che blocca elettivamente la nascita del potenziale di
azione (vedi Capitolo 4), si pu depolarizzare le terminali anche
per valori che normalmente farebbero nascere il potenziale d'a-
zione e verificare cos la relazione tra depolarizzazione e aumento
di acetilcolina per una vasta gamma di depolarizzazione. 2) se si
riduce la concentrazione di ioni calcio o si aggiungono ioni ma-
gnesio al liquido di perfusione si osserva che il potenziale d'azione
presinaptico decresce e che la riduzione avviene per quantit fisse
pari ad un quanto di acetilcolina o suoi multipli. Si pu giungere,
aumentando la concentrazione di Mg
++
, al punto che l'arrivo di un
potenziale d'azione presinaptico causa a livello postsinaptico la na-
scita di un potenziale di placca piccolo come il potenziale di placca
in miniatura.
Sulla base di questi dati Katz e Miledi hanno proposto che la
depolarizzazione abbia come primo effetto un aumento della per-
meabilit della membrana al calcio. Questo entrando nelle termi-
nali formerebbe dei complessi colle vescicole o comunque farebbe
scattare un processo per cui le vescicole riescono a fuoriuscire fa-
cilmente dal bottone terminale. Mentre vi sono buone prove che la
depolarizzazione delle terminali aumenti la permeabilit del Ca
++
e
questi entri nell'assone, la seconda parte del fenomeno non del
tutto chiarita. L'azione antagonista del Mg
++
spiegata con un'a-
zione competitiva col Ca
++
Per concludereinteressantenotareche comeesistono dei ve
88 89
len che bloccano la sinapsi neuromuscolare postsinapticamente, e-
sistono dei veleni che la bloccano presinapticamente, impedendo la
liberazione di acetilcolina. Tra questi da ricordare la tossina
botulinica, prodotto dal clostridium botulini, un germe anaerobi-
co causa non rara di gravissime intossicazioni alimentari.
8) TRASMISSIONE SINAPTICA
NEL SISTEMA NERVOSO CENTRALE
Alla fine del secolo scorso era prevalente l'idea che il sistema
nervoso fosse formato da un reticolo diffuso di cui i neuroni fosse-
ro i nodi. Secondo tale concezione i prolungamenti dei singoli
neuroni si continuavano nel soma di quelli adiacenti dando cos
una effettiva unit anatomica alla rete nervosa. Fondamento
della moderna neurofisiologia al contrario la teoria che considera
il neurone come l'unit funzionale del sistema nervoso. I neuroni
sono in contatto tra di loro, ma ci avviene attraverso parti specia-
lizzate delle loro membrane: le sinapsi, e il loro rapporto prevalente
quello della contiguit e non quello della continuit.
La teoria del neurone si basa su quattro postulati:
1) Il neurone un'unit genetica. L'individualit dei neuro-
blasti stato uno degli argomenti pi antichi contro l'idea della rete
diffusa.
2) Il neurone un'unit trofica. La prova della veridicit di
questo postulato si ha esaminando gli effetti del taglio dei nervi. Se
un assone viene sezionato si osserva che la parte a valle degenera fino
al prossimo neurone, ma la degenerazione non si estende al di l delle
sinapsi. Questa degenerazione prende il nome di degenerazione
anterograda. (In alcuni casi si pu avere una degenerazione anche
oltre la sinapsi - degenerazione transneuronica -. Queste eccezioni
non tolgono per validit alla legge generale). A monte dello assone
tagliato compare una serie di modificazioni come ad es. la
cromatolisi e lo spostamento del nucleo in posizione eccentrica
(degenerazione retrograda). Nonostante ci non v' alcun danno
90 91
nelle fibre presinaptiche che terminano sul neurone leso e la con-
duzione in esse normale anche quando le risposte del neurone di-
ventano patologiche o scompaiono del tutto.
3) Il neurone un'unit anatomica. Questo postulato potreb-
be essere dedotto dai due precedenti. In realt esso stato formu-
lato per asserire una discontinuit citoplasmatica tra cellula e cellu-
la, una completa separazione tra neuroni dovuta alla presenza delle
membrane cellulari e di una fessura tra di esse. I recenti progressi
nella conoscenza delle sinapsi, dovuti alla microscopia elettronica,
hanno confermato nelle linee generali tale assunto; essi hanno mo-
strato per anche che esistono dei neuroni che hanno le membra-
ne cellulari fuse (tight junctions) e che esistono delle sinapsi attra-
versate da ponti protoplasmatici.
4) Il neurone un'unit funzionale. Questo significa che un
determinato neurone non influenzato dagli eventi elettrici che si
verificano nelle cellule adiacenti. Ogni neurone elabora l'informa-
zione che gli arriva dai neuroni a monte e la trasmette ai neuroni
posti a valle.
Problema centrale per la teoria del neurone la spiegazione
della capacit che le cellule hanno di comunicare le une con le al-
tre nonostante la discontinuit che esiste tra le loro superfici. La
comunicazione tra le cellule avviene solo in regioni particolarmente
differenziate chiamate sinapsi e mediante complessi meccanismi di
trasmissione. Vediamo innanzitutto come si classificano le sinapsi
nel sistema nervoso centrale. A seconda delle parti cellulari che
vengono in contatto esse possono essere distinte in tre classi
fondamentali: sinapsi asso-somatiche, sinapsi asso-dendritiche e si-
napsi asso-assoniche.
Le sinapsi possono venire anche classificate in base agli organuli
submicroscopici in esse presenti e l'aspetto della loro membrana. La
classificazione qui sotto riportata si basa su queste caratteristiche.
1) Sinapsi prive di vescicole
Tipo di tramissione: elettrico. Base morfologica: "gap junctions"
A) Topografia convenzionale B) Topografia non-convenzionale
a) asso-dendritiche a) dendro-dendritiche
b) asso-somatiche b) dendro-somatiche
c) asso-assoniche e) somato-somatiche
2) Sinapsi con vescicole
Tipo di trasmissione: chimico. Base morfologica: presenza di una
larga fessura sinaptica
A) Topografia convenzionale B) Topografia non-convenzionale
a) asso-dendritiche, di solito a) dendro-dendritiche
con vescicole sferiche, si-
napsi di tipo I
b) asso-somatiche, di solito b) asso-dendro-dendritiche
con vescicole piatte, si-
napsi di tipo II
c) asso-assoniche c) altri tipi
L'articolo di Bodian da cui tratta questa classificazione si in-
titola "Giunzioni nervose: una decade rivoluzionaria". Il titolo e-
sprime bene il mutamento nel concepire le sinapsi che ha avuto
luogo negli ultimi anni. Si passati da un'idea della sinapsi centrale
modellata su quella della placca neuromuscolare ad una concezione
delle sinapsi centrali molto pi complessa e varia. Per i fini della
nostra trattazione tratteremo solo alcuni tipi di sinapsi e di
trasmissione sinaptica. Precisamente quelle che nella nomenclatura
di Bodian sono chiamati di topografia convenzionale.
Trasmissione sinaptica elettrica
Nel suo libro Nervo, Muscolo e Sinapsi, Katz esamina se la tra-
smissione sinaptica elettrica sia in teoria possibile. Egli assume che
la resistenza elettrica delle membrane postsinaptiche sia identica
alla resistenza delle membrane cellulari note e per semplicit con-
92 93
sidera che la membrana presinaptica e quella postinaptica siano
giustapposte formando un setto. Facendo gli opportuni calcoli egli
dimostra che per una fibra presinaptica di 5 la quantit di cor-
rente depolarizzante che attraversa il setto formato dalle membrane
inferiore all' 1
0
/o della corrente presinaptica. Tale attenuazione
non permetter mai la nascita di un potenziale d'azione al di l della
sinapsi. Nella realt la situazione ancora peggiore in quanto la
corrente depolarizzante nel trasmettersi postsinapticamente
trova non solo l'alta resistenza della membrana postsinaptica, ma
anche la fessura sinaptica contenente del liquido. Questo liquido
ricco di sali cortocircuiti la corrente diminuendo ulteriormente la
quantit di essa che arriva alla membrana postsinaptica. Da questi
calcoli chiaro che una sinapsi con struttura e propriet di mem-
brana simili a quella della placca neuromuscolare non permette
una trasmissione elettrica cio una trasmissione senza un mediato-
re chimico.
Sinapsi tuttavia che permettono una trasmissione elettrica
sono state ripetutamente descritte in questi ultimi anni e parecchie
nozioni sono state acquisite sulla loro struttura. La trasmissione si-
naptica elettrica stata dimostrata per la prima volta al di l di o-
gni dubbio da Furshpan e Potter studiando, in un crostaceo, la
propriet di una sinapsi asso-assonica. Essi inserirono elettrodi re-
gistranti e elettrodi stimolanti sia nella fibra presinaptica che in
quella postsinaptica. Essi videro che stimolando la parte presinapti-
ca nascevano potenziali d'azione che si trasmettevano alla parte
postsinaptica senza ritardo. Ci significava che la trasmissione de-
gli impulsi era dovuto ad un flusso di corrente elettrica e non alla
liberazione di un mediatore chimico. Come gi sappiamo la secre-
zione dei mediatori porta via del tempo.
La sinapsi studiata da Furshpan e Potter non permetteva la tra-
smissione in senso antidromico, dalla parte postsinaptica alla parte
presinaptica. Infatti la stimolazione della fibra postsinaptica faceva
nascere dei potenziali d'azione che non si propagavano alla parte
presinaptica. Questa sinapsi aveva quindi la propriet di "valvola"
che permette il decorso degli impulsi in una sola direzione.
Sinapsi elettriche sono state dimostrate successivamente nel si-
stema nervoso di molte specie di invertebrati e vertebrati e recente-
mente anche nei mammiferi. Alcune sinapsi elettriche hanno pro-
priet simile a quella della sinapsi ora descritta, altre trasmettono
gli impulsi nervosi in entrambe le direzioni.
Per le considerazioni esposte all'inizio di questa sezione ovvio
che le propriet morfologiche delle sinapsi elettriche devono essere
diverse da quelle delle sinapsi chimiche. Le caratteristiche morfolo-
giche essenziali delle sinapsi elettriche sono: a) assenza di vescico-
le nei bottoni terminali; b) stretta vicinanza delle membrane sinap-
tiche. Invece di una fessura di circa 200 A quale si osserva nelle si-
napsi chimiche, in esse vi una fessura tra le membrane di circa 20
o
A. Questi luoghi di apposizione tra le membrane appaiono al mi
croscopio elettronico come placche lievemente tondeggianti e ven-
gono chiamate `gap junctions". Il fatto che tali "gap junctions"
sono frequenti nel sistema nervoso di topi, ratti, gatti e scimmie f
pensare che le sinapsi elettriche, anche se funzionalmente spesso
ancora non dimostrate, siano frequenti in questi animali e quindi
anche nell'uomo.
Quale pu essere la funzione delle sinapsi elettriche? Per ora
non v' alcun schema concettuale del sistema nervoso in cui esse
abbiano un ruolo particolare. Basandosi sulle loro propriet si pu
solo fare osservare che esse sono pi rapide delle sinapsi chimiche
e che in certe condizioni anche 0,5 msec possono essere utili per
sfuggire ad es. ad un pericolo. Le sinapsi elettriche infine sono me-
no sensibili delle sinapsi chimiche alle sostanze chimiche e quindi
anche a sostanze tossiche.
Trasmissione sinaptica chimica
Le propriet generali della trasmissione sinaptica chimica sono
state esposte in dettaglio parlando della trasmissione neuromusco-
lare. La differenza principale tra la trasmissione sinaptica neuro-
muscolare e quella centrale sta nel fatto che la prima ha funzioni
di relay, cio di trasmettere sicuramente e rapidamente l'impulso
nervoso ad un certo numero di fibre muscolari, la seconda ha fun-
94
95
zioni di integrazione. Questa integrazione risulta da differenze
quantitative e qualitative che esistono tra la trasmissione centrale e
quella neuromuscolare. La differenza quantitativa consiste nel fatto
che praticamente senza eccezioni ogni neurone del sistema nervoso
centrale riceve molte fibre nervose. Perch nasca un potenziale
d'azione occorre, in genere, che pi fibre vengano eccitate o,
alternativamente, che una stessa fibra spari pi volte. In altre paro-
le la membrana del neurone centrale deve sommare pi messaggi
prima che il potenziale d'azione nasca. La differenza qualitativa
consiste nel fatto che mentre le fibre che arrivano ai muscoli sche-
letrici sono, nei vertebrati, tutte eccitatorie, le fibre che arrivano ai
neuroni centrali possono essere o eccitatorie o inibitorie.
L'80
/o delle sinapsi centrali sono rappresentate da sinapsi del
tipo I o del tipo II di Gray. La sinapsi di tipo I in genere asso-
dendritica ed funzionalmente una sinapsi eccitatoria. Essa ca-
ratterizzata da vescicole sferiche (Fig. 8-1, A). La sinapsi di tipo II
Fig. 8.1 - Rappresentazione schematica di vari tipi di sinapsi.
(Modificato da D. Bodian, Anat. Rec. 174:73, 1972).
e generalmente asso-somatica ed inibitoria. Le sue vescicole sono
piatte (Fig. 8 1, B). La figura 8-1 mostra anche una sinapsi elettri-
ca (gap junction; C) e una mista (D). Le frecce indicano la direzio-
ne in cui passano gli impulsi nervosi. La sinapsi elettrica della fi-
gura non ha la propriet di fare da valvola. Questa propriet
sempre presente nelle sinapsi chimiche.
Potenziali postsinaptici eccitatori (EPSP)
Le nostre conoscenze sulle sinapsi dei neuroni centrali sono
dovute principalmente ai lavori di Eccles sui motoneuroni di gatto.
Eccles fu il primo infatti a sfruttare a fondo la tecnica della regi-
strazione intracellulare nello studio del sistema nervoso dei
mammiferi. L'esperimento di base il seguente: si introduce un
microelettrodo nell'interno di un motoneurone e si pongono degli
elettrodi stimolanti sulle fibre che ad esso arrivano dai fusi neuro-
muscolari.
La figura 8-2 mostra i risultati dell'esperimento. Si vede che la
stimolazione delle fibre afferenti determina la crescita nel moto-
neurone di una depolarizzazione (tracciato inferiore dei due mo-
strati sotto ogni lettera). Questa depolarizzazione chiamata po-
Fig. 8.2 - Potenziali postsinaptici eccitatori registrati da motoneuroni spinali.
(Da J.C. Eccles, R.M. Eccles and A. Lundberg, J. Physiol. /36:517-546,1957).
B
96
97
tenziale postsinaptico eccitatorio EPSP (excitatory post-synaptic
potential). L'ampiezza del potenziale postsinaptico cresce coll'au-
mentare dell'intensit della stimolazione (vedi figura; il tracciato
superiore sotto ogni lettera rappresenta il neurogramma della
radice dorsale: un'onda maggiore significa stimolazione pi forte),
mentre la sua forma (tempo di salita e tempo di discesa) non
cambia. Se l'EPSP supera una certa ampiezza nasce il potenziale
d'azione. Questo evento non mostrato in figura.
L'EPSP ha le stesse propriet del potenziale di placca (vedi
cap. 7). Per quanto riguarda le modificazioni ioniche che lo deter-
minano si ammette che, come per il potenziale di placca, l'EPSP
sia dovuto ad un aumento della permeabilit della membrana per
gli ioni Na
+
e K
+
causato dal mediatore chimico. L'entrata del Na'
nell'interno del neurone depolarizza la membrana, ma poich v'
una simultanea uscita del K
+
non si ha l'inversione di polarit che
caratterizza il potenziale d'azione. Il potenziale postsinaptico si
propaga elettrotonicamente alla membrana cellulare adiacente al
punto della sua origine. La depolarizzazione elettrotonica aumenta
la permeabilit della membrana al Na
+
e se la depolarizzazione su-
pera la soglia nasce il potenziale d'azione. In condizioni normali
esso origina in corrispondenza del monticolo o segmento iniziale
del neurone. Basta depolarizzare il monticolo di 15 mV per avere
la nascita del potenziale d'azione.
Usando la tecnica della registrazione intracellulare si potuto
stabilire il tempo che viene perso nella trasmissione sinaptica chi-
mica nel sistema nervoso centrale. Il ritardo sinaptico precisa-
mente il tempo che intercorre tra l'arrivo del potenziale d'azione
alle terminazioni sinaptiche e la comparsa dell'EPSP. I valori pi
bassi di ritardo sinaptico sono dell'ordine di 0,2 msec. Altro tempo
perduto tra il momento della comparsa dell'EPSP e quello della
nascita del potenziale d'azione in quanto la depolarizzazione gra-
duale e non arriva subito al livello critico per la nascita del poten-
ziale d'azione. Il ritardo chiamato ritardo nucleare la somma del
ritardo sinaptico e del tempo di risposta postsinaptico. Il ritardo
centrale di un riflesso (chiamato anche tempo latente centrale) la
somma del ritardo nucleare e del tempo di conduzione centrale.
Potenziali postsinaptici inibitori (IPSP)
Registrando intracellularmente dai motoneuroni del midollo
spinale Eccles e i suoi collaboratori dimostrarono che nei moto-
neuroni compare un aumento della polarizzazione della membrana
quando si stimolano le fibre nervose che eccitano i motoneuroni
antagonisti a quelli da cui si effettua la registrazione. Questo po-
tenziale prende il nome di IPSP (inhibitory post-synaptic poten-
tial). La sua azione inibitoria in quanto, aumentando la differenza
di potenziale tra l'esterno e l'interno, il raggiungimento della
soglia per la nascita del potenziale d'azione diventa pi difficile.
Potenziali postsinaptici inibitori sono mostrati nella figura 8-3:
L'esperimento analogo a quello della Fig. 8-2, solo che in questo
caso i nervi stimolati provengono da muscoli antagonisti rispetto a
quelli innervati dal motoneurone da cui si registra. Si pu vedere
dalla figura come gli IPSP siano dei potenziali graduati. Analoga-
mente agli EPSP essi esercitano la loro azione elettrotonicamente.
Il potenziale postsinaptico inibitorio compare se il potenziale
di riposo di - 70 mV. Se il potenziale di membrana viene portato
a valori negativi superiori a - 80 mV, la stimolazione dei nervi che
Fig. 8.3 - Potenziali postsinaptici inibitori registrati da motoneuroni spinali.
(Da D.R. Curtis and J.C. Eccles, J. Physiol. 145:529-546, 1969).
fanno nascere l'IPSP determina invece una depolarizzazione. Ci
significa che il potenziale d'equilibrio per l'IPSP si trova tra i -90
mV del potenziale d'equilibrio del K. ed i -70 mV del Cl. Si per-
tanto concluso che il mediatore chimico inibitorio aumenti la per-
meabilit della membrana simultaneamente agli ioni K. e Cl-. Gli
ioni Na' non interverrebbero nel processo.
Non si conosce con certezza quale sia il mediatore chimico re-
sponsabile dell'inibizione nei motoneuroni spinali. Certe sostanze
come la glicina o il GABA hanno azione inibitoria, ma non vi sono
prove certe che siano essi i mediatori inibitori del midollo spinale.
Si conoscono invece delle sostanze in grado di bloccare l'azione dei
mediatori chimici inibitori sui motoneuroni. Tra queste le pi note
sono la stricnina e la tossina tetanica. Il loro meccanismo verosi-
milmente competitivo, dovuto ad affinit strutturali con i media-
tori chimici inibitori. Della stricnina in particolare stato detto
che il curaro dell'inibizione. La somministrazione di queste so-
stanze antagoniste dei mediatori inibitori causa fenomeni convul-
sivi. E' ovvio che ci dovuto perch i normali processi eccitatori
non sono pi bilanciati dai processi inibitori.
Inibizione presinaptica
Registrando intracellularmente dai motoneuroni del midollo
spinale, Frank e Fuortes osservarono che la stimolazione di fibre af-
ferenti al midollo spinale poteva in certi casi causare la diminuzio-
ne degli EPSP provocati dalla stimolazione di fibre afferenti al mo-
toneurone registrato senza determinare la comparsa di IPSP n mo-
dificare la permeabilit della membrana postsinaptica. In altre pa-
role c'era un'inibizione: i potenziali postsinaptici eccitatori erano
diminuiti, ma non c'era alcun segno di inibizione postsinaptica.
Questo fenomeno stato interpretato come un'inibizione a li-
vello presinaptico. Sono gli impulsi eccitatori presinaptici che di-
ventano meno efficaci nella loro azione. La base morfologica del
fenomeno una sinapsi asso-assonica. Le fibre ad azione inibitoria
terminano sulle terminazioni eccitatorie e ne diminuiscono la
capacit di secernere il mediatore chimico.
L'inibizione presinaptica nei mammiferi un fenomeno relati-
vamente lungo. Stimolando ripetutamente la via afferente inibito-
ria si vede che l'inibizione presinaptica dura oltre 100 msec, rag-
giungendo il massimo del suo effetto dopo circa 20 msec. Eccles
ed i suoi collaboratori sono riusciti a registrare intracellularmente
dalle terminazioni presinaptiche eccitatorie. Essi hanno trovato
che queste terminazioni durante l'inibizione presinaptica sono
depolarizzate. Tale depolarizzazione diventa massima circa 20
msec dopo la stimolazione delle fibre inibitorie e dura per oltre
100 msec. Questi dati indicano che il fenomeno alla base dell'ini-
bizione presinaptica un fenomeno eccitatorio, la depolarizzazio-
ne delle terminali.
Perch allora c' un'inibizione? Per capire questo bisogna ricor-
dare che la quantit di mediatore chimico che si libera in corri-
spondenza delle terminazioni nervose dipende dall'entit della de-
polarizzazione della loro membrana. Se le terminazioni sono gi
depolarizzate la depolarizzazione provocata dall'arrivo del poten-
ziale d'azione sar minore di quella che si ha normalmente e per-
tanto si liberer meno mediatore chimico. Ecco come un processo
eccitatorio pu provocare un effetto finale inibitorio.
I mediatori chimici responsabili dell'inibizione presinaptica
non sono conosciuti. Non v' dubbio per che essi debbano essere
diversi da quelli responsabili dell'inibizione postsinaptica. Infatti, a
parte considerazioni logiche che rendono altamente improbabile
un'identit dei mediatori implicati nei due fenomeni: l'inibizione
postsinaptica un vero processo inibitorio, l'inibizione presinaptica
dal punto di vista elettrico un processo eccitatorio, vi sono prove
sperimentali basate sulle sostanze competitive. L'inibizione presi-
naptica bloccata dalla picrotossina, ma non dalla stricnina, che
come sappiamo blocca l'inibizione postsinaptica. La picrotossina,
come la stricnina, somministrata all'uomo o agli animali determina
fenomeni convulsivi.
100 101
Nascita dei potenziali d'azione nei neuroni centrali
L'idea classica sull'organizzazione sinaptica nei neuroni centrali
era che gli impulsi afferenti arrivassero principalmente ai dendriti,
che in corrispondenza di questi nascessero i potenziali d'azione, che
infine questi si propagassero al soma cellulare e poi all'assone. Le
registrazioni eseguite con elettrodi intracellulari hanno mostrato
che la sequenza degli eventi del tutto diversa. Gli impulsi nervosi
arrivano ai dendriti ed al soma cellulare ma, in condizioni normali, vi
determinano la nascita di potenziali non propagati,eccitatori e
inibitori. Questi esercitano la loro azione mediante correnti
elettrotoniche sul segmento iniziale dell'assone. Qui nasce il poten-
ziale d'azione. La ragione per cui gli impulsi nascono in corrispon-
denza del monticolo che questo il punto ove la membrana ha la
soglia pi bassa per la comparsa del processo rigenerativo. Basta
una depolarizzazione di 10 mV perch scatti questo processo e
quindi nasca il potenziale d'azione.
Il monticolo quindi in un certo senso il centro decisionale del
neurone centrale. I potenziali postsinaptici eccitatori ed inibitori
hanno la funzione di modulare la sua membrana. A questo punto
ovvio che devono esistere delle sinapsi "influenti" e delle sinapsi
"poco influenti". Le sinapsi "influenti" o fuori di metafora pi ef-
ficaci sono quelle poste vicino al monticolo in quanto, data la vici-
nanza ad esso, le correnti elettrotoniche generate dal potenziale
postsinaptico arrivano alla sua membrana; le sinapsi poco "influenti"
saranno quelle lontane in quanto, per la propriet di cavo delle
membrane, solo una frazione della corrente che parte da esse arriva
al monticolo.
Questa suddivisione tra sinapsi efficaci e poco efficaci pone dei
problemi concettuali per quanto riguarda le sinapsi dendritiche. In-
fatti che peso possono avere delle sinapsi, come ad es. quello sullo
albero dendritico delle cellule del Purkinje, quando la loro posizio-
ne in pratica impedisce ogni azione sul monticolo? Una possibilit
che la loro azione sia indiretta. Esse modificano l'eccitabilit della
membrana di punti a loro vicini dendritici e somatici. Questa
modificazione dell'eccitabilit influisce (sommandosi o sottraendo
si) su quella evocata da sinapsi pi vicine al monticolo. In altre pa-
role le sinapsi lontane non riuscendo a comunicare direttamente
col centro decisionale influenzano l'azione di quelle sinapsi che
hanno accesso diretto ad esso. I n certe cellule dell'ippocampo
stato osservato che i potenziali postsinaptici eccitatori dei dendriti
se superano una certa soglia possono dare luogo ad un processo ri-
generativo. Il potenziale che nasce non in grado di propagarsi data
la soglia molto alta dei punti di membrana adiacenti, ma data la sua
ampiezza riesce ad influenzare punti della membrana pi lontani di
un normale potenziale postsinaptico.
I potenziali postsinaptici hanno durata variabile. Essi sono brevi
nei motoneuroni (vedi Fig. 8-2, 8-3) dove la durata degli EPSP ed
IPSP corrisponde alla durata rispettivamente della facilitazione e
inibizione dei riflessi monosinaptici. In altre strutture per come il
talamo o l'ippocampo i potenziali postsinaptici sono molto pi
lunghi, nell'ambito di decine o persino di qualche centinaio di
msec. Questo significa che questi neuroni hanno funzioni integra-
tive maggiori dei motoneuroni.
Per capire meglio il concetto di attivit integrativa del neurone
centrale immaginiamo che ogni neurone sia un centro operativo
cui arrivano vari messaggi. In base alla somma di questi messaggi il
neurone deve decidere se mandare avanti l'informazione o no.
Ogni messaggio assume la forma di un EPSP o di un IPSP e viene
tenuto "in memoria" per un certo periodo di tempo, per il tempo
cio corrispondente alla durata del potenziale postsinaptico. Se un
altro messaggio arriva sulla stessa linea mentre il primo ancora in
memoria si ha una sommazione (sommazione temporale) di due
messaggi, se due messaggi arrivano assieme su due linee diverse si
ha ancora sommazione (sommazione spaziale). Se per effetto di
messaggi inibitori (IPSP) o per la debolezza di quelli eccitatori non
si raggiunge, a livello del monticolo, la soglia per il potenziale d'a-
zione, l'informazione proveniente dalle vie nervose a monte del
neurone centrale non passa attraverso il neurone e viene persa. Se
viceversa gli effetti eccitatori prevalgono il messaggio va avanti nel
sistema nervoso centrale.
102
Un dato interessante trovato colla tecnica intracellulare che il
potenziale d'azione nato nel segmento iniziale si propaga non solo
in senso ortodromico, ma anche in senso antidromico, all'indietro,
invadendo il corpo cellulare. La Fig. 8-4 mostra (tracciato superio-
re) la registrazione intracellulare della risposta di un motoneurone
va cancellata. Questa messa a zero del sistema, il "reset" come vie-
ne chiamato nei calcolatori, dato dall'invasione del potenziale
d'azione del soma cellulare e dei dendriti con la relativa scomparsa
di tutti i potenziali postsinaptici.
103
Fig. 8.4 - Registrazione intracellulare della risposta di un motoneurone ad una
scarica afferente.
(Da J.S. Coombs, J.C. Eccles and D.R. Curtis, J. PhysioL 139:232, 1957).
ad una scarica afferente monosinaptica. Si pu vedere che dopo la
lenta deflessione iniziale che corrisponde all'EPSP, compare il po-
tenziale d'azione. Esso per formato da due porzioni messe chia-
ramente in evidenza nel tracciato inferiore in cui le componenti
del potenziale d'azione sono elettricamente differenziate. La pri-
ma corrisponde al potenziale d'azione nato nel segmento iniziale
(IS), la seconda al potenziale d'azione somato-dendritico (SD).
Questa invasione della porzione somato-dendritica del neurone
logica se si pensa alla funzione integrativa del neurone esposta
prima. Prima che il potenziale d'azione nasca, il neurone "tiene in
memoria" i vari potenziali postsinaptici in attesa di decidere, ma
una volta che la decisione stata presa ed il potenziale d'azione
nato, l'informazione concernente i messaggi precedenti inutile e
9) ORGANIZZAZIONE DEL MIDOLLO SPINALE
Il midollo spinale, come gi stato brevemente descritto nel
capitolo 5, ha una struttura segmentaria. La sua suddivisione in
segmenti (o mielomeri) basata sulla presenza delle radici spinali. In
sezione trasversa si riconosce nel midollo spinale una parte formata
dalla sostanza grigia ed una parte formata dalla sostanza bianca
(Fig. 9-1).
La sostanza grigia ha una forma che somiglia vagamente ad una
H. In essa si riconosce una parte anteriore bilaterale che prende il
nome di corna (o colonne) grigie anteriori, una parte bilaterale
posteriore che prende il nome di corna (o colonne) grigie posterio-
ri ed una parte intermedia. La parte intermedia, dal secondo seg-
mento toracico al primo lombare, d origine ad una estroflessione
bilaterale che prende il nome di corna grigie laterali. I nfine la
sostanza grigia che unisce la met destra con la met sinistra della
sostanza grigia forma la commissura grigia.
La sostanza grigia del midollo spinale non omogenea, ma in
essa si possono distinguere degli addensamenti cellulari che si
estendono longitudinalmente per alcuni segmenti o lungo tutto il
midollo spinale. Questi addensamenti prendono il nome di gruppi
o nuclei delle corna grigie del midollo spinale.
Nelle corna grigie anteriori vi sono tre gruppi cellulari: un
gruppo mediale, un gruppo laterale ed un gruppo centrale. Il grup-
po mediale si estende praticamente per tutti i segmenti midollari
ed in certe porzioni del midollo come ad es. a livello toracico, si
sdoppia in due parti: ventromediale e dorso-mediale (vedi Fig. 9-2)
II gruppo laterale, a sua volta suddivisibile in tre parti, ventrale,
105
107
Fig. 9.1 - Sezione trasversa del midollo spinale a livello toracico.
(Da R. Warwick and P.L. Williams, Gray's Anatomy, Philadelphia, Saunders,
1973).
Fig. 9.2 - Organizzazione della sostanza grigia del midollo spinale. Suddivisio-
ne in nuclei o gruppi neuronali.
(Da R. Warwick and P.L. Williams, Gray's Anatomy, Philadelphia, Saunders,
1973).
dorsale e retrodorsale, contiene i motoneuroni spinali. Il gruppo la-
terale particolarmente sviluppato nei segmenti cervicali (C
4
-C
8
) e
lombo-sacrali (L
2
-S
2
) ove sono presenti i motoneuroni che inner-
vano la muscolatura degli arti. Il gruppo centrale identificabile a
livello cervicale (C
3
-C
7
). Esso prende il nome di nucleo frenico ed
in esso sono localizzati i neuroni che innervano il diaframma. Infi-
ne nella figura, parte tratteggiata, mostrato anche la parte spinale
del n. accessorio. Questa formazione presente nei primi segmenti
cervicali.
Nelle corna grigie posteriori due gruppi cellulari sono presenti
in tutti i segmenti midollari. Il primo prende il nome di sostanza
gelatinosa. Esso formato da neuroni molto piccoli i cui assoni
dopo un decorso pi o meno breve terminano nella sostanza gelati-
nosa stessa. Il secondo gruppo il nucleo proprio. Esso formato
da cellule pi grandi che inviano il loro assone sia ad altre porzioni
del midollo spinale che ai centri sopraspinali. La sostanza gelatino-
sa (vedi Fig. 9-2) separata dalla sostanza bianca da una sottile la-
mina nervosa ove accanto a cellule piccole vi sono neuroni di gran-
de diametro. Questa lamina nervosa prende il nome di zona margi-
nale.
Alla base delle corna grigie posteriori situato il nucleo dorsale
o toracico di Clarke. Nell'uomo esso si estende dall'ottavo mielo-
mero cervicale (C
8
) al quarto lombare (L
4
). I neuroni pi grandi di
questo nucleo danno origine al tratto spino-cerebellare. Lateral-
mente al nucleo toracico v' un nucleo che si pensa abbia funzioni
vegetative. Esso si estende da T
3
a L
3
.
La regione intermedia della sostanza grigia, comprese le corna
grigie laterali, formata da cellule relativamente piccole. Esse rap-
presentano le cellule preganglionari dei sistemi autonomi. Esse
sono riunite in due lunghi nuclei craniali (da C
8
-T
1
fino a L
2
-L
3
) ed
in un nucleo caudale (S
2
-S
3
-S
4
). I due nuclei craniali (vedi Fig. 9-2,
n. intermedio-mediale ed intermedio-laterale) sono la sede dei
neuroni pregangliari del sistema simpatico, il nucleo sacrale la
sede dei neuroni pregangliari del parasimpatico (parasimpatico sa-
crale).
sostanza gelatinosa
nucleo proprio
nucleo toracico
sostanza grigia viscerale
gruppo intermedio laterale
gruppo intermedio mediale
gruppo retrodorsale
gruppo dorsomediale
gruppo dorsolaterale
nucleo frenico
gruppo ventrolaterale
gruppo ventromediale
nucleo accessorio
108
La suddivisione in nuclei, esposta nei paragrafi precedenti,
basata su materiale istologico colorato col metodo di Nissl. Pi di
recente stata proposta una suddivisione del midollo spinale che
tenga conto anche delle connessioni tra cellule nervose. Secondo
questa suddivisione il midollo spinale viene diviso in nove lamine
andando da dorsale a ventrale, pi una centrale. La parcellazione
in lamine non in contrasto con quella in nuclei e permette una
migliore descrizione delle terminazioni delle radici dorsali, dei fasci
discendenti e delle propriet delle cellule poste in varie parti del
midollo. La Fig. 9-3 mostra la suddivisione in lamine proposta da
Fig. 9.3 - Organizzazione della sostanza grigia del midollo spinale.Suddivisione
in lamine. A: quinto segmento lombare; B: terzo segmento toracico.
Rexed e che viene normalmente usata negli studi del midollo spi-
nale.
La lamina I corrisponde alla zona marginale della classificazione
classica. La lamina II e, secondo alcuni autori, parte della lamina
III formano la sostanza gelatinosa. La lamina IV e parte o tutta la
lamina III corrispondono al nucleo proprio. Le prime quattro
lamine ricevono la maggior parte delle fibre esterocettive delle radici
dorsali, con le fibre termiche e dolorifiche concentrate nelle pri
109
me 3 lamine e le fibre che portano la sensibilit tatto-pressione
rappresentate soprattutto nella quarta. Da queste quattro lamine
iniziano i riflessi polisinaptici intra ed intersegmentali.
Le lamine V e VI corrispondono al collo ed alla base delle
corna grigie posteriori. I neuroni della lamina V rispondono a sti-
moli cutanei e si pensa che ricevano afferenze dal IV strato. Dalla
lamina V partono molte delle fibre dei fasci spino-talamici. La la-
mina VI riceve fibre del gruppo I e fibre dalle articolazioni. I suoi
neuroni sono attivati da movimenti articolari (neuroni propriocet-
tivi).
Le lamine VI - VII e VIII sono chiamate da Kuypers la zona
intermedia del midollo spinale per distinguerle dalle prime cinque
lamine, zona sensitiva, e dalla lamina IX che rappresenta la zona
motoria. (La lamina VI , in realt anche sensitiva ricevendo le
vie propriocettive). La zona intermedia d origine al fascio spino-
cerebellare, controlla i movimenti e regola il tono muscolare. Il
controllo sul tono e sui movimenti si esercita mediante le vie pro-
prio-spinali mediante cio vie che partono dalla zona intermedia e
terminano nella lamina I X agendo sui motoneuroni a e y. Nella
zona intermedia si deve distinguere una porzione ventro-mediale
ed una dorso-laterale. La porzione ventro-mediale controlla i mo-
vimenti della muscolatura assiale e di quella prossimale degli arti,
la porzione dorso-laterale quella della muscolatura distale degli
arti. Nella zona intermedia terminano gran parte delle vie discen-
denti (vedi sotto) e, date le propriet degli interneuroni della zona
intermedia, le vie che terminano sulla porzione ventro-mediale
controllano i muscoli del capo, del tronco e della parte prossimale
degli arti, mentre le vie che arrivano alle porzioni dorso-laterali
controllano i movimenti distali. Infine nella lamina VII, nei seg-
menti appropriati, sono contenuti i neuroni che danno origine alle
fibre pregangliari del sistema autonomo.
I motoneuroni a e 'y si trovano, assieme ad interneuroni, nella
lamina IX. Questa lamina organizzata somatotopicamente. I mo-
toneuroni posti pi medialmente innervano i muscoli della colonna
vertebrale. Essi sono in numero praticamente costante nei vari mie-
110
111
lomeri. In contrasto i motoneuroni posti pi lateralmente aumen..
tano considerevolmente in corrispondenza della regione cervicale
inferiore e lombo-sacrale. I n queste regioni i neuroni ventrali
(gruppo ventro-laterale) innervano i muscoli dei cinti scapolare e
lombare, nonch i muscoli prossimali degli arti, i neuroni dorsali
(gruppo dorso-laterale) innervano le porzioni distali degli arti. Nei
primati e soprattutto nell'uomo i motoneuroni ricevono parte delle
vie cortico-spinali, che in altri animali, ad es. nei carnivori, ter-
minano nella zona intermedia.
Infine la lamina X, posta centralmente, comprende la sostanza
grigia intorno al canale centrale.
La sostanza bianca del midollo spinale, per le estroflessioni
della sostanza grigia formanti le corna anteriori e posteriori e per la
presenza delle radici, suddivisibile in tre settori. Questi settori
prendono il nome di cordoni o funicoli. La posizione dei tre cor-
doni, rispettivamente cordone anteriore, cordone laterale e cordo-
ne posteriore mostrata nella figura 9.1.
Le fibre che formano i cordoni hanno varia origine. Schemati-
camente esse possono essere cos divise: a) fibre afferenti dalle cel-
lule poste nei gangli spinali; b) fibre ascendenti che conducono
impulsi ai centri nervosi sopraspinali; c) fibre discendenti che pro-
vengono dai centri sopraspinali; d) fibre che conducono impulsi
nell'ambito del midollo spinale (fibre propriospinali); e) fibre effe-
renti dai motoneuroni delle corna grigia anteriori e laterali.
Vediamo ora quali sono i pi importanti fasci discendenti ed
ascendenti.
Vie discendenti
1. Via cortico-spinale (via piramidale). Le fibre corticospinali
nascono dalla corteccia cerebrale e precisamente dalle aree citoar-
chitettoniche 4, 6 e 3-1-2. Esse attraversano la capsula interna, i
peduncoli cerebrali ed entrano nelle piramidi bulbari; nella parte
bassa del bulbo la maggioranza delle fibre si crocia e discende cau-
dalmente formando, nei cordoni laterali, il fascio cortico-spinale
laterale. La parte che non si crocia continua nel fascio cortico-spi-
nale anteriore. Questo fascio, che decorre nei cordoni anteriori, si
trova solo nei primati e la sua grandezza varia molto da individuo
ad individuo.
I n genere esso formato dal 10-30
0
/o delle fibre piramidali.
Data l'enorme importanza del fascio piramidale di esso verr parlato
in esteso quando verr trattata l'organizzazione della corteccia
motoria ed il controllo della motilit. Per quanto riguarda l'aspetto
midollare importante conoscere su quali gruppi cellulari esso ter-
mina. Secondo gli studi pi recenti nei primati le vie piramidali ter-
minano nella maniera segente: a) lamine VI - VII - VIII, porzione
ventro-mediale, bilateralmente; b) lamine VI - VII - VIII, porzione
dorso-laterale, controlateralmente; c) lamina IV e V, controlateral-
mente; d) lamina IX, controlateralmente.
2. Via vestibolo-spinale. Deriva principalmente dal nucleo ve-
stibolare laterale (n. di Deiters). E' una via essenzialmente ipsilate-
rale che porta le cellule motrici del midollo spinale sotto il control-
lo del sistema vestibolare. Decorre nel cordone anteriore e termina
nella porzione ventro-mediale della zona intermedia.
3. Fascio tetto-spinale. Nasce dagli strati profondi del collisolo
superiore e decorre nei cordoni anteriori. E' una via crociata che
termina prevalentemente nei segmenti cervicali del midollo spinale.
Analogamente alla via vestibolo-spinale termina nelle porzioni ven-
tro-mediali della zona intermedia.
4. Fascio rubro-spinale. E' un fascio la cui esistenza ben
provata oltre che nei carnivori anche nei primati. V' tuttavia di-
vergenza d'opinioni sulla sua importanza nell'uomo. E' un fascio
crociato che decorre nei cordoni laterali. Le fibre terminano nelle
porzioni dorso-laterali della zona spinale intermedia.
5. Fascio reticolo-spinale mediale. Nasce dalla formazione re-
ticolare mediale del ponte e decorre ipsilateralmente. Come verr
studiato in seguito la parte della formazione reticolare da cui nasce
ha una funzione facilitante sul tono muscolare. Decorre in maniera
diffusa nei cordoni anteriori. Termina nella porzione ventro-mediale
della zona intermedia.
112 113
6. Fascio reticolo-spinale laterale. E' un sistema di fibre che
decorre medialmente ai fasci rubro e cortico-spinali. Gli assoni ori-
ginano in parte dalle grandi cellule del nucleo reticolare giganto-
cellulare, in parte dalle cellule adiacenti, di calibro minore, della
reticolare bulbare. E' essenzialmente, anche se non esclusivamente
crociato. Esso termina sulle porzioni dorso-laterali della zona inter-
media. Avrebbe un'azione inibitoria sul tono muscolare.
E' opportuno sottolineare alla fine di questo elenco di vie di-
scendenti che la funzione motoria di ciascuna di esse non dipende
tanto dalla localizzazione delle loro cellule d'origine, quanto dal
gruppo di interneuroni o motoneuroni su cui ciascuna di esse ter-
mina. Precisamente le vie che fanno sinapsi nella parte ventro-me-
diale della zona intermedia controllano i movimenti del capo, del
tronco e i movimenti delle parti prossimali degli arti; le vie che ter-
minano sulla parte dorso-laterale della zona intermedia agiscono su
interneuroni che determinano movimenti conseguenti alla messa in
gioco, simultanea e sinergica, di pi gruppi muscolari delle estremit
distali; infine, il fascio piramidale terminando anche direttamente
sui motoneuroni in grado di causare movimenti isolati delle dita.
La connessione diretta infatti coi motoneuroni libera il fascio
piramidale dai sinergismi mediati dagli interneuroni.
7. Vie discendenti del sistema autonomo. Le connessioni tra i
centri vegetativi del tronco dell'encefalo e i neuroni pregangliari
del midollo spinale sono poco conosciute. Si pensa che si tratti di
connessioni diffuse bilaterali che decorrono prevalentemente nei
cordoni laterali. Dovrebbe trattarsi di vie polisinaptiche formate da
fibre di piccolo diametro.
Vie propriospinali
A secondo della loro posizione nel midollo spinale si dividono
in fascio intersegmentale (o propriospinale) anteriore, laterale e po-
steriore. Il fascio posteriore formato da fibre che originano da
cellule delle corna grigia posteriori, il fascio anteriore e laterale da
fibre a partenza dai neuroni della zona intermedia. Le fibre pro
priospinali laterali terminano in corrispondenza della zona inter-
media ed in corrispondenza dei motoneuroni che innervano i mu-
scoli distali, le fibre propriospinali anteriori terminano, oltre che
nella zona intermedia, sui motoneuroni dei muscoli assiali e delle
parti prossimali degli arti.
Vie ascendenti
1. Fasci spinotalamici. Si dividono in fascio spinotalamico an-
teriore e laterale, posti rispettivamente nel cordone anteriore e la-
terale. Dati clinici indicano che, nell'uomo, il fascio spinotalamico
anteriore porti soprattutto la sensibilit tatto-pressione, mentre il
fascio laterale quella dolorifica e le sensibilit per il caldo e per il
freddo. Poich molte delle fibre che decorrono nel midollo nei fa-
sci spinotalamici terminano nella sostanza reticolare del tronco
dell'encefalo stato proposto di chiamare il sistema formato dai
due fasci "sistema della sensibilit antero-laterale" in contrapposi-
zione a quello "posteriore" formato dai fascicoli gracile e cuneato.
L'origine delle fibre del sistema antero-laterale principalmente
nella lamina V, tuttavia numerose cellule che proiettano nei fasci
del sistema antero-laterale si trovano negli strati IV, I e VI; alcune
infine anche negli strati VII e VIII. Le fibre dei due tratti si incro-
ciano nella grande maggioranza dei casi. L'incrociamento avviene
nella commessura bianca anteriore.
2. Fascicoli gracile e cuneato. Portano informazioni esterocet-
tive e propriocettive. Rappresentano il sistema della sensibilit epi-
critica o discriminativa. Il fascicolo gracile inizia al limite caudale
del midollo spinale. Le fibre coccigee e quelle sacrali pi caudali
sono le pi mediali. Il fascicolo cuneato inizia a livello medio-tora-
cico e si appone lateralmente al fascicolo gracile. Entrambi i fasci-
coli sono ipsilaterali e le loro fibre prendono origine da cellule po-
ste nei gangli spinali. Si tratta di fibre mieliniche di medio calibro,
maggiori quelle del fascicolo cuneato.
3. Fasci spino-cerebellari. Sono due: il fascio spino-cerebellare
dorsale ed il fascio spino-cerebellare ventrale. Il primo forma-
114
to dagli assoni del nucleo toracico ipsilaterale. Questo a sua volta
riceve impulsi afferenti dalle collaterali delle fibre dei cordoni po_
steriori e dalle terminazioni di fibre ascendenti a partenza dalle
corna posteriori. E' un tratto ipsilaterale che raggiunge il cervelletto
attraverso il peduncolo cerebellare inferiore. Il fascio spino-ce-
rebellare ventrale un fascio crociato che arriva al cervelletto
attraverso i peduncoli cerebellari superiori. Le cellule d'origine non
sono note. I fasci spino-cerebellari portano informazioni proprio-
cettive ed esterocettive al cervelletto.
4. Fascio spino-olivare. Decorre nei cordoni laterali. Porta in-
formazioni propriocettive ed esterocettive ai nuclei olivari.
DISTURBI CONSEGUENTI ALLA SEZIONE COMPLETA DEL MIDOLLO
SPI NALE
La sezione completa del midollo spinale a qualsiasi livello seg-
mentale causa tre ordini di disturbi: 1) perdita permanente della
sensibilit al di sotto del livello della lesione; 2) perdita permanente
della motilit volontaria mediata dai mielomeri posti sotto il livello
di lesione; 3) perdita transitoria dei riflessi mediati dai segmenti
midollari posti al di sotto della lesione. Quest'ultimo disturbo
prende il nome di shock spinale.
Perch v' perdita di sensibilit? Questo deficit dovuto al
fatto che le sensazioni, il sapere che si stati stimolati, originano
nei centri cerebrali superiori. Quando le vie midollari ascendenti
sono interrotte questi centri non ricevono pi informazioni sugli
eventi che accadono alla periferia. In caso di sezione completa del
midollo spinale l'anestesia totale in quanto sono interrotte le vie
che portano la sensibilit esterocettiva, propriocettiva ed entero-
cettiva.
La spiegazione delle cause per cui la lesione determina una
perdita della motilit volontaria (paralisi) analoga a quella espo-
sta prima per l'anestesia. I movimenti volontari sono iniziati nei
centri cerebrali superiori. L'interruzione a livello midollare delle
vie discendenti impedisce che i comandi motori provenienti dai
115
centri superiori raggiungano i motoneuroni spinali. Sia i disturbi di
moto (paralisi) che quelli di senso (anestesia) sono permanenti.
Questo in quanto nel sistema nervoso centrale, incluso il midollo
spinale, non v' rigenerazione delle vie nervose, dopo una lesione,
s
ufficiente a compensare gli effetti del danno.
La gravit della sintomatologia dopo sezione del midollo spinale
dipende dal livello della lesione. Le lesioni pi gravi sono quelle pi
alte. Infatti quando la lesione alta un numero maggiore di fibre,
ascendenti e discendenti, leso ed un distretto corporeo pi vasto
colpito.
La maggiore gravit delle lesioni alte non per solo dovuta ad
un maggiore e pi completo interessamento di vie con funzioni
identiche, essa dipende anche dall'organizzazione intrinseca del
midollo spinale. Infatti, come gi stato descritto nei paragrafi
precedenti, a livello cervicale si trova il centro frenico, responsabile
dell'innervazione del diaframma e, a livello toraco-lombare, sono
posti i neuroni da cui partono le fibre pregangliari del sistema sim-
patico. Una lesione alta disconnette i centri respiratori situati nel
tronco dell'encefalo dai motoneuroni che danno origine ai nervi in-
tercostali e da quelli del centro frenico. I comandi dai centri respi-
ratori non arrivano quindi ai motoneuroni che innervano i muscoli
respiratori. La conseguenza la paralisi respiratoria. Infine le lesio-
ni al di sopra di C8 disconnettono i centri vasomotori, situati nel
tronco dell'encefalo, dai neuroni simpatici pregangliari. La man-
canza degli impulsi discendenti dai centri vasomotori causa una
ipofunzione dei neuroni simpatici toraco-lombari con conseguente
marcata caduta della pressione arteriosa. Tale caduta pressoria
per, in parte, causata anche dalla perdita dei riflessi vasomotori
conseguenti allo shock spinale.
In cosa consiste lo shock spinale? Per shock spinale si intende
quella condizione morbosa, successiva ad una lesione acuta del mi-
dollo spinale in cui mancano o sono deficitari i riflessi spinali sot-
tostanti al livello della lesione. E' importante avere chiaro che i cir-
cuiti midollari alla base dei riflessi non sono, dal punto di vista
anatomico, interrotti; l'alterazione puramente funzionale.
116
117
Perch essa compare? La spiegazione pi accettata che l'assen-
za dei riflessi immediatamente dopo la sezione sia dovuta ad una
mancanza di impulsi facilitatori provenienti dai centri superiori. In
condizioni normali questi impulsi bombardano continuamente i
neuroni spinali mantenendo depolarizzata la loro membrana. Se le
vie discendenti sono tagliate gli impulsi provenienti dai recettori pe-
riferici, la cui stimolazione normalmente causa i riflessi, non riesco-
no a depolarizzare soprasoglia i neuroni. Ecco che nonostante l'inte-
grit anatomica dell'arco riflesso il riflesso non si manifesta. Nei car-
nivori perch compaia lo shock spinale cruciale la distruzione delle
vie vestibolo-spinali e reticolo-spinali; nei primati assume maggiore
importanza la via cortico-spinale. In neurologia diaschisi il termine
generale con cui si indica un deficit funzionale conseguente ad una
lesione acuta. Lo shock spinale un caso particolare di diaschisi.
La sintomatologia dovuta allo shock spinale evolve nel tempo.
Questa evoluzione rapida negli animali a scarsa encefalizzazione,
al contrario lenta nei primati ed, in particolare, nell'uomo. Nello
uomo si distinguono nel decorso dello shock spinale quattro stadi:
I) stadio dell'ariflessia completa; 2) stadio dell'attivit riflessa mi-
nima; 3) stadio del ricupero dell'attivit flessoria; 4) stadio del ri-
cupero dell'attivit riflessa estensoria.
Stadio dell'ariflessia completa. E' lo stadio pi drammatico
dello shock spinale. Tutti i riflessi, sia quelli somatici che quelli ve-
getativi, sono assenti al di sotto della lesione. La mancanza dei ri-
flessi nocicettivi particolarmente pericolosa per il paziente. Infat-
ti in assenza di essi facile che stimoli tattili, termici o dolorifici
portino a danno dei tessuti.
Lo stesso peso corporeo esercitando una pressione su determi-
nate parti del corpo, come ad es. il dorso, pu causare, se al pa-
ziente non viene fatto spesso cambiare di posizione, la formazione
di piaghe (piaghe da decubito). Conseguenze gravissime pu avere
la mancanza dei riflessi vegetativi come quelli della defecazione e
della minzione. In assenza di quest'ultimo riflesso l'urina permane
nella vescica fino a quando la pressione intravescicale supera la
resistenza dello sfintere. A questo punto si ha una fuoriuscita di
urina, ma non appena la pressione nell'interno della vescica diventa
inferiore alla resistenza offerta dallo sfintere la minzione cessa. Ci
significa che v' un continuo ristagno urinario e se non si intervie-
ne rimuovendo l'urina con un cateterismo, si instaurano fenomeni
infettivi ed a lungo andare un danno renale.
Il primo stadio dello shock spinale dura da 2 a 6 settimane. Se
trascorso questo periodo i riflessi non ricuperano significa che v'
un danno anatomico e non solo funzionale al di sotto del presunto
livello della lesione.
Stadio dell'attivit riflessa minima. In questa fase ricompaiono
anche se in forma abortiva i riflessi nocicettivi ed i riflessi vegetati-
vi. La stimolazione, specie con stimoli intensi, della pianta del pie-
de (una zona a bassa soglia riflessogena) determina un lieve movi-
mento dell'alluce, una sorta di tremolio prevalentemente in esten-
sione. Nel maschio la stimolazione della zona genitale pu provo-
care l'erezione del pene. Ritorna parzialmente il riflesso della min-
zione. In questo stadio il riempimento della vescica determina in
via riflessa una contrazione della muscolatura vescicale accompa-
gnata da un rilasciamento parziale dello sfintere. Un residuo urina-
rio rimane per costantemente nella vescica ed il cateterismo rima-
ne indispensabile. La durata della seconda fase in genere di qual-
che mese.
Stadio della ripresa dell'attivit flessoria. E' una fase dinamica
in cui si passa dalla ricomparsa dei riflessi flessori ad una esagera-
zione degli stessi. All'inizio di questa fase la stimolazione della
pianta del piede determina la comparsa di una dorsiflessione dello
alluce del piede accompagnato da un allargamento a ventaglio delle
dita del piede. Questo riflesso patologico (nella persona normale la
stimolazione della pianta del piede determina una flessione ventra-
le delle dita) indice di una lesione del fascio piramidale. E' un
segno fondamentale della neurologia; prende il nome di segno di
Babinski. Col passare del tempo la stimolazione della pianta del
118
119
piede non determina solo un movimento delle dita ma una retra-
zione del piede e ancor pi avanti di tutto l'arto. Questa retrazione
pu accompagnarsi ad una estensione dell'arto controlaterale. An-
dando ancora avanti col tempo si ha un ulteriore accentuarsi dei ri-
flessi flessori. E' sufficiente infatti il toccamento del piede per evo-
care la triplice retrazione dell'arto. Si ha anche un'esagerazione di
altri riflessi come ad es. di quelli genitali, I riflessi flessori esagerati
che compaiono in questa fase prendono il nome di riflessi flessori
di massa.
Stadio del ricupero dell'attivit estensoria. I riflessi da stira-
mento incominciano a comparire circa sei mesi dopo la lesione. La
loro ricomparsa caratterizza l'ultima fase dello shock spinale. Ini-
zialmente si riesce ad evocare solo i riflessi da stiramento fasici
come ad esempio il riflesso patellare e l'achilleo (si evocano usando
il martelletto del neurologo ed applicando dei bruschi colpi sui
tendini). Col passare del tempo i riflessi da stiramento fasici au-
mentano e diventano pi vivaci di quelli presenti nelle persone
sane. Si ha cio una iperiflessia profonda (I riflessi da stiramento
fasici sono chiamati in neurologia "riflessi profondi"). Compaiono
inoltre anche i riflessi da stiramento tonici. Questi possono ricupe-
rare al punto che il soggetto, posto in posizione eretta, riesce a
mantenerla per qualche minuto. I riflessi flessori permangono mol-
to vivaci. Paradossalmente quindi la sintomatologia da sezione del
midollo che inizia con una depressione dei riflessi termina con una
loro accentuazione.
Perch v' un'accentuazione dei riflessi? Questo problema non
del tutto chiarito, una spiegazione possibile per quella della
ipersensibilit da denervazione. Questo fenomeno stato origina-
riamente descritto nel muscolo. Nei mammiferi se si taglia un ner-
vo di moto il muscolo da questo innervato diventa poco tempo do-
po il taglio pi sensibile all'acetilcolina di un muscolo normale.
L'aumento della chemosensibilit del muscolo drammatica. Si pu
dimostrare, perfondendo il muscolo denervato o iniettando il me-
diatore chimico nell'arteria che vascolarizza il muscolo, che tale
aumento di sensibilit dell'ordine di 100-1000 volte rispetto al
muscolo normale. L'ipersensibilit dovuta ad un'alterata distribu-
zione dei recettori dell'acetilcolina nel muscolo denervato. Infatti
a differenza del muscolo normale dove la membrana sensibile al
mediatore chimico solo in corrispondenza delle sinapsi neuromu-
scolari, nel muscolo denervato la membrana diventa progressiva-
mente sensibile anche in parti distanti, finch, circa sette giorni
dopo il taglio, praticamente tutta la membrana uniformemente
sensibile all'acetilcolina. E' stato dimostrato che dopo sezione del
midollo spinale i motoneuroni sottostanti al taglio diventano iper-
sensibili all'acetilcolina ed ad altre sostanze chimiche. Ulteriori os-
servazioni hanno confermato il fenomeno in neuroni posti in altri
centri del sistema nervoso centrale separati dalla loro via afferente.
E' possibile quindi che l'accentuazione dei riflessi nelle ultime fasi
dello shock spinale trovi la sua spiegazione nell'ipersensibilit da
denervazione dei neuroni sotto il livello di lesione. Il mediatore
chimico secreto in risposta alle stimolazioni periferiche riesce, a
causa dell'ipersensibilit nei neuroni, ad eccitare soprasoglia popo-
lazioni neuronali maggiori che nel soggetto normale e a produrre
cos dei riflessi esagerati.
Infine, per concludere questo capitolo, importante sottoli-
neare il fatto che un malato che ha una paralisi (cio una perdita
dei movimenti volontari) non necessariamente ha anche una perdi-
ta dei riflessi. Abbiamo visto che ci accade nelle prime fasi dello
shock spinale; ma nelle fasi finali la paralisi rimane, mentre i rifles-
si ritornano. Vedremo in seguito che i riflessi da stiramento sono
accentuati nella maggior parte delle paralisi per lesioni del sistema
nervoso centrale al di sopra del midollo spinale.
PARTE SECONDA
I recettori
La sensibilit somatica
Il talamo
La corteccia cerebrale
123
1) INTRODUZIONE ALLE FUNZIONI DI SENSO
Qualsiasi tipo di energia fisica che ecciti in maniera adeguata
un certo tipo di recettori prende il nome di stimolo. Soggettiva-
mente quando stimoli diversi ci colpiscono noi possiamo sentire o
delle sensazioni totalmente differenti o delle sensazioni che si
somigliano tra di loro. Le sensazioni totalmente differenti appar-
tengono a modalit sensoriali diverse. Le sensazioni che hanno
qualche cosa in comune appartengono alla stessa modalit senso-
riale ma differiscono per la loro qualit.
Il gusto, l'olfatto, la vista e l'udito sono modalit sensoriali dif-
ferenti. Cos pure modalit sensoriali differenti sono il tatto-pres-
sione, il caldo, il freddo, il dolore, il prurito ed il senso di posizione
del nostro corpo.
Nessuno di noi ha dei dubbi nel classificare una sensazione visi-
va come completamente differente da una sensazione acustica o
una sensazione acustica come completamente differente da una
tattile. Quando invece siamo stimolati da una luce rossa o da una
luce blu, per quanto anche in questo caso siamo certi che si tratti
di stimoli diversi, sappiamo anche che qualche cosa li accomuna.
Questo qualche cosa consiste nel fatto che la sensazione di rosso e
di blu appartengono ad un continuum di sensazioni entro il quale
sono possibili passaggi e comparazioni. Dal punto di vista oggettivo
a questa nostra certezza introspettiva fa riscontro il fatto che effet-
tivamente sensazioni diverse per qualit sono causate da stimoli si-
mili, da stimoli cio che appartengono ad uno stesso continuum
energetico. Basti pensare alle sensazioni visive tutte causate da on-
124
de elettromagnetiche di diversa lunghezza d'onda. Il rapporto pre-
ciso tra tipo di stimolo e qualit della sensazione viene studiata da
quella branca della fisiologia che la psicofisica. Si parla di corri-
spondenza psicofisica quando viene stabilito un rapporto preciso
tra stimolo e sensazione.
Un punto cruciale della fisiologia delle funzioni di senso la
osservazione che la modalit sensoriale evocata da un certo stimolo
dipende dai centri nervosi eccitati dallo stimolo e non dallo stimolo
per s. Questo si vede applicando ad un organo recettoriale stimoli
impropri. Se esercitiamo una pressione sul bulbo oculare de-
terminiamo una sensazione luminosa, eppure in questo caso non
c' stato nessun stimolo luminoso. La legge delle energie specifiche
di Mller codifica esperienze di questo tipo. Essa dice che la moda-
lit sensoriale non dipende dalla natura dello stimolo, ma dall'orga-
no stimolato.
Questa legge, formulata il secolo scorso, vera solo in parte.
Infatti se essa giustamente indica che la natura dello stimolo non
fondamentale nel determinare la modalit sensoriale, essa assegna
il ruolo centrale in tale compito all'organo recettoriale. Ci sba-
gliato. Con l'introduzione degli stimoli elettrici si visto che la sti-
molazione dei nervi afferenti o di certe aree corticali produce delle
sensazioni che dipendono dalla struttura stimolata. Se, ad esempio,
invece di stimolare l'occhio ad i suoi recettori, applichiamo uno
stimolo elettrico al nervo ottico o alla corteccia visiva abbiamo una
evidente sensazione luminosa. Tale sensazione, come d'altronde
tutti gli altri tipi di sensazione, dipende dall'attivit del sistema
nervoso centrale. I n condizioni normali vi corrispondenza tra
stimoli captati da recettori specifici ed attivazione di determinate
aree corticali. Le nostre sensazioni quindi non ci ingannano, ma ci
dicono esattamente quale stimolo ci ha colpito. Se si facesse per
una operazione chirurgica per cui le fibre acustiche arrivassero
all'area visiva della corteccia, i suoni provocherebbero delle sensa-
zioni visive. In altre parole noi vedremmo i suoni.
I l problema del perch certe aree corticali danno sensazioni
125
tattili, altre sensazioni visive ed altre ancora sensazioni acustiche
non risolto, neanche in via ipotetica. Esso rappresenta uno degli
aspetti del problema pi vasto delle relazioni tra mente e cervello,
un problema che ha avuto risposte filosofiche, ma del quale si pu
dire assai poco dal punto di vista scientifico, sperimentale.
Oltre che per modalit sensoriale e per qualit le sensazioni dif-
feriscono per la loro intensit. Anche in questo caso al dato sogget-
tivo corrisponde un dato oggettivo. Stimoli pi intensi determinano
infatti, entro certi limiti, sensazioni pi forti. Quando una va-
riazione di energia troppo debole essa non viene percepita. Inten-
sit soglia l'intensit necessaria perch una variazione di energia
venga percepita, diventi cio uno stimolo. Conoscendo questa in-
tensit si conosce la soglia assoluta della sensazione per un dato sti-
molo. Soglia differenziale indica invece le differenze minime di in-
tensit che ci devono essere tra due stimoli perch questi siano per-
cepiti come differenti. Le leggi che regolano i rapporti tra stimolo
e sensazioni nella modalit tatto-pressione verranno trattate nel
capitolo 5.
Un'altra importante informazione che ci danno i sistemi senso-
riali concerne il luogo dove gli stimoli vengono presentati, la loro
posizione. Se gli stimoli sono localizzati sul nostro corpo, il siste-
ma somato-sensoriale e precisamente la sua componente lemniscale
(vedi capitolo 7) a informarci dove gli stimoli si trovino. Se lo
stimolo si trova nello spazio esterno al nostro corpo la vista che
ci permette di localizzarli con precisione. I meccanismi responsabili
della localizzazione degli oggetti nello spazio sono assai complessi e
solo in piccola parte conosciuti.
Un ultimo concetto che importante introdurre fino da ora
quello di campo recettivo. Questo concetto emerso con lo studio
delle propriet funzionali dei singoli neuroni, registrati con la tec-
nica microelettrodica (vedi volume 1). Usando questa tecnica si os-
serva che i neuroni sensoriali rispondono a stimoli posti in una zona
circoscritta di spazio. Questa zona nel sistema somatico rap-
presentata da porzioni di cute, nel sistema visivo da settori del
126
campo visivo. Per campo recettivo di un neurone si intende quindi
quella porzione di spazio la cui stimolazione determina una modi-
ficazione della scarica del neurone. Questa modificazione pu essere
eccitatoria o inibitoria. I campi recettivi possono essere puramente
eccitatori, puramente inibitori o formati da regioni eccitatorie e da
regioni inibitorie. La grandezza dei campi recettivi varia molto.
Nel sistema somato-sensoriale i campi recettivi possono estendersi
per pochi millimetri di cute o estendersi ad una met del corpo.
Ugualmente nel sistema visivo esistono campi recettivi della
grandezza di pochi minuti d'arco e campi recettivi grandi alcune
decine di gradi. Vedremo in seguito l'importanza funzionale dei
campi recettivi di diverse dimensioni.
127
2) ORGANIZZAZIONE DEI SISTEMI SENSORIALI
I sistemi sensoriali hanno come disegno fondamentale una ca-
tena di elementi in serie: il recettore, il neurone sensitivo, i neuroni
centrali.
Il recettore una cellula specializzata in grado di trasformare
l'energia di uno stimolo - meccanica, chimica, luminosa ecc. - in un
potenziale elettrico. Occorre tenere presente che questa definizione
di recettore, definizione fisiologica, non corrisponde a quella
anatomica. In fisiologia recettore implica un processo di trasduzio-
ne, di trasformazione cio di una forma di energia in un'altra. In
anatomia si d il nome di recettore ad una serie di corpuscoli o di
strutture che possono avere la funzione fisiologica della trasduzione
o possono invece solo modificare le propriet fisiche degli stimoli
prima che questi colpiscano il recettore. Il termine pi appropriato
per i corpuscoli che hanno questa seconda funzione quello di
organi recettoriali accessori.
I recettori in senso proprio (recettori fisiologici) si dividono in
recettori di primo e di secondo tipo. I recettori di primo tipo sono
rappresentati dalle terminazioni periferiche dei neuroni sensoriali.
In questi la membrana terminale sensibile agli stimoli ed in rispo-
sta ad essi genera un potenziale elettrico. Questo potenziale prende
il nome di potenziale generatore. Il recettore di primo tipo pub es-
sere libero o essere circondato da strutture accessorie. Un esempio
di recettori di primo tipo senza strutture accessorie sono le termi-
nazioni libere delle fibre dolorifiche. Una tipica terminazione ner-
vosa che funziona da recettore, ma che circondata da una grossa
128 129
struttura accessoria il corpuscolo del Pacini. Nei recettori di pri-
mo tipo il potenziale generatore si trasmette elettrotonicamente a
parti adiacenti della membrana e vi fa nascere il potenziale d'azio-
ne. Nella stessa struttura nasce quindi sia il potenziale generatore
che il potenziale d'azione.
I recettori di secondo tipo sono cellule specializzate nella tra-
sformazione di energia in potenziali elettrici senza per essere in
grado di generare potenziali d'azione. L'evento elettrico da essi
generato prende il nome di potenziale di recettore. Il potenziale
d'azione nasce nella cellula sensitiva con cui il recettore di secondo
tipo in contatto sinaptico. Il meccanismo il seguente: il poten-
ziale di recettore determina la liberazione di un mediatore chimico
che depolarizza la membrana della cellula successiva, se la depola-
rizzazione sufficiente nasce il potenziale d'azione.
Alla distinzione tra recettori di primo e secondo tipo corri-
sponde la distinzione tra neuroni sensitivi di primo e di secondo
tipo. I neuroni sensitivi di primo tipo sono quei neuroni le cui ter-
minazioni hanno funzioni recettoriali; i neuroni sensitivi di secondo
tipo sono i neuroni che vengono eccitati per via sinaptica dai recettori.
Neuroni sensitivi di primo tipo sono i neuroni posti nei gangli
spinali e nei gangli dei nervi cranici. Essi portano ai centri superiori
le sensazioni tattili, termiche, dolorifiche, il prurito ed il senso di
posizione. Neuroni sensitivi di secondo tipo sono le cellule del
sistema vestibolare ed acustico. Queste vengono eccitate per via
sinaptica dalle cellule ciliate, che rappresentano i recettori (recet-
tori di secondo tipo) di questi sistemi. Infine un'organizzazione a
se stante si trova nel sistema visivo. In esso i potenziali d'azione
non si originano n nei recettori, coni e bastoncelli, n nelle cellule
bipolari, che corrispondono ai neuroni sensitivi di secondo tipo,
ma in un terzo elemento della catena sensoriale, le cellule ganglio-
nari della retina. Si parla in questo caso di neuroni sensitivi di terzo
tipo.
Indipendentemente dal fatto che un recettore sia di primo o di
secondo tipo esso rispondespecificatamenteadeterminati stimoli.
Questi stimoli prendono il nome di stimoli adeguati. I l recettore
pu essere eccitato anche da stimoli non adeguati, come ad esem-
pio i recettori retinici dalla pressione esercitata sull'occhio. Si tratta
per di situazioni abnormi che nulla tolgono al fatto che ogni
recettore richiede uno stimolo specifico. A secondo del tipo di sti-
molo richiesto i recettori si dividono in termocettori, sensibili al
caldo ed al freddo, nocicettori, sensibili a stimoli doloriferi, che-
mocettori, sensibili a stimoli chimici e responsabili del gusto e del-
l'olfatto, fotocettori, sensibili alla luce ed infine in meccanocettori,
sensibili a stimoli meccanici. I meccanocettori sono responsabili
delle seguenti sensazioni: tatto-pressione, dovuta ai meccanocettori
della cute e dei tessuti sottocutanei; senso di posizione e di
movimento, dovuto ai meccanocettori delle articolazioni e degli
organi vestibolari; udito, di cui sono responsabili i meccanocettori
della coclea. I recettori di stiramento, posti nei muscoli e nei ten-
dini, sono responsabili della propriocezione incosciente ed in par-
te di quella cosciente (senso di posizione). Infine meccanocettori
sono i recettori viscerali di pressione, come ad esempio, i recettori
caro tidei.
131
3) IL PROCESSO DI TRASDUZIONE
Nei recettori di primo tipo il processo di trasduzione avviene in
corrispondenza della membrana delle terminazioni periferiche. Ve-
dremo in dettaglio in questo capitolo come ci avviene. Il recettore
di scelta per esperimenti sulla trasduzione il corpuscolo del Patini.
Ci dovuto al fatto che mentre le terminazioni della maggior
parte dei neuroni sensitivi di primo ordine sono difficili da isolare,
relativamente facile liberare il corpuscolo del Pacini dai tessuti
circostanti ed averlo quindi isolato.
Il corpuscolo del Pacini mostrato nella Fig. 3-1. Si pu notare
che il corpuscolo formato da due parti: la fibra nervosa e la
struttura recettoriale accessoria.
La fibra che innerva il corpuscolo mielinica. Essa mantiene
questa guaina nel primo tratto del decorso intracorpuscolare
(C - D - E), mentre la perde nel tratto successivo (B - C). La fibra
termina ramificandosi come indicato schematicamente in B. La fi-
bra nervosa avvolta, sia nel tratto mielinico che in quello amieli-
nico, dalla guaina endoneurale, la cui continuazione nel corpuscolo
forma la parte pi interna della struttura accessoria, la clava interna.
La parte pi esterna di questa formata dall'involucro. Questo ha la
forma di una cipolla ed costituito da una serie di lamelle applicate
concentricamente le une sulle altre e separate da interstizi ripieni di
linfa. La clava interna occupa lo spazio tra l'assone e le lamelle
pi interne dell'involucro. La Fig. 3-1 oltre la struttura del
corpuscolo del Pacini, mostra anche la posizione dei nodi di Ranvier
nella fibra nervosa. Il primo (D) intracorpuscolare, il se-
132 133
Fig. 3-1 - Il corpuscolo di Pacini. B e C = porzione amielinica della fibra ner-
vosa; D, F e G = nodi di Ranvier; 1, 2, 3 = porzione internodale della fibra
mielinica. Per altre spiegazioni vedi testo.
condo posto subito dopo l'uscita della fibra dal corpuscolo (F).
La Fig. 3-2 illustra gli effetti della stimolazione del corpuscolo
del Pacini. In 1, a sinistra, mostrato il corpuscolo del Pacini. La
freccia indica che uno stimolo meccanico viene applicato alla parte
corpuscolare. La stimolazione determina (parte destra della figura)
la nascita di un potenziale lento che prende il nome di potenziale
generatore. Esso ha propriet simili a quelle dei potenziali post-
s
inaptici. Il potenziale generatore graduabile in ampiezza. Si pu
vedere dalla figura che stimoli pi forti determinano potenziali ge-
neratori pi ampi (Fig. 3-2, lb, c, d). Si tratta di potenziali non
propagati che si diffondono elettronicamente ai punti adiacenti
della membrana. Se il potenziale generatore supera una certa am-
piezza esso determina la nascita di un processo rigenerativo e quin-
di la comparsa di un potenziale d'azione (Fig. 3-2, le).
I tracciati 2 e 3 della Fig. 3-2 illustrano il fatto che sia il poten-
ziale generatore che il potenziale d'azione nascono nella fibra ner-
vosa. In 2 stato asportato l'involucro, in 3 oltre l'involucro
Fig. 3-2 - Stimolazione del corpuscolo del Pacini intatto (1), dopo asportazione
del suo involucro (2, 3, 4) e dopo lesione del suo assone (5). a,b,c,d = potenziali
generatori di ampiezza crescente; e = potenziale d'azione.
134 135
stata danneggiata anche la clava interna. Si vede che la capacit
della terminazione nervosa di rispondere alle deformazioni mecca-
niche con risposte elettriche preservata. Infatti sia i potenziali
generatori che il potenziale d'azione sono presenti e normali.
In condizioni fisiologiche il potenziale d'azione nasce in corri-
spondenza del primo nodo di Ranvier della fibra mielinica. Questo
fatto illustrato nella riga 4 della Fig. 3-2. A sinistra illustrato
un esperimento in cui, contemporaneamente alla stimolazione
meccanica, una pressione viene esercitata sul nodo di Ranvier. Si
pu vedere, a destra, che i potenziali generatori sono identici a
quelli che compaiono in assenza di blocco del nodo, ma il poten-
ziale d'azione manca. Vi una stretta analogia con la nascita dei
potenziali d'azione nelle cellule nervose. In queste i potenziali
postsinaptici depolarizzano la membrana, ma il potenziale d'azione
nasce in corrispondenza del monticolo. Nel caso delle terminazioni
nervose il punto a soglia pi bassa, corrispondente quindi al monti-
colo, il primo nodo di Ranvier. I potenziali generatori nascono
nelle parti distali delle fibre, ma depolarizzano sopra il livello so-
glia per primo il nodo.
La riga 5 della Fig. 3-2 mostra infine che se l'assone viene ta-
gliato e lasciato degenerare, la stimolazione della clava interna non
produce alcun evento elettrico. E' la riprova che i potenziali gene-
ratori nascono nella terminazione nervosa.
Il potenziale generatore ha origine per il fatto che la deforma-
zione meccanica della terminazione della fibra causa un aumento
della permeabilit della fibra agli ioni Na
+
e, verosimilmente, agli
ioni K
+
. Non pare che alcun evento chimico intervenga tra stimolo
meccanico e nascita del potenziale generatore. Il potenziale d'equi-
librio del potenziale generatore intorno a O. Ci significa che il
sodio non il solo ione responsabile della nascita del potenziale ge-
neratore, ma che la sua azione controbilanciata da altri ioni. Si
pensa che un ruolo centrale nell'opporsi alla depolarizzazione l'ab-
bia il potassio. La membrana, deformata meccanicamente, diver-
rebbe maggiormente permeabile sia al sodio che al potassio con
te
mporaneamente, cos come avviene per i potenziali postsinaptici
nella trasmissione nervosa.
Esempi di recettori di secondo tipo sono le cellule ciliate del-
l'
a
pparato vestibolare. La Fig. 3-3 mostra una di queste cellule con
le sue connessione nervose.
Come si pu vedere dalla figura questo recettore presenta ad
un polo una serie di ciglie, mentre all'altro polo vi sono delle sina-
psi. La parte cigliata funziona da trasduttore meccano-elettrico.
Fig. 3-3 - Cellula ciliata dell'apparato vestibolare.
136
Precisamente il piegamento delle ciglia verso quella pi lunga, il
chinociglio, produce una depolarizzazione della membrana. Il fe-
nomeno elettrico causato dalla deformazione meccanica delle ci-
glie prende il nome di potenziale del recettore e fa parte della fa-
miglia dei potenziali lenti, assieme ai potenziali di placca, ai poten-
ziali postsinaptici ed ai potenziali generatori.
La cellula ciliata non in grado di generare potenziali d'azione.
Il potenziale del recettore causa per la liberazione chimica di un
mediatore posto nelle vescicole delle cellule ciliate (vedi Fig. 3-3).
Il mediatore a sua volta determina la nascita di un potenziale post-
sinaptico nei terminali delle fibre afferenti. Se la depolarizzazione
sufficiente si origina il potenziale d'azione che si propaga alla cel-
lula d'origine della fibra, posta nel ganglio dello Scarpa, e poi ai
nuclei del nervo vestibolare. Il fatto che la sinapsi chimica sia ecci-
tatoria stato chiaramente dimostrato con esperimenti di registra-
zione. Recentemente stato isolato anche il mediatore chimico. Si
tratta dell'acido y-aminobutirrico (GABA). Questo un dato piut-
tosto sorprendente in quanto, in genere, l'azione del GABA nel si-
stema nervoso centrale inibitoria.
L'attivit dei recettori di secondo tipo pu essere modulata dal
sistema nervoso centrale. Se si esamina la Fig. 3-3 si vede che ac-
canto ad una sinapsi il cui verso dalla cellula ciliata alla fibra ner-
vosa, c' un'altra dalla fibra nervosa alla cellula ciliata. Vi sono
prove che questa sinapsi efferente sia una sinapsi inibitoria. La fi-
bra efferente nasce dai nuclei vestibolari e termina sulle cellule ci-
liate. Quando essa attiva in grado, mediante una inibizione
postsinaptica, di diminuire la capacit della cellula ciliata di libera-
re il mediatore chimico. Abbiamo visto in precedenza (vol. 1) che
un sistema centrale di controllo esiste anche per i recettori di stira-
mento. Il meccanismo tuttavia con cui questo agisce molto diverso
(vedi vol. 1, cap. 6). In quali condizioni avvenga la modulazione
della cellula ciliata da parte della fibra afferente non del tutto
chiarito.
Accanto alla distinzione tra recettori di primo ordine e di se
137
condo ordine, fondamentale la suddivisione dei recettori in recet-
tori a lento adattamento ed a rapido adattamento. Prendono il no-
m
e di recettori a lento adattamento quei recettori il cui potenziale
lento (potenziale generatore o potenziale di recettore) dura per
tutto il tempo durante il quale lo stimolo applicato; si chiamano
recettori a rapido adattamento quei recettori che rispondono al-
l'inizio ed alla fine dello stimolo o solo all'inizio di questo. I recet-
tori a rapido adattamento segnalano quindi solo i transienti, la fase
dinamica dello stimolo, e non la fase statica.
Un tipico recettore a rapido adattamento il corpuscolo del
Pacini. La Fig. 3-4 (a sinistra) mostra il potenziale generatore regi-
strato dalla terminazione nervosa di un corpuscolo del Pacini in
risposta ad uno stimolo meccanico protratto. La durata dello sti-
molo meccanico (parte inferiore del tracciato) di circa 50 msec.
Si pu vedere come il potenziale generatore (parte superiore del
tracciato) compare solo all'applicazione dello stimolo ed al suo
cessare. La trasduzione dei transienti e non della fase statica la
caratteristica tipica dei recettori a rapido adattamento.
Fig. 3-4 - La registrazione di sinistra (tracciato superiore) mostra il potenziale
generatore evocato nella terminazione nervosa di un corpuscolo del Pacini in-
tatto all'applicazione ed al rilasciamento di uno stimolo meccanico (tracciato
inferiore). La registrazione di destra mostra il potenziale generatore evocato
in maniera analoga dopo asportazione della parte accessoria del corpuscolo.
Recettori a lento adattamento particolarmente ben studiati sono
i fusi neuro-muscolari e tra questi soprattutto quelli della rana. Il
loro studio infatti particolarmente agevole in quanto essi possono
essere facilmente isolati e mantenuti a lungo in vita in un am-
138
Fig. 3-5 - Risposta di un fuso neuromuscolare allo stiramento. A: nel tracciato
superiore si vede una serie di potenziali d'azione che si originano da un pro-
lungato potenziale generatore, nel tracciato inferiore mostrata la durata del-
lo stimolo; B: i potenziali d'azione sono stati bloccati dall'applicazione di un
anestetico locale. Si pu vedere il potenziale generatore (tracciato superiore)
in risposta allo stiramento. Parte destra della figura: il diagramma superiore
mostra come l'ampiezza del potenziale generatore vari con lo stiramento del
fuso. L'entit dello stiramento indicata nel diagramma inferiore.
biente ionico controllato. Lo stiramento del fuso produce nella
terminazione nervosa un potenziale generatore che dura per tutta
la durata dello stiramento. Questo chiaramente dimostrato nella
Fig. 3-5.
Conviene esaminare in questa figura per prima la parte indicata
con B. Il tracciato inferiore mostra l'inizio e la fine dello stimolo.
Il tracciato superiore, il potenziale generatore. In B la fibra stata
trattata con un anestetico locale che ha bloccato la nascita dei po-
tenziali d'azione, lasciando integro il potenziale generatore. Si pu
vedere come all'inizio della stimolazione v' una risposta fasica si-
mile a quella che si osserva nel corpuscolo del Pacini. Diversamente
che in questo per il potenziale generatore non torna a zero dopo
il transiente ma si mantiene ad un certo valore, anche se piccolo,
139
per tutti i 400 msec. dello stiramento. Se la fibra non trattata
con sostanze che bloccano la nascita di potenziali d'azione, si ha
una scarica tonica continua causata dal potenziale generatore.
Questo fenomeno mostrato nella parte A della figura dove si
vede una serie di potenziali d'azione sovrapposti al potenziale
g
eneratore.
La parte destra della Fig. 3-5 mostra come vi sia una propor-
zionalit tra entit dello stiramento al fuso ed ampiezza del poten-
ziale durante la fase dinamica. Si vede anche che, entro certi limiti,
per stiramenti protratti il potenziale generatore mantiene un'am-
piezza costante, proporzionale al grado di allungamento del fuso.
Cosa determina la diversit di comportamento dei recettori e li
fa diventare recettori a lento o a rapido adattamento? La causa
principale la presenza o l'assenza intorno ai recettori di strutture
accessorie. Sono infatti queste che filtrano gli stimoli e fanno si
che i recettori rispondano solo ai transienti. Esaminiamo ancora il
corpuscolo del Pacini. In questo recettore le componenti ad alte
frequenze delle forze compressive applicate alla struttura accesso-
ria si trasmettono alla fibra, mentre quelle a bassa frequenza sono
fortemente attenuate dalle propriet fisiche della porzione lamellare.
La componente continua che si ha durante una compressione
prolungata del corpuscolo si disperde nella struttura a cipolla, so-
prattutto per la presenza del liquido intralamellare, e non arriva alla
terminazione nervosa. Quando lo stimolo cessa, il rilasciamento
delle lamelle compresse porta ad una deformazione della termina-
zione nervosa, e compare quindi un secondo potenziale generatore
che segnala la fine dello stimolo. La prova che il rapido adattamento
del corpuscolo del Pacini dovuto alla parte corpuscolata si ottiene
stimolando il recettore dopo distruzione della struttura accessoria.
Ci illustrato nella Fig. 3-4, parte destra. Come gi esposto prima,
a sinistra, si vede la risposta del corpuscolo del Pacini intatto ad
uno stimolo protratto. A destra mostrato il potenziale generatore
allo stesso stimolo dopo asportazione della parte accessoria. Si pu
vedere come in quest'ultimo caso la stimolazione
140
meccanica produca un prolungato potenziale generatore. La fibra
del corpuscolo del Pacini quindi, senza strutture accessorie, un
recettore a lento adattamento.
E' importante notare che, dopo ablazione della parte accesso-
ria, il potenziale generatore del corpuscolo del Pacini per quanto
prolungato, non provoca treni di potenziali d'azione nella fibra
nervosa, come invece avviene nel fuso neuro-muscolare ed in altri
recettori a lento adattamento. Ci dovuto alle diverse propriet
accomodative delle varie fibre nervose. Per accomodazione si in-
tende quel fenomeno (vedi volume 1) per cui il tempo di salita di
uno stimolo influisce sul voltaggio soglia a cui nasce il potenziale
d'azione. Pi lentamente la membrana viene depolarizzata, maggiore
il valore della depolarizzazione a cui bisogna giungere per avere il
potenziale d'azione. Il fenomeno simile a quello che interviene
nella genesi del periodo refrattario. Anche nel caso dell'accomo-
dazione l'aumento della permeabilit della membrana al Na- indot-
ta dalla depolarizzazione controbilanciata da un progressivo au-
mento della permeabilit al potassio. Nel caso del corpuscolo del
Pacini il forte potere di accomodazione della membrana delle fibre
in corrispondenza del primo nodo di Ranvier fa s che il potenziale
generatore, anche se prolungato nel tempo non riesce a generare
pi di uno o due potenziali d'azione; viceversa nel fuso neuromu-
scolare il potere d'accomodazione scarso e la cellula scarica in
maniera ripetitiva.
In conclusione le differenze nella rapidit di adattamento tra i
vari recettori e le varie cellule sensoriali sono dovute alla presenza
alla periferia di strutture che modificano la durata del potenziale
generatore e all'effetto che i potenziali generatori hanno sulle
membrane nervose.
141
4) LA SENSIBILITA' SOMATICA
La stimolazione dei tessuti del corpo provoca sei tipi di moda-
lit sensoriali: tatto-pressione, caldo, freddo, dolore, prurito e sen-
so di posizione. Le prime cinque modalit sensoriali originano pre-
valentemente, anche se non esclusivamente dalla cute; il senso di
posizione, con la submodalit del senso di movimento, in strutture
recettoriali poste in corrispondenza delle articolazioni e dei musco-
li. L'insieme di queste modalit sensoriali forma la sensibilit so-
matica.
Le diverse modalit sensoriali della sensibilit somatica sono
portate da fibre specifiche per ognuna di esse. Non esistono fibre
che portano due modalit sensoriali. Ci vale anche per il dolore.
Teorie che tendevano a spiegare questa modalit sensoriale come
dovuta ad un eccesso di stimolazione di fibre responsabili di altre
modalit, ad esempio di quelle del tatto, sono state smentite dai
dati sperimentali.
Esiste una correlazione tra tipo di modalit sensoriale e diame-
tro delle fibre nervose che portano l'informazione specifica ai cen-
tri midollari e del tronco dell'encefalo. Si pu dimostrare questa
correlazione mediante esperimenti di blocco selettivo delle fibre di
vario diametro. 11 blocco pu essere eseguito mediante iniezione
nel nervo di un anestetico locale o mediante compressione del
tronco nervoso. Con la prima procedura vengono bloccate, nell'or-
dine, le fibre amieliniche, poi le mieliniche di piccolo calibro ed in-
fine quelle di calibro maggiore; con la seconda procedura l'ordine
invertito, prima vengono bloccate le fibre di calibro maggiore, ulti-
142
me le fibre pi sottili. Questa sequenza dovuta al fatto che, nel
caso del blocco anestetico, le fibre maggiori, specie le mieliniche,
sono protette dalle loro guaine dall'azione dell'anestetico il quale
per agire deve raggiungere la membrana della fibra. Da qui il suo
effetto, a bassa concentrazione, solo sulle fibre amieliniche. Nel
caso del blocco asfittico le fibre pi grosse soffrono per prime in
quanto hanno un metabolismo pi elevato e quindi hanno maggiore
necessit di ossigeno. Per chiarire quali fibre siano responsabili
delle varie modalit sensoriali occorre usare entrambi i metodi. In-
fatti qualora la stessa modalit sensoriale fosse portata da fibre di
diametro diverso, ci non potrebbe essere messo in luce usando
una sola delle due procedure. I nfatti bloccando un gruppo, ad
esempio quello delle fibre pi fini, l'altro gruppo, quello formato
dalle fibre pi grosse, potrebbe compensare l'azione delle prime,
dando cos l'impressione che la modalit sensoriale in questione
portata esclusivamente dalle fibre grosse. Se si usano entrambi i
metodi questo equivoco non pu sorgere.
Gli esperimenti di blocco si fanno in soggetti normali, volontari.
Indipendentemente dal metodo usato per bloccare la conduzione
nervosa, prima e durante il blocco si stimola elettricamente il
nervo con intensit variabile e si registra il neurogramma. Questo
permette di avere un quadro oggettivo di quali fibre conducono e
quali sono state bloccate. Contemporaneamente il soggetto riferi-
sce le sensazioni che prova in risposta alla stimolazione del nervo.
Usando il blocco anestetico, le prime fibre ad essere interessate
sono le fibre del gruppo C. Quando queste sono bloccate il sogget-
to non percepisce pi il prurito e quel particolare tipo di dolore
che viene chiamato dolore urente o dolore emozionale. Rimango-
no invece le sensazioni del dolore puntorio, del dolore cio sentito
con scarsa o addirittura senza coloritura emotiva, e tutte le altre
modalit somato-sensoriali. Aumentando la dose di anestetico il
blocco interessa anche le fibre mieliniche pi piccole (gruppo I I I ,
A delta). A questo punto il soggetto cessa di percepire il caldo, il
freddo ed ogni tipo di dolore. Permane la sensibilit tatto-pressio
143
ne
. Con un ulteriore aumento dell'anestetico scompare anche questa
sensibilit. Contemporaneamente cessa l'attivit delle fibre del
gruppo II (A beta). Come noto dai capitoli precedenti (vedi volu
me
1), nei nervi cutanei, i nervi interessati in questi esperimenti, non
vi sono fibre del gruppo I. Queste sono presenti solo nei nervi
muscolari e hanno un ruolo, assieme alle fibre II (vedi sotto), nel
senso di posizione.
I l blocco asfittico si ottiene esercitando una pressione locale
sul nervo. Ci, in genere, viene fatto applicando all'arto un mani-
cotto come quelli usati per misurare la pressione arteriosa ed au-
mentando progressivamente la pressione sull'arto. Le prime fibre
ad essere bloccate sono le fibre del gruppo II (A beta). Quando
queste sono inattivate il soggetto perde completamente gli aspetti
discriminativi della sensibilit tatto-pressione e quasi completa-
mente il senso di posizione. Le capacit tattili grossolane cos co-
me le altre modalit sensoriali somatiche rimangono praticamente
invariate. II tatto-pressione grossolano, le capacit di discriminare
piccole variazioni di temperatura (sia caldo che freddo) ed il dolore
puntorio non sono pi percepiti quando anche le fibre mieliniche
pi piccole sono inattivate (fibre del gruppo III, A delta). L'integrit
funzionale delle fibre amieliniche permette di percepire il dolore
urente, il prurito e le temperature estreme. Infine se anche le fibre
amieliniche vengono bloccate l'anestesia diventa totale.
In conclusione chiaro da questi esperimenti che fibre diverse
portano diverse sensibilit somatiche. Inoltre due gruppi di fibre
sono responsabili sia della sensibilit dolorifica che di quella tattile.
In entrambi i casi sono le fibre di calibro maggiore che mediano gli
aspetti discriminativi della rispettiva modalit sensoriale. Infine le
fibre amiliniche sono in relazione con gli aspetti pi grossolani del
dolore, del caldo e del freddo.
145
5) TATTO-PRESSIONE E SENSO DI POSIZIONE:
CAPACITA' DISCRIMINATIVE NELL'UOMO
Nel capitolo precedente abbiamo visto che responsabili delle
capacit tattili discriminative sono le fibre mieliniche del gruppo
II. Per quanto sia oltre lo scopo di queste lezioni trattare la psicofi-
sica della percezione tattile, alcuni cenni sulle capacit discrimina-
tive nella modalit tatto-pressione ed in quella del senso di posizione
sono indispensabili per capire i problemi che pone Io studio del
sistema somato-sensoriale. Inoltre tali nozioni sono indispensabili
per poter trovare nei pazienti i segni di lesione delle vie o dei centri
somato-sensoriali.
E' stato gi detto (vedi Cap. 1) che per soglia assoluta, in tutte
le modalit sensoriali, si intende la misura del minimo stimolo ap-
prezzabile. Essa si determina applicando stimoli deboli di intensit
variabile e stabilendo quando uno stimolo viene percepito nel
50
/o dei casi. La soglia assoluta nella modalit tatto-pressione varia
a secondo della regione corporea stimolata. Essa minima in
corrispondenza delle labbra, della faccia e, anche se con valori pi
alti, dalle dita della mano; massima sul dorso e sulle gambe. Que-
ste differenze sono in relazione ad una differente innervazione del-
le varie regioni. La soglia assoluta minore dove l'innervazione
pi ricca.
Applicando stimoli di intensit lievemente diversa si pu stabi-
lire la soglia differenziale (AS). La soglia differenziale esprime di
quanto uno stimolo deve essere aumentato per essere percepito co-
me diverso dal precedente. Per stimoli di media intensit l'incre-
mento discriminabile pari al 3
/o dello stimolo base. La legge di
Weber codifica questa relazione. Essa stabilisce che la soglia diffe-
renziale relativa (AS/S) costante. In altre parole la soglia diffe-
renziale aumenta in termini assoluti mano a mano che lo stimolo
pi intenso, ma resta costante in valore percentuale. La soglia dif-
ferenziale relativa resta per invariata solo per stimoli di media in-
tensit. Per stimoli molto deboli o per stimoli intensi l'incremento
discriminabile pu raggiungere il 10-20% dello stimolo base.
Un aspetto importante della somaestesia la sua capacit di
segnalare il luogo ove lo stimolo stato applicato. Due semplici
test di questa capacit sono comunemente usati nell'esame neuro-
logico clinico. Il primo test valuta l'accuratezza con cui il pazien-
te sa dove stato toccato. Mentre il soggetto ha gli occhi chiusi,
il medico tocca con una punta smussa un certo punto della cute.
I l soggetto normal e sa i ndi care con un dito esattamente dove
stato toccato. I l secondo test valuta la distanza minima di cute
che stimolata con le due punte di un compasso d una percezione
distinta delle due punte. Anche in questo caso il test viene fatto ad
occhi chiusi. La distanza tra le due punte del compasso viene pro-
gressivamente aumentata. Se le due punte sono molto ravvicinate
il soggetto riferisce di essere stato toccato in un punto solo. Se le
due punte sono pi distanziate egli percepisce una linea. Finalmen-
te ad una certa apertura del compasso percepisce due punti distinti.
Questa l'acuit tattile.
L'acuit tattile varia molto a secondo della regione stimolata.
Ci chiaramente illustrato nella Fig. 5-1. Si pu vedere in essa
che l'acuit tattile di circa 2-3 mm quando gli stimoli sono appli-
cati ai polpastrelli delle dita, mentre essa supera i 30 mm sull'avam-
braccio ed ha valori ancora pi alti sulla faccia anteriore della
coscia.
Studi recenti di psicofisica hanno dimostrato che le capacit di
risoluzione spaziale sono molto maggiori di quelle stabilite con gli
studi classici. Usando come stimoli delle grate disposte orizzontal-
mente o verticalmente sporgenti di 900 p rispetto ad un piano e
forzando i soggetti a dire, anche quando non ne sono certi, quale
Fig. 5-1 - L'acuit tattile in varie parti della cute e nella mucosa boccale del-
l'uomo.
l'orientamento degli stimoli si trovato che la soglia di discrimina-
zione di 0,8 mm. La prova stata fatta applicando gli stimoli ai
polpastrelli delle dita. E' chiaro che i valori trovati sono molto mi-
nori dei 3 mm che rappresentano l'acuit tattile per questa regione
cutanea stabilita coi metodi classici. Tutti i valori fino ad ora citati
sono valori statici, valori in cui il soggetto non pu esplorare atti-
vamente le superfici, muovendo la mano o le dita. Permettendo tale
manovra le capacit discriminative migliorano notevolmente. Basti
dire che esplorando una superficie con l'unghia si riescono a
scoprire affossamenti dell'ordine di 1 micron.
Un'altra importante propriet della somestesia umana la ca-
146 147
148
pacit di segnalare stimoli meccanici periodici. Questa sensibilit
prende il nome di sensibilit vibratoria o pallestesia. Essa si studia
facendo vibrare un diapason applicato a vari punti ossei (malleoli
stiloidea del radio e dell'ulna, rotula, ecc.). La sensibilit
vibratoria consta di due qualit differenti. La prima descritta
come un senso di tremore. 11 tremore cutaneo si sente per oscilla-
zioni di bassa frequenza (5-40 c/sec). La seconda qualit consiste
nel senso di vibrazione vero e proprio. Essa si ottiene con stimoli
di frequenza tra 60 e 400 c/sec. La frequenza vibratoria ottimale,
quella che si sente pi forte a parit di stimolo fisico, intorno ai
200 c/sec. Come vedremo nel capitolo successivo le due qualit
della pallestesia sono dovute all'eccitazione di recettori diversi.
Prende il nome di senso di posizione la nostra capacit di cono-
scere la posizione delle parti del nostro corpo rispetto al corpo
stesso. Per senso di movimento (cinestesia) si intende la capacit
di percepire i movimenti delle nostre articolazioni. Il senso di posi-
zione si studia muovendo passivamente un segmento corporeo, ad
esempio un braccio, di un soggetto che tiene gli occhi chiusi. Poi
l'arto viene fermato in una certa posizione ed il soggetto, sempre
ad occhi chiusi, viene invitato a portare l'arto opposto nella stessa
posizione. Il senso di movimento si ricerca muovendo, ad occhi
chiusi, il segmento di un arto di un soggetto e chiedendogli se per-
cepisce il movimento ed in quale direzione questo avviene.
Il senso di posizione particolarmente sviluppato nei segmenti
prossimali degli arti. La posizione imposta della spalla pu venire
imitata controlateralmente con errori di 2-3 gradi. Analogamente
la sensibilit cinetica pi pronunciata per le articolazioni prossi-
mali che per quelle distali. La variazione minima nella posizione
della spalla che percepita durante un movimento passivo del-
l'ordine di 1 grado. Per le falangi delle dita dell'ordine di 5-10
gradi. Nel caso quindi del senso di posizione e movimento si ha un
gradiente di sensibilit che decresce dalla parti prossimali a quelle
distali. Esattamente l'opposto di quello che si trova per il senso
tatto-pressione.
149
Unultima capacit sensoriale che viene comunemente ricercata
nellesame neurologico della sensibilit la stereognosi. Con que-
sto termine si intende la capacit di riconoscere, ad occhi chiusi, la
forma e la grandezza di oggetti manipolati dal soggetto. Si tratta di
una funzione complessa dovuta ad una interazione centrale di af-
ferenze tattili e propriocettive.
6) I MECCANOCETTORI
E' stato dimostrato nei capitoli precedenti che il fenomeno
della trasduzione nella modalit tatto-pressione avviene nelle fibre
nervose. Queste rappresentano dal punto di vista fisiologico i veri
recettori. A secondo della maniera in cui le fibre nervose sensoriali
terminano esse danno origine a due tipi di terminazioni: termina-
zioni libere e terminazioni incapsulate. Gli anatomici designano in
genere col nome di recettore solo quest'ultime. Ci errato. L'er-
rore dovuto a ragioni storiche. Infatti fino a non molto tempo fa
si pensava che la trasduzione avvenisse sugli organi accessori e per-
tanto solo nelle terminazioni incapsulate. Oggi noto che tale pro-
cesso avviene sia nelle terminazioni libere che in quelle incapsulate.
Le terminazioni libere si trovano ovunque, nella cute, nei tes-
suti profondi e nei visceri. Nella cute esse sono molto diffuse e ar-
rivano fino allo strato germinativo dell'epidermide. La Fig. 6-1 rap-
presenta una sezione di pelle glabra. In essa sono rappresentate va-
rie terminazioni incapsulate ed alcune terminazioni libere. Una di
queste si vede a sinistra. Essa si diparte dal plesso sottocutaneo ed
arriva all'epidermide. Un'altra a partenza dallo strato sotto-papillare
mostrata a destra nella stessa figura.
La Fig. 6-2 mostra delle terminazioni libere ingrandite. Si vede
come la fibra nervosa dopo avere perso la guaina mielinica, resta
avvolta dalla guaina dello Schwann. Solo una piccola regione, pro-
prio alla fine della terminazione, rimane scoperta. Accanto a termi-
nazioni libere che originano da fibre mieliniche, molte rappresenta-
no la continuazione di fibre amieliniche.
151
152
153
Cellule di Schwann
Guaina mielinica
Fig. 6-1 - Sezione di pelle glabra tagliata trasversalmente attraverso le creste
papillari. Si vedano i tipi pi importanti di meccanocettori cutanei.
Fig. 6-2 - Disegno di due terminazioni libere basato su fotografie prese al mi-
croscopio elettronico.
Le terminazioni incapsulate sono terminazioni nervose ricoperte
da strutture connettivali pi o meno complesse. Sono particolar-
mente diffuse nelle regioni dove la sensibilit pi sviluppata. Le
pi importanti sono:
a) I corpuscoli di Meissner. Si trovano nelle papille del derma.
La loro distribuzione nella cute illustrata nella Fig. 6-1. Struttu-
ralmente i corpuscoli di Meissner sono formati dalle terminazioni
(da due a sei) di una fibra mielinica di grosso calibro, che si ramifi-
cano intorno a cellule piatte di tipo epitelioide. Il complesso av-
volto da una guaina connettivale. Una serie di sepimenti a partenza
dalla guaina dividono il corpuscolo in cellette incompletamente se-
parate.
b) I corpuscoli del Pacini. Si trovano nei tessuti sottocutanei,
nei legamenti, nel periostio ed anche nel mesentere e nel perito-
neo. La loro posizione nella cute mostrata nella Fig. 6-1. Per la
loro struttura vedi Cap. 3, Fig. 3-1.
c) I corpuscoli del Ruffini. Sono presenti nel derma della pelle
glabra e pelosa. La terminazione nervosa, continuazione di una fi-
bra mielinica di grosso calibro, si ramifica e prende contatto con
una serie di fibrille collagene ricoperte da una capsula (Fig. 6-3).
154
Fig. 6-3 - Corpuscolo del Ruffini. La capsula stata parzialmente asportata. Si
vede lo stretto contatto tra terminazioni nervose e fibrille collagene.
L'aspetto globale del recettore e la sua posizione nella cute illu-
strato nella Fig. 6-1.
d) I dischi di Merkel. Sono molto frequenti nella pelle glabra
della mano e del piede. Pi rari nella pelle ricoperta da peli. Si tratta
di recettori intermedi per complessit tra quelli incapsulati e le
terminazioni libere. Le fibre nervose di questo recettore sono mie-
liniche. Esse perdono la loro guaina mielinica in prossimit dell'e-
pitelio cutaneo, si dividono quindi ripetutamente (vedi Fig. 6-1) e
si insinuano o si accostano allo strato epiteliale germinativo. Ogni
ramo di divisione termina in una struttura ovoidale che fa contatto
con una cellula a forma di disco, la cellula di Merkel (Fig. 6-4).
Questa per il suo aspetto si distingue nettamente dalle altre cellule
epidermiche.
Dal punto di vista funzionale conviene esaminare separatamente
i recettori della pelle glabra, quelli della pelle ricoperta da peli e
quelli delle articolazioni.
. Nella pelle glabra si trovano tutti e quattro i tipi di recettori a
struttura complessa descritti sopra (Fig. 6-1). Tutti essi sono inner-
vati da fibre mieliniche del gruppo II (A beta). I dischi di Merkel
ed i corpuscoli del Ruffini sono recettori a lento adattamento. Le
fibre che li innervano rispondono con una forte scarica iniziale non
appena lo stimolo cutaneo stato applicato e poi, per tutta la du-
rata della stimolazione con una scarica continua, proporzionale al-
l'intensit dello stimolo. I corpuscoli del Meissner sono recettori a
rapido adattamento. Essi rispondono con una brusca scarica all'ap-
plicazione dello stimolo, ma cessano di sparare anche se lo stimolo
viene mantenuto. Scaricano di nuovo quando lo stimolo tolto. I
corpuscoli del Meissner sono sensibili a stimoli meccanici periodici
di bassa frequenza (risposta ottimale 30-40 c/sec). I corpuscolo del
Pacini hanno propriet simili a quelli del Meissner, ma la frequenza
ottimale cui rispondono a stimoli periodici di circa 250 c/sec. I
corpuscoli del Meissner sono responsabili della submodalit tattile
chiamata tremore, i corpuscoli del Pacini della sensibilit vibratoria.
Nella pelle coperta da peli troviamo ancora le terminazioni in-
capsulate descritte sopra, soprattutto i corpuscoli del Ruffini e
quelli del Pacini. Inoltre sono presenti i recettori del follicolo pili-
fero. La loro morfologia mostrata nella Fig. 6-5. Si tratta di re-
155
Cellula basale
dell'epidermide
Cellula di Merkel
Terminazione nervosa
Fig. 6-4 Disco di Merkel. Disegno basato su una fotografia presa al microsco-
pio elettronico.
156
Fig. 6-5 - Terminazioni nervose intorno al follicolo pilifero.
Fig. 6-6 - Rappresentazione semischematica dei quattro tipi fondamentali di
recettori articolari.
157
cettori a rapido adattamento innervati da una fibra mielinica di tipo
II. Sono presenti inoltre, come d'altronde nella pelle glabra, numerose
terminazioni libere. Queste possono derivare da fibre A beta, A delta
o C.
Nelle articolazioni gli autori moderni descrivono quattro tipi di
recettori. Essi vengono indicati con i numeri romani: recettori arti-
colari di tipo I, di tipo II, di tipo III e di tipo IV. Il loro aspetto
rappresentato schematicamente nella Fig. 6-6. Esistono notevoli
analogie strutturali tra i quattro tipi di recettori articolari ed altri
tipi di recettori posti nella cute o nei tendini. I recettori di tipo I
sono una variet dei corpuscoli del Ruffini, i recettori articolari di
tipo II sono assai simili ai corpuscoli del Pacini, quelli di tipo III
sono analoghi agli organi tendinei del Golgi ed infine il IV tipo
rappresentato da terminazioni libere amieliniche. A parte quest'ul-
timo recettore che responsabile della sensibilit dolorifica, gli al-
Fig. 6-7 - Distribuzione dei recettori articolari nella capsula e nei legamenti
del ginocchio.
158
159
tri sono recettori del senso di posizione e di movimento. La Fig.
6-7 mostra la disposizione dei vari recettori nell'articolazione del
ginocchio.
Nell'ultimo decennio sono state addotte prove convincenti che
accanto ai recettori articolari anche quelli muscolari e soprattutto i
fusi neuro-muscolari abbiano un ruolo nella propriocezione. In fa-
vore di questo punto di vista parla, ad esempio, il fatto che in pa-
zienti cui stata sostituita l'articolazione dell'anca, il senso di posi-
zione ancora presente. Per quanto il contributo alla propriocezio-
ne dei recettori articolari e muscolari sia materia di disputa, da
molti autori si ammette che i recettori articolari siano soprattutto
importanti per il senso di posizione e movimento delle articolazio-
ni distali (ad es. dita delle mani, dei piedi), mentre quelli muscolari
per il senso di posizione e di movimento delle articolazioni prossi-
mali (anca, ginocchio).
7) VIE AFFERENTI PRETALAMICHE DELLA
SENSIBILITA' SOMATICA
Gli impulsi provenienti dai recettori periferici sono portati al
midollo spinale da fibre che hanno la loro origine nelle cellule op-
positopolari (cellule a T) dei gangli spinali. Il ramo centrale di que-
sti neuroni entra nel midollo spinale formando le radici dorsali. In
ogni radice possiamo distinguere due porzioni: una mediale, una
laterale. Quella mediale formata essenzialmente da fibre mielini-
che di grosso calibro, quella laterale composta da fibre di piccolo
calibro mieliniche ed amieliniche. Questa dicotomia, presente nelle
radici dorsali, persiste nel decorso successivo dei due gruppi di fi-
bre e correla con le loro propriet funzionali. La porzione mediale
infatti d origine al sistema dorsale delle vie afferenti e successiva-
mente al lemisco mediale, la parte laterale d origine al sistema an-
terolaterale, quello che anticamente veniva chiamato il sistema spi-
no-talamico. Dal punto di vista funzionale i due sistemi sono radi-
calmente diversi. Il sistema lemniscale responsabile delle proprie-
t discriminative del tatto-pressione, il cosiddetto tatto epicritico,
del senso di posizione e del senso di vibrazione; il sistema antero-
laterale del tatto grossolano o tatto protopatico, in piccola parte di
quello epicritico e della sensibilit termica, dolorifica e del prurito.
Sistema dorsale e lemnico mediale
La concezione anatomica classica di questo sistema era che es-
so fosse formato da fasci di sostanza bianca che prendevano origi-
ne dai gangli spinali ed ascendevano senza interrompersi nei cordo-
160
161
Cervel l et t o
Nucl eo cuneat o
Fasci o spi no-
cerebel l are
dorsal e
Lemni sco
medi al e
Nucl eo Z
Fascicolo
cuneat o
Fascicolo
gracile
Colonna di Clarke
B
Nucleo
ventrale
portelo
laterale del
talamo
Sezione cervicale
del mi dol l o
spinale
Sezione lombare
del mi dol l o
spinale
A
ni posteriori terminando nei nuclei gracile e cuneato. Tale idea del
sistema dorsale si profondamente modificata negli ultimi anni. Se
vero che molte fibre dei cordoni posteriori sono fibre di primo
ordine, fibre cio che nascono nei gangli spinali, vero anche che
molteplici fibre che decorrono in questi cordoni sono fibre di se-
condo ordine, fibre cio che originano dalle cellule delle corna gri-
gie posteriori. Inoltre le fibre che portano informazioni ai nuclei
gracile e cuneato non decorrono solo nei cordoni posteriori, ma
anche nelle porzioni dorsali dei cordoni laterali. Quindi una parte
dei cordoni laterali deve essere considerata come appartenente al
sistema dorsale. I nfine esistono fibre discendenti che decorrono
nei cordoni dorsali. Uno schema moderno, anche se semplificato,
delle vie ascendenti nel midollo spinale facenti parte del sistema
dorsale mostrato nella Fig. 7-1.
Nella figura sono presenti separatamente il decorso delle vie
che portano il tatto-pressione (A) e il senso di posizione (B). Per
quanto riguarda il tatto-pressione non v' differenza nell'organizza-
zione delle fibre che entrano nel midollo spinale ai vari livelli mi-
dollari. Sia per le fibre lombari che per quelle cervicali esistono tre
percorsi che portano l'informazione ai nuclei gracile e cuneato: a)
un percorso diretto, senza sinapsi nel midollo spinale, lungo i cor-
doni posteriori. Questo il percorso classico dei vecchi testi di ana-
tomia; b) un percorso indiretto con sinapsi nelle corna grigie poste-
riori e fibra di secondo ordine che ascende lungo i cordoni poste-
riori; c) un secondo percorso indiretto con sinapsi nelle corna gri-
gia posteriori e fibra di secondo ordine che sale lungo i cordoni
dorso-laterali.
Il percorso che seguono le fibre che portano il senso di posizio-
ne indicato in B. V' una diversit nel tragitto delle fibre prove-
nienti dagli arti superiori ed inferiori. Mentre quelle provenienti
dagli arti superiori seguono il percorso classico nel fascicolo cunea-
to, quelle degli arti inferiori dopo un breve percorso nel fascicolo
gracile fanno sinapsi nella colonna di Clarke e poi ascendono lungo
i cordoni dorsolaterali. Le fibre provenienti dagli arti superiori ter-
Fig. 7-1 - Schema del sistema dorsale e del lemnisco mediale. A: decorso delle
fibre che portano la sensibilit tatto-pressione; B: decorso delle fibre prove-
nienti dai recettori articolari e muscolari a lento adattamento presumibilmente
responsabili del senso di posizione.
minano nel nucleo cuneato, quelle degli arti inferiori non terminano
nel nucleo gracile. Esse terminano in un nucleo rostrale adiacente
ai nuclei vestibolari che prende il nome di nucleo Z. Fibre dal
nucleo di Clarke arrivano anche al cervelletto. Queste per non
intervengono nella propriocezione cosciente.
162
163
Infine accanto alla grande massa di fibre ascendenti nei cordoni
dorsali si trovano anche fibre discendenti. Queste hanno la loro
origine nei nuclei gracile e cuneato e terminano nelle corna grigia
posteriori. Si pensa che intervengano nel controllo delle informa-
zioni ascendenti e soprattutto nel controllo del dolore.
La grande via ascendente della sensibilit tattile epicritica e
del senso di posizione prende il nome di lemnisco mediale. Essa na-
sce dai nuclei gracile, cuneato e dal nucleo Z (Fig. 7-1).
I nuclei gracile e cuneato sono stati estesamente studiati in
questi ultimi anni sia dal punto di vista anatomico che funzionale.
I stologicamente essi si dividono in due zone citoarchitettoniche:
una dorsale, una situata rostralmente e ventralmente alla prima. La
zona dorsale caratterizzata da grandi cellule rotonde con ricca
arborizzazione dendritica, la zona ventrale-rostrale formata da
cellule di medio calibro con lunghi dendriti. La prima zona per il
caratteristico raggrupparsi delle sue cellule viene chiamata zona a
grappolo ("cluster zone") o anche, per l'aspetto che ha nella scim-
mia, "pars rotunda"; la seconda zona viene chiamata zona reticolare
("reticular zone"). La pars rotunda riceve ricche proiezioni pre-
cisamente organizzate dalle fibre di primo ordine dei cordoni po-
steriori, particolarmente dalle porzioni distali degli arti. La zona
reticolata ha afferenze da fibre sia di primo che di secondo ordine
ed in connessione soprattutto con le porzioni prossimali degli
arti. La zona reticolata riceve afferenze dalla corteccia cerebrale.
La registrazione extracellulare dei potenziali d'azione di singoli
neuroni dei nuclei delle colonne dorsali ha dimostrato che la mag-
gior parte di essi sono "modalit-specifici", rispondono cio solo
ad una modalit sensoriale. Non v' quindi convergenza su un sin-
golo neurone di informazioni tattili e propriocettive. Non solo, ma
se un neurone risponde, ad esempio, a recettori della parte non pe-
losa della cute, esso non risponde alla stimolazione dei peli adia-
centi alla zona che eccita il neurone. Non v' quindi convergenza
nemmeno tra le varie submodalit somato-sensoriali. I campi recet-
tivi tattili dei nuclei gracile e cuneato sono piccoli, specie in corri
s
pondenza delle porzioni distali del corpo (polpastrelli delle dita,
faccia, ecc.). I neuroni tattili possono essere a rapido o a lento
adattamento. Esistono neuroni che rispondono alla vibrazione
(unit pallestesiche) ed altri sensibili al movimento delle articola-
zioni (unit propriocettive). Unit propriocettive a rapido adatta-
mento si trovano sia nel nucleo gracile che nel nucleo cuneato; uni-
t propriocettive a lento adattamento, verosimilmente responsabili
del senso di posizione, sono frequenti nel nucleo cuneato, rare nel
gracile. Ci in accordo coi dati anatomici che l'informazione sul
senso di posizione degli arti inferiori termina prevalentemente nel
nucleo Z.
Le propriet descritte fin'ora sono proprie dei neuroni della
zona rotonda dei nuclei gracili e cuneati. Queste propriet vengono
chiamate propriet lemniscali, in quanto esse si ritrovano nel lemni-
sco mediale. E' importante notare che le propriet lemniscali - campi
recettivi piccoli, segregazione delle varie modalit e submodalit
sensoriali ed infine, non citata prima, costanza di risposta a stimo-
lazioni ripetute - sono le propriet necessarie per la discriminazio-
ne degli stimoli. Se, ad esempio, fino dai primi stadi di elaborazione
l'informazione tattile si mescolasse a quella dolorifica, il sistema
nervoso avrebbe un'enorme difficolt ad approntare le risposte
specifiche per rispondere selettivamente ad una delle due modalit
sensoriali. Analogamente, se i campi recettivi fossero gi grandi al-
l'inizio del processo di elaborazione dell'informazione tattile, il si-
stema nervoso non sarebbe in grado di segnalare se uno stimolo
forte o due stimoli deboli spazialmente vicini siano stati applicati
alla cute, in quanto in entrambi i casi lo stesso neurone sarebbe
stato eccitato con la stessa intensit. Infine la costanza del fluire
dell'informazione ad ogni stimolo permette ai centri superiori di
decidere se rispondere o no agli stimoli. Se con una stimolazione
ripetuta la risposta cessasse, il nostro organismo perderebbe parec-
chia libert nelle sue decisioni. Vedremo in seguito che le propriet
lemniscali sono proprie anche dei nuclei talamici cui il lemnisco
mediale arriva e delle aree somatiche della corteccia cerebrale.
164
165
Il quadro delle risposte dei neuroni della zona reticolare pi
eterogeneo di quello della pars rotunda. Se si trovano ancora neu-
roni con caratteristiche lemniscali, si trovano per anche cellule
con campi recettivi molto grandi e cellule che rispondono a pi di
una modalit sensoriale. Tra queste vi sono alcune che rispondono
al dolore oltre che al tatto. Vi sono differenze tra la pars rotunda e
la parte reticolare anche per quanto riguarda le efferenze. I neuroni
della pars rotunda mandano i loro assoni a formare il lemnisco me-
diale, i neuroni della parte reticolare hanno vari destini. Essi posso-
no: a) contribuire al lemnisco mediale; b) mandare i loro assoni
nella pars rotunda, agendo da interneuroni e modulando cos l'atti-
vit di questa zona citoarchittetonica; c) inviare fibre al cervellet-
to; d) inviare fibre ad altre strutture sottocorticali come ad es. le
olive inferiori ed i collicoli superiori ed inferiori.
Sistema cervicale laterale
Accanto ai due grandi sistemi ascendenti della sensibilit soma-
tica: il sistema dorsale ed il sistema antero-laterale, un terzo siste-
ma - il sistema cervicale laterale - noto da tempo nei carnivori,
stato dimostrato anche nei primati. Assoni di secondo ordine che
nascono dalle lamine III, V e soprattutto IV del midollo spinale,
ascendono nei cordoni dorsolaterali e terminano in un gruppo di
cellule poste a livello dei primi due segmenti cervicali in prossimit
delle corna grigia posteriori. I neuroni di queste cellule mandano i
loro assoni nel lemnisco mediale controlaterale. Il decorso del si-
stema cervicale laterale chiamato anche sistema spino-cervico-tala-
mico mostrato nella Fig. 7-2, A.
Le cellule del nucleo cervicale laterale rispondono essenzial-
mente a stimoli tattili superficiali, alcune per sono sensibili a sti-
moli nocicettivi. Come gi accennato questo nucleo stato studia-
to prevalentemente nel gatto. Tuttavia si ammette che le propriet
neuronali nei primati non siano molto dissimili. L'opinione che il
nucleo cervicale laterale sia nell'uomo una struttura vestigiale non
A B
Fig. 7-2 - Schema dei sistemi cervicale-laterale (spino-cervico-talamico) e ante-
ro-laterale. Il primo rappresentato in A, il secondo in B. Del secondo mo-
strata solo la componente neo-spino-talamica.
attualmente accettata. E' verosimile invece che nella scimmia e
nell'uomo parte dei neuroni del nucleo cervicale laterale siano in-
corporati nelle adiacenti corna grigie posteriori. Il sistema cervicale
laterale appare quindi come un sistema in grado di trasmettere in-
formazioni tattili e nocicettive dalla periferia al talamo.
166
Sistema antero-laterale
Il sistema antero-laterale rappresenta la seconda grande via
ascendente della sensibilit somatica cosciente. Le sensazioni di
caldo, freddo, dolore (con le eccezioni citate sopra) e prurito sono
portate da questo sistema. Inoltre esso responsabile anche del
tatto grossolano (protopatico) ed in una certa misura anche di
quello epicritico. A differenza del sistema dorsale che nel midollo
spinale ha un decorso ipsilaterale rispetto al lato del corpo che in-
nerva, le fibre del sistema anterolaterale si crociano nel midollo
spinale. Le fibre infatti di questo sistema entrano attraverso le ra-
dici dorsali e fanno sinapsi nelle corna grigie posteriori. Da qui par-
tono fibre di 2
ordine che si decussano nella commissura bianca
anteriore e salgono verso i centri superiori. La Fig. 7-2 B riassume
lo schema organizzativo generale del sistema antero-laterale a livello
midollare. Essa mostra inoltre il decorso del tratto spino-talamico.
Il sistema antero-laterale consta di tre componenti:
1) Spino-reticolare. Si tratta di fibre che dopo il decorso nel mi-
dollo spinale indicato nella figura terminano nel tronco dell'en-
cefalo facendo sinapsi con i neuroni della sostanza reticolare.
2) Paleo-spino-talamico. Questa via va direttamente dai neuroni di
2
ordine del midollo spinale al nucleo centralis lateralis, ed in
parte al nucleo paracentralis. Entrambi questi nuclei apparten-
gono al gruppo dei nuclei talamici aspecifici.
3) Neo-spino-talamico. E' un fascio che nasce, come il paleo-spi-
no-talamico, dai neuroni midollari. Esso termina nel complesso
ventro-basale del talamo e precisamente nella sua parte poste-
riore. Parte delle sue fibre terminano nel complesso nucleare
posteriore.
Si parlava tradizionalmente di due fasci spino-talamici: uno an-
teriore ed uno laterale. In realt il fascio spino-talamico un unico
sistema di fibre che decorre prevalentemente nel cordone laterale,
spingendosi medialmente in quello anteriore. La Fig. 7-3 mostra in
maniera schematica la posizione del fascio spino-talamico nel mi-
dollo spinale.
Fascio piramidale Fibre propriospinali
Fig. 7-3 - Diagramma semplificato del midollo spinale che mostra la disposi-
zione segmentale delle fibre nei maggiori tratti ascendenti e discendenti. Le
fibre propriospinali sono indicate dalla punteggiatura. C = cervicale; T = tora-
cico; L = lombare; S = sacrale.
Data l'origine del sistema antero-laterale da neuroni delle corna
grigie posteriori del midollo spinale, le propriet funzionali di que-
sto sistema possono essere studiate registrando extracellularmente
l'attivit dei neuroni posti nelle lamine da cui il sistema origina.
Queste sono essenzialmente le lamine I e V di Rexed. I neuroni
della lamina I rispondono a stimoli dolorifici, quelli della lamina V
a stimoli tattili, termici e dolorifici. Esistono in questa lamina neu-
roni unimodali, con campi recettivi piccoli. Questi dovrebbero es-
sere le cellule d'origine del fascio neo-spino-talamico. Molti neuroni
invece hanno campi recettivi grandi e mostrano una convergenza
polisensoriale. Possono rispondere, ad esempio, a stimoli tattili e
termici o a stimoli somatici e viscerali. Questi neuroni con campi
recettivi grandi, polisensoriali danno informazioni di carattere ge-
nerico. Essi segnalano se uno stimolo stato applicato o no e pos-
sono dire qualche cosa sul tipo di stimolo. Non sono invece in gra-
167
Fascicoli gracile e cuneato
Fascio piramidale
Sistema antero-laterale
168 169
do di dare informazioni su dove lo stimolo stato applicato. Questi
neuroni privi di specificit danno origine alla componente spino-
reticolare. La loro funzione quella di attivare la sostanza reticolare
facilitante del tronco dell'encefalo. Questa a sua volta regola le
attivit globali dell'organismo. Un aumento della sua attivit sve-
glia l'animale o l'uomo se questi addormentato o aumenta l'at-
tenzione globale dell'individuo sveglio rendendolo pi atto a ri-
spondere agli stimoli che lo circondano. Funzioni simili a quelle
della componente spino-reticolare dovrebbe avere anche la compo-
nente paleo-spino-talamica. Al contrario la componente neo-spino-
talamica sarebbe responsabile degli aspetti discriminativi per la
temperatura, per il dolore ed in parte per la modalit tatto-pres-
sione.
Sistema trigeminale
II sistema trigeminale completa il quadro delle vie della sensibi-
lit somatica. Esso infatti responsabile della sensibilit della fac-
cia, della congiuntiva e delle mucose delle cavit nasale ed orale.
I neuroni d'origine del nervo trigemino (V nervo cranico) si
trovano nel ganglio semilunare o di Gasser. Si tratta di cellule op-
positopolari (cellule a T) di cui un assone va alla periferia, l'altro
al tronco dell'encefalo. Il nervo nel suo decorso periferico si divide
in tre branche: la branca oftalmica, la branca mascellare e quella
mandibolare. La Fig. 7-4 mostra la distribuzione cutanea dei tre
nervi.
Il ramo centrale del V nervo cranico entra nel tronco dell'ence-
falo a livello del ponte. Qui la maggior parte delle fibre del nervo si
dividono in rami brevi ascendenti ed in rami lunghi discendenti. 1
primi terminano nel nucleo sensoriale principale (vedi Fig. 7-5), gli
altri discendono come un tratto di fibre ben distinto, il tratto spi-
nale del V nervo, fino al secondo segmento cervicale. Durante il loro
tragitto le fibre discendenti lasciano il tratto spinale e terminano o
come collaterali delle fibre che proseguono verso il basso o come
terminazioni vere e proprie nel nucleo del tratto spinale.
Fig. 7-4 - Distribuzione periferica del nervo trigemino e degli adiacenti nervi
cervicali.
Il nucleo principale ed il nucleo del tratto spinale (chiamato
anche nucleo trigemino-spinale) sono strutturalmente diversi. Il
primo, filogeneticamente pi recente considerato omologo ai nu-
clei dei cordoni posteriori; l'altro simile alle lamine dorsali delle
corna grigie posteriori. Il nucleo del tratto spinale citoarchitteto-
nicamente suddivisibile in tre parti: pars oralis, pars intermedia,
pars caudalis (Fig. 7-5).
Accanto al nucleo principale ed al nucleo del tratto spinale v'
un terzo nucleo trigeminale sensoriale: il nucleo mesencefalico. Esso
formato principalmente da cellule oppositopolari simili a
quelle del ganglio semilunare. L'assone periferico di questi neuroni
Fig. 7-5 - Organizzazione dei nuclei trigeminali nel gatto. Il muso rappresen-
tato a tutti i livelli rostro-caudali del complesso. Esso mostrato a due livelli.
In quello causale si vede la rappresentazione degli arti nel nucleo della colonna
dorsale.
esce dal sistema nervoso e seguendo la branca mandibolare del V
nervo arriva ai muscoli della masticazione. Il ramo centrale ha co-
me destinazione pi importante il nucleo motorio del V. (Per le
funzioni motorie del trigemino si rimanda ai testi di anatomia). Al-
tre fibre centrali del nucleo mesencefalico terminano al cervelletto.
Dal punto di vista funzionale il nucleo mesencefalico responsabile
di riflessi propriocettivi a partenza dai muscoli masticatori, ad es.
del riflesso mandibolare, e della sensibilit propriocettiva incosciente.
Un suo ruolo nella sensibilit cosciente non dimostrato.
I neuroni del nucleo sensoriale principale hanno propriet fun-
zionali del tutto simili a quelle dei neuroni dei nuclei gracile e cu-
neato. Essi rispondono ad una sola forma di stimolazione meccanica
ed i loro campi recettivi sono piccoli. Propriet lemniscali ha pure
la pars oralis del nucleo del tratto spinale. Al contrario la pars
caudalis ha propriet tattili protopatiche ed essenziale per la sen
171
sibilit termica e dolorifica della faccia. Lesioni di questo nucleo,
eseguite talvolta in chirurgia umana per alleviare nevralgie trigemi-
nali incurabili con terapie mediche, mentre determinano anestesia
termo-dolorifica, portano a deficit della sensibilit tattile del tutto
trascurabile. Infine la pars intermedia non sembra contribuire alla
somestesia cosciente, le sue fibre efferenti vanno al cervelletto.
La distinzione funzionale tra nucleo principale e pars caudalis
del nucleo del tratto spinale omologa a quella che si ha per la
sensibilit del corpo tra sistema dorsale e sistema antero-laterale.
Ci confermato dalle terminazioni delle fibre dei due nuclei tri-
geminali. Il nucleo principale manda infatti le sue fibre al comples-
so ventro-basale del talamo dove termina anche il lemnisco mediale;
la pars caudalis innerva il complesso nucleare posteriore ed i nuclei
talamici aspecifici. La pars oralis del nucleo del tratto spinale
dovrebbe corrispondere alla componente neospinotalamica del si-
stema antero-laterale. Le sue fibre infatti terminano nel complesso
ventro-basale.
Nuclei sensitivi
principali Ganglio
semilunare
Nucleo orale
Nucleo della
col onna
dorsale
Nucleo caudale
173
8) IL TALAMO
II terzo neurone delle grandi vie della sensibilit somatica po-
sto nel talamo. Solo una piccola parte per di questa regione del
cervello ha funzioni somato-sensoriali. Il talamo una struttura
eterogenea formata da molti nuclei a funzione diversa, la maggior
parte dei quali invia informazioni ad aree particolari della corteccia
cerebrale. In questo capitolo ci occuperemo dell'organizzazione ge-
nerale del talamo. I nuclei della sensibilit somatica verranno trat-
tati in maggior dettaglio di quelli con altre funzioni. Questi ultimi
verranno ripresi quando si parler delle vie visive, uditive e delle
grandi vie ascendenti con funzione motoria.
Macroscopicamente il talamo formato da due parti simmetri-
che ovoidali di sostanza grigia, separate dal 3
ventricolo. Ogni met
del talamo consta di una serie di nuclei distinguibili dal punto di
vista citoarchitettonico e mieloarchitettonico. Questi nuclei sono
divisi in tre gruppi da una lamina a forma di Y di sostanza bianca,
la lamina midollare interna. I tre gruppi nucleari (Fig. 8-1) sono i
nuclei anteriori, i nuclei mediali ed i nuclei laterali.
La lamina midollare interna non strutturalmente omogenea.
In essa si trovano vari nuclei di sostanza grigia chiamati nuclei in-
tralaminari del talamo. I pi importanti di essi sono: il nucleo cen-
trale laterale, il nucleo paracentrale, il nucleo centromediano ed il
nucleo parafascicolare. Inoltre non compresi nella classificazione
in nuclei anteriori, mediali e laterali un gruppo di nuclei posti
medialmente in corrispondenza della zona di unione dei due tala-
mi. Questi nuclei prendono il nome di nuclei della linea mediana.
174
175
Int. lam.
Int. med. lam.
ac.
opt. t r i g .
Fig. 8-1 - Ricostruzione del talamo di uomo visto dorso-lateralmente. La parte
posteriore separata da quella anteriore per mostrare alcuni aspetti della strut-
tura interna. Il nucleo reticolare stato tolto eccetto nel polo rostrale. Abbre-
viazione dei nuclei talamici: A = n. anteriore; CM = Centromediano; Int. lam. =
lamina midollare interna; LD e LP = n. laterale dorsale e n. laterale posteriore;
LG = corpo genicolato laterale; LM = corpo genicolato mediale; MD = mediale
dorsale; ML = linea mediana; P = pulvinar; R = n. reticolare; VA = n. ventrale
anteriore; VL = n. ventrale laterale; VPL e VPM = n. ventroposterolaterale e
ventroposteromediale.
Infine il talamo avvolto esternamente da un sottile strato di cel-
lule frammisto a fibre. Questo strato di cellule prende il nome di
nucleo reticolare del talamo. Esso si vede nella Fig. 8-1 in corri-
spondenza del polo rostrale del talamo. Le sue altre parti sono state
rimosse per permettere di vedere i nuclei anteriori, mediali e laterali.
Il nucleo reticolare del talamo separato dal corpo principa-
le del talamo da una lamina di sostanza bianca chiamata lamina mi-
dollare esterna.
Il talamo dal punto di vista delle efferenze e delle afferenze
strettamente connesso alla corteccia cerebrale. Se si fa una ablazione
corticale diffusa si nota che la maggior parte dei nuclei talamici
degenerano (degenerazione retrograda), una parte resta intatta. I
nuclei cortico-dipendenti prendono il nome di nuclei talamici spe-
cifici, i nuclei non cortico-dipendenti (quelli che non degenerano)
prendono il nome di nuclei talamici aspecifici o a proiezione dif-
fusa
I nuclei talamici specifici sono quelli che formano le masse nu-
cleari anteriore, mediale e laterale. I nuclei talamici aspecifici sono
i nuclei intralaminari del talamo, quelli della linea mediana ed il
nucleo reticolare.
Nuclei talamici aspecifici
Il concetto classico sulla funzione dei nuclei talamici aspecifici
che questi nuclei facciano parte del sistema reticolare. La loro
funzione sarebbe quella di modulare l'attivit elettrica corticale in-
tervenendo cos nella regolazione dello stato di veglia, di sonno e
della intensit dell'attenzione. Essi, a differenza dei nuclei talamici
specifici, non convoglierebbero informazioni specifiche, n senso-
riali n di altro tipo, alla corteccia, ma permetterebbero che queste
siano utilizzate.
A favore dell'ipotesi aspecifica, "attenzionale", dei nuclei tala-
mici aspecifici sta il fatto che la loro stimolazione esercita un'azione
diffusa su entrambi gli emisferi cerebrali. Inoltre il tipo di onda che
si ottiene in corteccia per stimolazione di questi nuclei diversa da
quella che si ha per stimolazione dei nuclei specifici.
La Fig. 8-2 mostra i risultati di un esperimento in cui si appli-
cato un singolo shock elettrico ad un nucleo talamico specifico ed
ad un nucleo talamico aspecifico. In entrambi i casi la registrazione
macroelettrodica con elettrodi posti sulla superficie corticale. Si
vede che la stimolazione del nucleo aspecifico d un'onda negativa,
quello del nucleo specifico un'onda positivo-negativa.
La spiegazione di questi dati la seguente: i nuclei talamici
specifici inviano le loro fibre agli strati intermedi della corteccia
cerebrale, soprattutto al 4
strato. Da qui l'informazione si propaga
agli altri strati. Il primo evento che si ha una depolarizzazione
negli strati intermedi. Se l'elettrodo fosse in corrispondenza di
questi si vedrebbe un'onda negativa. Questo per in superficie.
Ora la superficie corticale, quando gli strati intermedi sono negativi
diventa per ragioni fisiche (teoria del dipolo) positiva. La prima
MI.
176
Fig. 8-2 - Risposta evocata in corteccia visiva dopo stimolazione elettrica del
corpo genicolato laterale (A) e di un nucleo talamico aspecifico (B e C). La
risposta in C stata ottenuta dopo lesione del corpo genicolato laterale.
onda quindi che si registra un'onda positiva. Successivamente o
per eccitazione sinaptica dei neuroni posti negli strati superficiali o
per una depolarizzazione dei dendriti apicali delle cellule piramida-
li gli strati superficiali diventano negativi. L'onda superficiale che
si registra, un'onda negativa.
L'interpretazione dell'onda negativa dopo stimolazione dei nu-
clei talamici aspecifici si basa sugli stessi principi. Si ammette per
in questo caso che le efferenze di questi nuclei terminino diretta-
mente negli strati corticali superficiali. Da qui una depolarizzazione
degli elementi nervosi posti in questi strati e soprattutto dei
dendriti apicali. Essendosi depolarizzati gli strati superficiali l'elet-
trodo posto in superficie registra un'onda negativa. Recenti dati
anatomici ottenuto coi metodi di trasporto assonale, hanno con-
177
fermato questa interpretazione, inizialmente puramente teorica,
dei dati elettrici. E' stato dimostrato infatti che gli strati superfi-
ciali sono il bersaglio maggiore, anche se non l'unico, dei neuroni
posti nei nuclei talamici aspecifici.
Perch questi dati sono in favore di una interpretazione "mo-
dulatoria", attenzionale, dei sistemi aspecifici? Noi sappiamo (vedi
vol. 1) che l'efficacia sinaptica di un "input" (afferenza) dipende
dalla vicinanza della sua terminazione al monticolo assonale. L'af-
ferenza aspecifica termina sui dendriti apicali delle cellule corticali
piramidali. L"`input" aspecifico quindi debole, non in grado di
fare nascere dei potenziali d'azione. Esso tuttavia modifica la ecci-
tabilit corticale e, data la sua influenza diffusa a molte aree corti-
cali, la modifica in maniera globale. Si ha quindi un controllo da
parte dell"`input" aspecifico dell'efficacia di quello specifico. La
maggiore o minore capacit dei neuroni corticali di rispondere a
quest'ultimo produce modificazioni globali del nostro comporta-
mento e dei nostri stati mentali, produce cio la veglia attenta, la
veglia rilassata, il sonno.
Altre prove a favore dell'ipotesi "modulatoria" dei nuclei tala-
mici aspecifici si ricavano da esperimenti in cui questi nuclei ven-
gono stimolati con treni di impulsi. Se si stimolano i nuclei tala-
mici a bassa cadenza (5-14 c/sec) compaiono delle particolari ri-
sposte chiamate risposte reclutanti o potenziali a reclutamento. Un
esempio mostrato nella Fig. 8-3.
L'esame delle risposte reclutanti mostra che esse sono caratte-
rizzate da un andamento di "va e vieni" (Fig. 8-3 C). Le onde che
le formano (onde negative) prima crescono d'ampiezza e poi cala-
no. Il nome di risposte reclutanti ha origine proprio per il fatto che
occorre una prolungata stimolazione per ottenere le onde di mag-
gior ampiezza. Il motivo per cui le onde reclutanti sono un dato in
favore dell'ipotesi "modulatoria" la loro somiglianza con un
evento elettroencefalografico tipico del sonno: i fusi del sonno.
Questa somiglianza si pu facilmente osservare paragonando il
tracciato A con quello C della figura. Si vede che stimolando elet-
178 179
Fig. 8-3 - Attivit elettriche corticali. A = fuso spontaneo del sonno; B = fuso
del sonno evocato da uno shock elettrico applicato ad un nucleo talamico
aspecifico; C = risposta a reclutamento.
tricamente i nuclei talamici aspecifici si possono ottenere attivit
elettroencefalografiche assai simili a quelle del sonno. Questa asser-
zione avallata da due altri dati sperimentali. Primo, se l'animale
sonnolento, un singolo shock elettrico applicato ai nuclei talamici
aspecifici sufficiente a produrre un fuso del sonno (Fig. 8-3 B).
Secondo, la distruzione dei nuclei talamici aspecifici fa sparire dal-
l'elettroencefalogramma i fusi del sonno in maniera irreversibile.
L'insieme di questi dati indica che i nuclei talamici aspecifici sono
importanti per la sincronizzazione iniziale (fase 2) del sonno e
quindi versosimilante per uno sviluppo normale del ciclo del son-
no. E' importante notare che altri tipi di sincronizzazione elettrica
(ritmo teta, ritmo delta) non sembrano essere in relazione con i
nuclei talamici aspecifici. Infine, se una stimolazione a bassa fre-
quenza sincronizza l'elettroencefalogramma, una stimolazione dei
nuclei talamici aspecifici ad alta frequenza (200-300 c/sec) ha ef-
fetti desincronizzanti sui tracciati elettroenfalografici e risveglianti
sul comportamente dell'animale. In altre parole si ottengono effetti
analoghi a quelli che si hanno per stimolazione della sostanza
reticolare.
In tempi recenti la teoria che i nuclei talamici specifici abbiano
come funzione primaria quella di "modulare" l'attivit elettrica
c
orticale ha perso molti dei suoi sostenitori. Le critiche sono le
seguenti:
1) I nuclei talamici aspecifici sono molto eterogenei tra di loro
per formare un sistema funzionalmente omogeneo. Ad esempio i
nuclei intralaminari anteriori (centrale laterale (Cl) e paracentralis
(Pc)) sono riccamente innervati da fibre sensitive ascendenti. Essi
infatti sono i nuclei talamici bersaglio del sistema paleospinotala-
mico. Al contrario i nuclei intralaminari posteriori (il centromedia-
no (Cm) ed il parafascicularis (PD) ricevono poche fibre ascenden-
ti. Il loro "input" principalmente dalla corteccia centrale (area 4
per il Cm, area 6 per il Pf).
2) L'efferenza principale dei nuclei talamici aspecifici non
verso la corteccia, ma verso i gangli della base. Precisamente i due
nuclei intralaminari anteriori (Cl e Pc) mandano fibre al caudato,
mentre quelli posteriori (Cm e PF) inviano fibre al putamen. Que-
ste proiezioni hanno una precisa organizzazione topografica sia in
senso antero-posteriore che medio-laterale.
Da questi dati chiaro che c' una stretta relazione funzionale
tra nuclei talamici aspecifici e gangli della base. Questa relazione
confermata da studi di anatomia comparata. I n animali infatti in
cui la corteccia poco sviluppata il talamo formato quasi esclusi-
vamente dai nuclei talamici aspecifici. Quelli specifici compaiono
solo quando si sviluppa la neocorteccia. La relazione nuclei talami-
ci aspecifici - gangli della base spiega anche il perch questi nuclei
non degenerino dopo ablazione corticale. Ci dovuto al fatto
che, a differenza dei nuclei talamici specifici, quelli aspecifici inviano
le loro efferenze principali ai gangli della base. La distruzione
della corteccia lascia integri quindi i loro assoni. In conclusione, la
funzione principale dei nuclei talamici aspecifici quella di convo-
gliare informazioni di vario tipo ai gangli della base. Essi stanno a
questi gangli come i nuclei talamici specifici stanno alla corteccia.
Detto questo non ne consegue necessariamente che i dati clas-
180
181
Bici siano completamente sbagliati. L'idea che il sistema dei nuclei
talamici aspecifici sia principalmente un sistema attenzionale dif-
ficile da sostenere. E' possibile per che i nuclei talamici aspecifici
abbiano come funzione secondaria quella di attivare o di modulare
l'attivit corticale. E' abbastanza plausibile che quando essi inviano
informazioni ai gangli della base, essi contemporaneamente modu-
lino l'attivit della corteccia, rendendo questa pronta ad agire in
sinergia con i gangli stessi. Molti teorici moderni postulano che
l'attenzione sia innanzittutto capacit di preparare risposte agli sti-
moli presenti nell'ambiente. In questa luce il nesso tra attivit mo-
torie dovute ai gangli della base e modulazione dell'attivit cortica-
le appare meno strano di quanto possa sembrare a prima vista.
Un cenno a parte merita il nucleo reticolare del talamo. A dif-
ferenza dei nuclei talamici specifici il cui bersaglio principale la
corteccia e dei nuclei talamici aspecifici il cui bersaglio principale
sono i gangli della base, il nucleo reticolare invia i suoi assoni verso
gli altri nuclei talamici. E' stato proposto che la sua funzione sia
quella di controllare l'attivit di questi nuclei. Avrebbe quindi per i
nuclei talamici una funzione simile a quella della sostanza reticola-
re per la corteccia cerebrale.
Nuclei talamici specifici
I nuclei talamici specifici rappresentano una stazione obbligata
per la maggior parte delle vie ascendenti nel loro decorso verso la
corteccia cerebrale. Anche se recentemente sono state dimostrate
alcune vie che dai centri sottocorticali vanno alla corteccia senza
fare sinapsi nel talamo, si tratta sempre di vie che terminano in
corteccia in maniera diffusa. Le vie specifiche, quelle che termina-
no in zone corticali ristrette si fermano tutte nel talamo.
Secondo la classificazione classica i nuclei talamici specifici si
dividono dal punto di vista funzionale in tre classi: 1) nuclei di re-
lay sensoriali, 2) nuclei di relay non sensoriali, 3) nuclei associativi.
I nuclei di relay sensoriale sono i nuclei in cui terminano le
grandi vie della sensibilit (somatica, acustica e visiva) e che ritra-
smettono le informazioni concernenti queste modalit sensoriali
alle aree sensoriali primarie della corteccia cerebrale. I nuclei di
relay non sensoriale sono quei nuclei che ricevono il loro "input"
dalle grandi vie ascendenti non sensoriali (cervello, gangli della ba-
se, ippocampo) e a loro volta trasmettono l'informazione a ristrette
aree corticali. Infine i nuclei associativi, secondo la classificazione
classica, sarebbero dei nuclei che ricevono principalmente afferenze
da altri nuclei talamici e mandano le loro efferenze alle aree
associative corticali.
Questa classificazione stata negli ultimi anni notevolmente
modificata. Infatti stato trovato che i nuclei talamici associativi
non ricevono informazioni, se non in piccola parte, da altri nuclei
talamici. L'organizzazione di base del talamo a moduli verticali
indipendenti. Inoltre i nuclei talamici associativi ricevono, come
quelli di relay, informazioni dai centri sottostanti. Per fare un
esempio, il pulvinar, un tipico nucleo associativo della classifica-
zione tradizionale, non riceve fibre dal corpo genicolato laterale (il
nucleo di relay visivo) ma dal collicolo superiore e dal pretetto da
strutture visive cio sottocorticali complesse.
La classificazione dei nuclei talamici specifici che verr adottata
la seguente:
I) Nuclei talamici associati alle vie sensoriali
a) corpo genicolato laterale (vista)
b) corpo genicolato mediale (udito)
c) complesso ventro-basale (tatto-pressione, senso di posi-
zione)
d) gruppo nucleare posteriore (verosimilmente dolore).
Questo gruppo corrisponde ai nuclei di relay sensoriali della
classificazione tradizionale.
2) Nuclei talamici associati alle vie con funzioni motorie
a) nucl eo ventral e anteri ore
b) nucleo ventrale laterale.
Questi nuclei corrispondono ad alcuni dei nuclei di relay non
sensoriali della vecchia classificazione.
182
3) Nuclei talamici associati a funzioni emozionali o percettive
complesse
a) nuclei anteriori
b) nucl eo lateral e dorsal e
c) nucl eo medi al e dorsal e
d) nucleo laterale posteriore
e) complesso del pulvinar.
Nuclei talamici associati alle vie sensoriali
La Fig. 8-4 mostra in basso (B) una serie di sezioni trasversali
del talamo con indicata la posizione dei vari nuclei talamici, in alto
(A) una veduta laterale della corteccia cerebrale di scimmia con le
zone di proiezione corticale dei vari nuclei talamici. Vengono pre-
sentate mappe del talamo e della corteccia di scimmia in quanto
l'organizzazione sia del talamo che della corteccia molto meglio
conosciuta in questo animale che nell'uomo. Vi sono prove per
che il piano generale dell'organizzazione talamica assai simile nei
vari primati.
Il nucleo talamico associato alla sensibilit visiva il corpo ge-
nicolato laterale (GL - Fig. 8-4 B,b), quello associato alla sensibilit
acustica il corpo genicolato mediale (GM - Fig. 8-4 B,c). Il primo
manda le sue efferenze all'area 17 del lobo occipitale, il secondo
alla circonvoluzione temporale superiore. Delle propriet funzionali
di questi nuclei tratteremo nei capitoli concernenti le modalit
visive ed acustica.
11 nucleo talamico principale per la sensibilit somatica il
complesso ventrobasale del talamo. Si tratta di una voluminosa
massa di sostanza grigia suddivisibile in vari sottonuclei. Di questi i
pi importanti sono il nucleo ventro-postero-laterale (VPL) ed il
nucleo ventro-postero-mediale (VPM) (Fig. 8-4 B,b). Il VPL riceve
il lemnisco mediale ed il fascio neo-spino-talamico, il VPM riceve la
via trigeminale. Se si considerano i due nuclei assieme si vede che
nel complesso ventrobasale del talamo c' una completa rappre-
B
Fig. 8-4 - Schema dell'organizzazione talamo-corticale. A: veduta laterale
della corteccia cerebrale di scimmia. B: sezioni coronali in sequenza rostro-
caudale del talamo. Le parti marcate nella stessa maniera indicano i nuclei
talami- ci e le aree corticali nei quali proiettano. Al mostra le regioni corticali
che ricevono connessioni dal nucleo dorsale e dal complesso pulvinar-laterale
posteriore. A2 indica le regioni che ricevono dai nuclei di relay sensoriale e
da quelli associati alle vie con funzioni motorie. AD, AM e AV = nuclei
anteriori; VA e VL = nuclei ventrale anteriore e ventrale laterale; MD = n.
mediale dorsale; VPL, VPM e VPI = nuclei ventroposterolaterale,
ventroposteromediale e ventroposteroinferiore; LP = n. laterale posteriore; LD
= n. laterale dorsale; GLd = corpo genicolato laterale; GM = corpo genicolato
mediale; CL, CM, Pf = n. centrale laterale, n. centromediano, n.
f i l S i l t
184 185
Fig. 8-5 - Sezione frontale di talamo di scimmia. Registrazione effettuata dai
nuclei VPL e VPM in corrispondenza dei punti indicati con quadratini neri.
La stimolazione delle porzioni di cute indicate in nero ed in grigio dava risposte
rispettivamente forti e deboli. Notare la disposizione somatotopica con la
bocca posta medialmente e le parti caudali del corpo lateralmente.
s'entazione dell'emicorpo controlaterale, con la faccia posta me-
dialmente, e gli arti ed il tronco posti lateralmente. La disposizione
somatotopica nel piano frontale illustrata nella Fig. 8-5.
La figura rappresenta in forma grafica i risultati di un esperi-
mento di stimolazione cutanea e di registrazione di potenziali evo-
cati del complesso ventro-basale. Si vede che il toccamento della
bocca d risposte nel VM, quello della mano al bordo mediale del
VPL, infine quello degli arti inferiori al bordo laterale di questo
nucleo.
Registrando extracellularmente l'attivit dei singoli neuroni
del complesso ventro-basale del talamo si trova che questi hanno
propriet lemniscali. Sono cio unimodali, rispondono con breve
latenza e in maniera costante a stimoli tattili o propriocettivi, han-
no campi recettivi di piccole dimensioni. La Fig. 8-6 mostra le ri-
sposte (a sinistra) ed il campo recettivo (a destra) di un neurone
registrato dal complesso ventro-basale di un uomo durante un in-
tervento chirurgico. Nella parte superiore della figura (a sinistra) si
vede l'attivit di due neuroni, uno di piccola ampiezza che scarica
spontaneamente ad alta frequenza, uno di ampiezza maggiore quasi
silente; nella parte inferiore della figura (a sinistra) uno stimolo
cutaneo viene applicato per tre volte al campo recettivo dell'unit
(zona indicata in nero sul dito medio), si pu osservare che il neu-
rone pi grande scarica intensamente in risposta alla stimolazione.
Le tre deflessioni sotto i tracciati dei potenziali d'azione indicano
quando lo stimolo stato applicato.
Nel complesso ventro-basale le varie modalit e submodalit
somatosensoriali sono spazialmente segregate. I neuroni che portano
la sensibilit tatto-pressione sono concentrati posteriormente,
mentre quelli che rispondono a stimoli articolari o muscolari sono
Fig. 8-6 - Registrazione di singoli neuroni dal complesso ventrobasale di tala-
mo di uomo. Per le spiegazioni della figura vedi testo.
186
187
posti pi rostralmente. Possiamo quindi immaginare il complesso
ventro-basale come fatto di una serie di sezioni frontali in ciascuna
delle quali rappresentato un omuncolo (Fig. 8-5). Questi omun-
coli sono sovrapposti l'uno all'altro in direzione rostro-caudale.
Quelli posteriori rispondono a varie submodalit tattili (neuroni a
rapido o lento adattamento, sensibili all'eccitazione dei recettori
dei peli, della pelle glabra, vibrazione ecc.), quelli anteriori rispon-
dono a stimolazioni delle articolazioni e delle strutture profonde e
sono responsabili del senso di posizione. Nella parte posteriore del
complesso ventrobasale termina il fascio neo-spino-talamico. Esso
porta al complesso ventrobasale soltanto informazioni sulla moda-
lit tatto-pressione.
Il gruppo nucleare posteriore un complesso eterogeneo for-
mato da pi nuclei. La sua posizione si pu ricavare dalla Fig. 8-4
(B.c) dove sono indicati due dei nuclei che lo formano: il soprage-
nicolato (Sg) ed il limitante (Li). Al gruppo nucleare posteriore ar-
rivano fibre dal collicolo superiore (visive), dal corpo genicolato
mediale (uditive), e soprattutto dal fascio neo-spino-talamico (so-
matosensoriali). Di particolare interesse il fatto che molti neuroni
di questo gruppo nucleare rispondono specificatamente a stimoli
dolorosi. Poich non vi sono altre regioni talamiche sensibili a
stimoli nocicettivi, si ammette che il gruppo nucleare posteriore sia
il centro talamico del dolore. I l gruppo nucleare posteriore proiet-
ta in corteccia nella profondit del solco silviano, vicino all'area so-
matica II ed all'insula.
Nuclei talamici associati alle vie con funzione motorie
Due sono le grandi vie ascendenti che portano alla corteccia in-
formazioni elaborate da centri motori sottocorticali. Sono la via
efferente dal cervelletto e la via efferente dai gangli della base. Per
quanto riguarda la prima le fibre prendono origine nei nuclei cere-
bellari, soprattutto nel dentato, e terminano nei nuclei ventrale la-
terale (VL) e ventrale anteriore (VA). Per quanto riguarda la se-
conda, le fibre prendono origine dal globo pallido e dalla pars reti-
culata della sostanza nigra. Anche esse terminano nei due nuclei
ventrale laterale e ventrale anteriore. A sua volta questi nuclei in-
viano fibre alla vasta regione corticale formata dall'area 4 (area
motoria) e dall'area 6 (area premotoria). I nuclei VA e VL sono vi-
sibili nella Fig. 8-4 B,a, mentre la loro zona bersaglio presentata
nella stessa figura in A,b (zona a righe verticali).
Studi recenti hanno dimostrato che l'informazione cerebellare
e quella dei gangli della base non si mescola n a livello del talamo,
n a livello corticale. Schematicamente, l'area 4 riceve dalle parti
pi caudali del complesso VA-VL ed sotto il controllo cerebella-
re, la parte laterale dell'area 6 riceve da porzioni pi rostrali del
complesso ed anch'essa un bersaglio della via cerebellare, la par-
te mediale dell'area 6 e soprattutto l'area motoria supplementare
ricevono fibre talamiche da neuroni del complesso VA-VL riceventi
fibre dai gangli della base.
Nuclei talamici associati a funzioni emozionali e percettive com-
plesse
I nuclei anteriori ricevono afferenze dall'ippocampo attraverso
il fornice ed attraverso i corpi mamillari (tratto mamillo-talamico).
Essi proiettano al giro del cingolo (lobo limbico) sulla faccia me-
diale dell'emisfero. Connessioni afferenti simili a quelle dei nuclei
anteriori sono state descritte per il nucleo laterale dorsale. Le sue
efferenze sono poco conosciute. Pare che esso proietti al giro cin-
golo posteriormente ai nuclei anteriori. Considerata l'importanza
del giro cingolo per la vita emotiva, i nuclei anteriori e quello late-
rale dorsale dovrebbero fare parte di circuiti che regolano le emo-
zioni.
Il complesso mediale dorsale (MD) riceve connessioni dall'ipo-
talamo e dall'amigdala e manda efferenze a tutta la parte rostrale
del lobo frontale (Fig. 8-4 A,1). Questa vasta regione ha funzioni
cognitive superiori, intervenendo soprattutto nella previsione delle
188
189
conseguenze dei nostri atti. L'input del MD porterebbe a questa re-
gione corticale informazioni motivazionali ed affettive.
Il nucleo laterale posteriore (LP) ed il pulvinar costituiscono
gran parte del talamo posteriore. II loro sviluppo va pari passo con
lo sviluppo nei primati e soprattutto nell'uomo dell'area corticale
cui essi inviano le loro fibre: l'area associativa parieto-temporo-oc-
cipitale (Fig. 8-4 A,1). Negli ultimi anni sono state estesamente
studiate nella scimmia le afferenze e le efferenze del LP e delle va-
rie suddivisioni del pulvinar (pulvinar anteriore (PA), pulvinar me-
diale (PM), pulvinar laterale (PL) e pulvinar inferiore (PI). I risultati
possono essere schematicamente cos riassunti:
1) Il PI ed il PL ricevono informazioni dagli strati superficiali
del collicolo superiore e del pretetto ed inviano fibre alle aree visi-
ve 18-19. Inviano a queste aree informazioni visive relativamente
semplici.
2) II PM riceve informazioni dagli strati profondi del collicolo
superiore ed invia fibre alle aree associative del lobo temporale. In-
terverrebbe in funzioni visive complesse ed in funzioni uditive.
3) 11 PA ed il LP ricevono fibre dagli strati profondi del colliso-
lo superiore e mandano fibre alle aree associative del lobo parieta-
le. Questo interverrebbe nella percezione dello spazio personale
(senso del proprio corpo) ed extra personale (percezione degli og-
getti rispetto al proprio corpo; relazione degli oggetti tra di loro).
9) LA CORTECCIA CEREBRALE
La corteccia cerebrale la parte pi rostrale dell'encefalo. Si
tratta di un enorme agglomerato di sostanza grigia formato nell'uo-
mo da circa 50 miliardi di neuroni (Mountcastle 1978). La cortec-
cia cerebrale non strutturalmente omogenea. Dal punto di vista
filogenetico in essa si possono distinguere tre parti, morfologica-
mente molto diverse: l'ippocampo o archicortex, l'area piriforme
(nell'uomo rappresentata dal giro dell'ippocampo) o paleocortex
e la corteccia dorsale o neocortex. La neocorteccia si sviluppa
enormemente nei mammiferi superiori tanto da rappresentare il
90-95
/o di tutta la corteccia. Lo sviluppo della neocorteccia spo-
sta in una posizione mediale la corteccia pi antica che nell'uomo
cos si viene a trovare posta medialmente al solco rinale. In questo
capitolo ci occuperemo solo della neocorteccia.
La corteccia cerebrale possiede molti tipi di neuroni, tre per
sono i tipi fondamentali: 1) Cellule piramidali, 2) Cellule stellate
o granuli, 3) Cellule fusiformi.
Le cellule piramidali hanno un corpo triangolare con la base
orientata verso la sostanza bianca e l'apice verso la superficie cor-
ticale (Fig. 9-1, parte sinistra). Il loro albero dendritico si divide in
una parte basale ed in una parte apicale. La parte basale formata
da una ricca arborizzazione dendritica a decorso prevalentemente
orizzontale (Fig. 9-1) la cui estensione proporzionale alla gran-
dezza del soma della cellula piramidale. La parte apicale formata
da un lungo ramo verticale che sale negli strati superficiali e poi
raggiunge il I strato. Sia il ramo apicale che le sue diramazioni sono
190
191
coperte da protrusioni chiamate spine. Su di esse fanno sinapsi
moltissime fibre afferenti. Nella maggior parte delle cellule pirami-
dali l'assone ha un decorso discendente, verso quindi la sostanza
bianca. Esistono delle cellule piramidali, chiamate cellule del Mar-
tinotti il cui assone ha un decorso opposto. Essa sale cio verso gli
strati superficiali facendo sinapsi coi dendriti delle altre cellule cor-
ticali. La grandezza delle cellule piramidali varia molto. Le pi pic-
cole hanno corpi cellulari di 15 x 10 p, le pi grandi raggiungono i
120 x 100 p.
Fig. 9-1 - Struttura della corteccia cerebrale. A sinistra: aspetto della corteccia
colorata col metodo di Golgi; al centro: colorazione col metodo di Nissl; a de-
stra: colorazione per la mielina.
Le cellule stellate o granuli hanno corpi cellulari piccoli e di
forma circolare. L'arborizzazione dendritica profusa ma limitata
alla zona intorno al corpo cellulare. L'assone resta per lo pi nelle
vicinanze della cellula facendo sinapsi coi dendriti e con i corpi cel-
lulari delle cellule vicine. Esempi di cellule stellate sono mostrati
nella Fig. 9-1, IV strato.
Le cellule fusiformi hanno il corpo a forma di fuso con due
ciuffi di dendriti ai due poli. Di solito il loro assone esce dalla so-
stanza grigia, raramente ha un decorso ascendente. Le cellule fusi-
formi si trovano nel VI strato della corteccia (Fig. 9-1, parte sini-
stra).
Le varie cellule nervose non sono distribuite a caso nella cor-
teccia. Esse sono ragruppate secondo il tipo di cellula e la sua gran-
dezza. Questo ordine nella loro distribuzione porta al formarsi di
una serie di strati corticali. Caratteristico della neocorteccia l'avere
sei strati. La corteccia a sei strati viene anche chiamata isocor-
teccia. Le corteccia pi antiche hanno invece un numero di strati
minori, esse prendono il nome di allocortex. E' importante notare
che nello sviluppo alcune aree corticali, ad esempio l'area motrice,
perdono l'organizzazione a sei strati. Tuttavia esse vengono definite
come isocorteccia in quanto il loro aspetto nella vita adulta una
modificazione di ordine superiore dell'organizzazione di base a sei
strati presente nella vita fetale. Al contrario l'allocortex non ha mai
tale organizzazione.
I sei strati tipici dell'isocortex sono mostrati nella figura 8-1.
Essi sono:
1) Strato zonale o molecolare. Si trova immediatamente al di
sotto della pia. E' ricco di fibre e povero di cellule. Caratteristiche
di questo strato sono le cellule orizzontali di Cajal. Si tratta di neu-
roni di piccolo diametro con un lungo assone che decorre parallela-
mente alla superficie corticale. Nel I strato v' un denso plesso di
fibre mieliniche a decorso tangenziale. Si pu vedere nella parte
destra della figura dove mostrata l'organizzazione corticale come
appare dopo colorazione delle fibre mieliniche.
t l a
lb
2
3a'
3a
2
3b
4
5a
5b
6a'
Via
6a
2
Vlb
6b
1
6b2
192 193
2) Strato dei granuli esterni. E' uno strato ricco di piccole cel-
lule addensate le une alle altre. La maggior parte di esse hanno for-
ma piramidale, altre sono di tipo granulare.
3) Strato piramidale esterno. Esso formato di cellule pirami-
dali. Le cellule maggiori sono poste in profondit al confine con il
IV strato. Se si paragona il III strato con quello sovrastante si vede
che gli elementi cellulari che lo formano sono pi grandi che nel II
strato.
4) Strato granulare interno. Contiene soprattutto piccoli neu-
roni. La maggior parte di essi appartiene alla classe delle cellule
stellate. Esistono per anche piccole cellule piramidali. In questo
strato si trova un ricco plesso mielinico a decorso orizzontale (stria
esterna del Baillarger).
5) Strato piramidale interno o strato ganglionare. E' composto
di cellule piramidali di medio e grande calibro. V' una ricca arbo-
rizzazione dendritica orizzontale dovuta ai dendriti basali delle cel-
lule piramidali. Nella parte inferiore dello strato si trova la stria in-
terna del Baillarger.
6) Strato delle cellule fusiformi o strato multiforme. Contiene
essenzialmente cellule fusiformi. E' suddivisibile in due sottostrati:
strato 6a e strato 6b. Quest'ultimo uno strato misto di sostanza
grigia e bianca.
La differenza in grandezza e forma delle cellule che formano i
vari strati riflette una differenza nelle loro afferenze e nella desti-
nazione delle loro efferenze. E' un dato classico che lo strato corti-
cale ricevente per eccellenza sia il IV strato. Il principale "input"
sottocorticale, quello dai nuclei talamici specifici, termina infatti
proprio in questo strato. Cos pure noto da tempo che il V strato
sia uno strato corticifugo. Da esso, ad esempio, parte il fascio pira-
midale, la via che direttamente congiunge la corteccia col midollo
spinale. Negli ultimi anni l'uso delle tecniche anatomiche basate
sul trasporto assonale (aminoacidi marcati, perossidasi tratta dalla
radice di rafano (horseradish peroxidase o HRP), sostanze coloran-
ti fluorescenti) hanno fornito nuovi dati sull'origine delle vie a par-
tenza dalla corteccia e sulla terminazione in essa delle vie cortico-
corticali e sottocorticali. Per quanto esistano differenze tra una re-
gione e l'altra e, per alcune aree corticali, vi siano discrepanze tra
gli autori, possibile tracciare al giorno d'oggi un quadro generale
delle connessioni corticali. Non bisogna dimenticare per che si trat-
ta di uno schema che ha delle eccezioni. Lo schema il seguente:
Vie afferenti
1) Le proiezioni talamo-corticali specifiche salgono, ancora
mielinizzate, attraverso gli strati VI e V e terminano nel IV strato e
nella parte inferiore del III. Le fibre afferenti si connettono esten-
sivamente con i dendriti delle cellule dei granuli e con i dendriti
apicali delle cellule piramidali degli strati profondi. Nelle aree cor-
ticali prive di I V strato (vedi sotto) le fibre afferenti terminano
nella parte inferiore del III strato.
2) Le proiezioni talamiche aspecifiche ascendono attraverso
tutti gli strati corticali formando collaterali a vari livelli. Esse ter-
minano principalmente nel I strato.
3) Le fibre di associazione (le fibre cio che uniscono aree cor-
ticali dello stesso emisfero cerebrale) terminano preferenzialmente
negli strati III e IV. Proiezioni meno dense sono state trovate an-
che negli strati infragranulari (V e VI). Esistono variazioni regio-
nali.
4) Le fibre commissurali (le fibre cio che uniscono aree radi-
cali site in emisferi diversi) terminano come le fibre associative.
Anche per esse vi sono differenze regionali.
Vie efferenti
1) Le fibre di associazione e commissurali nascono dalle cellule
piramidali degli strati II e III.
2) Le fibre di proiezione al midollo spinale, al tronco dell'ence-
falo ed ai gangli della base nascono dalle cellule piramidali del V
strato.
3) Le fibre di proiezione cortico-talamiche prendono origine
dalle cellule fusiformi del VI strato.
194
195
Se si cerca di interpretare questi dati esaminando un'area sen-
soriale, si vede che le afferenze del talamo arrivano essenzialmente
ai granuli del IV strato. Da qui fibre ascendenti e discendenti tra-
smettono l'informazione talamica agli strati superiori (sopragra-
nulari) ed inferiori (infragranulari). Le cellule degli strati superiori
elaborano l'informazione e la trasmettono poi ad aree corticali as-
sociative. Le cellule degli strati inferiori le trasmettono a centri
sottocorticali sensori-motori (ad es. la corteccia visiva al collicolo
superiore) ed al talamo ove esse controllano l'afferenza alla cortec-
cia. Questo schema con piccole variazioni vale anche per le aree as-
sociative e per le aree motorie. Possiamo quindi concludere che
ogni area corticale ha funzioni recettive (IV strato), associative (II
e III strato) e motorie (V e VI strato).
Un'ispezione della corteccia cerebrale anche a occhio nudo
permette di evidenziare differenze regionali nella sua organizzazio-
ne. Usando metodi che colorano selettivamente gli elementi cellu-
lari (metodo di Nissl e simili) Campbell, C. e O. Vogt, Brodmann
ed altri parcellarono la corteccia cerebrale in aree cerebrali a secon-
do della grossezza dei vari strati, la loro ricchezza in cellule, la pre-
senza di particolari tipi di neuroni. Le mappe cos ottenute pren-
dono il nome di mappe citoarchitettoniche.
Le mappe citoarchitettoniche pi usate sono quelle di Brod-
mann. Quella della corteccia cerebrale dell'uomo mostrata nella
Fig. 9-2. In essa si distinguono circa 50 aree indicate con i numeri
arabi. Nei suoi studi citoarchitettonici Brodmann sezion il cervel-
lo orizzontalmente. Questo spiega perch le aree dorsali hanno i
numeri pi piccoli, mentre quelle ventrali portano i numeri mag-
giori. Il taglio orizzontale inoltre port alla scoperta alternata di
aree ora rostrali ora caudali. Questa la ragione per cui l'ordine
delle aree non n dal davanti all'indietro, n viceversa. Infine al-
cune aree, come ad esempio l'area 6, sono state parcellate in sub-
aree dopo la scoperta di altre zone corticali. Il risultato stato che,
ad es., l'area 44, originariamente inclusa nell'area 6, si trova oggi
posta dorsalmente rispetto ad aree con numero pi piccolo.
io
17
Fig. 9.2 - Mappa citoarchitettonica della corteccia cerebrale di uomo secondo
Brodmann. Parte superiore della figura = veduta laterale, parte inferiore = ve-
duta mediale.
196
197
La presenza di caratteristiche simili in varie aree citoarchitetto-
niche permette di riunirle in gruppi. Secondo von Economo esistono
cinque tipi fondamentali di aree corticali. Nella Fig. 9-3 mostrata,
in basso, l'organizzazione di base dei cinque gruppi di aree; in alto
indicato dove nella corteccia cerebrale questi tipi di organizzazione
sono presenti.
I tipi di organizzazione corticale 2, 3 e 4 possiedono, nell'uo-
mo adulto, tutti e sei gli strati corticali. Questi tipi formano la cor-
teccia orno tipica. Essa caratterizzata dalle aree corticali a funzio-
ne pi complessa, le cosiddette aree associative. Nei tipi 4 e 5 alcuni
degli strati sono male sviluppati. Questi tipi formano la corteccia
eterotipica.
Si pu vedere dalla figura che la caratteristica fondamentale
della corteccia di tipo I la quasi assoluta mancanza delle cellule
stellate. Il II strato formato esclusivamente da piramidi e lo stra-
to IV manca. (Nella figura tratta da Von Economo indicato co-
me IV strato uno strato formato da cellule piramidali. La maggior
parte degli autori moderni usa chiamare Va lo strato IV di Von
Economo e Vb il suo strato V). La corteccia di tipo 1 chiamata
corteccia agranulare. Essa si trova nelle aree a funzione prevalente-
mente motoria come le aree 4 e 6.
L'altro tipo di corteccia eterotipica il tipo 5. Essa caratte-
rizzata da una grande ricchezza in granuli e da un marcato sviluppo
del IV strato. Prende il nome di corteccia granulare o koniocortex.
Aree di questo tipo si trovano intorno alla scissura calcarina (area
17), al di dietro del solco centrale (aree 3, 1 e 2) e nella parte
superiore e posteriore della prima circonvoluzione temporale (aree
41 e 42). Si tratta delle aree sensoriali primarie, delle aree cio
riceventi, rispettivamente, la via visiva principale, la sensibilit
somatosensoriale e quella acustica.
La Fig. 9-4 mostra la mappa citoarchitettonica della corteccia
di scimmia. L'organizzazione della corteccia di scimmia di no-
tevole interesse in quanto la maggior parte dei dati sull'organizza-
zione funzionale della corteccia sono stati ottenuti in questo ani-
Fig. 9_3 - I principali tipi di corteccia (parte inferiore della figura) e la loro di-
stribuzione nella corteccia secondo von Economo. 1: corteccia granulare; 2:
corteccia di tipo frontale; 3: corteccia di tipo parietale; 4: corteccia di tipo
polare; 5: corteccia granulare.
198
17
12
21
Fig. 9-4 - Mappa citoarchitettonica della corteccia di scimmia secondo Brod-
mann.
male. Questi dati hanno permesso e permettono di fare delle ipotesi
sul funzionamento della corteccia nell'uomo, ipotesi che vengono
poi verificate mediante registrazioni nei pazienti neurochirurgici o
mediante lo studio di particolari casi clinici.
Se si paragona la mappa corticale del macaco con quella del-
l'uomo (Fig. 9-2) si vede subito che v' una similarit di fondo tra
le due mappe. Ci dimostrato dalla presenza in entrambe dei me-
desimi solchi principali (solco centrale, solco silviano, solco tempo-
rale superiore) e dal fatto che in entrambe si ritrovano, con alcune
eccezioni, le stesse aree citoarchitettoniche. Esistono anche delle
importanti differenze. Tra queste notevole la diversit di svilup-
po della regione parieto-temporo-occipitale molto maggiore nel-
l'uomo che nella scimmia. Due delle aree di questa regione presenti
nell'uomo (area 39 e 40) sembrano mancare nella scimmia. Alcuni
autori sostengono tuttavia che parti dell'area 7 sarebbero gli
omologhi nella scimmia di queste due aree. Lo sviluppo nell'uomo
199
dell'area associativa parieto-temporo-occipitale ha spostato mediai-
mente le aree visive che si trovano nella corteccia cerebrale umana
sulla faccia mediale dell'emisfero. Nella scimmia esse occupano
gran parte del polo caudale degli emisferi cerebrali sulla superficie
laterale (vedi posizione dell'area 17 nelle mappe citoarchitetto-
niche).
Un'altra differenza nella organizzazione della corteccia dell'uo-
mo rispetto a quella della scimmia consiste nel grande sviluppo nella
prima del lobo frontale. La corteccia pi semplice della scimmia
permette per di cogliere in maniera immediata alcune importanti
caratteristiche di questo lobo. Nella scimmia presente un solco
che manca nell'uomo: il solco arcuato. Questo solco divide il lobo
frontale in una porzione posteriore agranulare (area 4 e 6) ed in
una porzione rostrale omotipica. La prima riceve afferenze dai nu-
clei talamici ventrale laterale (VL) e ventrale anteriore (VA), la se-
conda sotto il dominio del nucleo dorsale mediale (MD). Le due
porzioni sono funzionalmente diverse. Quella caudale ha funzioni
motorie, quella rostrale ha funzioni cognitive. Anche se questa
suddivisione del lobo frontale non evidente nell'uomo all'esame
macroscopico, l'organizzazione citoarchitettonica, i rapporti tala-
mo-corticali e le propriet funzionali hanno confermato anche per
l'uomo la dicotomia tra una porzione caudale (area 4 e 6) ed una
porzione rostrale del lobo frontale. Quest'ultima avrebbe il ruolo
di prevedere le conseguenze dei nostri atti. La porzione rostrale del
lobo frontale viene spesso chiamata lobo prefrontale.
Analogamente al lobo frontale anche il lobo temporale pi
semplice nella scimmia che nell'uomo. Nella prima il lobo tempo-
rale diviso in due parti da un solco molto profondo (il solco tem-
porale superiore). La parte superiore ha funzioni acustiche, la parte
inferiore, chiamata anche lobo inferotemporale, ha funzioni visive.
La stessa dicotomia vale anche per l'uomo. L'area 22 e le sue
ulteriori parcellazioni (area 41 e 42) sono poste dorsalmente al solco
temporale superiore ed hanno funzioni uditive o funzioni legate a
questa modalit. Le aree 20 e 21 poste ventralmente al solco sono
aree associative visive.
200 201
Infine interessante notare che nella scimmia esistono due sol-
chi che non sono presenti nell'uomo. Uno il solco lunato che,
grosso modo, forma il confine tra l'area 18 e 19, l'altro il solco
arcuato di cui si discusso prima. Poich talvolta gli esperimenti
di fisiologia sono descritti facendo riferimento ai solchi, queste no-
zioni possono essere utili per una comprensione migliore dei dati.
Accanto alle mappe citoarchitettoniche esistono mappe corti-
cali basate sulla distribuzione regionale della sostanza bianca. Que-
ste mappe prendono il nome di mappe mieloarchitettoniche. L'a-
spetto che hanno i preparati istologici di corteccia colorati per la
mielina mostrata nella Fig. 9-1. Le mappe mieloarchitettoniche
sono usate molto meno di quelle citoarchitettoniche, anche se, in
alcuni casi, l'aspetto del decorso delle fibre mieliniche pu aiutare
a separare un'area da un'altra.
Recentemente l'interesse per le mappe cerebrali si molto ac-
cresciuto in quanto i risultati degli studi elettrofisiologici hanno
confermato la validit delle parcellazioni anatomiche. Ci ha por-
tato alla messa a punto di nuove tecniche per lo studio della strut-
tura della corteccia. Tra queste vale la pena di ricordare la tecnica
della citocromo ossidasi che evidenzia l'attivit enzimatica del neu-
ropilo nei vari strati. Le mappe citocromossidasiche coincidono in
genere con quelle citoarchitettoniche, ma in alcuni casi (ad es. nel-
l'area 6) permettono una parcellazione corticale pi precisa. Una
altra tecnica che stata introdotta in questi ultimi anni quella
che mette in evidenza i pigmenti cellulari. Infine molti autori si sono
dedicati allo studio della concentrazione di sostanze chimiche
(dopamina, norepinefrina, acetilcolina, ecc.) nelle varie regioni ce-
rebrali. Scopo di questi studi non per la segregazione anatomo-
funzionale della corteccia in varie aree, ma quello di ottenere un
quadro della quantit di queste sostanze nelle varie aree corticali
dei soggetti normali per raffrontarle con quello che si osserva in
certe affezioni patologiche come per esempio le demenze. Lo scopo
ultimo di questi studi la speranza di trovare delle terapie sostitutive
nelle malattie da carenza di mediatori chimici o di modulatori del
sistema nervoso.
Aree della sensibilit somatica
Se si applicano stimoli tattili od articolari alle varie parti del
corpo e si registrano in corteccia i potenziali evocati da questi sti-
moli, si trova che esistono quattro regioni cerebrali in cui rappre-
sentato il corpo umano. Due di esse si trovano al di dietro della
scissura centrale di Rolando, due al davanti di essa. La stimolazione
elettrica di queste aree provoca dei movimenti discreti e precisi. Per
questa ragione queste quattro aree sono state chiamate aree
sensorimotorie. Nei mammiferi superiori comunque le due aree
sensorimotorie posteriori hanno perso gran parte delle loro funzio-
ni di moto ed hanno sviluppato quelle sensoriali, l'opposto avve-
nuto per quelle anteriori. I n questo capitolo ci occuperemo delle
due aree prevalentemente sensoriali. Esse sono l'area somatica sen-
soriale principale (Sm I o S I) e l'area somatica sensoriale seconda
(Sm II o S II). La posizione delle due aree sensoriali e delle due
aree prevalentemente motorie indicata nella Fig. 9-5. Le due aree
a prevalenza motoria sono indicate come Ms I e Ms II.
Fig. 9-5 - Veduta della corteccia di scimmia con la rappresentazione dell'area
somatica principale (Sm I), dell'area somatica seconda (Sm II), dell'area mo-
toria principale (Ms I) e dell'area motoria supplementare (Ms II).
202 203
Area somatica sensoriale principale
L'area somatica principale posta nel giro postcentrale. Essa
riceve le sue afferenze dal complesso ventrobasale del talamo. Il
piano generale della sua organizzazione noto dai lavori di Wool-
sey. Come si vede dalla figura (Fig. 9-5) nell'area somatica v' una
rappresentazione del corpo disegnata come un "omuncolo". Que-
sto `omuncolo", ricavato con la stimolazione tattile delle varie
parti del corpo, ha la faccia rivolta in basso verso il solco del Silvio,
mentre gli arti inferiori sono posti vicino alla scissura interemisfe-
rica sia sulla faccia laterale che sulla faccia mediale dell'emisfero.
Il dorso orientato verso le aree parietali associative, le parti distali
verso l'area 4. La rappresentazione del corpo controlaterale.
L'emicorpo di destra rappresentato nell'emisfero di sinistra, quello
di sinistra nell'emisfero di destra.
L"`omuncolo" non una copia del corpo dell'animale. Esso ne
rappresenta un'immagine considerevolmente distorta. Ci dovuto
al fatto che la superficie di rappresentazione corticale proporzio-
nale al numero di recettori presenti in un certo distretto corporeo
e non alla superficie di questo. Le parti pi rappresentate sono
quindi la faccia, la mano e, nelle scimmie, l'arto inferiore.
Le registrazioni con microelettrodi extracellulari hanno dimo-
strato che i neuroni dell'area somatica principale hanno caratteri-
stiche lemniscali. Essi rispondono ad una sola modalit sensoriale,
tatto-pressione o propriocezione, e nell'ambito di questa modalit
ad una sola submodalit. I loro campi recettivi sono piccoli, so-
prattutto nelle parti a maggior acuit sensoriale.
Le registrazioni microelettrodiche hanno anche dimostrato che
i neuroni che rispondono a stimoli tattili si trovano vicino al solco
centrale, mentre quelli che rispondono a stimoli propriocettivi sono
posti nell'area citoarchitettonica 2. Questi dati sembravano difficili
da conciliare con la rappresentazione di un solo omuncolo come
volevano i dati classici di Woolsey (Fig. 9-5). Recenti studi mi-
croelettrodici eseguiti con estrema cura hanno dimostrato che l'a-
rea somatica principale suddivisibile in varie subaree corrispon
denti alle aree citoarchitettoniche che formano il giro postcentrale.
Queste aree sono l'area 3 (l'area pi rostrale) divisa in area 3a e 3b,
l'area 1 e l'area 2. I n ognuna di queste aree rappresentato un
"omuncolo" pi o meno completo. Ci che differenzia i vari
"omuncoli" sono gli stimoli cui rispondono.
Il tatto-pressione posto nell'area 3b. Questa l'area che riceve
le pi ricche afferenze talamiche. I suoi neuroni rispondono agli
stimoli tattili con le propriet tipiche dei recettori a lento adatta-
mento. Il senso di posizione rappresentato nell'area 2. In questa
area a differenza della precedente v' un prevalere delle afferenze
dalle parti prossimali del corpo (vedi Cap. 5). L'area 1 ha una rap-
presentazione meno ricca di quella dell'area 3b. I suoi neuroni sono
tattili per lo pi a rapido adattamento. I nfine i neuroni dell'area
3a, posta nella profondit del solco centrale tra il giro postcentrale e
quello precentrale, rispondono alla stimolazione dei fusi
neuromuscolari. L'area 3a contribuisce con l'area 2 al senso di
posizione.
Se si fa una penetrazione con un microelettrodo perpendico-
larmente alla superficie corticale e si registra l'attivit elettrica dei
neuroni posti nei vari strati, si trova che i neuroni dal I al VI strato
formano una colonna con propriet simili. Essi rispondono tutti
alla stimolazione della stessa parte della cute o della stessa articola-
zione e sono sensibili alla stessa modalit e submodalit sensoriale.
Ad esempio se la registrazione fatta dall'area 2 si trover una
colonna di cellule che rispondono al movimento articolare. Se le
prime cellule rispondono, mettiamo, alla flessione del polso, si
trover che anche le altre, poste in profondit, rispondono allo
stesso stimolo. Se ora si sposta l'elettrodo si trover un'altra colon-
na che risponde all'estensione del polso. Se si muove di molto
l'elettrodo, sempre per nell'area 2, si trover una colonna che
risponde al movimento di un'altra articolazione, ad esempio alla
flessione del pollice, ma di nuovo tutte le cellule nell'interno della
colonna risponderanno allo stesso stimolo e con caratteristiche
identiche. Lo studio di varie aree corticali ha dimostrato che la
204
205
colonna, originariamente scoperta proprio nell'area somatica
principale, il principio di base dell'organizzazione corticale.
Le efferenze delle tre divisioni citoarchitettoniche del giro
postcentrale seguono le regole che abbiamo esposto nello studio
della corteccia cerebrale. Le vie di proiezione nascono dagli strati
infragranulari e vanno al talamo, ai nuclei gracile e cuneato e al
midollo spinale. Le vie discendenti lunghe decorrono assieme a
quelle a partenza dal lobo frontale nel fascio piramidale. Le vie
commissurali congiungono l'area S I con quella controlaterale e
Fig. 9-6 - Omuncolo somatoestesico. La mappa stata ottenuta mediante sti-
molazione elettrica della circonvoluzione parietale ascendente in pazienti neu-
rochirurgici. Il paziente, non anestetizzato, riferiva in che parte del corpo pro-
vava delle sensazioni durante la stimolazione elettrica.
con l'area S II dell'altro emisfero. Pi complesso il quadro delle
vie associative. L'area 2 manda fibre all'area 4 e alle aree associa-
tive parietali (5 e 7). L'area 3b invia connessioni reciproche all'area
1, alle aree associative parietali e all'area S II. Le afferenze proprio-
cettive influenzano quindi direttamente l'area motoria, mentre
quelle tattili la possono influenzare solo attraverso i centri asso-
ciativi.
L'area somato sensoriale dell'uomo ha una organizzazione fon-
damentalmente identica a quella della scimmia. L'organizzazione
somatotopica stata dimostrata con stimolazione elettrica delle
varie parti del giro postcentrale in malati neurochirurgici. I pazienti
erano svegli, senza anestesia e riferivano dove sentivano le sensazioni
durante la stimolazione. Queste con correnti deboli venivano riferite
a parti precise, limitate del corpo controlaterale. Una mappa della
corteccia cerebrale somestesica cos ottenuta mostrata nella Fig.
9-6. In essa si vede la deformazione dell'-omuncolo" corticale.
Come nella scimmia la faccia, le dita ed il pollice sono
enormemente rappresentati.
Area somatica sensoriale II
L'area somatica seconda (S II) posta nel lobo parietale in cor-
rispondenza del labbro superiore del solco di Silvio. E' un'area or-
ganizzata in maniera somatotopica. In essa la rappresentazione
della faccia occupa una posizione rostrale superficiale, gli arti ed
il corpo sono posti caudalmente ed in profondit in una direzione
che va verso l'insula (Fig. 9-5). Fino dalla scoperta di quest'area,
avvenuta usando i potenziali evocati, si osservato che in essa v'
una rappresentazione bilaterale del corpo. Questi dati sono stati
confermati da studi recenti di registrazione microelettrodica. Si
trovato infatti che molti neuroni rispondono alla stimolazione ipsi-
laterale oltre che a quella controlaterale del corpo. I neuroni sensi-
bili alla stimolazione del tronco e della faccia hanno campi recetti-
vi consistenti di un'unica area in parte ipsilaterale in parte contro-
206 207
laterale al lato di registrazione; i neuroni che rispondono alle parti
distali, soprattutto alle mani, hanno campi recettivi formati da due
zone spazialmente separate, l'una controlaterale, l'altra ipsilaterale.
Le due zone che formano i campi recettivi distali sono poste su
parti simmetriche delle mani o dei piedi.
I neuroni della S II rispondono a stimoli della modalit tatto-
pressione. Non sono stati trovati neuroni sensibili agli stimoli arti-
colari. Questo dato in accordo con l'evidenza anatomica che l'a-
rea S II riceve afferenze dall'area 3b, ma non dall'area 2 della cor-
teccia postcentrale. Come stato ricordato precedentemente la
prima l'area sensoriale primaria per le modalit tatto-pressione, la
seconda per il senso di posizione. I nfine esistono neuroni tattili
che sono sensibili alla direzione del movimento lungo il loro campo
recettivo. Tale propriet poco sviluppata nelle aree sensoriali
primarie.
I neuroni della corteccia circostante l'area S II hanno propriet
simili a quelle del gruppo nucleare posteriore del talamo. Hanno
campi recettivi grandi, sono spesso polisensoriali e molti di essi sono
eccitati solo da stimoli nocicettivi. Questa zona corticale posta
intorno alla S II. e non ben definita dal punto di vista anatomico,
potrebbe essere il centro corticale per il dolore.
Le connessioni anatomiche dell'area 3b e i dati fisiologici sulle
propriet dei neuroni dell'area 5 e 7 hanno messo in dubbio la con-
cezione classica che queste ultime due aree siano i centri di integra-
zione superiore per la modalit tattile. La funzione delle aree 5 e 7
secondo questi studi sembra essere quella di estrarre informazioni
sulla posizione globale del nostro corpo, di stabilire le relazioni tra
il corpo ed il mondo esterno (spazio egocentrico) e quelle tra gli
oggetti posti nel mondo esterno. L'area S II sarebbe invece la pri-
ma stazione di integrazione tattile, da essa partirebbero informa-
zioni tattili verso le aree associative motorie ed il lobo limbico.
I l fatto che l'area S I I sia un centro che mette in connessione
le aree sensoriali tattili con le aree associative motorie stato con-
fermato dalla recente scoperta di una ricca via anatomica che uni
sce la S II con l'area 6 laterale (un'area posta nella scimmia imme-
diatamente al di dietro del solco arcuato - vedi Fig. 9-4). I neuroni
di quest'area hanno propriet sensoriali per molti versi simili a
quelli dei neuroni della S II. Si pensa che l'organizzazione dei mo-
vimenti volontari in risposta a stimoli tattili segua la via 3b-* SII -*
-+area 6 ->area 4.
Il ruolo dell'area S II nel convogliare informazioni tattili al lobo
limbico e di intervenire pertanto nell'apprendimento di discri-
minazioni tattili confermato da dati anatomici e da esperimenti
di lesione. Esiste una via polisinaptica che congiunge l'area S II col
lobo limbico sia attraverso il polo temporale che attraverso il lobo
prefrontale. Inoltre l'ablazione dell'area S II nella scimmia porta a
deficit nell'apprendimento di disciminazioni tattili, mentre la so-
glia per gli stimoli tattili rimane normale. Anche se difficile dire
se questo deficit dovuto al danno diretto alla S II o alla distruzione
di un circuito che porta informazioni al lobo limbico, tuttavia
questi dati sono in accordo col concetto che l'area S II sia un cen-
tro superiore di integrazione tattile.
209
10) LESIONI DELLE VIE E DEI CENTRI DEL SISTEMA
SOMATOSENSORIALE
Deficit conseguenti a lesioni dei cordoni dorsali
I cordoni posteriori sono la principale via ascendente della sen-
sibilit tattile epicritica e del senso di posizione (vedi Cap. 7). Il
quadro classico da lesione dei cordoni posteriori il seguente: 1)
perdita del senso di posizione, 2) perdita del senso di vibrazione,
3) incapacit di discriminare se la cute stata toccata in uno o due
punti, 4) lieve aumento della soglia al toccamento. Tutti questi di-
sturbi sono ipsilaterali al lato della lesione.
Ai disturbi sensoriali si aggiungono deficit della coordinazione
motoria. Questi prendono il nome di atassia. Il soggetto atassico
goffo nel raggiungere gli oggetti; la sua marcia incerta, oscillante;
egli ha difficolt nel mantenere la stazione eretta specie a base ri-
stretta (piedi posti uno vicino all'altro con gli alluci a contatto). I
disturbi peggiorano ad occhi chiusi. La causa dei disturbi atassici
che il soggetto per compiere normalmente i movimenti ha bisogno
dell'informazione propriocettiva, di "sapere" dove si trovano i suoi
arti. L'assenza dell"`input" propriocettivo compensato in parte
dalla vista. Questo spiega perch la chiusura degli occhi peggiori i
disturbi.
La sintomatologia classica da lesione dei cordoni posteriori
stata descritta originariamente in malati tabetici. La tabe dorsale
una manifestazione tardiva meningitica della malattia sifilitica che
produce uno strozzamento delle radici posteriori e quindi una gra-
ve sofferenza delle fibre mieliniche specie di quelle di maggior cali-
bro. All'esame anatomo-patologico si ha una degenerazione dei
210 211
cordoni posteriori. Esperimenti recenti su scimmie e casi neurochi-
rurgici in cui i cordoni dorsali erano completamente recisi senza
altri danni concomitanti, hanno mostrato che la lesione pura dei
cordoni posteriori porta a disturbi molto meno severi di quelli de-
scritti nella sindrome classica. Ad esempio il senso di vibrazione
conservato, il tatto epicritico ed il senso di posizione sono lesi solo
transitoriamente. Perch questa discrepanza tra sindrome da lesio-
ne dei cordoni posteriori pura e quella classica? Il motivo che il
tatto epicritico ed in parte il senso di posizione sono trasportati da
fibre che decorrono nei cordoni dorsolaterali. Quando la lesione
solo dei cordoni posteriori, queste fibre e quelle del fascio neo-spi-
no-talamico sono intatte e possono compensare in parte o del tut-
to il danno. Nelle lesioni tabetiche come d'altronde in certe malat-
tie degenerative tutte le fibre con propriet metaboliche o chimi-
che simili degenerano indipendentemente dal loro decorso anato-
mico. Il danno quindi maggiore e la sintomatologia pi severa.
Deficit conseguenti a lesioni dei cordoni anterolaterali
I cordoni anterolaterali sono la via principale per la conduzio-
ne degli impulsi termici e dolorifici. Lesioni unilaterali dei cordoni
anterolaterali causano una perdita delle sensazioni del dolore e del-
la temperatura controlateralmente alla sede della lesione in tutti i
segmenti sottostanti alla lesione stessa. Il deficit controlaterale in
quanto le fibre lese fanno parte di una via crociata (vedi Cap. 7).
Per quanto riguarda la sensibilit tatto-pressione in genere si am-
mette che essa non venga interessata dalla lesione. Esami accurati
condotti con tecniche psicofisiche hanno mostrato che in realt
esiste un certo aumento della soglia per questa sensibilit. Ci in
accordo col fatto che parte delle vie tattili decorrono nel sistema
anterolaterale.
Studi moderni di lesione dei cordoni anterolaterali in scimmie
hanno smentito l'assioma classico che le fibre tattili decorrano nei
cordoni anteriori, mentre quelle dolorifiche e termiche nei cordoni
laterali. Per eliminare le sensazioni dolorose le lesioni devono in-
cludere entrambi i cordoni. Ad una conclusione analoga sono
giunti anche i neurochirurghi per la terapia del dolore intrattabile
nell'uomo.
Un dato riportato dai neurochirurghi che, trascorso un certo
periodo dopo l'operazione, i malati con sezione unilaterale dei cor-
doni anterolaterali ricuperano parzialmente la sensibilit dolorifi-
ca. Ci in parte dovuto al fatto che un piccolo contingente del si-
stema anterolaterale decorre nel midollo spinale senza crociarsi. La
storia per pi complicata. Infatti se vero che la cordotomia bi-
laterale pi efficace di quella unilaterale, un certo ricupero della
sensibilit dolorifica avviene anche dopo questa operazione. La
spiegazione pi probabile del fenomeno che fibre di secondo or-
dine che viaggiano nel sistema dorsale portino sensazioni dolorifi-
che. Ci sarebbe in accordo col dato, trovato nella scimmia, che
parte dei neuroni posti nella parte reticolata dei nuclei gracile e
cuneato rispondono a stimoli nocicettivi. Si deve concludere quin-
di che anche il sistema dorsale, anche se in minima parte, respon-
sabile delle sensazioni dolorose.
Sindromi da emisezione del midollo spinale, da lesione delle corna
grigie posteriori e da lesione della sostanza grigia centrale del mi-
dollo spinale
La conoscenza delle propriet anatomo-funzionali delle vie
della sensibilit somatica permette di spiegare i deficit conseguenti a
lesioni delle varie parti del midollo spinale.
L'emisezione del midollo spinale produce: 1) perdita ipsilatera-
le della sensibilit tatto-pressione e del senso di posizione sotto il
livello di lesione (disturbo dovuto a sezione del sistema posterio-
re), 2) perdita controlaterale della sensibilit termica e dolorifica
sotto il livello di lesione (disturbo dovuto a sezione del sistema an-
terolaterale), 3) paralisi ipsilaterale (disturbo dovuto a sezione del-
le vie motorie discendenti, incluso il fascio piramidale). Accanto a
212 213
questi disturbi generali vi sono segni segmentali dovuti alla distru-
zione delle corna grigie posteriori ed anteriori a livello della lesio-
ne. La sindrome da emisezione del midollo spinale prende il nome
di sindrome di Brown-Squard.
Lesioni delle corna grigie posteriori portano a deficit ipsilaterali
della sensibilit termica e dolorifica a livello della lesione. Non vi
sono disturbi della sensibilit tattile e del senso di posizione. Questi
possono comparire nelle malattie espansive per compressione o
invasione dei cordoni posteriori.
Lesioni della sostanza grigia centrale del midollo spinale, dovute
per lo pi ad allargamento del canale ependimale (siringomielia)
portano a disturbi simili a quelli da lesione delle corna grigie poste-
riori. L'espansione del canale ependimale porta ad una interruzio-
ne delle fibre che nascono dalle corna grigie posteriori e che si cro-
ciano nella commissura bianca anteriore. Si avr quindi un deficit
bilaterale della sensibilit termica e dolorifica con conservazione di
quella tattile. Questa dissociazione tra sensibilit tattile e termo-
dolorifica prende il nome di dissociazione siringomielica.
Deficit conseguenti a lesioni del complesso ventrobasale del tala-
mo e dell'area somatica principale della corteccia cerebrale
Rare sono le lesioni che distruggono selettivamente nell'uomo
il complesso ventrobasale del talamo. Cos pure una lesione speri-
mentale pura di questo nucleo difficile da fare data la posizione
profonda del talamo nel cervello. Piccole lesioni del complesso
ventrobasale eseguite nell'uomo durante interventi chirurgici il cui
scopo era quello di alleviare dolori intrattabili, producono gravi de-
ficit della meccanorecezione localizzati controlateralmente. In le-
sioni talamiche estese centrate sul complesso ventrobasale i deficit,
in accordo con le propriet lemniscali dei neuroni del nucleo, ri-
guardano le capacit tattili discriminative ed il senso di posizione.
Il tatto protopatico, il senso del caldo e del freddo ed il dolore sono
risparmiati.
Un particolare aspetto delle lesioni talamiche la frequente
comparsa, accanto ai deficit sensoriali, di crisi dolorose. Queste
hanno per lo pi caratteristiche parossistiche. Non v' una spiega-
zione accettata da tutti del fenomeno. E' stato suggerito che si tratti
di una mancanza di controllo sui centri del dolore da parte dei
centri talamici della meccanorecezione. Un'altra possibilit che le
crisi dolorose siano una conseguenza della lesione dei nuclei tala-
mici aspecifici anch'essi agenti da freno sui centri del dolore. Biso-
gna dire per che lesioni selettive dei nuclei talamici aspecifici non
producono crisi dolorose. E' verosimile che la sindrome sia dovuta
ad una liberazione dei centri del dolore della sostanza reticolare da
controlli multipli sia talamici che corticali (vie cortico discendenti
passanti in prossimit del talamo).
La lesione dell'area somatica principale (giro postarcuato) por-
ta a gravi deficit controlaterali della somatoestesia. V' un deficit
permanente del senso di posizione, della pallestesia e degli aspetti
discriminativi della sensibilit tattile (vedi Cap. 5). La sensibilit
termica e dolorifica sono conservate. Lesioni parziali danno disturbi
ristretti a parti del corpo in accordo con le mappe corticali della
rappresentazione corporea. Compare talvolta una sintomatologia
dolorosa simile a quella che si ha nella sindrome talamica. L'inter-
pretazione che si d di questo disturbo la stessa che per la sindro-
me talamica.
Anda mungkin juga menyukai
- NeurologiaDokumen50 halamanNeurologiaSalvatore FerraroBelum ada peringkat
- Sbobinature Neurologia PDFDokumen336 halamanSbobinature Neurologia PDFMichele Benvenuto100% (1)
- I Ritmi in Osteopatia: I ritmi all'interno del corpo e nella relazione con l'ambienteDari EverandI Ritmi in Osteopatia: I ritmi all'interno del corpo e nella relazione con l'ambientePenilaian: 5 dari 5 bintang5/5 (1)
- Tesi Gianpiero CapraDokumen37 halamanTesi Gianpiero CapraLuca Bevar100% (1)
- La dopamina nel nucleo accumbens: la cocaina, la motivazione e la sensazione di piacere: la cocaina, la motivazione e la sensazione di piacereDari EverandLa dopamina nel nucleo accumbens: la cocaina, la motivazione e la sensazione di piacere: la cocaina, la motivazione e la sensazione di piacereBelum ada peringkat
- Tesi Finale PDFDokumen116 halamanTesi Finale PDFLuca LupiBelum ada peringkat
- Le correnti a radiofrequenza applicate alla terapia del doloreDari EverandLe correnti a radiofrequenza applicate alla terapia del doloreBelum ada peringkat
- Fisioterapia-Tesi Universitaria-TRATTAMENTO RIABILITATIVO IN PAZIENTE DOPO RICOSTRUZIONE IN ARTROSCOPIA DEL L.C.ADokumen33 halamanFisioterapia-Tesi Universitaria-TRATTAMENTO RIABILITATIVO IN PAZIENTE DOPO RICOSTRUZIONE IN ARTROSCOPIA DEL L.C.ASharon TaylorBelum ada peringkat
- NeurologiaDokumen226 halamanNeurologiaΑντώνιος Χατζηγεωργίου50% (2)
- Sbob Russo-Calabro 2018-2019 PDFDokumen156 halamanSbob Russo-Calabro 2018-2019 PDFStani SantangeloBelum ada peringkat
- BPCODokumen31 halamanBPCOlalazarovBelum ada peringkat
- Corso Di Laurea in FisioterapiaDokumen19 halamanCorso Di Laurea in FisioterapiaRiccardo PiluduBelum ada peringkat
- NeuroanatomiaDokumen29 halamanNeuroanatomiaRoberta PirasBelum ada peringkat
- RM Del Ginocchio Patologia MeniscaleDokumen15 halamanRM Del Ginocchio Patologia MeniscaleAndrea FerreraBelum ada peringkat
- Esame NeurologicoDokumen28 halamanEsame NeurologicoLaura Fearsome ViewBelum ada peringkat
- Malformazione Di Chiari - Tonsille CerebellariDokumen50 halamanMalformazione Di Chiari - Tonsille CerebellarisololuiBelum ada peringkat
- Le Applicazioni Delle Cellule Staminali in Medicina RigenerativaDokumen86 halamanLe Applicazioni Delle Cellule Staminali in Medicina RigenerativaPiGreekBelum ada peringkat
- 6 - INTERNA Scompenso CardiacoDokumen12 halaman6 - INTERNA Scompenso CardiacoGiulia MeniconziBelum ada peringkat
- Programmi Testi Consigliati FisioterapiaDokumen58 halamanProgrammi Testi Consigliati FisioterapiarosaBelum ada peringkat
- ElettroencefalografiaDokumen5 halamanElettroencefalografiacaila8716Belum ada peringkat
- RIPASSO Anatomia Umana I Parte PDFDokumen78 halamanRIPASSO Anatomia Umana I Parte PDFDa NyBelum ada peringkat
- TESI La Riabilitazione Del Paziente Con Scompenso CardiacoDokumen45 halamanTESI La Riabilitazione Del Paziente Con Scompenso CardiacoVincenzo La SalandraBelum ada peringkat
- Dispensa StatisticaDokumen29 halamanDispensa Statisticaandrespesss100% (1)
- Manuale Malattie Rare CNR ASP4Dokumen493 halamanManuale Malattie Rare CNR ASP4scribdangeloBelum ada peringkat
- Accesso Economia e Management - Dispense StatisticaDokumen141 halamanAccesso Economia e Management - Dispense StatisticaAnnaBarlettaBelum ada peringkat
- 4 Fisiopat CuoreDokumen82 halaman4 Fisiopat CuoreSergioBelum ada peringkat
- Immunologia ClinicaDokumen38 halamanImmunologia ClinicaFedericoPppzPippo100% (1)
- Tirocinio (E.O. Neurologico) 5Dokumen22 halamanTirocinio (E.O. Neurologico) 5Matteo FerrariBelum ada peringkat
- 1 Farmacocinetica FarmacodinamicaDokumen96 halaman1 Farmacocinetica FarmacodinamicaEugenia DantonioBelum ada peringkat
- 2.fisiologia II - Neurofisiologia - Parte IIDokumen32 halaman2.fisiologia II - Neurofisiologia - Parte IIFedericoPppzPippoBelum ada peringkat
- Come Aprire Studio OsteopataDokumen1 halamanCome Aprire Studio OsteopataNicolaCursiBelum ada peringkat
- La Saggezza Del CorpoDokumen5 halamanLa Saggezza Del CorpoSpinelli PietroBelum ada peringkat
- Kin 30346 1 PDFDokumen18 halamanKin 30346 1 PDFOrazio MeliBelum ada peringkat
- LG ReumatologiaDokumen222 halamanLG ReumatologiacinziaboxBelum ada peringkat
- LEUCODISTROFIEADokumen56 halamanLEUCODISTROFIEARoberta Lulù TerranovaBelum ada peringkat
- Osteopatia Pianostudi TibodyworkDokumen8 halamanOsteopatia Pianostudi TibodyworkPaoloBelum ada peringkat
- 01 CONOSCENZE DI BASE Introduzione All'anatomiaDokumen12 halaman01 CONOSCENZE DI BASE Introduzione All'anatomiaAndrea Carboni100% (1)
- Argomenti Di Terapia Occupazionale PDFDokumen240 halamanArgomenti Di Terapia Occupazionale PDFalex alexBelum ada peringkat
- Gratificazione e Dipendenza Sostanze D'abusoDokumen35 halamanGratificazione e Dipendenza Sostanze D'abusoFrancesco PaleseBelum ada peringkat
- Patologia Generale Fisiopatologia GeneraleDokumen25 halamanPatologia Generale Fisiopatologia Generalemaria divirgilioBelum ada peringkat
- Riabilitazione Neuromotoria.....Dokumen3 halamanRiabilitazione Neuromotoria.....Ciprian VrancianuBelum ada peringkat
- Fisio CompleteDokumen172 halamanFisio CompleteSebastianoBelum ada peringkat
- 8 CervellettoDokumen44 halaman8 CervellettoMoussa LandryBelum ada peringkat
- Nefro SegoloniDokumen76 halamanNefro SegolonisucailcazzovaBelum ada peringkat
- Riassunto Neuropsicologia Dei Lobi FrontaliDokumen22 halamanRiassunto Neuropsicologia Dei Lobi FrontaliDavide SaggeseStyleBelum ada peringkat
- Dispensa Teoria1Dokumen31 halamanDispensa Teoria1Davide CattiBelum ada peringkat
- 41 (1713-1730) NeuroriabilitazioneDokumen18 halaman41 (1713-1730) NeuroriabilitazioneLuisa FortezzaBelum ada peringkat
- Tesi La Discinesia Di ScapolaDokumen30 halamanTesi La Discinesia Di ScapolaAntonino RussoBelum ada peringkat
- Doping e Cultura AntidopingDokumen76 halamanDoping e Cultura AntidopingGerardina CaputoBelum ada peringkat
- Lezioni Vie Nervose SNAutonomoDokumen80 halamanLezioni Vie Nervose SNAutonomoVincenzo BinantiBelum ada peringkat
- La NIRS Nella Chirurgia Della Dissezione Aortica Di Tipo Stanford ADokumen21 halamanLa NIRS Nella Chirurgia Della Dissezione Aortica Di Tipo Stanford APasquale AstoreBelum ada peringkat
- Società Italiana Paraplegia - Gli Indicatori Di OutcomeDokumen25 halamanSocietà Italiana Paraplegia - Gli Indicatori Di OutcomeBruna Ortiz100% (1)
- Fusi NeuromuscolariDokumen3 halamanFusi NeuromuscolariRosaria GuidoBelum ada peringkat
- NEUROANATOMIADokumen172 halamanNEUROANATOMIAFrancesco LanzaBelum ada peringkat
- Elementi Di Etica Cap.4Dokumen19 halamanElementi Di Etica Cap.4Rux AndaBelum ada peringkat
- PATOLOGIADokumen54 halamanPATOLOGIAGrazia AlberioBelum ada peringkat
- Heart Rate Variability (HRV) ITALIANO 2007Dokumen4 halamanHeart Rate Variability (HRV) ITALIANO 2007Nikos GiannopoulosBelum ada peringkat
- Metodi Chimici Per Lo Studio DellDokumen9 halamanMetodi Chimici Per Lo Studio DellSimone Bonasso100% (1)
- Appunti NeurologiaDokumen25 halamanAppunti NeurologiaMatteo Gidgio MeloniBelum ada peringkat
- Sistema LimbicoDokumen13 halamanSistema LimbicoCarolina ArecaceaeBelum ada peringkat
- Fondamenti Bellomo Guariglia PDFDokumen163 halamanFondamenti Bellomo Guariglia PDFCarola PernaBelum ada peringkat
- Sistema Nervoso, Encefalo e Nervi CraniciDokumen10 halamanSistema Nervoso, Encefalo e Nervi CraniciFrancesco FalconieriBelum ada peringkat
- Nuclei Del TelencefaloDokumen1 halamanNuclei Del TelencefaloRolando LagangiaBelum ada peringkat
- Anatomia 2 (Denise) AppuntiunipiDokumen158 halamanAnatomia 2 (Denise) AppuntiunipinuunumclBelum ada peringkat
- Seconda Parte Controllo Motorio, Corteccia Cerebrale e CerebellareDokumen24 halamanSeconda Parte Controllo Motorio, Corteccia Cerebrale e Cerebellareapi-3704348100% (1)
- NeurologiaDokumen16 halamanNeurologiaenzocavajuoloBelum ada peringkat
- La Plasticita Cerebrale Aa 14.15Dokumen56 halamanLa Plasticita Cerebrale Aa 14.15Pia MisitiBelum ada peringkat
- Sistema LimbicoDokumen1 halamanSistema LimbicoRolando LagangiaBelum ada peringkat
- Anatomia 2Dokumen58 halamanAnatomia 2GioBelum ada peringkat
- Giacomo Rizzolatti - Lezioni Di Fisiologia Del Sistema NervosoDokumen108 halamanGiacomo Rizzolatti - Lezioni Di Fisiologia Del Sistema NervosoMassimo OmeriBelum ada peringkat
- Corso I Poteri Del Subconscio - Come Fare Della Tua Vita Un MiracoloDokumen33 halamanCorso I Poteri Del Subconscio - Come Fare Della Tua Vita Un MiracoloNicola Balestri100% (1)
- Vie e Circuiti RiverberantiDokumen3 halamanVie e Circuiti RiverberantiOmmalleyBelum ada peringkat
- Tabella Vie SNCDokumen3 halamanTabella Vie SNCLeonardo Pzl100% (1)
- Atassie Sensitive e Cerebellari PDFDokumen145 halamanAtassie Sensitive e Cerebellari PDFturchettinoBelum ada peringkat
- Domande Da Pinel Gennaio 2012Dokumen13 halamanDomande Da Pinel Gennaio 2012Anna MaranoBelum ada peringkat
- Sistema Nervoso RiassuntoDokumen64 halamanSistema Nervoso Riassuntolucchini.paolo3002Belum ada peringkat
- Neuroanatomia - Riassunto Del CattaneoDokumen47 halamanNeuroanatomia - Riassunto Del CattaneoAlessandro Fazio50% (2)
- Lezione 19 MacchiarelliDokumen21 halamanLezione 19 Macchiarellilone wolfBelum ada peringkat
- NeurologiaDokumen241 halamanNeurologiaAndrea Rosi100% (4)
- Midollo TroncoDokumen15 halamanMidollo Troncoeve_612Belum ada peringkat
- Nervi Cranici 3,4,6 e SpinaliDokumen6 halamanNervi Cranici 3,4,6 e SpinaliGiulia PonzoBelum ada peringkat
- Neurologia RiassuntoDokumen85 halamanNeurologia RiassuntoGerti Koka75% (8)
- Dal Sistema Limbico Al Cervello EmotivoDokumen46 halamanDal Sistema Limbico Al Cervello Emotivopaolo continiBelum ada peringkat