Cinética
Diunggah oleh
evertonsktHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Cinética
Diunggah oleh
evertonsktHak Cipta:
Format Tersedia
Universidade Federal da Bahia
Instituto de Qumica
Departamento de Qumica Geral e Inorgnica
QUI029 - Qumica Geral
CINTICA QUMICA
Prof. Elisson Andrade
Cintica qumica
A cintica o estudo da velocidade na qual as reaes qumicas
ocorrem.
Figura 01. Diferentes reaes, diferentes velocidades: exploso, corroso e a eroso.
Objetivo: compreender as reaes qumicas no nvel molecular.
Temperatura e velocidade
Fator orientao e a Teoria das Colises
Para que uma reao ocorra, as molculas do reagente devem colidir com a
orientao correta e com energia suficiente para formar os produtos.
Considere:
Cl + NOCl NO + Cl2
Existem duas maneiras possveis para que os tomos de Cl e as molculas de
NOCl possam colidir; uma efetiva; a outra no
Exerccio 1
Levando em conta o Fator Orientao e a Teoria das Colises,
argumente sobre os seguintes fatores e sua relao com a
velocidade da reao.
(a) o estado fsico do reagente,
(b) as concentraes dos reagentes,
(c) a temperatura na qual a reao ocorre e
(d) a presena de um catalisador.
Temperatura e velocidade
Energia de ativao
Arrhenius: as molculas devem possuir uma quantidade mnima de
energia para que elas reajam. Por qu?
Para que formem produtos, as ligaes devem ser quebradas
nos reagentes.
A quebra de ligao requer energia.
A energia de ativao, Ea, a energia mnima necessria para
iniciar uma reao qumica.
Temperatura e velocidade
Temperatura e velocidade
C
A+B
Ea
REAO DO TIPO: A + B C
Temperatura e velocidade
Temperatura e velocidade
Energia de ativao
10
Velocidades de reaes
Velocidade mdia para uma reao do tipo A B
calculada pela relao entre a quantidade de um reagente (ou
produto) que consumido (ou produzido) e o intervalo de tempo
gasto para isto.
11
Velocidades de reaes
Variao da concentrao com o tempo
Considere:
C4H9Cl(aq) + H2O(l) C4H9OH(aq) + HCl(aq)
12
Velocidades de reaes
13
Velocidades de reaes
Velocidade de reao e a estequiometria
Para a reao, sabemos que:
C4H9Cl(aq) + H2O(l) C4H9OH(aq) + HCl(aq)
Em geral, para
aA + bB cC + dD
14
Exerccio 2
Considere a reao:
2O3(g) 3O2(g)
(a) como a velocidade de desaparecimento do oznio relaciona-se com a
velocidade de aparecimento do oxignio?
(b) Se a velocidade de aparecimento de O2, [O2]/ t, 6,0 x 10-5 mol.L-1.s-1 em
determinado instante, qual o valor da velocidade de desaparecimento do O3,
- [O3]/ t, nesse mesmo instante?
15
Velocidades de reaes
Em geral, as velocidades aumentam medida que as concentraes
aumentam.
NH4+(aq) + NO2-(aq) N2(g) + 2H2O(l)
16
Concentrao e velocidade
Para a reao
NH4+(aq) + NO2-(aq) N2(g) + 2H2O(l)
observamos que:
medida que a [NH4+] duplica com a [NO2-] constante, a
velocidade dobra,
medida que a [NO2-] duplica com a [NH4+] constante, a
velocidade dobra,
conclumos que a velocidade [NH4+][NO2-].
A constante k a constante de velocidade.
17
Concentrao e velocidade
Expoentes na lei de velocidade
Para uma reao geral com a lei da velocidade
dizemos que
reagente 2.
reao
de
ordem
no
reagente
no
A ordem global de reao m + n +
Uma reao pode ser de ordem zero se m, n, so zero.
Observe que os valores dos expoentes (ordens) tm que ser determinados
experimentalmente. Eles no esto simplesmente relacionados com a
estequiometria.
18
Concentrao e velocidade
Uso das velocidades iniciais para
determinar as leis de velocidade
Uma reao de ordem zero em um reagente se a variao da concentrao
daquele reagente no produz nenhum efeito.
Uma reao de primeira ordem se, ao dobrarmos a concentrao, a velocidade
dobrar.
Uma reao de ordem n se, ao dobrarmos a concentrao, a velocidade
aumentar de 2n.
Observe que a constante de velocidade no depende da concentrao.
19
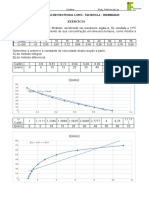
Exerccio 3
A velocidade inicial de uma reao A + B C foi medida para vrias
concentraes iniciais diferentes de A e B, e os resultados so como seguem:
Usando esses dados, determine (a) a lei de velocidade para a reao; (b) a
magnitude da constante de reao; (c) a velocidade de reao quando [A] = 0,050
mol/L e [B] = 0,100 mol/L.
20
Exerccio 4
Os seguintes dados foram medidos para a reao do xido ntrico com hidrognio:
(a) determine a lei de velocidade para a reao; (b) calcule a constante de
velocidade; (c) calcule a velocidade de reao quando [NO] = 0,050 mol/L e
[H2] = 0,100 mol/L.
21
Mecanismos de reao
Mecanismos com uma etapa inicial rpida
Considere o seguinte mecanismo
Anda mungkin juga menyukai
- Velocidade Reações QuímicasDokumen22 halamanVelocidade Reações QuímicasVirginia SouzaBelum ada peringkat
- Cinética químicaDokumen10 halamanCinética químicaItalo PiresBelum ada peringkat
- Perfis de concentração em reações de transferência de massaDokumen8 halamanPerfis de concentração em reações de transferência de massaEdilton NunesBelum ada peringkat
- Aula 6 Combinacao Reatores PDFDokumen53 halamanAula 6 Combinacao Reatores PDFwillisson santos100% (1)
- Regulação da Glicólise por Enzimas-ChaveDokumen15 halamanRegulação da Glicólise por Enzimas-Chavewalas joãoBelum ada peringkat
- CM 250 - Bioquímica 10-05-21Dokumen39 halamanCM 250 - Bioquímica 10-05-21Rafael BachBelum ada peringkat
- 2 Lista Exercícios Avaliativa CR2Dokumen1 halaman2 Lista Exercícios Avaliativa CR2Hebert SutilBelum ada peringkat
- Química lista exercícios fixação AV02Dokumen6 halamanQuímica lista exercícios fixação AV02Natalia AmaralBelum ada peringkat
- Cinética química e reatoresDokumen19 halamanCinética química e reatoresArtur VcrBelum ada peringkat
- Arqv PDFDokumen9 halamanArqv PDFVinicius Ribeiro VelosoBelum ada peringkat
- Instrucoes Transaminase Alt TGP CineticaDokumen6 halamanInstrucoes Transaminase Alt TGP CineticaTEXTO LOCUTORBelum ada peringkat
- Cinetica Quimica Das Reacoes Homogeneas Benedito PDFDokumen92 halamanCinetica Quimica Das Reacoes Homogeneas Benedito PDFEládio R Moura AraujoBelum ada peringkat
- Didática - Plano de AulaDokumen12 halamanDidática - Plano de AulaRaiana Canzian LimaBelum ada peringkat
- Cinética Química – Reação relógio iodeto/iodoDokumen11 halamanCinética Química – Reação relógio iodeto/iodoRafael Araújo Borges100% (1)
- PUCPR Biotecnologia Lista Exercícios EnzimasDokumen4 halamanPUCPR Biotecnologia Lista Exercícios EnzimasLuiz Rodrigo AssisBelum ada peringkat
- Lista Cinética QuímicaDokumen6 halamanLista Cinética QuímicavfmgarciaBelum ada peringkat
- Enzimas: definição, função, estrutura, classificação e cinéticaDokumen32 halamanEnzimas: definição, função, estrutura, classificação e cinéticaemgvqBelum ada peringkat
- Atividade Cinética II SGDokumen7 halamanAtividade Cinética II SGademairmoreiraBelum ada peringkat
- Exercício Cinética QuímicaDokumen6 halamanExercício Cinética QuímicaLucas BentesBelum ada peringkat
- Cinética química: Fatores que influenciam a velocidade de reaçõesDokumen14 halamanCinética química: Fatores que influenciam a velocidade de reaçõesMatheus FerreiraBelum ada peringkat
- Ficha V - Cinetica Quimica - Parte II - Equacao de ArrheniusDokumen2 halamanFicha V - Cinetica Quimica - Parte II - Equacao de ArrheniusAngelique ViannyBelum ada peringkat
- Cinética e ReatoresDokumen55 halamanCinética e Reatoresbrayamperini100% (1)
- Fatores que afetam a cinética químicaDokumen17 halamanFatores que afetam a cinética químicaMateus DinizBelum ada peringkat
- Atv - Cinética QuímicaDokumen3 halamanAtv - Cinética Químicamourabraga09Belum ada peringkat
- Apostila Introdutória - Cinética Química - 2013Dokumen13 halamanApostila Introdutória - Cinética Química - 2013Fabio ReisBelum ada peringkat
- Biom8 - Enzimas Estrutura e FunçãoDokumen32 halamanBiom8 - Enzimas Estrutura e FunçãoDavid Duarte100% (1)
- Introdução à cinética químicaDokumen63 halamanIntrodução à cinética químicaGermanomartins100% (1)
- Exercicio Físico Química 2 2017 1Dokumen5 halamanExercicio Físico Química 2 2017 1Vitor LimaBelum ada peringkat
- Aplicações dos reagentes Labtest para o BA-88ADokumen52 halamanAplicações dos reagentes Labtest para o BA-88ALaboratorio de BioquimicaBelum ada peringkat