Entropia
Diunggah oleh
Anonymous wH8gUfAFnHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Entropia
Diunggah oleh
Anonymous wH8gUfAFnHak Cipta:
Format Tersedia
Entropia
En termodinmica, la entropa (simbolizada como S) es una magnitud
fsica que, mediante clculo, permite determinar la parte de la
energa que no puede utilizarse para producir trabajo. Es una funcin
de estado de carcter extensivo y su valor, en un sistema aislado,
crece en el transcurso de un proceso que se d de forma natural. La
entropa describe lo irreversible de los sistemas termodinmicos. La
palabra entropa procede del griego () y significa evolucin o
transformacin. Fue Rudolf Clausius quien le dio nombre y la
desarroll durante la dcada de 1850;1 2 y Ludwig Boltzmann, quien
encontr en 1877 la manera de expresar matemticamente este
concepto, desde el punto de vista de la probabilidad.3
ndice [ocultar]
1 Introduccin
2 Entropa y termodinmica
2.1 Significado
2.2 Cero absoluto
2.3 Entropa y reversibilidad
3 Historia de la entropa
4 Interpretacin estadstica de la entropa
4.1 Entropa y desorden
4.2 Entropa como creadora de orden
4.3 Relacin de la entropa con la teora de la informacin
4.4 La entropa como flecha del tiempo
5 Vase tambin
6 Referencias
7 Enlaces externos
Introduccin[editar]
Cuando se plantea la pregunta: Por qu ocurren los sucesos en la
Naturaleza de una manera determinada y no de otra manera?, se
busca una respuesta que indique cul es el sentido de los sucesos.
Por ejemplo, si se ponen en contacto dos trozos de metal con distinta
temperatura, se anticipa que finalmente el trozo caliente se enfriar,
y el trozo fro se calentar, finalizando en equilibrio trmico. El
proceso inverso, el calentamiento del trozo caliente y el enfriamiento
del trozo fro es muy improbable que se presente, a pesar de
conservar la energa. El universo tiende a distribuir la energa
uniformemente; es decir, a maximizar la entropa.
La funcin termodinmica entropa es central para la segunda Ley de
la Termodinmica. La entropa puede interpretarse como una medida
de la distribucin aleatoria de un sistema. Se dice que un sistema
altamente distribuido al azar tiene alta entropa. Un sistema en una
condicin improbable tendr una tendencia natural a reorganizarse a
una condicin ms probable (similar a una distribucin al azar),
reorganizacin que dar como resultado un aumento de la entropa.
La entropa alcanzar un mximo cuando el sistema se acerque al
equilibrio, y entonces se alcanzar la configuracin de mayor
probabilidad.
Una magnitud es una funcin de estado si, y slo si, su cambio de
valor entre dos estados es independiente del proceso seguido para
llegar de un estado a otro. Esa caracterizacin de funcin de estado
es fundamental a la hora de definir la variacin de entropa.
La variacin de entropa nos muestra la variacin del orden molecular
ocurrido en una reaccin qumica. Si el incremento de entropa es
positivo, los productos presentan un mayor desorden molecular
(mayor entropa) que los reactivos. En cambio, cuando el incremento
es negativo, los productos son ms ordenados. Hay una relacin entre
la entropa y la espontaneidad de una reaccin qumica, que viene
dada por la energa de Gibbs.
Entropa y termodinmica[editar]
Esta idea de desorden termodinmico fue plasmada mediante una
funcin ideada por Rudolf Clausius a partir de un proceso cclico
reversible. En todo proceso reversible la integral curvilnea de
\frac{\delta Q}{T}
slo depende de los estados inicial y final, con independencia del
camino seguido (Q es la cantidad de calor absorbida en el proceso en
cuestin y T es la temperatura absoluta). Por tanto, ha de existir una
funcin del estado del sistema, S=f(P,V,T), denominada entropa, cuya
variacin en un proceso reversible entre los estados 1 y 2 es:
\Delta S = S_2 - S_1 = \int_1^2 \frac {\delta Q} {T} .
Tngase en cuenta que, como el calor no es una funcin de estado, se
usa Q, en lugar de dQ. La entropa fsica, en su forma clsica, est
definida por la ecuacin siguiente:
dS = \frac{\delta Q}{T}
o, ms simplemente, cuando no se produce variacin de temperatura
(proceso isotrmico):
S_2 - S_1 = \begin{matrix} \cfrac{Q_{1 \to 2}}{T} \end{matrix}
donde S es la entropa, Q_{1 \to 2} la cantidad de calor intercambiado
entre el sistema y el entorno y T la temperatura absoluta en kelvin.
Unidades: S=[cal/K]
Los nmeros 1 y 2 se refieren a los estados iniciales y finales de un
sistema termodinmico.
La termodinmica, por definirla de una manera muy simple, fija su
atencin en el interior de los sistemas fsicos, en los intercambios de
energa en forma de calor que se llevan a cabo entre un sistema y
otro. A las magnitudes macroscpicas que se relacionan con el estado
interno de un sistema se les llama coordenadas termodinmicas;
stas nos van a ayudar a determinar la energa interna del sistema.
En resumen, el fin ltimo de la termodinmica es encontrar entre las
coordenadas termodinmicas relaciones generales coherentes con los
principios bsicos de la fsica (recurdese el principio de la
conservacin de la energa que tratamos en el nmero 3 de "Horizonte
Social).
La termodinmica basa sus anlisis en algunas leyes: La Ley "cero",
referente al concepto de temperatura, la Primera Ley de la
termodinmica, que nos habla de el principio de conservacin de la
energa, la Segunda Ley de la termodinmica, que nos define a la
entropa. A continuacin vamos a hablar de cada una de estas leyes,
haciendo hincapi en la segunda ley y el concepto de entropa.
La Ley cero
La Ley cero de la termodinmica nos dice que si tenemos dos cuerpos
llamados A y B, con diferente temperatura uno de otro, y los ponemos
en contacto, en un tiempo determinado t, estos alcanzarn la misma
temperatura, es decir, tendrn ambos la misma temperatura. Si luego
un tercer cuerpo, que llamaremos C se pone en contacto con A y B,
tambin alcanzar la misma temperatura y, por lo tanto, A, B y C
tendrn la misma temperatura mientras estn en contacto.
De este principio podemos inducir el de temperatura, la cual es una
condicin que cada cuerpo tiene y que el hombre ha aprendido a
medir mediante sistemas arbitrarios y escalas de referencia (escalas
termomtricas).
La Primera Ley
La Primera ley de la termodinmica se refiere al concepto de energa
interna, trabajo y calor. Nos dice que si sobre un sistema con una
determinada energa interna, se realiza un trabajo mediante un
proceso, la energa interna del sistema variar. A la diferencia de la
energa interna del sistema y a la cantidad de trabajo le denominamos
calor. El calor es la energa transferida al sistema por medios no
mecnicos. Pensemos que nuestro sistema es un recipiente metlico
con agua; podemos elevar la temperatura del agua por friccin con
una cuchara o por calentamiento directo en un mechero; en el primer
caso, estamos haciendo un trabajo sobre el sistema y en el segundo le
transmitimos calor.
Cabe aclarar que la energa interna de un sistema, el trabajo y el calor
no son ms que diferentes manifestaciones de energa. Es por eso que
la energa no se crea ni se destruye, sino que, durante un proceso
solamente se transforma en sus diversas manifestaciones.
La Segunda Ley
Por ltimo, vamos a ver el contenido de la segunda ley de la
termodinmica. En trminos ms o menos sencillos dira lo siguiente:
"No existe un proceso cuyo nico resultado sea la absorcin de calor
de una fuente y la conversin ntegra de este calor en trabajo". Este
principio (Principio de Kelvin-Planck) naci del estudio del
rendimiento de mquinas y mejoramiento tecnolgico de las mismas.
Si este principio no fuera cierto, se podra hacer funcionar
una central trmica tomando el calor del medio ambiente;
aparentemente no habra ninguna contradiccin, pues el medio
ambiente contiene una cierta cantidad de energa interna, pero
debemos sealar dos cosas: primero, la segunda ley de la
termodinmica no es una consecuencia de la primera, sino una ley
independiente; segundo, la segunda ley nos habla de las restricciones
que existen al utilizar la energa en diferentes procesos, en nuestro
caso, en una central trmica. No existe una mquina que utilice
energa interna de una sola fuente de calor.
El concepto de entropa fue introducido por primera vez por R. J.
Clausius a mediados del siglo XIX. Clausius, ingeniero francs,
tambin formul un principio para la Segunda ley: "No es posible
proceso alguno cuyo nico resultado sea la transferencia de calor
desde un cuerpo fro a otro ms caliente". En base a este principio,
Clausius introdujo el concepto de entropa, la cual es una medicin de
la cantidad de restricciones que existen para que un proceso se lleve
a cabo y nos determina tambin la direccin de dicho proceso. Vamos
ahora a hablar de las tres acepciones ms importantes de la palabra
entropa.
La entropa, el desorden y el grado de organizacin.
Vamos a imaginar que tenemos una caja con tres divisiones; dentro de
la caja y en cada divisin se encuentran tres tipos diferentes de
canicas: azules, amarillas y rojas, respectivamente. Las divisiones son
movibles as que me decido a quitar la primera de ellas, la que separa
a las canicas azules de las amarillas. Lo que estoy haciendo dentro del
punto de vista de la entropa es quitar un grado o ndice de restriccin
a mi sistema; antes de que yo quitara la primera divisin, las canicas
se encontraban separadas y ordenadas en colores: en la primera
divisin las azules, en la segunda las amarillas y en la tercera las
rojas, estaban restringidas a un cierto orden.
Al quitar la segunda divisin, estoy quitando tambin otro grado de
restriccin. Las canicas se han mezclados unas con otras de tal
manera que ahora no las puedo tener ordenas pues las barreras que
les restringan han sido quitadas.
La entropa de este sistema ha aumentado al ir quitando las
restricciones pues inicialmente haba un orden establecido y al final
del proceso (el proceso es en este caso el quitar las divisiones de la
caja) no existe orden alguno dentro de la caja.
La entropa es en este caso una medida del orden (o desorden) de un
sistema o de la falta de grados de restriccin; la manera de utilizarla
es medirla en nuestro sistema inicial, es decir, antes de remover
alguna restriccin, y volverla a medir al final del proceso que sufri el
sistema.
Es importante sealar que la entropa no est definida como una
cantidad absoluta S (smbolo de la entropa), sino lo que se puede
medir es la diferencia entre la entropa inicial de un sistema Si y la
entropa final del mismo Sf. No tiene sentido hablar de entropa sino
en trminos de un cambio en las condiciones de un sistema.
Entropia, procesos reversibles y procesos irreversibles.
Volviendo al ejemplo anterior de la caja con separaciones y canicas,
vamos a explicar qu es un proceso reversible y qu un proceso no
reversible.
Llamamos proceso reversible al que se puede invertir y dejar a
nuestro sistema en las mismas condiciones iniciales. Teniendo en
cuenta
nuestra caja ya sin las separaciones, tenemos a las canicas revueltas
unas con otras, es decir, sin un orden. Si el proceso que efectuamos
de quitar las divisiones fuera reversible, las canicas tendran que
ordenarse espontneamente en azules, amarillas y rojas, segn el
orden de las divisiones. Esto no ocurrir.
El proceso que efectuamos con nuestra caja de canicas fue un proceso
no reversible, en donde una vez terminado, el orden que haba en las
condiciones iniciales del sistema ya nunca volver a establecerse. El
estudio de este tipo de procesos es importante porque en la
naturaleza todos los procesos son irreversibles.
La entropa y la energa "gastada".
En el principio enunciado por Clausius que anteriormente citamos,
podemos encontrar la relacin con la entropa y la energa liberada en
un proceso. Pensemos en un motor. El motor necesita de una fuente
de energa para poder convertirla en trabajo. Si pensamos en un
coche, la gasolina, junto con el sistema de chispa del motor,
proporciona la energa (qumica) de combustin, capaz de hacer que
el auto se mueva. qu tiene que ver la entropa aqu?
La energa que el coche "utiliz" para realizar trabajo y moverse, se
"gast", es decir, es energa liberada mediante un proceso qumico
que ya no es utilizable para que un motor produzca trabajo.
Este es uno de los conceptos ms difciles de entender de la entropa,
pues requiere un conocimiento un poco menos trivial del
funcionamiento de motores, frigorficos y el ciclo de Carnot. Pero para
nuestros fines con esta explicacin es suficiente.
Para qu sirve la entropa?
La entropa, como medida del grado de restriccin o como medida del
desorden de un sistema, o bien en ingeniera, como concepto auxiliar
en los problemas del rendimiento energtico de las mquinas, es una
de las variables termodinmicas ms importantes. Su relacin con la
teora del caos le abre un nuevo campo de estudio e investigacin a
este tan "manoseado" concepto.
Etimolgicamente entropa, asociada a la termodinmica, surgi
como palabra acuada del griego, de em (en: en, sobre, cerca de...) y
sqopg (trope: mudanza, giro, alternativa, cambio, evolucin).
entropia001
Rudolf Emanuel Clausius.
La termodinmica, por definirla de una manera muy simple, fija su
atencin en el interior de los sistemas fsicos, en los intercambios de
energa en forma de calor que se llevan a cabo entre un sistema y otro
y tiene sus propias leyes.
Uno de los soportes fundamentales de la Segunda Ley de la
Termodinmica es la funcin denominada entropa que sirve para
medir el grado de desorden dentro de un proceso y permite distinguir
la energa til, que es la que se convierte en su totalidad en trabajo,
de la intil, que se pierde en el medio ambiente.
La segunda ley de la termodinmica fue enunciada por S. Carnot en
1824. Se puede enunciar de muchas formas, pero una sencilla y
precisa es la siguiente:
La evolucin espontnea de un sistema aislado se traduce siempre
en un aumento de su entropa.
La palabra entropa fue utilizada por Clausius en 1850 para calificar el
grado de desorden de un sistema. Por tanto la segunda ley de la
termodinmica est diciendo que los sistemas aislados tienden al
desorden, a la entropa.
entropia005
Abajo, aumenta la entropa.
Este desorden se grafica en la mayor o menor produccin de energa
disponible o no disponible, y sobre esta base, tambin podemos
definir la entropa como el ndice de la cantidad de energa no
disponible en un sistema termodinmico dado en un momento de su
evolucin.
Segn esta definicin, en termodinmica hay que distinguir entre
energa disponible o libre, que puede ser transformada en trabajo y
energa no disponible o limitada, que no puede ser transformada en
l.
Para comprender conceptualmente lo dicho, analicemos el ejemplo de
un reloj de arena, que es un sistema cerrado en el que no entra ni sale
arena.
La cantidad de arena en el reloj es constante; la arena ni se crea ni se
destruye en ese reloj. Esta es la analoga de la primera ley de la
termodinmica: no hay creacin ni destruccin de la materia-energa.
Aunque la cantidad de arena en el reloj es constante, su distribucin
cualitativa est constantemente cambiando: la cavidad inferior se va
llenando, mientras la cavidad superior se vaca. Esta es la analoga de
la segunda ley de la termodinmica, en la que la entropa (que es la
arena de la cavidad inferior) aumenta constantemente.
La arena de la cavidad superior (la menor entropa) es capaz de hacer
un trabajo mientras cae, como el agua en la parte superior de una
catarata. La arena en la cavidad inferior (alta entropa) ha agotado su
capacidad de realizar un trabajo. El reloj de arena no puede darse la
vuelta: la energa gastada no puede reciclarse, a menos que se
emplee ms energa en ese reciclaje que la que ser desarrollada por
la cantidad reciclada.
Tambin podemos hacer el anlisis tomando como ejemplo una cadena
trfica.
entropia003
La entropa acabar con el Universo.
En las cadenas trficas al ir subiendo de nivel (de productores a
consumidores) se va perdiendo energa qumica potencial. A medida
que subimos en los niveles de la cadena, el contenido total de este
tipo de energa es menor pero va aumentando la liberacin de otro
tipo de energa: El calor. Este ltimo es un tipo de energa con menor
probabilidad de aprovecharse ya que podemos generar menos trabajo
con este tipo de energa que con la energa qumica potencial.
Al proceso por el cual la energa pierde su capacidad de generar
trabajo til o, mejor dicho, se transforma en otra energa que es
menos aprovechable, se le llama entropa.
Mirado desde otro punto de vista, y para una comprensin y
aplicacin ms general del concepto, la entropa se entiende como el
grado de desorden de un sistema, as, por ejemplo, en la medida en
que vamos subiendo niveles en la cadena trfica, cada vez tenemos
menos control sobre la energa qumica potencial que sirve para
generar trabajo ya que sta se ha ido transformando en calor y
nosotros podemos aprovechar (controlar) menos este tipo de energa,
es decir va aumentando el grado de descontrol (desorden) que
tenemos sobre la cadena trfica.
Por eso se dice que todo sistema biolgico tiende a la entropa; es
decir, al desorden.
Como podemos apreciar, la entropa es el elemento esencial que
aporta la termodinmica, ciencia de los procesos irreversibles, es
decir orientados en el tiempo.
entropia004
Fragmentos de plato con alta entropa.
Ejemplos de procesos irreversibles pueden ser: la descomposicin
radioactiva, la friccin o la viscosidad que modera el movimiento de
un fluido. Todos estos procesos poseen una direccin privilegiada en
el tiempo, en contraste con los procesos reversibles.
Precisamente, la distincin entre procesos reversibles e irreversibles
la introduce en termodinmica el concepto de entropa, que Clausius
asocia ya en 1865 al segundo principio de la termodinmica.
Todos hemos visto alguna vez un plato que se cae desde una mesa y
se hace aicos contra el suelo. Lo que antes estaba ordenado en una
nica pieza de porcelana, se convierte en una multitud de fragmentos
desordenados. Pero la situacin contraria, la recomposicin de un
plato a partir de sus fragmentos de manera espontnea, al menos que
se sepa, no la ha visto nadie.
La ruptura del plato es un suceso natural e irreversible, una secuencia
temporal adecuada; su recomposicin, en cambio, no lo es. Es la
evolucin natural del orden al desorden o, en trminos cientficos, la
natural tendencia del Universo a aumentar su entropa.
Todos tenemos una cierta idea, intuitiva, de lo que significa orden y
desorden, pero desconocemos que el paso de una situacin a la otra
implica, de forma indefectible, el final de todo movimiento, la muerte
del Universo.
Anda mungkin juga menyukai
- Trabajo 21Dokumen2 halamanTrabajo 21Anonymous wH8gUfAFnBelum ada peringkat
- Ubicacion y Consecuencias ChoropampaDokumen5 halamanUbicacion y Consecuencias ChoropampaAnonymous wH8gUfAFnBelum ada peringkat
- Ubicacion y Consecuencias ChoropampaDokumen5 halamanUbicacion y Consecuencias ChoropampaAnonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Prueba CCCMDokumen3 halamanPrueba CCCMAnonymous wH8gUfAFnBelum ada peringkat
- Prueba CCCMDokumen3 halamanPrueba CCCMAnonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- FENÓMENOS CRÍTICOS ccr7Dokumen13 halamanFENÓMENOS CRÍTICOS ccr7Anonymous wH8gUfAFnBelum ada peringkat
- Scilador Armónico Cuántico 123Dokumen5 halamanScilador Armónico Cuántico 123Anonymous wH8gUfAFnBelum ada peringkat
- Movimiento Browniano 123Dokumen42 halamanMovimiento Browniano 123Anonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Cronograma 2016Dokumen7 halamanCronograma 2016Anonymous wH8gUfAFnBelum ada peringkat
- Plancha Polinomica MRWDokumen16 halamanPlancha Polinomica MRWAnonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Principios de Termodinamica 123Dokumen5 halamanPrincipios de Termodinamica 123Anonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Plancha Polinomica MRWDokumen16 halamanPlancha Polinomica MRWAnonymous wH8gUfAFnBelum ada peringkat
- System ScainerDokumen114 halamanSystem ScainerAnonymous wH8gUfAFnBelum ada peringkat
- Monografia Ccr7Dokumen3 halamanMonografia Ccr7Anonymous wH8gUfAFnBelum ada peringkat
- Disco QuemDokumen1 halamanDisco QuemAnonymous wH8gUfAFnBelum ada peringkat
- Plancha PolinomicaDokumen7 halamanPlancha PolinomicaAnonymous wH8gUfAFnBelum ada peringkat
- Trabajo 1Dokumen9 halamanTrabajo 1Anonymous wH8gUfAFnBelum ada peringkat
- Coordinates ThermalDokumen13 halamanCoordinates ThermalAnonymous wH8gUfAFnBelum ada peringkat
- Teoría de SturmDokumen66 halamanTeoría de SturmAnonymous wH8gUfAFnBelum ada peringkat
- Que Es La Vida SchrodingerDokumen6 halamanQue Es La Vida SchrodingerAnonymous wH8gUfAFnBelum ada peringkat
- Mechanics CLDokumen2 halamanMechanics CLAnonymous wH8gUfAFnBelum ada peringkat
- Que Es La Vida SchrodingerDokumen6 halamanQue Es La Vida SchrodingerAnonymous wH8gUfAFnBelum ada peringkat
- Word TraducidoDokumen37 halamanWord TraducidoAnonymous wH8gUfAFnBelum ada peringkat
- Experimento 123Dokumen12 halamanExperimento 123Anonymous wH8gUfAFnBelum ada peringkat
- PM1 Caminos Navistar Similar Procedimiento Sterling LT9500Dokumen5 halamanPM1 Caminos Navistar Similar Procedimiento Sterling LT9500Ricardo La CruzBelum ada peringkat
- MT CBX250 Suplemento 2003 - 00X65-KPF-002Dokumen40 halamanMT CBX250 Suplemento 2003 - 00X65-KPF-002Vaquero EnmotoBelum ada peringkat
- Importancia de la salud y la pobrezaDokumen32 halamanImportancia de la salud y la pobrezaBrayer Tito HuamánBelum ada peringkat
- Acero MoldeadoDokumen2 halamanAcero MoldeadoLilibeth GonzalezBelum ada peringkat
- Altazor Canto 1Dokumen30 halamanAltazor Canto 1Marquitx Gálvez ArrietBelum ada peringkat
- OXACIDOSDokumen6 halamanOXACIDOSBryan Mendieta QuiñonesBelum ada peringkat
- Medir magnitudes con el Sistema InternacionalDokumen3 halamanMedir magnitudes con el Sistema InternacionalJulian PopovBelum ada peringkat
- Guia Practica Hospitalseguro PDFDokumen24 halamanGuia Practica Hospitalseguro PDFRuben MartinezBelum ada peringkat
- Evaluacion 2 CRMDokumen8 halamanEvaluacion 2 CRMalbeiro palaciosBelum ada peringkat
- Importancia de la ética laboralDokumen4 halamanImportancia de la ética laboralRMMBelum ada peringkat
- TP01 Marradi Método Metodología TécnicasDokumen14 halamanTP01 Marradi Método Metodología TécnicasbibliotecafastaBelum ada peringkat
- Aceite Dielectrico para TransformadoresDokumen24 halamanAceite Dielectrico para TransformadoresEduardo Villanueva PríncipeBelum ada peringkat
- Jonathan Gonzalez Introduccion A La Programacion Semana 7Dokumen10 halamanJonathan Gonzalez Introduccion A La Programacion Semana 7cristian chacon muñozBelum ada peringkat
- Boletín SagradinoDokumen6 halamanBoletín SagradinoJennifer FreemanBelum ada peringkat
- Capitulo 3 CuerdasDokumen14 halamanCapitulo 3 CuerdasWilson MorenoBelum ada peringkat
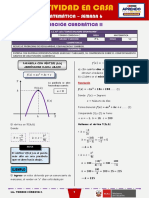
- SEMANA 6 - FUNCIÓN CUADRÁTICA II (3ro MATEMÁTICA)Dokumen2 halamanSEMANA 6 - FUNCIÓN CUADRÁTICA II (3ro MATEMÁTICA)Torimat CordovaBelum ada peringkat
- 13 Reglas de Composicion FotograficaDokumen15 halaman13 Reglas de Composicion FotograficaJaves Y. Cespedes DiazBelum ada peringkat
- NUMEROLOGIADokumen36 halamanNUMEROLOGIAjcesarin1Belum ada peringkat
- POlítica Educativa y Libros de Texto Gratuitos - MéxicoDokumen11 halamanPOlítica Educativa y Libros de Texto Gratuitos - MéxicoJorge JimenezBelum ada peringkat
- TAREA 1.2 Diseño Del Producto v2Dokumen10 halamanTAREA 1.2 Diseño Del Producto v2Ulises CabreraBelum ada peringkat
- Computos MetricosDokumen28 halamanComputos MetricosKarlita Osorio PedrazaBelum ada peringkat
- Acciones de Cierre. Formación Titulada VirtualDokumen29 halamanAcciones de Cierre. Formación Titulada VirtualKaren Steffany Colon CaballeroBelum ada peringkat
- Acherontia Styx (Polilla de La Muerte)Dokumen12 halamanAcherontia Styx (Polilla de La Muerte)Gustavo LimachiBelum ada peringkat
- Ensayo Marketing SensorialDokumen2 halamanEnsayo Marketing SensorialJennifer Rodriguez Carrero50% (4)
- Física I - Cuestionario sobre estructura de la materia, electricidad estática y ley de CoulombDokumen2 halamanFísica I - Cuestionario sobre estructura de la materia, electricidad estática y ley de CoulombJugeteria HaruBelum ada peringkat
- Ejercicio de Reflexion Curso - DD014 - Dirección y Planificación EstrategicaDokumen5 halamanEjercicio de Reflexion Curso - DD014 - Dirección y Planificación EstrategicaKlebber Aristides Monasterio RuizBelum ada peringkat
- Formato - Fase 3 Diseñar Una Propuesta de Experiencia Aprendizaje.Dokumen9 halamanFormato - Fase 3 Diseñar Una Propuesta de Experiencia Aprendizaje.Lina RuizBelum ada peringkat
- De La Globalización y El NeoliberalismoDokumen1 halamanDe La Globalización y El NeoliberalismoSantiago GomezBelum ada peringkat
- Diseño Estr RecipientesDokumen316 halamanDiseño Estr RecipientesviglesBelum ada peringkat
- Cálculo de equilibrios múltiples en sistemas complejosDokumen43 halamanCálculo de equilibrios múltiples en sistemas complejosEMERSONBelum ada peringkat