Espectrofotometria
Diunggah oleh
leydi ninaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Espectrofotometria
Diunggah oleh
leydi ninaHak Cipta:
Format Tersedia
PRACTICA 01: ESPECTROSCOPIA
INTRODUCCION
La espectrofotometra es el mtodo de anlisis ptico ms usado en las
investigaciones qumicas y biolgicas.
El espectrofotmetro es un instrumento que permite comparar la radiacin
absorbida o transmitida por una solucin que contiene una cantidad
desconocida de soluto, y una cantidad conocida de la misma sustancia.
Hay varios tipos de espectrofotmetros, puede ser de absorcin atmica o espectrofotmetro
de masa.
Este instrumento tiene la capacidad de proyectar un haz de luz monocromtica a travs de una
muestra y medir la cantidad de luz que es absorbida por dicha muestra. Esto le permite al
operador realizar dos funciones:
1. Dar informacin sobre la naturaleza de la sustancia en la muestra
2. Indicar indirectamente que cantidad de la sustancia que nos interesa est presente en la
muestra
OBJETIVOS
Conocer los fundamentos de la espectrofotometra y las variables
involucradas en la ley de Lambert-Beer
Construir una curva patrn de una solucin a descubrir a diferentes
longitudes de onda.
MARCO TEORICO
1. NATURALEZA DE LA RADIACIN ELECTROMAGNTICA
La Radiacin Electromagntica es una forma de Energa radiante que se
propaga en forma de ondas. En este fenmeno ondulatorio se define:
a) Longitud de onda (l): es la distancia entre dos mximos de un ciclo
completo del movimiento ondulatorio. Se expresa, segn el S.I. en
nanmetros (nm) y sus equivalencias son: 1nm = 1mm =10 A0 = 10-9 m.
b) Frecuencia (n): es el nmero de ciclos por segundo. Es inversa a la
longitud de onda. Su frmula es: n = c/l, y se mide en ciclos por segundo o
hertzios.
c) Fotones: la luz est formada por fotones, y estos son paquetes
discontinuos de E. La E de un fotn depende de la frecuencia y de la
longitud de onda, segn la siguiente expresin: E = h x n = h x c/n (h =
Cte. de Planck = 6,62.10-27erg/seg.). La Energa Electromagntica se mide
el Ergios. La relacin entre la longitud de onda y la Energa es inversa, por lo
tanto a menor longitud de onda mayor Energa y viceversa.
d) Espectro Electromagntico: cubre un amplio intervalo de E radiante,
desde los rayos g de longitud de onda corta hasta las ondas de radio, de
longitud de onda larga. Se divide en varias regiones, las ms interesantes
para nosotros son:
Regin Ultravioleta: l = 10-380 nm
Regin Visible: l = 380-780 nm
Regin Infrarroja: l = 780-30.000 nm
En la Regin Visible, la luz se descompone en colores. La luz blanca
contiene todo el espectro de longitudes de onda. Si interacciona con una
molcula puede ser dispersada o absorbida.
2. FENMENOS DE INTERACCIN ENTRE LUZ Y MATERIA
A.
FENMENO DE ABSORCIN
Cuando una partcula que se encuentra en estado de reposo o estado
fundamental interacciona con un haz de luz, absorbe E y se transforma en
una partcula en estado excitado. La molcula absorbe la E de la onda y
aumenta su energa, y ese aumento de energa es igual a la E de la
Radiacin Electromagntica absorbida (E = h.n). La partcula en estado
excitado tiende a volver de forma espontnea a su estado de reposo
desprendiendo la E absorbida en forma de calor.
Espectro de Absorcin. Cada especie absorbente, que recibe el nombre de
cromgeno, tiene un determinado espectro de absorcin. El espectro de
absorcin es un grfico donde se representa en ordenadas la Absorbancia y
en abcisas la longitud de onda. La medida de la cantidad de luz absorbida
por una solucin es el fundamento de la espectrofotometra de absorcin.
Por eso es importante trabajar a la longitud de onda a la que la sustancia
estudiada absorbe la mayor cantidad de luz (a mayor cantidad de luz,
mayor cantidad de sustancia).
B.
FENMENO DE EMISIN
Algunos compuestos, tras ser excitados por la luz, vuelven al estado
fundamental produciendo la emisin de energa radiante. En este caso, lo
que se mide es la energa emitida y, en este fenmeno se basa la
fotometra de llama o la fluorescencia.
3.
LEYES DE ABSORCIN
Cuando un haz de luz pasa a travs de un medio, se registra una cierta
prdida de intensidad, debido a la absorcin por parte de la sustancia.
Se llama TRANSMITANCIA (T) a la relacin entre la luz incidente y la luz
transmitida:
T = Is / I0 ;
%T = (Is / I0 ) x 100.
Se puede perder intensidad por la interaccin con la cubeta o el solvente.
Para evitar este error se hace una primera medida con una solucin de
referencia o BLANCO, que contiene todos los posibles compuestos que
intervienen en la lectura menos el que vamos a medir. Todas las medidas
que se hagan con posterioridad sern referidas a esta medida inicial y se
harn en la misma cubeta que se utiliz en la medida del blanco.
La Transmitancia se usa poco, se emplea ms la Absorbancia (A) porque la
relacin entre A y la concentracin de una solucin es directamente
proporcional y la de la T es inversamente proporcional.
La relacin entre la absorbancia y la transmitancia es la siguiente:
Si el %T = 100
A = 2-log T = 2-log 100 = 0
Si el %T = 0
A = 2-log 0 =
En los aparatos que se usan actualmente se presentan absorbancias, pero el
aparato lo que mide realmente es %T que luego transforma a absorbancia.
3.1. LEY DE BEER Y LAMBERT
La absorbancia de una solucin es directamente proporcional ala
concentracin y a la longitud del paso de la luz.
A = e . b. c
Siendo:
A: absorbancia. No tiene unidades.
e: el coeficiente de extincin molar, tambin llamado coeficiente de
absorcin. Es constante para un compuesto dado siempre que se fijen
condiciones de longitud de onda, de pH, de temperatura, de solventes, etc.
Sus unidades son 1/ (mol/cm).
b: es la longitud de paso de la luz, en cm.
c: es la concentracin del absorbente. Se mide en mol/L.
La aplicacin prctica de la Ley de Beer es, que conociendo la absorbancia
de una sustancia podemos averiguar su concentracin y esto lo podemos
hacer de dos formas:
1.
Por comparacin con una solucin conocida: si tenemos 2 soluciones,
una problema (P) y una estndar (S), podemos establecer la siguiente
relacin matemtica entre ellas:
2.
A travs de una curva de calibracin: la curva de calibracin es la
representacin grfica en un eje de coordenadas de la Absorbancia (eje de
ordenadas) frente a la Concentracin (eje de abcisas). Se ensayan varias
soluciones de concentracin conocida y se determinan sus A,
construyndose la curva de calibrado, que es una recta. Una vez ensayadas
las soluciones problemas, su concentracin se averigua por interpolacin de
las A de las soluciones problema en la curva de calibracin.
Hay que tener en cuenta la LINEALIDAD, que es el intervalo de
concentraciones del cromgeno entre las cuales existe una relacin lineal
entre Absorbancia y Concentracin.
Cuando la concentracin del cromgeno sobrepasa los lmites de
linealidad se deja de cumplir la Ley de Beer, convirtindose la recta en una
curva. La lectura de la Absorbancia fuera de los lmites de linealidad se
traduce en una concentracin falsamente baja de cromgeno. En esta
situacin, hay que diluir la muestra para que su concentracin entre en los
lmites de la linealidad.
Empleo de los Factores de Calibracin: Para reactivos estables y
sistemas fotomtricos estables, este factor se puede mantener constante,
siendo slo necesario ensayar las muestras problema multiplicando la
A resultante por el factor F.
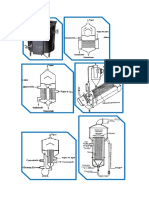
4. ESPECTROFOTMETRO
Se distinguen dos tipos de aparatos:
Fotmetro o Colormetro: se caracterizan porque utilizan filtros que solo
permiten el paso de una determinada longitud de onda.
Espectrofotmetros: utilizan cromadores. Con ellos se obtiene un haz de
luz monocromtico cuya longitud de onda se vara a voluntad. Los
monocromadores pueden ser de dos tipos: prismas y redes de difraccin.
4.1 COMPONENTES DEL ESPECTROFOTMETRO
1. Fuente de luz: proporciona energa radiante en forma de luz visible o no
visible.
Tipos de lmparas:
- Lmparas de filamento de tungsteno: se utilizan para longitudes de onda
del espectro visible y el ultravioleta prximo. Son fuentes de un espectro
continuo de energa radiante entre 360-950 nm.
- Lmparas de filamentos de haluros de tungsteno: son de mayor duracin
y emiten energa radiante de mayor intensidad.
- Lmparas de Hidrgeno y Deuterio: producen un espectro continuo en la
regin ultravioleta entre 220-360 nm.
- Lmparas de vapores de Mercurio: Emiten un espectro discontinuo o
espectro de lneas que se utilizan para calibracin de longitudes de onda, se
emplean solo para espectrofotmetros y cromatografa HPLC.
2. Rendija de entrada: tiene como funcin reducir al mximo la luz difusa y
evitar que la luz dispersa entre en el sistema de seleccin de longitud de
onda.
3. Monocromadores. Pueden ser:
- Prismas: son fragmentos con forma de cua de un material que permite
el paso de la luz. Ej. De vidrio para trabajar en el espectro visible o cuarzo
para trabajar en el ultravioleta lejano.
- Redes de difraccin: son un gran nmero de lneas paralelas situadas a
distancias iguales entre s y son hendiduras sobre un vidrio o una superficie
metlica. Cada una de estas hendiduras se comporta como un pequeo
prisma.
4. Rendija de salida: tiene como funcin impedir que la luz difusa atraviese
la cubeta de la muestra, que provocara desviaciones a la Ley de Beer.
5. Cubeta: es el recipiente donde se coloca la muestra para la medicin.
Pueden ser de distintos tipos y tamaos (cuadradas, rectangulares,
redondas). Se obtienen mejores resultados usando cubetas de bordes
paralelos. Si se utilizan cubetas redondas se deben marcar e introducir en el
aparato siempre en la misma posicin. Suelen estar fabricadas en vidrio o
en plstico.
6. Detector. Puede ser de dos tipos:
Fotoclulas o clulas fotovoltaicas:
Fototubos multiplicadores:
MATERIALES Y REACTIVOS
Papel milimetrado
Lpiz
Regla
PROCEDIMIENTO
Anlisis de una muestra desconocida:
A partir de una solucin a descubrir se construir una curva patrn a
diferentes longitudes de onda.
RESULTADOS
LONGITUD DE
ONDA
LECTURA DE ABSORVANCIAS
400
mu
0,03
430
mu
0,05
520
mu
0,26
570
mu
0,38
620
mu
0,14
700
mu
0,1
Los datos obtenidos se representan en un papel milimetrado grficamente
de manera que figure las longitudes de onda l en las abscisas en funcin
de las absorbancia A en las ordenadas; trazando una curva suave que una
todos los puntos.
El punto de mxima absorcin fue el de 570
mu
de longitud de onda y su
lectura de 0, 38 de concentracin.
CONCLUSIONES
Esta prctica nos sirvi para entender los conceptos de espectrofotometra y las leyes que
la involucran las leyes de Lambert-Beer-Bourger.
En la parte experimental no se pudo realizar disoluciones para sus
respectivas lecturas debido a que el espectrofotmetro se encontraba sin
mantenimiento y no funcionaba. Pero si logramos tener una idea al realizar
una curva patrn de una muestra desconocida a diferentes longitudes de onda,
estos datos fueron facilitados por la profesora.
Representar grficamente sirvi no solo para ver cmo se utiliza el espectrofotmetro
sino tambin para saber utilizar los datos que ste arroja.
LINKOGRAFIA
http://perso.wanadoo.es/sergioram1/espectrofotometria.htm
http://quimica-experimental.blogspot.pe/2013/05/practica-25espectrofotometria.html
http://materias.fi.uba.ar/6305/download/Espectrofotometria.pdf
Anda mungkin juga menyukai
- ESPECTROFOTOMETRÍADokumen8 halamanESPECTROFOTOMETRÍAkaren paulinaBelum ada peringkat
- Determinación Espectrofotométrica de HierroDokumen11 halamanDeterminación Espectrofotométrica de HierroOmar Fernando67% (3)
- Espectrofotometría laboratorio ingeniería agroindustrialDokumen12 halamanEspectrofotometría laboratorio ingeniería agroindustrialJean Franco Calderon Zavaleta100% (1)
- ESPECTROFOTOMETRIADokumen7 halamanESPECTROFOTOMETRIAArturo TorresBelum ada peringkat
- EspectrofotometríaDokumen28 halamanEspectrofotometríaPerla DuncanBelum ada peringkat
- Principio de La EspectrofotometriaDokumen6 halamanPrincipio de La EspectrofotometriaRobert Torrico CamachoBelum ada peringkat
- EspectrofotometriaDokumen17 halamanEspectrofotometriaSoraya FredesBelum ada peringkat
- Espectroscopia BeluDokumen15 halamanEspectroscopia BeluGuillermo Exequiel LanatiBelum ada peringkat
- Espectrofotometría UV-VisDokumen9 halamanEspectrofotometría UV-VismarinagamoBelum ada peringkat
- Práctica 2. Espectrofotometría - G2 - BioquímicaDokumen14 halamanPráctica 2. Espectrofotometría - G2 - BioquímicaSTEFHANY PAOLA MENDOZA HERNANDEZBelum ada peringkat
- Determinación de NitritosDokumen11 halamanDeterminación de Nitritosjhonny fuentes laraBelum ada peringkat
- Metodo Del Carmin PDFDokumen9 halamanMetodo Del Carmin PDFRodrigo ConciBelum ada peringkat
- Ley Beer-Lambert UMSADokumen12 halamanLey Beer-Lambert UMSAKath RodríguezBelum ada peringkat
- Espectrofotometría: Fundamentos y aplicaciones en el análisis de sustanciasDokumen10 halamanEspectrofotometría: Fundamentos y aplicaciones en el análisis de sustanciasEilen Gineth Rincon PallaresBelum ada peringkat
- Practica Profesionalizante-EspectrofotometriaDokumen6 halamanPractica Profesionalizante-Espectrofotometriasamanta yapuraBelum ada peringkat
- Practica #2 Quimica Analitica 2Dokumen13 halamanPractica #2 Quimica Analitica 2Victor VazquezBelum ada peringkat
- Fundamento de EspectrofotometriaDokumen15 halamanFundamento de Espectrofotometriamiguel100% (1)
- Espectrofotometría: Análisis óptico en investigaciones biológicasDokumen31 halamanEspectrofotometría: Análisis óptico en investigaciones biológicasJavier OrtizBelum ada peringkat
- 2 Ley de BeerDokumen12 halaman2 Ley de BeerKath RodríguezBelum ada peringkat
- Espectrofotometria 2° ParteDokumen8 halamanEspectrofotometria 2° Partesamanta yapuraBelum ada peringkat
- ESPECTROFOTOMETRÍADokumen13 halamanESPECTROFOTOMETRÍAAlexandra AlvarezBelum ada peringkat
- Bioquimica P2Dokumen9 halamanBioquimica P2Angélica JiménezBelum ada peringkat
- Informe 01 InstruDokumen11 halamanInforme 01 Instrualedrop10% (1)
- Espectrofotometría I3-: Determinación ε a partir de curva patrónDokumen9 halamanEspectrofotometría I3-: Determinación ε a partir de curva patrónMontse MoMo Mtz100% (1)
- EspectometriaDokumen10 halamanEspectometriaBerioskaRosasCartolínBelum ada peringkat
- Absorcion de RadiacionDokumen41 halamanAbsorcion de RadiacionMontse PérezBelum ada peringkat
- Espectrometría y Espectrometria Uv VisibleDokumen23 halamanEspectrometría y Espectrometria Uv VisibleIssabel DalinaBelum ada peringkat
- Análisis de nitratos en aguas mediante espectrofotometría UVDokumen19 halamanAnálisis de nitratos en aguas mediante espectrofotometría UVJair Jhosue Zavala RojasBelum ada peringkat
- Absorcion (Analisis Quimico)Dokumen11 halamanAbsorcion (Analisis Quimico)ruthsulbaranBelum ada peringkat
- Informe 2 Espectrofotometría PDFDokumen16 halamanInforme 2 Espectrofotometría PDFDianys LCBelum ada peringkat
- TEMA 1 - EspectrometríaDokumen10 halamanTEMA 1 - EspectrometríapablozglezBelum ada peringkat
- Resumen Equipos de Medición ÓpticaDokumen10 halamanResumen Equipos de Medición ÓpticaDra. Lisy BarçaBelum ada peringkat
- Análisis InstrumentalDokumen6 halamanAnálisis InstrumentalJorge Luis Melendez LazoBelum ada peringkat
- Espectroscopia y ColorimetriaDokumen11 halamanEspectroscopia y ColorimetriaYuriPaolaVallejoNovaBelum ada peringkat
- EspectrofotometríaDokumen14 halamanEspectrofotometríaMarco RichterBelum ada peringkat
- Informe ColorimetríaDokumen5 halamanInforme ColorimetríaDaniela Sierra Delgado100% (1)
- AbsorbanciaDokumen14 halamanAbsorbanciaGonzi MamaniBelum ada peringkat
- Fotocolorimetria Carlos LavarezDokumen13 halamanFotocolorimetria Carlos Lavarezcao4020% (1)
- El Espectrofotómetro. Manejo, Cuidados, Calibración. Obtención de Espectros y Su Interpretación.Dokumen5 halamanEl Espectrofotómetro. Manejo, Cuidados, Calibración. Obtención de Espectros y Su Interpretación.Hugo Franco Napán RodriguezBelum ada peringkat
- Cuantificación Por Espectrofotometría en El Uv-Visible - Grupo 4BDokumen19 halamanCuantificación Por Espectrofotometría en El Uv-Visible - Grupo 4BDANIEL VICTOR TRIGOSO LOSTAUNAUBelum ada peringkat
- Guias 6a - Reacción de Biuret (Fundamento y Procedimiento - Separata)Dokumen11 halamanGuias 6a - Reacción de Biuret (Fundamento y Procedimiento - Separata)WILDER PIZARRO CUNYASBelum ada peringkat
- Presentacion de EspectrofotometriaDokumen28 halamanPresentacion de EspectrofotometriaBeto Ramírez100% (1)
- Espectroscopia uItravioIetaDokumen27 halamanEspectroscopia uItravioIetaOLGA VEGABelum ada peringkat
- Determinacion de Concentración de Sulfato de Cobre Pentahidratado en EspectrosDokumen9 halamanDeterminacion de Concentración de Sulfato de Cobre Pentahidratado en EspectrosPABLO ANDRES BALLESTEROS CASTROBelum ada peringkat
- Qué Es Un Espectrofotómetro y para Qué SirveDokumen12 halamanQué Es Un Espectrofotómetro y para Qué SirveLuis DiazBelum ada peringkat
- QA - Espectroscopía UV-VISDokumen60 halamanQA - Espectroscopía UV-VISValentino FiccaBelum ada peringkat
- Resumen Introducción A La Química Clínica y EspectrofotometríaDokumen5 halamanResumen Introducción A La Química Clínica y EspectrofotometríajeiselllaBelum ada peringkat
- Espectrofotometría Ultravioleta VisibleDokumen12 halamanEspectrofotometría Ultravioleta VisibleMaría Del A. VargasBelum ada peringkat
- Guia ESPECTROSDokumen4 halamanGuia ESPECTROSLest SCBelum ada peringkat
- Bioquimica Practica IDokumen8 halamanBioquimica Practica INicolas Morales AlvarezBelum ada peringkat
- Laboratorio #3 Espectroscopia Visible. 1. ObjetivosDokumen15 halamanLaboratorio #3 Espectroscopia Visible. 1. ObjetivosJhoel ChaucaBelum ada peringkat
- Ley de Lambert-Beer SpectofotometríaDokumen8 halamanLey de Lambert-Beer SpectofotometríajosecarlosBelum ada peringkat
- Funcionamiento Espectrofotómetro UV-VISDokumen5 halamanFuncionamiento Espectrofotómetro UV-VISAnthony Carhuaz AncheliaBelum ada peringkat
- EspectrofotometriaDokumen36 halamanEspectrofotometriaAdelheint Bernstein100% (3)
- EspectrofotometríaDokumen29 halamanEspectrofotometríaCarlos EscobarBelum ada peringkat
- Practica 2Dokumen26 halamanPractica 2Marco A. Nieto AreyBelum ada peringkat
- Recepción y distribución de señales de radiodifusión. ELES0108Dari EverandRecepción y distribución de señales de radiodifusión. ELES0108Belum ada peringkat
- Solicitud Firma de CertificadosDokumen1 halamanSolicitud Firma de Certificadosleydi ninaBelum ada peringkat
- Analisis de Recorte Industrial PDFDokumen2 halamanAnalisis de Recorte Industrial PDFleydi ninaBelum ada peringkat
- Indice ManualesDokumen9 halamanIndice Manualesleydi ninaBelum ada peringkat
- Carne BovinaDokumen6 halamanCarne Bovinaleydi ninaBelum ada peringkat
- Leche Puntos Criticos y OperacionalesDokumen1 halamanLeche Puntos Criticos y Operacionalesleydi ninaBelum ada peringkat
- Tarea Diplomado Iso 9001Dokumen8 halamanTarea Diplomado Iso 9001leydi ninaBelum ada peringkat
- Imagenes de EvaporadoresDokumen3 halamanImagenes de Evaporadoresleydi ninaBelum ada peringkat
- Carne PorcinaDokumen10 halamanCarne Porcinaleydi ninaBelum ada peringkat
- Libros Interesantes Que Puedes Leer en Menos de Una HoraDokumen1 halamanLibros Interesantes Que Puedes Leer en Menos de Una Horaleydi ninaBelum ada peringkat
- Marcadores RegionesDokumen8 halamanMarcadores Regionesleydi ninaBelum ada peringkat
- Produccion Industrial y Arteanal de Leche y DerivadosDokumen4 halamanProduccion Industrial y Arteanal de Leche y Derivadosleydi ninaBelum ada peringkat
- Practica 01 Cip LambayequeDokumen6 halamanPractica 01 Cip Lambayequeleydi ninaBelum ada peringkat
- Accesorios de TuberíasDokumen9 halamanAccesorios de Tuberíasleydi ninaBelum ada peringkat
- AnexosDokumen9 halamanAnexosleydi ninaBelum ada peringkat
- DEFINICIONES Peligros, Riesgos, HACCP, Procesos Batch y ContinuoDokumen5 halamanDEFINICIONES Peligros, Riesgos, HACCP, Procesos Batch y Continuoleydi ninaBelum ada peringkat
- Indice de RefraccionDokumen1 halamanIndice de Refraccionleydi ninaBelum ada peringkat
- DEFINICIONES Peligros, Riesgos, HACCP, Procesos Batch y ContinuoDokumen5 halamanDEFINICIONES Peligros, Riesgos, HACCP, Procesos Batch y Continuoleydi ninaBelum ada peringkat
- Analisis Fisicoquimica de HarinaDokumen2 halamanAnalisis Fisicoquimica de Harinaleydi ninaBelum ada peringkat
- SobrealimentacionDokumen6 halamanSobrealimentacionleydi ninaBelum ada peringkat
- Norma Codex para aceites de oliva vírgenes y refinadosDokumen6 halamanNorma Codex para aceites de oliva vírgenes y refinadosAntonio Moscoso RodríguezBelum ada peringkat
- La EmpresaDokumen9 halamanLa Empresaleydi ninaBelum ada peringkat
- Recuperacion de Productos FermentadosDokumen13 halamanRecuperacion de Productos Fermentadosleydi ninaBelum ada peringkat
- Diptico Nectar QuinuaDokumen2 halamanDiptico Nectar QuinuaOzz SimonBelum ada peringkat
- Papa AlcoholDokumen32 halamanPapa Alcoholleydi nina100% (1)
- Procesados FrutasDokumen79 halamanProcesados FrutasDANGEROUSCATBelum ada peringkat
- SolicitudDokumen1 halamanSolicitudleydi ninaBelum ada peringkat
- DesnutricionDokumen47 halamanDesnutricionleydi ninaBelum ada peringkat
- Indice de RefraccionDokumen1 halamanIndice de Refraccionleydi ninaBelum ada peringkat
- Indice de RefraccionDokumen1 halamanIndice de Refraccionleydi ninaBelum ada peringkat
- TESIS 2014 - Propuesta TecnicaDokumen4 halamanTESIS 2014 - Propuesta Tecnicaleydi ninaBelum ada peringkat
- Caracterizacion Fundamentos ElectromecanicosDokumen13 halamanCaracterizacion Fundamentos ElectromecanicosAlexanderGonzalezBelum ada peringkat
- Fotoluminiscencia 2.0Dokumen7 halamanFotoluminiscencia 2.0JEFFERSON DAITON GOMEZ SHUPINGAHUABelum ada peringkat
- Laboratorio #4 Motor de CCDokumen10 halamanLaboratorio #4 Motor de CCDiego Canales0% (1)
- Desarrollo de Tarea 3Dokumen30 halamanDesarrollo de Tarea 3Hernado Nier ContrerasBelum ada peringkat
- LECTURA 1 - 1eroDokumen4 halamanLECTURA 1 - 1eroMary TiradoBelum ada peringkat
- INtroduccion A Los Sitema de Fibra Optica y Amplificadores Opticos TrabajoDokumen38 halamanINtroduccion A Los Sitema de Fibra Optica y Amplificadores Opticos TrabajoMichael SykesBelum ada peringkat
- Cuestionario y Autoevaluación 6Dokumen5 halamanCuestionario y Autoevaluación 6Nicole EvansBelum ada peringkat
- OpticaDokumen11 halamanOpticaAlfredo ElizaldeBelum ada peringkat
- Examen Previo Inductancia IDokumen7 halamanExamen Previo Inductancia IAlejandra VenturaBelum ada peringkat
- Informe 5 VainillinaDokumen7 halamanInforme 5 VainillinaJonnathan David Valbuena DíazBelum ada peringkat
- Guía Laboratorio 3 FotoelectricoDokumen8 halamanGuía Laboratorio 3 Fotoelectricojuan pablo eraso0% (2)
- Óptica GeométricaDokumen32 halamanÓptica GeométricaBernardo SilvaBelum ada peringkat
- Motores Sincronos PDFDokumen24 halamanMotores Sincronos PDFNeyra Martin100% (1)
- Lampara de HendiduraDokumen12 halamanLampara de HendiduraRene Gonzales VasquezBelum ada peringkat
- Conceptos Básicos para La Fotografía AéreaDokumen63 halamanConceptos Básicos para La Fotografía AéreaMajo Hernández ValdésBelum ada peringkat
- TABLADokumen1 halamanTABLAAntonio Rafael RugerinniBelum ada peringkat
- 2018 Repartido11Dokumen2 halaman2018 Repartido11Gonzalo de SouzaBelum ada peringkat
- Imágenes Pancromáticas y MultiespectralesDokumen5 halamanImágenes Pancromáticas y MultiespectralesREBECCA B.R.Belum ada peringkat
- Investigacion Lentes DelgadasDokumen10 halamanInvestigacion Lentes DelgadasPaco CortésBelum ada peringkat
- Fibra OpticaDokumen158 halamanFibra OpticaYenifer Bustamante Puello100% (1)
- Indicatrices Opticas PDFDokumen1 halamanIndicatrices Opticas PDFEdwin Estupiñan CadenaBelum ada peringkat
- Sistemas de PotenciaDokumen9 halamanSistemas de PotenciawilliamBelum ada peringkat
- Manual Caja de Pruebas 266Dokumen3 halamanManual Caja de Pruebas 266Aixaivan Juarez SanchezBelum ada peringkat
- Matematica de La Luz OriginalDokumen22 halamanMatematica de La Luz OriginalJosé Antonio MèndezBelum ada peringkat
- Informe 10Dokumen26 halamanInforme 10elbaBelum ada peringkat
- Naturaleza de la luz y dualidad onda-corpúsculoDokumen6 halamanNaturaleza de la luz y dualidad onda-corpúsculosensenom94Belum ada peringkat
- PDF de Exposicion de La LuzDokumen6 halamanPDF de Exposicion de La LuzJosé Antonio Mèndez100% (1)
- 4° - 0. Refracción - 2023 - 2Dokumen8 halaman4° - 0. Refracción - 2023 - 2KEYSI FIORELLA TALANCHA FLORESBelum ada peringkat
- Laboratorio de Conversion - Completo PDFDokumen30 halamanLaboratorio de Conversion - Completo PDFEdiquio GonzalezBelum ada peringkat
- Calculos de LuminariasDokumen20 halamanCalculos de LuminariasDimas Andrade GutierresBelum ada peringkat