Preguntas Del6 Al 10 Concentracion Normal de Hidrogeno
Diunggah oleh
Johan Castro Estrada0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
25 tayangan4 halamanquimica basica fiss uni
Judul Asli
Preguntas Del6 Al 10 concentracion normal de hidrogeno
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Iniquimica basica fiss uni
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
25 tayangan4 halamanPreguntas Del6 Al 10 Concentracion Normal de Hidrogeno
Diunggah oleh
Johan Castro Estradaquimica basica fiss uni
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 4
1.
Escriba las ecuaciones balanceadas del proceso rdox
2++ 4 H 2 O
3+ + M n
2+ 5 F e
++ 5 F e
+8 H
Mn O4
2. Calcule la normalidad de la solucin permanganato de potasio
KMnO
F e2 +
2+
F e x V
x N KMnO x V KMnO =N
4
c KMn O
7.08ml
N KMn O
= 0.004M x1 x
20ml
= 0.00225M
3. Calcule la concentracin de la solucin reductora
F e 2+
F e2 + x V
KMnO x M KMnO x V KMnO =N
4
0.00225M
X 9.6ml
F e 2+
C
X1X
10ml
F e 2+
c
4. El
KMnO 4
0.0108M
es un autoindicador del punto final? Por qu?
Porque si el color violeta del permanganato "desaparece", es decir, la
solucin se vuelve incolora, significa que el manganeso del permanganato
2+
se redujo a M n que es una especie incolora, y si el permanganato se
redujo, necesariamente otra especie tuvo que haberse oxidado.
5. En los anlisis exactos, las soluciones de NaOH se vuelven a
valorar cada vez que se emplean en das diferentes. Explique por
qu?
Esto se debe a que la solucin de NaOH reacciona con el medio ambiente,
absorbiendo la humedad (agua en forma de vapor) o si no reaccionando
con el CO2:
CO2 + H2O
H2CO3 + H2O
OH + H3O
H2CO3
HCO3 + H3O
H2O
6. Supongamos que una gota de la disolucin de HCl valorada queda
adherida en la pared del frasco de Erlenmeyer durante la valoracin
de la solucin de NaOH:
a) Cul sera el efecto de este error tcnico en el valor de la
concentracin de NaOH?
Si una gota de HCl queda adherida a la pared del Erlenmeyer, entonces el
volumen de HCl ( V HCl ) disminuira ya que todo el volumen de HCl
medido para el experimento no reaccionara.
b) Cmo afectara este error tcnico en el reporte del peso en moles de un
cido desconocido?
N equi.NaOH = N equi. HCl
NV (NaOH) = NV (HCl)
Pero en este caso:
N (NaOH) = M (NaOH)
N (HCl) = M (HCl)
Entonces
MV (NaOH) = MV (NaOH)
Se puede observar que si se mantienen constantes el V (NaOH( y M (HCl) , al
disminuir el V(HCl) disminuira la concentracin de NaOH ya que son directamente
proporcionales.
7.
Diferencie el significado entre punto equivalente y punto final en una
titulacin:
El punto de equivalencia: Es el punto de la valoracin en el que la cantidad
aadida de reactivo estndar (reactivo valorante) equivale exactamente a la de
analito en la muestra. El punto de equivalencia en una valoracin de formacin de
complejos es acompaado con frecuencia por un cambio algo marcado en el pH
que puede ser sealado con un indicador cido-base.
El punto final: Es el punto de una valoracin en el que se produce un cambio fsico
asociado a la condicin de equivalencia qumica. Normalmente el punto final se
detecta aadiendo un indicador a la disolucin de analito, con el fin de obtener un
cambio fsico observable (punto final).
8. Suponga que una burbuja de aire originalmente atrapada en un extremo de
la bureta, desaparece durante la titulacin. Cmo afectara
la
concentracin de KMnO4 presente en la muestra desconocida?
Habra un cambio en la concentracin, sera un aumento de este al considerar un
mayor volumen al verdadero, se genera un gasto mayor.
9.
Si una muestra de soldadura (aleacin de Pb y Sn) de 0.8750 gr se
disuelve, y se oxida el estao de la soldadura de Sn2+ a Sn4+ mediante
24.72 mL de K2Cr2O7,0.033270M.Qu porcentaje de Sn hay en la
soldadura?
3Sn2+ + Cr2O72- + 14H+
3Sn4+ + 2Cr3+ + 7H2O
Relacin de moles es de 3 a 1.
3
x
=
1 ( 0.033270 M ) ( 24.72.103 L )
x=moles
Porcentaje de Sn=
x .118,70 .100 0.292865 .100
=
=33.47068
0.8750
0.8750
10. Se necesitan 30.70 cm3 de KMnO4,00175 N, para valorar el hierro de
Fe(III) en una muestra de mineral que pesa 0.8270 g.Cul es el porcentaje
de hierro de muestra?
5Fe+2 +MnO4- +8H+
5Fe3+ +Mn+2 + 4H2O
5
x
=
1 (0.0175 N )(30,70. 103 L)/5
x=moles
Porcentaje de Fe=
x .55,845 .100 0,02999.100
=
=3.627
0.8270
0.8270
Anda mungkin juga menyukai
- 05.protocolo Tintes Penetrantes ESCalera 3Dokumen5 halaman05.protocolo Tintes Penetrantes ESCalera 3Carlos Alberto Leyva Giraldo100% (4)
- Teñido y EstampadoDokumen41 halamanTeñido y EstampadoJassiel Diaz33% (3)
- INTE 31-07-03-01 (Colores de Tuberias)Dokumen9 halamanINTE 31-07-03-01 (Colores de Tuberias)cdmontero100% (1)
- Informe Citrar UniDokumen11 halamanInforme Citrar UniJenny CQBelum ada peringkat
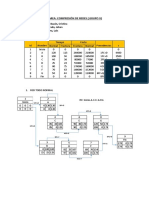
- Compresión de RedesDokumen3 halamanCompresión de RedesJohan Castro EstradaBelum ada peringkat
- M121 Variantes Tratamiento AireDokumen4 halamanM121 Variantes Tratamiento AireVictor Angel Miranda Cordero100% (1)
- Mezclas AsfalticasDokumen41 halamanMezclas AsfalticasgenesisBelum ada peringkat
- Construccion de Una Red de Aire ComprimidoDokumen17 halamanConstruccion de Una Red de Aire ComprimidoLucas PaglieriBelum ada peringkat
- Determinación de DBODokumen6 halamanDeterminación de DBODarioArizaRBelum ada peringkat
- Determinacion de Cocaina en Pelo Power PointDokumen20 halamanDeterminacion de Cocaina en Pelo Power PointEdwar Abraham Altamirano TincopaBelum ada peringkat
- Geologia AplicadaDokumen81 halamanGeologia Aplicadaeves_25h100% (3)
- Curso de AcueductosDokumen196 halamanCurso de AcueductosIngSanitaria100% (2)
- Cryomig Acero CarbonoDokumen1 halamanCryomig Acero Carbonopablitochoa0% (1)
- Consumo de EnergíaDokumen2 halamanConsumo de EnergíaJohan Castro EstradaBelum ada peringkat
- Puente PostensadoDokumen4 halamanPuente PostensadoJohan Castro EstradaBelum ada peringkat
- Número EstructuralDokumen1 halamanNúmero EstructuralJohan Castro EstradaBelum ada peringkat
- Fin Comun Aspecto FilosoficoDokumen3 halamanFin Comun Aspecto FilosoficoJohan Castro EstradaBelum ada peringkat
- Cálculo de PoblacionDokumen2 halamanCálculo de PoblacionJohan Castro EstradaBelum ada peringkat
- PertDokumen4 halamanPertJohan Castro EstradaBelum ada peringkat
- Periodo de DiseñoDokumen2 halamanPeriodo de DiseñoJohan Castro EstradaBelum ada peringkat
- Periodo de DiseñoDokumen2 halamanPeriodo de DiseñoJohan Castro EstradaBelum ada peringkat
- Tarea #3 Cálculo de La Evapotranspiración PotencialDokumen1 halamanTarea #3 Cálculo de La Evapotranspiración PotencialJohan Castro EstradaBelum ada peringkat
- Demanda CultivosDokumen2 halamanDemanda CultivosJohan Castro EstradaBelum ada peringkat
- Grupo 9: Cálculo de módulo y ritmo para construcción de carretera de 80 kmDokumen1 halamanGrupo 9: Cálculo de módulo y ritmo para construcción de carretera de 80 kmJohan Castro EstradaBelum ada peringkat
- Partes de La Celula 1Dokumen1 halamanPartes de La Celula 1Johan Castro EstradaBelum ada peringkat
- Calibración Del Coeficiente de Manning para DrenajeDokumen9 halamanCalibración Del Coeficiente de Manning para DrenajeJohan Castro EstradaBelum ada peringkat
- Requisitos para Tramitar Factibilidad de Servicios de Agua Potable y Alcantarillado para Nuevas HabilitacionesDokumen2 halamanRequisitos para Tramitar Factibilidad de Servicios de Agua Potable y Alcantarillado para Nuevas HabilitacionesJose Valdez NeyraBelum ada peringkat
- 2.2.2.2 EspectrofotometroDokumen3 halaman2.2.2.2 EspectrofotometroNadia BelindaBelum ada peringkat
- El Militarismo en El PeruDokumen368 halamanEl Militarismo en El Peruynl_libros71% (7)
- Teorias de CompactacionDokumen137 halamanTeorias de CompactacionEnzo VinciBelum ada peringkat
- DesarrolloDokumen17 halamanDesarrolloJohan Castro EstradaBelum ada peringkat
- Construccion de Carreteras RuralesDokumen181 halamanConstruccion de Carreteras RuralesSiDi Mohammed El Mejdoubi100% (2)
- PresentacionDokumen19 halamanPresentacionLizanaSantistebanAlfonsoBelum ada peringkat
- Metodo de DeflexionesDokumen16 halamanMetodo de DeflexionesJohan Castro EstradaBelum ada peringkat
- Compactación de SuelosDokumen7 halamanCompactación de SuelosJohan Castro EstradaBelum ada peringkat
- Datos de curvas circularesDokumen20 halamanDatos de curvas circularesJohan Castro EstradaBelum ada peringkat
- Dialnet LasCarreterasYSuInfluenciaEnElDesarrolloEconomicoY 45385Dokumen19 halamanDialnet LasCarreterasYSuInfluenciaEnElDesarrolloEconomicoY 45385Johan Castro EstradaBelum ada peringkat
- Semiconductor de SilicioDokumen2 halamanSemiconductor de SilicioJohan Castro EstradaBelum ada peringkat
- REPLANTEO DE CURVAS CON Pi y Curvas de DesarrolloDokumen4 halamanREPLANTEO DE CURVAS CON Pi y Curvas de DesarrolloJohan Castro EstradaBelum ada peringkat
- Clase #Formas Farmacéuticas SolidasDokumen53 halamanClase #Formas Farmacéuticas SolidasJackelin DionisioBelum ada peringkat
- Metales, No Metales y Gases NoblesDokumen7 halamanMetales, No Metales y Gases NoblesVivi Reca GBelum ada peringkat
- Electro Fenton Con Hierro Galvanizado y PeroxidoDokumen4 halamanElectro Fenton Con Hierro Galvanizado y PeroxidoJose L CamaBelum ada peringkat
- WA6167D Manual de Uso y Cuidado PDFDokumen25 halamanWA6167D Manual de Uso y Cuidado PDFMauricio Rodriguez VasquezBelum ada peringkat
- TermicoB PDFDokumen5 halamanTermicoB PDFVladimir Illich PinzonBelum ada peringkat
- Fertilizantes: Evolución y TecnologíaDokumen73 halamanFertilizantes: Evolución y TecnologíaMiguel Angel RiveroBelum ada peringkat
- Exam Final Edafologia 6 de Diciembre LGODokumen3 halamanExam Final Edafologia 6 de Diciembre LGODania ChacónBelum ada peringkat
- Análisis DimensionalDokumen10 halamanAnálisis DimensionalRoxana RafaileBelum ada peringkat
- Limpieza equipos ordeño 40Dokumen5 halamanLimpieza equipos ordeño 40Andres PerezBelum ada peringkat
- Haccp Seco Salado de TolloDokumen22 halamanHaccp Seco Salado de TolloFlor De Maria Ticona100% (1)
- Determinacion Del Contenido de Aceite en Las Semillas de Jaca Articulo CientificoDokumen6 halamanDeterminacion Del Contenido de Aceite en Las Semillas de Jaca Articulo CientificoViviana ValdesBelum ada peringkat
- Tipos de CompresoresDokumen4 halamanTipos de Compresoresnicola_vescio0% (1)
- Modelo Propuesto Por M. CookDokumen13 halamanModelo Propuesto Por M. CookOmar FieldsBelum ada peringkat
- Caja redonda GUA certificada RETIEDokumen3 halamanCaja redonda GUA certificada RETIEwilliamsBelum ada peringkat
- Preparacion de Catalizadores SolidosDokumen48 halamanPreparacion de Catalizadores SolidosJulio R Avila Mavare100% (1)
- 5 Paper BOD - En.esDokumen13 halaman5 Paper BOD - En.esDavid BeniqueBelum ada peringkat
- Informe de Analisis Cualitativo de FenolesDokumen5 halamanInforme de Analisis Cualitativo de FenolesSebastian SaldarriagaBelum ada peringkat
- STULZ Mini Space Brochure 0909 EsDokumen4 halamanSTULZ Mini Space Brochure 0909 Esthomassrod7223Belum ada peringkat
- Panadería y microbiología: Resumen del proceso de fabricación de pan y los microorganismos implicadosDokumen3 halamanPanadería y microbiología: Resumen del proceso de fabricación de pan y los microorganismos implicadosMARVINBelum ada peringkat