Evaluacion de Lab QG1 IT 2013
Diunggah oleh
Karlita Puente CastroHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Evaluacion de Lab QG1 IT 2013
Diunggah oleh
Karlita Puente CastroHak Cipta:
Format Tersedia
ESPOL FCNM DCQA
QUIMICA GENERAL 1
EVALUACION DE LABORATORIO I TERMINO 2013 (04/09/13)
SOLUCION DEL EXAMEN
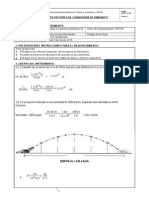
1. (10 puntos) Para determinar el EQUIVALENTE GRAMO DE ALUMINIO usted desarrollo un experimento
cuyos datos se incluyen a continuacin. Con estos datos realice los clculos pertinentes y complete la
tabla de resultados:
TABLA DE DATOS
Volumen de hidrogeno
Temperatura H2O y H
Presin total
Constante de gases
Masa de aluminio
Presin de vapor del agua a la temperatura del laboratorio
53.4 ml 14 ml = 39.4 ml
24C
1 atm
0.0821 atm.L/ mol-K
0.0265 g
0.02921 atm
TABLA DE RESULTADOS
1
2
3
4
Ecuacin qumica balanceada de
la reaccin (2 PUNTOS)
Formula o ecuacin de estado de
los gases ideales (1 PUNTO)
Ecuacin o Ley de las presiones
parciales (1 PUNTO)
Presin parcial del hidrogeno (1
PUNTO)
Moles de H2 producido (1
PUNTO)
Moles de Aluminio (1 PUNTO)
Peso molecular calculado del
Aluminio (2 PUNTO)
Masa equivalente- gramo de Al (1
PUNTO)
LUIS VACA SALAZAR
2 Al + 6HCl 2AlCl3 + 3H2
PV=nRT
Ptotal= P1+P2+P3++Pn
Ptotal= PH2 + PH2O
PH2 = Ptotal - PH2O = 1 atm 0.02921 atm = 0,97079 atm
AYUDANTE
ESPOL FCNM DCQA
QUIMICA GENERAL 1
EVALUACION DE LABORATORIO I TERMINO 2013 (04/09/13)
2. (10 puntos) La concentracin de iones H+ en una botella de vino de mesa, justo despus de que se le
removi el corcho, fue de 3.2 x10 -4 M. Solo se consumi la mitad del vino. Se encontr que la otra
mitad, despus de haber estado expuesto a aire durante un mes, tena una concentracin de ion
hidrogeno igual a 1x10-3 M. Calcule el pH del vino en estas dos ocasiones.
[
a)
b)
3. (10 puntos) La masa de un vaso vaco es 274 g. Se mide, con una probeta graduada, 200 ml de aceite
de oliva y se vierten en el vaso. Se pesa el vaso con su contenido, obteniendo un valor de 456 g. Cul
es la densidad del aceite, expresada en g/cm 3 y en Kg/L?
4. (10 puntos) La sosa para lavar, un compuesto que se emplea para acondicionar aguas duras para el
lavado de ropa, es un hidrato, lo que significa que estn incluidas un cierto nmero de molculas de
agua en la estructura slida. Su frmula puede escribirse como Na2CO3XH2O, donde X representa las
moles de agua por cada mol de sal anhidra. Describa el experimento que usted llevo a cabo para
determinar X. Cuando una muestra de 2.56 g de sosa de lavandera que al final deja 0.95 g de sal.
Cul es la frmula completa del hidrato?
El experimento para determinar las molculas de agua consisti en lo siguiente: Se pesa un crisol seco y
se anota como primer peso, luego se agrega cierta cantidad de sal y se pesa nuevamente como segundo
peso, se somete a calentamiento hasta evaporar toda el agua, se deja enfriar y finalmente se pesa como
tercer peso, despus de hacer los clculos respectivos se determina la cantidad de sal anhidra y de agua
evaporada y de ah se calcula el nmero de molculas de agua por cada mol de sal.
LUIS VACA SALAZAR
AYUDANTE
ESPOL FCNM DCQA
QUIMICA GENERAL 1
EVALUACION DE LABORATORIO I TERMINO 2013 (04/09/13)
2,56 g
0,95 g
1,61 g
(Conservacin de la masa)
Plantear regla de tres con la relacin estequiomtrica de la reaccin:
Formula del Hidrato:
5. (10 puntos) Defina que es la solubilidad de una sustancia y en que unidades se mide. Describa el
experimento que realizo para determinar la solubilidad de una muestra en el laboratorio.
La solubilidad es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un
determinado medio (solvente); implcitamente se corresponde con la mxima cantidad de soluto
disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la
solucin est saturada. Su concentracin puede expresarse en moles por litro, en gramos por litro, o
tambin en porcentaje de soluto (g/100 g de H2O).
Para determinar la solubilidad de una sustancia se colocan 10 ml de agua en un vaso de precipitacin
pequeo y se aaden pequeas cantidades de sal hasta que se disuelvan, luego se coloca el vaso en un
Bao Mara y se calienta segn la temperatura asignada por el profesor, se agregan ms porciones de
sal hasta que se note el exceso y se calienta hasta la temperatura asignada. Se agita fuertemente para
comprobar que ya no se disuelve, se retira el vaso y se vierte solo el lquido en la capsula, pesar y
calentar hasta la presencia de un slido blando, se enfra y se vuelve a pesar. Finalmente se determina la
masa de soluto y solvente y se observa en la grfica de solubilidad vs temperatura al compuesto que
corresponda.
LUIS VACA SALAZAR
AYUDANTE
Anda mungkin juga menyukai
- C3 Flujo Debajo de CompuertasDokumen13 halamanC3 Flujo Debajo de CompuertasKarlita Puente CastroBelum ada peringkat
- Maquinaria de Construccion USADA EN DISTINTOS PROYECTOSDokumen2 halamanMaquinaria de Construccion USADA EN DISTINTOS PROYECTOSKarlita Puente CastroBelum ada peringkat
- Modelos de CeluaresDokumen2 halamanModelos de CeluaresKarlita Puente CastroBelum ada peringkat
- Tipos de Suelos Indentificacion VisualDokumen3 halamanTipos de Suelos Indentificacion VisualKarlita Puente CastroBelum ada peringkat
- Modelo de Ropa A La ModaDokumen2 halamanModelo de Ropa A La ModaKarlita Puente CastroBelum ada peringkat
- Deber 1 CimentacionDokumen1 halamanDeber 1 CimentacionKarlita Puente CastroBelum ada peringkat
- Computadoras en La HistoriaDokumen4 halamanComputadoras en La HistoriaKarlita Puente CastroBelum ada peringkat
- Fotos de Post Motivadoras y AlegresDokumen4 halamanFotos de Post Motivadoras y AlegresKarlita Puente CastroBelum ada peringkat
- Instalaciones Electricas Implmeentos y FormasDokumen3 halamanInstalaciones Electricas Implmeentos y FormasKarlita Puente CastroBelum ada peringkat
- Tipos de Carro y ModelosDokumen2 halamanTipos de Carro y ModelosKarlita Puente CastroBelum ada peringkat
- Tipos de Suelos Indentificacion Visual PDFDokumen3 halamanTipos de Suelos Indentificacion Visual PDFKarlita Puente CastroBelum ada peringkat
- Construccion Civil Imagenes DefinitivasDokumen3 halamanConstruccion Civil Imagenes DefinitivasKarlita Puente CastroBelum ada peringkat
- Hormigón armado introducciónDokumen18 halamanHormigón armado introducciónKarlita Puente CastroBelum ada peringkat
- Deber 2 CimentacionDokumen1 halamanDeber 2 CimentacionKarlita Puente CastroBelum ada peringkat
- Cap 2 Materiales ElectricosDokumen45 halamanCap 2 Materiales ElectricosKarlita Puente CastroBelum ada peringkat
- Unidad 2Dokumen22 halamanUnidad 2Williams CarrielBelum ada peringkat
- LF 33Dokumen2 halamanLF 33Karlita Puente CastroBelum ada peringkat
- Leccion 1Dokumen3 halamanLeccion 1Karlita Puente CastroBelum ada peringkat
- CIMENTACIONES SUPERFICIALES Y PROFUNDAS: TIPOS Y FACTORES DETERMINANTESDokumen20 halamanCIMENTACIONES SUPERFICIALES Y PROFUNDAS: TIPOS Y FACTORES DETERMINANTESKarlita Puente CastroBelum ada peringkat
- PRONTUARIO para Vigas y Porticos PDFDokumen52 halamanPRONTUARIO para Vigas y Porticos PDFCristian VelasquezBelum ada peringkat
- Capítulo 2 - Transmisión de Esfuerzos y Exploración Geotécnica PDFDokumen23 halamanCapítulo 2 - Transmisión de Esfuerzos y Exploración Geotécnica PDFKarlita Puente CastroBelum ada peringkat
- Cap 8 de Quimica La Ciencia CentralDokumen40 halamanCap 8 de Quimica La Ciencia CentralKarlita Puente CastroBelum ada peringkat
- Hormigón armado introducciónDokumen18 halamanHormigón armado introducciónKarlita Puente CastroBelum ada peringkat
- Formulario para V y P PDFDokumen52 halamanFormulario para V y P PDFKarlita Puente CastroBelum ada peringkat
- Análisis de hidrología y riesgo de inundaciones usando métodos estadísticosDokumen8 halamanAnálisis de hidrología y riesgo de inundaciones usando métodos estadísticosKarlita Puente CastroBelum ada peringkat
- Trabajo Virtual (Teoria y Ejercicios)Dokumen19 halamanTrabajo Virtual (Teoria y Ejercicios)Karlita Puente CastroBelum ada peringkat
- PRONTUARIO para Vigas y Porticos PDFDokumen52 halamanPRONTUARIO para Vigas y Porticos PDFCristian VelasquezBelum ada peringkat
- Formulario VigasDokumen16 halamanFormulario Vigasjcarvacho90% (10)
- Integrales de Mohr, Analisis EstructuralDokumen1 halamanIntegrales de Mohr, Analisis EstructuralKarlita Puente CastroBelum ada peringkat
- Fisica 3 Construccion de Un Electroscopio CaseroDokumen9 halamanFisica 3 Construccion de Un Electroscopio CaseroMaverick Aguirre JaraBelum ada peringkat
- Ejercicios ConversionesDokumen2 halamanEjercicios ConversionesBrayan BolañosBelum ada peringkat
- Recuperacion Fisica 11Dokumen1 halamanRecuperacion Fisica 11carlos300106Belum ada peringkat
- LABORATORIOHIDRAULICA1Dokumen6 halamanLABORATORIOHIDRAULICA1Leonel OrellanaBelum ada peringkat
- 1) Definiciones BásicasDokumen45 halaman1) Definiciones BásicasDiego Gutierrez YañezBelum ada peringkat
- 13 Problemas de RodillosDokumen8 halaman13 Problemas de RodillosDavid Coureaux MustelierBelum ada peringkat
- Caracteristicas de Las Construcciones Sismo ResistentesDokumen6 halamanCaracteristicas de Las Construcciones Sismo ResistentesLuz Esmeralda JaraBelum ada peringkat
- SENSORES RESISTIVOS y potenciómetrosDokumen118 halamanSENSORES RESISTIVOS y potenciómetrosmarcano3593% (44)
- Estatica y DinamicaDokumen3 halamanEstatica y DinamicaAlex Sebastian MachayBelum ada peringkat
- Modelos atómicos históricosDokumen9 halamanModelos atómicos históricosRICKΨ 煱 둻 睤 LATAMGAIMINGBelum ada peringkat
- Coulomb y CampoDokumen4 halamanCoulomb y CampoCAMILA ANDREA MANTILLA MESABelum ada peringkat
- Campo Eléctrico ExperimentoDokumen13 halamanCampo Eléctrico ExperimentoLisandro VilhBelum ada peringkat
- 11 MdeFluidos OrificiosDokumen30 halaman11 MdeFluidos OrificiosHernan QuishpeBelum ada peringkat
- Movimiento CompuestoDokumen3 halamanMovimiento CompuestoAlex VilavilaBelum ada peringkat
- Motores, conceptos básicos y métodos de arranqueDokumen4 halamanMotores, conceptos básicos y métodos de arranqueContreras Ramirez Jea DaniBelum ada peringkat
- Calor Molar de Vaporizacion y Punto de Ebullicion PDFDokumen7 halamanCalor Molar de Vaporizacion y Punto de Ebullicion PDFVictor HernandezBelum ada peringkat
- Prediccion Del TiempoDokumen3 halamanPrediccion Del Tiempojalepa_esBelum ada peringkat
- Veleta Monografia FinalDokumen23 halamanVeleta Monografia FinalFreddy Sucasaire CondoriBelum ada peringkat
- Circuitos limitadores diodosDokumen13 halamanCircuitos limitadores diodosVictor Victor Iguaran CampoBelum ada peringkat
- Taller Factores de Conversion de UnidadesDokumen16 halamanTaller Factores de Conversion de UnidadesAndrex Hernandez100% (1)
- Oleohidraulica Basica y Diseno de Circuitos Felip Roca PDFDokumen228 halamanOleohidraulica Basica y Diseno de Circuitos Felip Roca PDFfernandoBelum ada peringkat
- CBR suelos laboratorioDokumen12 halamanCBR suelos laboratorioMauricio Castillo GarciaBelum ada peringkat
- Teoría de la relatividad general de EinsteinDokumen3 halamanTeoría de la relatividad general de EinsteinMussuline G. Tenorio ABelum ada peringkat
- Práctica No. 3 - Lab. de Física EM-CBF212LDokumen10 halamanPráctica No. 3 - Lab. de Física EM-CBF212LAmbar SantanaBelum ada peringkat
- Capitulo I ChapmanDokumen2 halamanCapitulo I ChapmanDanLeo17Belum ada peringkat
- Cálculo de pérdidas por fricción y accesorios en tuberíasDokumen36 halamanCálculo de pérdidas por fricción y accesorios en tuberíasJamesMorenoBustamante100% (1)
- Tesis MBMDokumen175 halamanTesis MBMMariana CifuentesBelum ada peringkat
- A0RQ - Ejercicios de AplicacionDokumen6 halamanA0RQ - Ejercicios de AplicacionMIGUEL ANGEL ROLDAN MARTINBelum ada peringkat
- PROPIEDADES DE LOS FLUIDOS-viscosidadDokumen20 halamanPROPIEDADES DE LOS FLUIDOS-viscosidadABIGAIL SCARLET ARISPE LAFUENTEBelum ada peringkat
- Momento lineal y angularDokumen29 halamanMomento lineal y angularFranklinMauricioCampoverdeBelum ada peringkat