DEVOIR SURVEILLE N°3, Classe de 1°S
Diunggah oleh
الغزيزال الحسن EL GHZIZAL HassaneJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
DEVOIR SURVEILLE N°3, Classe de 1°S
Diunggah oleh
الغزيزال الحسن EL GHZIZAL HassaneHak Cipta:
Format Tersedia
Page 1 sur 2
DEVOIR SURVEILLE N3, classe de 1S
(20 points ; 1h30min)
N.B.
Deux points seront rservs la qualit de la prsentation
et de la rdaction.
- Dans la mesure du possible toute rponse devra tre justifie.
Exercice 1 ( 7 points)
PARTIE I
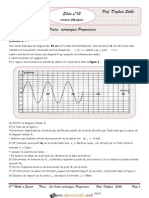
Les graphes en annexe1 reprsentent lvolution des quantits de matire des ractifs
en fonction de lavancement x de la raction dans le cas de la raction de prcipitation de
lhydroxyde de cuivre (II) selon lquation :
Cu2+(aq) + 2 HO-(aq) Cu(OH)2 (s)
Les graphes correspondent lvolution de deux systmes (a) et (b) dont les tats
initiaux sont diffrents.
1. Pour chaque systme, dduire des graphes la composition du systme dans ltat
initial.
2. Lun des deux systmes correspond-il un mlange stchiomtrique ? Si oui
lequel ?
3. Pour lautre systme dterminer :
3.1.
lavancement maximal de la raction et le ractif limitant ;
3.2.
la quantit de matire de lautre ractif dans ltat final.
PARTIE II
On verse dans un bcher un volume V1 = 20 mL dune solution dhydroxyde de sodium
(Na+(aq) + HO-(aq)) de concentration molaire apporte C1 = 0,40 mol.L-1 et un volume V2
= 30 mL dune solution de sulfate de cuivre (Cu2+(aq) + SO42-(aq)) de concentration
molaire apporte C2 = 0,10 mol.L-1. Il se forme un prcipit bleu dhydroxyde de cuivre (II)
(Cu(OH)2). Les ions sulfate et les ions sodium sont des ions spectateurs.
1. Dterminer les quantits de matire de ractifs dans ltat initial.
2. Complter le tableau dvolution de la raction se trouvant en annexe 2
(aucune justification nest demande). En dduire la masse de prcipit
obtenue ainsi que les concentrations molaires effectives des diffrentes espces
ioniques en fin de raction.
Donnes :
-
Masses molaires atomiques en g.mol1 : M(H) = 1,0 ; M(O) = 16,0 ; M(Na) = 23,0 ;
M(S) = 32,1 ;
M(Cu) = 63,5
Page 2 sur 2
Exercice 2 (4 points)
Lquation de dissolution du sulfate daluminium dans leau est :
Al2(SO4)3 (s) 2 Al3+ (aq) + 3 SO42- (aq)
1. Calculer les concentrations molaires effectives des ions aluminium et des ions
sulfate contenus dans une solution S de sulfate daluminium de concentration
molaire apporte C = 1,00 x 10-3 mol.L-1.
2. Calculer la conductivit de la solution S 25C sachant qu cette temprature :
Al 3 18,90
SO2 16,0
4
-1
mS.m2.mol-1
mS.m .mol ;
Exercice 3 (7 points )
On dispose dune solution S de chlorure de baryum (BaCl2) de concentration inconnue.
On souhaite dterminer, par conductimtrie, la concentration CS de la solution S.
1
On ralise une courbe dtalonnage en mesurant la conductance de solutions de
chlorure de baryum de concentrations connues (solutions titres). Les rsultats
sont regroups dans le tableau ci-dessous :
C (mmol.L1
)
G ( mS )
1,0
2,5
3.5
4,0
5,5
0,14
0,28
0,69
0,98
1,12
1,55
Tracer sur feuille de papier millimtr la courbe G = f( C )
chelles :
b
0,50
en abscisse 1 cm reprsente 0,5 mmol.L-1
en ordonne 1 cm reprsente 0,1 mS
Que peut-on dduire de lallure de la courbe obtenue ?
La solution S de concentration inconnue est trop concentre. On la dilue donc
avant deffectuer la dtermination de sa conductance. Par dilution on prpare 100
C S'
CS
5
mL dune solution dilue S de concentration
. La mesure de la
conductance de la solution S donne : G = 1,32 mS.
a Dcrire le mode opratoire qui permet dobtenir partir de la solution S la
solution S.
b Dterminer la concentration CS de la solution dilue S.
c En dduire la concentration CS de la solution S.
ANNEXE 1
Page 3 sur 2
Systme (a)
9
8
7
6
n(Cu2+) (mmol)
Linear (n(Cu2+) (mmol))
n(HO-) (mmol)
Linear (n(HO-) (mmol))
5
4
3
2
1
0
0
Systme (b)
9
8
7
6
n(Cu2+) (mmol)
Linear (n(Cu2+) (mmol))
n(HO-) (mmol)
Linear (n(HO-) (mmol))
5
4
3
2
1
0
0
ANNEXE 2 (A RENDRE AVEC LA COPIE)
Page 4 sur 2
N.B. On crira dans le tableau les valeurs numriques des
quantits initiales et finales des ractifs et du produit ainsi que la
valeur numrique de xmax
Cu2+(aq)
Cu(OH)2 (s)
Equation de la raction
Etat du systme Avancement
(mmol)
Etat initial
Etat
intermdiaire
Etat final
2 HO-(aq)
Quantits de matire (mmol)
ni(Cu2+)=
...
ni(HO-)=
ni(Cu(OH)2)= ..
.
..
..
..
Xmax
=.
nf(Cu2+)=
.
nf(HO-)=
nf(Cu(OH)2)=
Anda mungkin juga menyukai
- Exercices Du Chapitre 9Dokumen2 halamanExercices Du Chapitre 9bonvalot RobinBelum ada peringkat
- Devoir À Maison Svt2022 PCDokumen4 halamanDevoir À Maison Svt2022 PCKhalid Awtm0% (1)
- 63ffbb3081306 - Exercices Ondes Progressives M 0303 2023Dokumen5 halaman63ffbb3081306 - Exercices Ondes Progressives M 0303 2023Boruto UzumakiBelum ada peringkat
- Les Forces Electromagnetiques La Loi de Laplace Resume de Cours 2Dokumen3 halamanLes Forces Electromagnetiques La Loi de Laplace Resume de Cours 2abdelhamid100% (1)
- 4 DS3 2009 2010Dokumen4 halaman4 DS3 2009 2010Fethi Ferchiou100% (2)
- Devoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)Dokumen4 halamanDevoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)HaykelGaouaBelum ada peringkat
- Série D'exercices - Sciences Physiques - Bac Informatique (2014-2015) MR Daghsni SahbiDokumen7 halamanSérie D'exercices - Sciences Physiques - Bac Informatique (2014-2015) MR Daghsni SahbiMahmoud Essahbi Sahbi DaghsniBelum ada peringkat
- Devoir de Contrôle N°1 - Sciences Physiques - 3ème Sciences Exp (2017-2018) MR Mejri Chokri PDFDokumen3 halamanDevoir de Contrôle N°1 - Sciences Physiques - 3ème Sciences Exp (2017-2018) MR Mejri Chokri PDFSmaali Faouzi SmaaliBelum ada peringkat
- Devoir N°2 Type 3 S1 - 1bacDokumen2 halamanDevoir N°2 Type 3 S1 - 1bacخديجة بنزينب100% (1)
- Physique Chimie 2eme Bac Evaluation Diagnostique 6Dokumen2 halamanPhysique Chimie 2eme Bac Evaluation Diagnostique 6Ťăhã Êìî100% (2)
- Contrôle 2Dokumen3 halamanContrôle 2Mery EmBelum ada peringkat
- Détermination de La Formule Brute DDokumen4 halamanDétermination de La Formule Brute DBRICE THIERYBelum ada peringkat
- Série D'exercices N°2 - Chimie - Esterification - Hydrolyse - Bac Sciences Exp (2015-2016) MR Daghsni SahbiDokumen4 halamanSérie D'exercices N°2 - Chimie - Esterification - Hydrolyse - Bac Sciences Exp (2015-2016) MR Daghsni SahbiAmine AlaoUii AlaouiBelum ada peringkat
- Série D'exercices Conductance Et ConductivitéDokumen2 halamanSérie D'exercices Conductance Et Conductivitéammoura youssefBelum ada peringkat
- Series Ondes LumineusesDokumen4 halamanSeries Ondes LumineusesMoulayMoulyBelum ada peringkat
- Bac Blanc PDFDokumen2 halamanBac Blanc PDFMohameden Ahmed SalemBelum ada peringkat
- Sujet Up Devoir Terminale 1-1Dokumen4 halamanSujet Up Devoir Terminale 1-1larifuBelum ada peringkat
- Mouvement Particule Chargée MagnétiqueDokumen6 halamanMouvement Particule Chargée Magnétiqueالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- 56 Radioactivite M S PDFDokumen4 halaman56 Radioactivite M S PDFRayenne Ben Afia0% (1)
- CentraleDokumen2 halamanCentralePhobos Elfa100% (1)
- Série D'exercices: Mouvement D'une Particule Chargée Dans Un Champ Magnétique Uniforme - TsDokumen11 halamanSérie D'exercices: Mouvement D'une Particule Chargée Dans Un Champ Magnétique Uniforme - TsAmine AlaoUii AlaouiBelum ada peringkat
- Exercices 4 La Conductance Et La Conductivité Non CorrigeDokumen1 halamanExercices 4 La Conductance Et La Conductivité Non CorrigeMajed Gharib100% (1)
- Controle 1S1Dokumen2 halamanControle 1S1Moncef HadraouiBelum ada peringkat
- Controle 2 - 8 S1 PC 1bac FRDokumen2 halamanControle 2 - 8 S1 PC 1bac FRHamza MouhibBelum ada peringkat
- Série 2 - Quantité de MatièreDokumen4 halamanSérie 2 - Quantité de MatièreHafid TaziBelum ada peringkat
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFDokumen4 halamanDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFMohamed SaidiBelum ada peringkat
- Devoir 2 Modele 1 Physique Chimie 1er Bac Semestre 1Dokumen3 halamanDevoir 2 Modele 1 Physique Chimie 1er Bac Semestre 1Wijdane LouritiBelum ada peringkat
- Biof Exercices de Rotation 11-04-2020Dokumen6 halamanBiof Exercices de Rotation 11-04-2020opoyui097Belum ada peringkat
- Énergie Potentielle ExercicesDokumen3 halamanÉnergie Potentielle ExercicesBHIH ChaimaeBelum ada peringkat
- Travail Et Energie Cinetique Exercices Non Corriges 7Dokumen3 halamanTravail Et Energie Cinetique Exercices Non Corriges 7Papa SallBelum ada peringkat
- Contrôle 1 PR - ELANSARI SMDokumen2 halamanContrôle 1 PR - ELANSARI SMHassan Dib100% (1)
- La Gravitation Universelle Resume de Cours 2Dokumen2 halamanLa Gravitation Universelle Resume de Cours 2ZoujKooraBelum ada peringkat
- Cont 1 s1 PC 2 Bac Prof - Filali (WWW - Pc1.ma)Dokumen1 halamanCont 1 s1 PC 2 Bac Prof - Filali (WWW - Pc1.ma)said youssfiBelum ada peringkat
- Chap. 3 Mouvements Dans Un Champ UniformeDokumen9 halamanChap. 3 Mouvements Dans Un Champ UniformeDieu Est FidèleBelum ada peringkat
- Cherif AhmedDokumen5 halamanCherif AhmedMed Val ABBelum ada peringkat
- Devoir Surveille Ds de Physique de Niveau Premiere Mme MeunierDokumen8 halamanDevoir Surveille Ds de Physique de Niveau Premiere Mme Meunierالغزيزال الحسن EL GHZIZAL Hassane100% (2)
- Série Dipole RCDokumen6 halamanSérie Dipole RCSoukrani Abdeljabbar0% (1)
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Dokumen8 halamanControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- 5 Suivi D'une Transrormation Chimique PDFDokumen16 halaman5 Suivi D'une Transrormation Chimique PDFbrini med100% (2)
- Unlock-Devoir de Contrôle N°3 - Sciences Physiques - 3ème Informatique (2009-2010) MR ALIBI ANOUAR 2Dokumen2 halamanUnlock-Devoir de Contrôle N°3 - Sciences Physiques - 3ème Informatique (2009-2010) MR ALIBI ANOUAR 2stefanBelum ada peringkat
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Dokumen5 halamanChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- Pendule de Torsion Exercices Non Corriges 3Dokumen3 halamanPendule de Torsion Exercices Non Corriges 3Razan KhBelum ada peringkat
- Noyau, Énergie Et MasseDokumen6 halamanNoyau, Énergie Et MassetarazoterachidBelum ada peringkat
- Serie 06Dokumen2 halamanSerie 06Omar LANGEUR100% (1)
- 4 Ème - SC - Exp Profs - Abid - Hrizi - Feki Et Cherchari. Collège Sadiki Devoir de Synthèse N - 2 Samedi Chimie (9 Points)Dokumen5 halaman4 Ème - SC - Exp Profs - Abid - Hrizi - Feki Et Cherchari. Collège Sadiki Devoir de Synthèse N - 2 Samedi Chimie (9 Points)torkitaher100% (1)
- Controles Final 2in1Dokumen7 halamanControles Final 2in1Oussama EZZAITOUNIBelum ada peringkat
- ElectrolyteDokumen4 halamanElectrolytemhaouekBelum ada peringkat
- Pendule Elastique CoursDokumen4 halamanPendule Elastique Courseya GramiBelum ada peringkat
- Exercice (Induction - Auto Induction) PDFDokumen6 halamanExercice (Induction - Auto Induction) PDFhonoka flowerBelum ada peringkat
- Bac PCDokumen56 halamanBac PCOumar Traoré100% (2)
- Exercices Corriges Equilibrer Des Reactions Nucleaires Reaction de Fusion Dans Le SoleilDokumen3 halamanExercices Corriges Equilibrer Des Reactions Nucleaires Reaction de Fusion Dans Le Soleilroudy100% (1)
- 1bac Biof Exos de ChimieDokumen1 halaman1bac Biof Exos de Chimierihab100% (2)
- Série 2 - Cinématique Et Dynamique Du PointDokumen4 halamanSérie 2 - Cinématique Et Dynamique Du PointDjm AlgBelum ada peringkat
- 1-1-Devoir 1 S 1 PC 2BAC PDFDokumen5 halaman1-1-Devoir 1 S 1 PC 2BAC PDFmoon100% (3)
- Serie DahbiDokumen1 halamanSerie Dahbiel khamlichi dahbi100% (1)
- Chimie 3 Et 4 Serie D'exercices #3 Les Solutions ElecteolytiqueDokumen1 halamanChimie 3 Et 4 Serie D'exercices #3 Les Solutions ElecteolytiqueayoubbouuderqaBelum ada peringkat
- Série D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFDokumen4 halamanSérie D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFAzizElheniBelum ada peringkat
- C18 Dosages Par EtalonnageDokumen2 halamanC18 Dosages Par EtalonnageChaouki SaidiBelum ada peringkat
- Chimie TD 3 Cinétique ChimiqueDokumen4 halamanChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- SérieDokumen3 halamanSériemehdi benmassoudBelum ada peringkat
- Alcootest Et Oxydoreduction, Exercice de Chimie - 232424Dokumen3 halamanAlcootest Et Oxydoreduction, Exercice de Chimie - 232424الغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- MECANIQUE en LIGNE - Exercice de Cinématique - TreuilDokumen1 halamanMECANIQUE en LIGNE - Exercice de Cinématique - Treuilالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Exos OMP CorrigesDokumen6 halamanExos OMP Corrigesالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Cours Physique-Chimie 1bac BIOF .S1Dokumen47 halamanCours Physique-Chimie 1bac BIOF .S1الغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Physique 1 Et 2-Fi12999646Dokumen58 halamanPhysique 1 Et 2-Fi12999646الغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Cours Chimie 1BACDokumen43 halamanCours Chimie 1BACالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Exercices Qte de MatiereDokumen5 halamanExercices Qte de Matiereالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Exercices Qte de Matiere2Dokumen5 halamanExercices Qte de Matiere2الغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Evaluations CorrectionDokumen6 halamanEvaluations Correctionالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Travail Et Energie Cinetique Cours 2Dokumen9 halamanTravail Et Energie Cinetique Cours 2Smove Oner100% (1)
- 2005 Reunion Correction Exo2 Ammoniac 6 5ptsDokumen2 halaman2005 Reunion Correction Exo2 Ammoniac 6 5ptsالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Devoir N 1SII 2021 Bac BiofDokumen4 halamanDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Mouvement Particule Chargée MagnétiqueDokumen6 halamanMouvement Particule Chargée Magnétiqueالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Les Lois de MecaniqueDokumen13 halamanLes Lois de MecaniqueBordeauxMeknesAlamesBelum ada peringkat
- C6 La Pile ElectrochimiqueDokumen7 halamanC6 La Pile ElectrochimiquePecorellaBelum ada peringkat
- 2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsDokumen2 halaman2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- 2005 Antilles Spe Sujet Exo3 ModulationDokumen2 halaman2005 Antilles Spe Sujet Exo3 Modulationالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Devoir Surveillé de Physique NucléaireDokumen2 halamanDevoir Surveillé de Physique Nucléaireالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Serie 10 Lois de Newton FBDokumen5 halamanSerie 10 Lois de Newton FBالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Correction de Devoir SurveilléDokumen2 halamanCorrection de Devoir Surveilléالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Devoir 2bacspf 11Dokumen1 halamanDevoir 2bacspf 11الغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Devoir SurveilléDokumen3 halamanDevoir Surveilléالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Exercices 2 Les Lois de NewtonDokumen1 halamanExercices 2 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (5)
- Chapitre3-Exercice Cinematique Dynamique NewtonDokumen8 halamanChapitre3-Exercice Cinematique Dynamique Newtonالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Chapitre 11 Les Lois de NewtonDokumen12 halamanChapitre 11 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Site TS C 08 Les PilesDokumen9 halamanSite TS C 08 Les PilesPecorellaBelum ada peringkat
- Exercices Etat D Equilibre D Un Systeme ChimiqueDokumen4 halamanExercices Etat D Equilibre D Un Systeme Chimiqueالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- Les Piles PDFDokumen38 halamanLes Piles PDFKONAN ABO PHILEMON ARONOU100% (1)
- Chapitre 2 2011-2012 Les Piles ElectrochimiqueDokumen8 halamanChapitre 2 2011-2012 Les Piles ElectrochimiqueHAMADA19720% (1)
- Question Discussion Réponse: LimiteDokumen19 halamanQuestion Discussion Réponse: Limiteالغزيزال الحسن EL GHZIZAL HassaneBelum ada peringkat
- NF Dtu 45.2 P1-2 PDFDokumen11 halamanNF Dtu 45.2 P1-2 PDFYounes YounesBelum ada peringkat
- JavelDokumen5 halamanJavelmelxeroBelum ada peringkat
- Rapport 06AEP07Dokumen60 halamanRapport 06AEP07Mamadou FAYEBelum ada peringkat
- 2ie 1998 1 45Dokumen11 halaman2ie 1998 1 45Lobby Lob GratuitBelum ada peringkat
- 366 Dossier Energies Fossiles PDFDokumen18 halaman366 Dossier Energies Fossiles PDFzirconitaBelum ada peringkat
- Estion Des Déchets Ménagers Solides Dans La Ville de MonateleDokumen33 halamanEstion Des Déchets Ménagers Solides Dans La Ville de MonateleGhislain CAYOBelum ada peringkat
- Cours Filtration GaleniqueDokumen8 halamanCours Filtration Galeniquessarroura8075% (4)
- Datasheet Lead Carbon Battery FRDokumen1 halamanDatasheet Lead Carbon Battery FRSINES FranceBelum ada peringkat
- 7 - Types Corrosion PDFDokumen20 halaman7 - Types Corrosion PDFWilson Njange100% (2)
- Document 42Dokumen25 halamanDocument 42G95 PfeBelum ada peringkat
- Nomenclature de La Chimie InorganiqueDokumen18 halamanNomenclature de La Chimie Inorganiquejordy nzikaBelum ada peringkat
- A.Z.K Equipement Zi Oloumi Bp2464 Libreville Tél:077 78 03 61/065547777Dokumen3 halamanA.Z.K Equipement Zi Oloumi Bp2464 Libreville Tél:077 78 03 61/065547777laurent ewodjiBelum ada peringkat
- Note de Calcul Villa R 2 TIPAZADokumen23 halamanNote de Calcul Villa R 2 TIPAZAĦăm Ză100% (22)
- Ingenierie ReseauxDokumen90 halamanIngenierie ReseauxAnonymous WCNlcwBelum ada peringkat
- CHAPITRE IV Production Des Huiles de BaseDokumen13 halamanCHAPITRE IV Production Des Huiles de Basehamada aminaBelum ada peringkat
- Expose Materiaux CompositesDokumen72 halamanExpose Materiaux CompositesChristian Padji100% (1)
- Catalogue C2 MCDokumen8 halamanCatalogue C2 MCKouassi MartialBelum ada peringkat
- td3 redoxE-pHDokumen6 halamantd3 redoxE-pHEl Mounchit AyoubBelum ada peringkat
- Physique-Chimie 2de Éd. 2021 - Manuel Numérique Élève Actualisé - 9782401058927Dokumen1 halamanPhysique-Chimie 2de Éd. 2021 - Manuel Numérique Élève Actualisé - 9782401058927Марія РепкоBelum ada peringkat
- Chapitre 1: Généralités Sur La Construction Métallique: 1 12/09/2021 DR Adamah MESSANDokumen84 halamanChapitre 1: Généralités Sur La Construction Métallique: 1 12/09/2021 DR Adamah MESSANYves De KassenaBelum ada peringkat
- Module Maçonnerie TCDokumen19 halamanModule Maçonnerie TCkaoutarBelum ada peringkat
- S1 02 Structure BoisDokumen2 halamanS1 02 Structure BoisMéshakBelum ada peringkat
- RakuDokumen45 halamanRakui_ghosto100% (1)
- TD RDM-Poly 22-23Dokumen16 halamanTD RDM-Poly 22-23AimaneBelum ada peringkat
- Eff Tsgo 2015 PRDokumen4 halamanEff Tsgo 2015 PRIlyasse LgbtBelum ada peringkat
- Estimation de La Période Fondamentale de La StructureDokumen13 halamanEstimation de La Période Fondamentale de La StructureMoh YagoubBelum ada peringkat
- TheseDokumen234 halamanTheseOumaima HajjoubiBelum ada peringkat
- Actes JNB13Dokumen146 halamanActes JNB13yassineBelum ada peringkat
- Industrie KRAFTDokumen42 halamanIndustrie KRAFThsini09100% (1)
- Impact Des Matériaux Sur L'environnementDokumen19 halamanImpact Des Matériaux Sur L'environnementhassumo699Belum ada peringkat