Exp. No. 6 Propiedades Coligativas
Diunggah oleh
Rafael Fonseca Martinez0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
76 tayangan4 halamandfgh
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inidfgh
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
76 tayangan4 halamanExp. No. 6 Propiedades Coligativas
Diunggah oleh
Rafael Fonseca Martinezdfgh
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 4
PROPIEDADES COLIGATIVAS
OBJETIVO GENERAL
Ejemplificar experimentalmente la variacin del punto de ebullicin de una
disolucin.
FUNDAMENTOS
Las soluciones diluidas de solutos no-voltiles presentan propiedades muy
particulares denominadas propiedades coligativas, las cuales son:
a).- Descenso de la presin de vapor del disolvente.
b).- Descenso del punto de congelacin del disolvente.
c).- Aumento del punto de ebullicin.
d).- Presin osmtica.
Estas propiedades dependen nicamente del nmero de partculas en solucin
y no de la naturaleza de las mismas. En sta prctica se emplearn solutos del
tipo de no electrolitos ya que los electrolitos al disociarse en solucin
incrementan el nmero de partculas y por lo tanto se ven modificadas las
propiedades coligativas.
Aumento del punto de ebullicin de las disoluciones
Las disoluciones que contienen solutos no-voltiles presentan puntos de
ebullicin ms elevados que el disolvente puro. La diferencia entre el punto de
ebullicin de la solucin y el disolvente puro para una presin constante
establecida, se conoce como elevacin del punto de ebullicin que depende de
la naturaleza del disolvente y la concentracin del soluto, pero es
independiente, por lo menos en soluciones diluidas, de la naturaleza del soluto
en tanto este no se disocie.
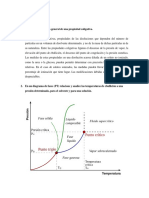
Consideremos el diagrama presin de vapor-temperatura que se muestra en la
figura 1.
Figura 1. Diagrama Presin de vapor Temperatura donde se muestra la lnea de
equilibrio lquido-vapor para el disolvente puro y la disolucin.
La curva AB representa la presin de vapor del disolvente puro en funcin de la
Prof. Grey C. Castellar Ortega Pgina 1
temperatura. Como la presin de vapor de la disolucin es para todas las
temperaturas, menor que la del disolvente, la curva de presin de vapor-
temperatura de la disolucin debe quedar debajo de la del disolvente puro y
est representado en el diagrama por la curva CD. A fin de alcanzar el punto de
ebullicin correspondiente a cierta presin externa que se ejerce sobre la
solucin P, debe calentarse a temperaturas a las cuales las presiones de vapor
respectivas igualan la del confinamiento.
El disolvente puede alcanzar la presin P a la temperatura T o, pero la solucin
debe elevarse a una temperatura mayor que T o antes de que se alcance la
misma presin. Por lo tanto, para la misma presin externa, la solucin debe
hervir a una temperatura ms elevada que la del disolvente puro; el ascenso
del punto de ebullicin ser entonces Tb =T-To.
Cuando aplicamos la ecuacin de Clausius-Clapeyron y la Ley de Raoult, es
posible deducir una relacin entre el ascenso del punto de ebullicin de la
solucin y su concentracin.
Como los puntos E y F quedan sobre la curva de presin de vapor de la
solucin, ambos pueden relacionarse mediante la ecuacin de Clausius-
Clapeyron.
En donde:
P y P son las presiones de vapor de la solucin a las temperaturas T y T o
respectivamente. Hv es el calor de vaporizacin por mol de disolvente de la
solucin, si la solucin es diluida T es prcticamente igual a T o y T To = To2
Cuando la ley de Raoult se aplica a la solucin, tenemos
X1 = fraccin mol del disolvente.
X2 = fraccin mol del soluto.
Por costumbre, se expresa la concentracin en moles de soluto por 1000 g de
disolvente, es decir en molalidad (m).
Prof. Grey C. Castellar Ortega Pgina 2
Si designamos con x1 al nmero de moles del disolvente en 1000 g tenemos:
Debido a que es una solucin diluida, m es pequeo en relacin con n 1 y puede
despreciarse quedando la ecuacin como sigue:
Para un disolvente dado, todas las cantidades en el parntesis de la ecuacin
anterior son constantes y podemos simplificar como sigue:
La constante Kb se denomina tambin constante molal de elevacin del punto
de ebullicin o constante ebulloscpica.
MATERIALES Y REACTIVOS
1 Baln de dos bocas de 100 mL
1 Termmetro
1 Condensador que se acople a una de las dos bocas del baln
1 Balanza digital
1 Equipo de calentamiento: mechero, trpode, malla y mangueras
6 Vasos de precipitados de 100 mL
2 Pipetas Pasteur
2 pipetas graduadas de 10 mL
Tapones
1 Soporte universal
1 Pinza para sujetar balones
Piedras de ebullicin
Agua destilada
Etilenglicol
METODOLOGA EXPERIMENTAL
Montar el equipo para punto de ebullicin de acuerdo con la figura 2.
Determine el punto de ebullicin del agua destilada, antes de iniciar el
calentamiento agregue perlas de ebullicin.
Colocar el agua destilada y el etilenglicol (EG) en un matraz bola, de acuerdo a
lo indicado en la tabla y determinar el punto de ebullicin de cada disolucin.
Antes de calentar, aadir perlas de ebullicin.
En la siguiente tabla, escribir los resultados obtenidos para cada solucin
preparada.
Tb del agua pura __________________C
Prof. Grey C. Castellar Ortega Pgina 3
PREGUNTAS
1. Para cada uno de los experimentos anteriores calcule el valor de T b y
promedie los resultados.
2. Consultar de la literatura el valor de K b para el agua. Determinar el peso
molecular experimental del etilenglicol y compararlo con su valor terico para
determinar el error relativo.
Prof. Grey C. Castellar Ortega Pgina 4
Anda mungkin juga menyukai
- LABORATORIO N 1 Propiedades Coligativas Ascenso Ebulloscopico y Descencso CrioscopicoDokumen8 halamanLABORATORIO N 1 Propiedades Coligativas Ascenso Ebulloscopico y Descencso Crioscopicoariel yana morgaBelum ada peringkat
- Práctica Propiedades Coligativas FisicoquimicaDokumen15 halamanPráctica Propiedades Coligativas FisicoquimicaIsi-romeo FuentesBelum ada peringkat
- Elevación Del Punto de Ebullición en SolucionesDokumen12 halamanElevación Del Punto de Ebullición en SolucionesUlisesYazielSosaLopezBelum ada peringkat
- Variacion de La SolubilidadDokumen11 halamanVariacion de La SolubilidadJorckeroBelum ada peringkat
- Propiedades ColigativasDokumen21 halamanPropiedades ColigativasMike RodriguezBelum ada peringkat
- Propiedades ColigativasDokumen29 halamanPropiedades ColigativasjorgeBelum ada peringkat
- Propiedades Coligativas de Las SolucionesDokumen6 halamanPropiedades Coligativas de Las SolucionesXerman Prieto DezaBelum ada peringkat
- Propiedades Coligativas de Las SolucionesDokumen5 halamanPropiedades Coligativas de Las SolucionesYonar Shmit Gallo QuispeBelum ada peringkat
- Disminución de La Temperatura de Fusión y Aumento de La Temperatura de EbulliciónDokumen3 halamanDisminución de La Temperatura de Fusión y Aumento de La Temperatura de EbulliciónLilianaFernandezCamachoBelum ada peringkat
- Propiedades ColigativasDokumen3 halamanPropiedades ColigativascristianBelum ada peringkat
- Propiedades ColigativasDokumen3 halamanPropiedades ColigativascristianBelum ada peringkat
- Destilación y purificación de disolventesDokumen23 halamanDestilación y purificación de disolventesMejia Chavez Samantha MozaliBelum ada peringkat
- Ecuación de Clausius ClapeyronDokumen6 halamanEcuación de Clausius Clapeyronperlafloresarellano100% (3)
- Propiedades coligativas soluciones diluidas no electrolíticasDokumen41 halamanPropiedades coligativas soluciones diluidas no electrolíticasEd CotBelum ada peringkat
- PROPIEDADES COLIGATIVASDokumen22 halamanPROPIEDADES COLIGATIVASJuan SalazarBelum ada peringkat
- Variación de La Presión de VaporDokumen13 halamanVariación de La Presión de VaporFannyEspinozaGiraldezBelum ada peringkat
- Lab N°4 Propiedades ColigativasDokumen4 halamanLab N°4 Propiedades ColigativasAnderson CastroBelum ada peringkat
- Propiedades ColigativasDokumen18 halamanPropiedades ColigativasROMMEL ALEXANDER TASINCHANO VIRAJUCHA100% (2)
- Act. 11 Propiedades Coligativas de Las SustanciasDokumen9 halamanAct. 11 Propiedades Coligativas de Las Sustanciasluis merazBelum ada peringkat
- Aumento del punto de ebullición de una solución acuosa en presencia de solutos no volátilesDokumen4 halamanAumento del punto de ebullición de una solución acuosa en presencia de solutos no volátilesAndres HernandezBelum ada peringkat
- Proceso de Evaporaciòn Simple EfectoDokumen32 halamanProceso de Evaporaciòn Simple EfectoFELIPE DURANBelum ada peringkat
- PropiedadesDokumen4 halamanPropiedadesJuan GomezBelum ada peringkat
- Propiedades ColigativasDokumen4 halamanPropiedades ColigativasNATALY ALMANZA AVILABelum ada peringkat
- Química - Guía-N° Propieedades ColigativasDokumen4 halamanQuímica - Guía-N° Propieedades ColigativasHugo TorresBelum ada peringkat
- Cuestionario 4Dokumen2 halamanCuestionario 4Saúl Linares MayhuallaBelum ada peringkat
- Propiedades coligativasDokumen9 halamanPropiedades coligativasOmar CabreraBelum ada peringkat
- Propiedades ColigativasDokumen16 halamanPropiedades Coligativaskvilla9Belum ada peringkat
- Propiedades ColigativasDokumen16 halamanPropiedades ColigativasErick Cordero SantosBelum ada peringkat
- Clase #02 Propiedades ColigativasDokumen25 halamanClase #02 Propiedades ColigativasJOSE MARTIN RIVERO CORCUERABelum ada peringkat
- Aplicaciones ColigativasDokumen9 halamanAplicaciones ColigativasMiriam Guerra RodríguezBelum ada peringkat
- Práctica 2.-Aumento Del Punto de Ebullición de Las Disoluciones"Dokumen6 halamanPráctica 2.-Aumento Del Punto de Ebullición de Las Disoluciones"Marcos Álvarez RodrÍguezBelum ada peringkat
- Propiedades ColigativasDokumen18 halamanPropiedades ColigativasRODRIGO SHUPINAGWUABelum ada peringkat
- Attachment 1Dokumen10 halamanAttachment 1Anonymous T02GVGzBBelum ada peringkat
- Experimento III - Propiedades Coligativas - Descenso Del Punto de SolidificaciónDokumen8 halamanExperimento III - Propiedades Coligativas - Descenso Del Punto de SolidificaciónDani ElaBelum ada peringkat
- Destilacion BencenoDokumen13 halamanDestilacion BencenoDejaee Bk D'alexkanitho100% (1)
- Propiedades Coligativas 1Dokumen19 halamanPropiedades Coligativas 1Pablo PerezBelum ada peringkat
- Punto de Ebullición de Las SolucionesDokumen20 halamanPunto de Ebullición de Las SolucionesJacinto Hernández Cruz0% (1)
- Propiedades ColigativasDokumen8 halamanPropiedades ColigativasJhon Fuentes GallegoBelum ada peringkat
- GUIAS Practice Segundo MedioDokumen4 halamanGUIAS Practice Segundo MedioMadai Trabol TorresBelum ada peringkat
- Propiedades ColigativasDokumen3 halamanPropiedades ColigativasMaria De Lourdes MatteiBelum ada peringkat
- Aumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaDokumen18 halamanAumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaJesús NavarroBelum ada peringkat
- Laboratorio Propiedades ColigativasDokumen6 halamanLaboratorio Propiedades ColigativasAlba GuadalupeBelum ada peringkat
- La Ecuación de Clapeyron Es Fundamental para Cualquier Análisis Del Equilibrio Entre 2 Fases de Una Sustancia PuraDokumen4 halamanLa Ecuación de Clapeyron Es Fundamental para Cualquier Análisis Del Equilibrio Entre 2 Fases de Una Sustancia PuraMoisesVeraBelum ada peringkat
- Propiedades Coligativas - Cátedra de Química, Guía de Problemas Número 5Dokumen5 halamanPropiedades Coligativas - Cátedra de Química, Guía de Problemas Número 5Patricio Castillo ManquecoyBelum ada peringkat
- Aplicaciones de Las Leyes de Roult y Henry y MasDokumen12 halamanAplicaciones de Las Leyes de Roult y Henry y MasJuan Pablo Galindo Beltran100% (1)
- PropiedadescoligativasDokumen9 halamanPropiedadescoligativasalejandro gutierrezBelum ada peringkat
- Guia de Laboratorio 2Dokumen7 halamanGuia de Laboratorio 2JhomiraRoñaBelum ada peringkat
- Unidad 6 Cambios de Estado y Propiedades Coligativas Parte 1Dokumen17 halamanUnidad 6 Cambios de Estado y Propiedades Coligativas Parte 1Paula PaivaBelum ada peringkat
- Propriedades ColigativasDokumen22 halamanPropriedades ColigativasLenin Cadillo GutierrezBelum ada peringkat
- Propiedades ColigativasDokumen14 halamanPropiedades Coligativascarina_gutiBelum ada peringkat
- Propiedadescoligativas VirtualDokumen10 halamanPropiedadescoligativas Virtualemmanuel cueto brafinaBelum ada peringkat
- Informe 9 - Equilibrio Líquido-VaporDokumen16 halamanInforme 9 - Equilibrio Líquido-VaporbryanBelum ada peringkat
- Guia-Propiedades ColigativasDokumen13 halamanGuia-Propiedades Coligativasbreiner mejiaBelum ada peringkat
- Propiedades ColigativasDokumen5 halamanPropiedades ColigativasAndres Cabrera ViloriaBelum ada peringkat
- 4COLIGATIVASDokumen43 halaman4COLIGATIVAScristianBelum ada peringkat
- Psicometría. Principios básicos y protocolos experimentales diversosDari EverandPsicometría. Principios básicos y protocolos experimentales diversosBelum ada peringkat
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDari EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesBelum ada peringkat
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDari EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSPenilaian: 4.5 dari 5 bintang4.5/5 (7)
- Tarea 2Dokumen4 halamanTarea 2Rafael Fonseca MartinezBelum ada peringkat
- Tarea 3Dokumen10 halamanTarea 3Rafael Fonseca MartinezBelum ada peringkat
- Tarea 1Dokumen3 halamanTarea 1Rafael Fonseca MartinezBelum ada peringkat
- Calculo 2018-2 Correcto 28nov17Dokumen3 halamanCalculo 2018-2 Correcto 28nov17Rafael Fonseca MartinezBelum ada peringkat
- MathDokumen224 halamanMathRafael Fonseca MartinezBelum ada peringkat
- Tarea 4Dokumen2 halamanTarea 4Rafael Fonseca MartinezBelum ada peringkat
- Tarea 5Dokumen3 halamanTarea 5Rafael Fonseca MartinezBelum ada peringkat
- Tarea 8Dokumen3 halamanTarea 8Rafael Fonseca MartinezBelum ada peringkat
- Tarea 6Dokumen5 halamanTarea 6Rafael Fonseca MartinezBelum ada peringkat
- Tarea 9Dokumen2 halamanTarea 9Rafael Fonseca MartinezBelum ada peringkat
- Tarea 7Dokumen2 halamanTarea 7Rafael Fonseca MartinezBelum ada peringkat
- Aspirantes Maestria Examen22-1Dokumen4 halamanAspirantes Maestria Examen22-1Rafael Fonseca MartinezBelum ada peringkat
- Tesis MaestriaDokumen150 halamanTesis MaestriaZarelix Eli ZanabriaBelum ada peringkat
- Algebra LinealDokumen2 halamanAlgebra LinealRafael Fonseca MartinezBelum ada peringkat
- Algebra Ok 2017-2Dokumen1 halamanAlgebra Ok 2017-2Rafael Fonseca MartinezBelum ada peringkat
- Est and Ares en Ciencias Naturales y SocialesDokumen48 halamanEst and Ares en Ciencias Naturales y SocialesMario De AvilaBelum ada peringkat
- 04 03 2021 Números NaturalesDokumen10 halaman04 03 2021 Números NaturalesRafael Fonseca MartinezBelum ada peringkat
- La Educacion para El Emprendimiento y La Innovacion IIDokumen4 halamanLa Educacion para El Emprendimiento y La Innovacion IIRafael Fonseca MartinezBelum ada peringkat
- Rce33 06expDokumen12 halamanRce33 06expFer GuBelum ada peringkat
- EmprendydesarrollolocalDokumen42 halamanEmprendydesarrollolocalBenjamín CaparóBelum ada peringkat
- Guia 21 Articulacion de La Educacion Con El MundoDokumen48 halamanGuia 21 Articulacion de La Educacion Con El MundoLizbeth SilvaBelum ada peringkat
- V24n43a02 PDFDokumen22 halamanV24n43a02 PDFjeancarBelum ada peringkat
- Cartilla Proyectos Pedagogicos Productivos Pa EstudiantesDokumen76 halamanCartilla Proyectos Pedagogicos Productivos Pa EstudiantesWalter Rodriguez Mantilla100% (1)
- El Proyecto Educativo Institucional - (Lavin-Solar-Padilla)Dokumen79 halamanEl Proyecto Educativo Institucional - (Lavin-Solar-Padilla)franciscoriverosBelum ada peringkat
- Proyecto Educativo Institucional PDFDokumen35 halamanProyecto Educativo Institucional PDFRafael Fonseca MartinezBelum ada peringkat
- Taller IDokumen2 halamanTaller IRafael Fonseca MartinezBelum ada peringkat
- PRESENTACIÓN No. 3 PARADIGMAS DE LA EDUCACIÓNDokumen29 halamanPRESENTACIÓN No. 3 PARADIGMAS DE LA EDUCACIÓNRafael Fonseca MartinezBelum ada peringkat
- P1AN 2020-1 SolDokumen1 halamanP1AN 2020-1 SolRafael Fonseca MartinezBelum ada peringkat
- Más Allá de La Teoría de La Reproducción.Dokumen6 halamanMás Allá de La Teoría de La Reproducción.Olga NiñoBelum ada peringkat
- Modelos AtomicossDokumen25 halamanModelos AtomicossRafael Fonseca MartinezBelum ada peringkat
- U2 - S3 - 4 - Unidades Químicas de MasaDokumen31 halamanU2 - S3 - 4 - Unidades Químicas de MasaJeimison Bazán PlasenciaBelum ada peringkat
- Redes NY5CAIDokumen2 halamanRedes NY5CAILuis Antony Tirado DelgadoBelum ada peringkat
- Solución Ciclo RankineDokumen6 halamanSolución Ciclo RankineLauraVillalobosCastroBelum ada peringkat
- Serie 5 - Magnitudes Atómico-MolecularesDokumen21 halamanSerie 5 - Magnitudes Atómico-MolecularesmatiasBelum ada peringkat
- Determinar El Volumen Que Ocupa Una Mol de Un Gas A 0ºC y 1 Atmósfera de PresiónDokumen2 halamanDeterminar El Volumen Que Ocupa Una Mol de Un Gas A 0ºC y 1 Atmósfera de Presiónjuan nelsonBelum ada peringkat
- TRANS6Dokumen27 halamanTRANS6CONSUELO VICTORIA CARASAS MORIBelum ada peringkat
- Problemas de equilibrio químico y cálculo de constantes KcDokumen3 halamanProblemas de equilibrio químico y cálculo de constantes Kcdieg028Belum ada peringkat
- Energía InternaDokumen4 halamanEnergía InternaOsbel Campos SandovalBelum ada peringkat
- Lab N°12 MEDIDA DE LA CONDUCTIVIDAD TERMICA DE MATERIALES METÁLICOSDokumen8 halamanLab N°12 MEDIDA DE LA CONDUCTIVIDAD TERMICA DE MATERIALES METÁLICOSJuancarlosMercedesAguilarBelum ada peringkat
- Ejercicios de Química AnalíticaDokumen3 halamanEjercicios de Química AnalíticaJhonatan LigueBelum ada peringkat
- Varsol Vs AguarrasDokumen2 halamanVarsol Vs AguarrasDaniela IH AlitaBelum ada peringkat
- Tarea MatlabDokumen9 halamanTarea MatlabJheanzhto PinedoBelum ada peringkat
- 3er Laboratorio de FisicoquimicaDokumen13 halaman3er Laboratorio de FisicoquimicaElizabeth Troncos100% (1)
- Equilibrio Entre FasesDokumen9 halamanEquilibrio Entre FasesJAVIER GONZALEZBelum ada peringkat
- Tablas de PerryDokumen4 halamanTablas de PerryCecilia PalmaBelum ada peringkat
- Quimica 1Dokumen21 halamanQuimica 1ÁlvaroAresApazaVascuenceBelum ada peringkat
- Guía de Autoaprendizaje Quimica Semana 22 y 23 26 de Julio Al 6 de AgostoDokumen5 halamanGuía de Autoaprendizaje Quimica Semana 22 y 23 26 de Julio Al 6 de AgostoNicolás vzcBelum ada peringkat
- Copia de Guia N° 9 - SolucionesDokumen6 halamanCopia de Guia N° 9 - SolucionesJorge RopónBelum ada peringkat
- Taller Unidad No. 6 Soluciones 2011-1Dokumen11 halamanTaller Unidad No. 6 Soluciones 2011-1Daniel Quintero0% (1)
- Discusion 6 2018Dokumen2 halamanDiscusion 6 2018Cecilia Diaz de FlamencoBelum ada peringkat
- Problemario de La Termodinamica de Vapor6Dokumen3 halamanProblemario de La Termodinamica de Vapor6Nova Peréz0% (1)
- Estequiometría CompletoDokumen41 halamanEstequiometría CompletoJoako Jerez IbarraBelum ada peringkat
- Electiva Alimentos EjerciciosDokumen3 halamanElectiva Alimentos EjerciciosAARON DAVID MORALES PEREZBelum ada peringkat
- Trabajo de Fisicoquimica IIDokumen19 halamanTrabajo de Fisicoquimica IIFrancis Camones Haro100% (1)
- Ejercicios Resueltos de Propiedades ColigativasDokumen6 halamanEjercicios Resueltos de Propiedades ColigativasTheivis07Belum ada peringkat
- Propiedades coligativas disolucionesDokumen12 halamanPropiedades coligativas disolucionesAndrea L Cabrera TamayoBelum ada peringkat
- Transfer 2Dokumen56 halamanTransfer 2Giannina FernandezBelum ada peringkat
- CLASE - Destilacion BinariaDokumen45 halamanCLASE - Destilacion BinariaNavaBurgosCleverCristianBelum ada peringkat
- Estequiometría: Cálculos y problemasDokumen41 halamanEstequiometría: Cálculos y problemasValeria RojasBelum ada peringkat
- Complemento (Termodinámica)Dokumen21 halamanComplemento (Termodinámica)Felipe VergaraBelum ada peringkat