UFCE - Lista 3 de exercícios de Química
Diunggah oleh
pedro alcantaraJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
UFCE - Lista 3 de exercícios de Química
Diunggah oleh
pedro alcantaraHak Cipta:
Format Tersedia
Universidade Federal do Cear
Departamento de Qumica Orgnica e Inorgnica
Disciplina: Introduo a Qumica
3 lista de exerccios (Solues; Cintica e Equilbrio)
1. Suponha que voc dissolva 2,56 g de cido succnico (C2H2(CO2H) em meio litro de gua (500
mL). Supondo que a densidade da gua 1,00 g/cm3, calcule a molalidade, a frao molar e a
porcentagem em massa do cido na soluo.
2.O cido clordrico (HCl) vendido como uma soluo aquosa concentrada. Se a molaridade do
HCl comercial for 12,0 e sua densidade for 1,18 g/cm3, calcule: a) a molalidade da soluo; b) a
porcentagem em massa de HCl na soluo.
3. Que quantidade de etilenoglicol (OHCH2CH2OH) deve ser adicionada a 125g de gua pura
para elevar o seu ponto de ebulio em 1,0 C? Em quantos graus diminuiria o ponto de
congelamento da gua nesta soluo? Caso voc utilizasse sacarose (C12H22O11), que massa seria
utilizada para aumentar o ponto de ebulio em 1C? Ke= +0,5121 C/m, Kc= -1,86 C/m.
4. Que quantidade de fenantreno (C14H10) deve ser adicionada em 125g de benzeno (C6H6) para
que seu ponto de ebulio aumente em 1,0C?
5.Uma mistura de etanol (C2H5OH) e gua tem ponto de congelamento de -16,0 C: a) Qual a
molalidade do lcool; b) Qual a porcentagem em massa de lcool na soluo? Kc= -1,86 C/m.
7.Uma soluo quosa contm 0,180g de um soluto no-inico desconhecido em 50,0 g de gua.
A soluo congela a -0,040 C. Qual a massa molar do soluto?
8.Quanto (em mL) de HCl 12 M so necessrios para preparar 250 mL de HCl 1M? E para
preparar 100 mL de HCl 0,2M?
9. D as velocidades relativas de desaparecimento dos reagentes e de formao dos produtos em
cada reao seguinte:
(a) 2O3(g) 3O2(g)
(b) 2HOF 2HF(g) + O2(g)
(c) N2(g) + 3H2(g) 2NH3(g)
10. Se a equao experimental de velocidade de uma reao V= k[A]2, o que acontece com a
velocidade quando a concentrao de A triplicada? E quando a concentrao de A dividida
por dois?
11. A reao entre o oznio e o dixido de nitrognio, a 231 K, de primeira ordem no NO2 e no
O3. 2NO2(g) + O3(g) N2O5(s) + O2(g)
(a) Escreva a equao de velocidade para a reao; (b) Como se altera a velocidade da reao se
a concentrao do NO2 mudar de 0,0022 mol/L para 0,0066 mol/L? (c) O que acontecer com a
velocidade da reao se a concentrao do O3 mudar de 0,0024 mol/L para 0,0012 mol/L?
12. Os dados na tabela referem-se seguinte reao entre o NO e o O2, a 660K.
2NO(g) + O2(g) 2NOBr(g)
[NO] (mol/L) [O2] mol/L Velocidade de desaparecimento do NO (mol.L-1.s-1)
0,010 0,010 2,5 x 10-5
0,020 0,010 1,0 x 10-4
0,010 0,020 5,0 x 10-5
(a) Determine a ordem de reao dos reagentes e escreva a equao de velocidade da reao. (b)
Calcule a constante de velocidade da reao. (c) Calcule a velocidade no instante em que [NO]
= 0,015 mol/L e [O2]= 0,0050 mol/L (d) No instante em que o NO est sendo consumido
velocidade de 1,0 x 10-4 mol.L-1.s-1, qual a velocidade de consumo do O2 e de formao do NO2?
13. O cianato de amnio, NH4NCO, sofre uma reorganizao em gua e d a uria, (NH2)2CO:
NH4NCO(aq) (NH2)2CO(aq)
A equao da cintica Velocidade= k. [NH4NCO]2, onde k= 0,0113 L.mol-1.min-1. Se a
concentrao inicial do NH4NCO for 0,229 mol/L, quanto tempo ser necessrio para se reduzir
a 0,180 mol/L?
14. A decomposio do N2O5 (para dar NO2 e O2) segue a equao de velocidade V= k[N2O5],
onde k= 5,0.10-4 s-1, numa certa temperatura. (a) Qual a meia-vida (em segundos) do N2O5 nesta
reao? (b) Quanto tempo se passa para que a concentrao do N2O5 caia a 10% da concentrao
inicial?
15. O istopo de ouro 198, radioativo, usado como indicador metlico no diagnstico de
problemas hepticos. A meia-vida do istopo 2,7 dias. Se a massa inicial do istopo, num
processo, for 5,6 mg, qual a quantidade remanescente depois de 1,0 dia?
16. Escreva as expresses das constantes de equilbrio das seguintes reaes. NO caso de gases,
adote presses parciais (Kp) ou molaridades (Kc):
(a) 2H2O2(g) 2H2O(g) + O2(g)
(b) CO(g) + O2(g) CO2(g)
(c) C(s) + CO2 (g) 2CO(g)
(d) FeO(s) + CO(g) Fe(s) + CO2(g)
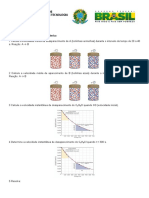
17. As figuras abaixo representam o estado de equilbrio para trs diferentes reaes. Qual reao
tem a maior constante de equilbrio? E qual tem a menor constante de equilbrio?
A2 + B2 2AB A2 + C2 2AC A2 + D2 2AD
18. O poluente presente no ar, NO, produzido pelos automveis atravs da reao:
N2(g) + O2(g) NO(g), sendo Kc = 1,7.10-3 a 2300K. Se as concentraes iniciais de N2 e O2 nessa
temperatura so ambas 1,40 M, qual a concentrao das trs espcies quando o sistema atinge o
equilbrio?
19. Verifica-se que 54,8% de uma amostra de 1,0 mol de CO2 em recipiente de 1,0L se
decompem em CO e O2 a 3000K. Calcule o valor de Kc. 2CO2(g) 2CO(g) + O2(g)
20. Na fase gasosa, o iodo reage com o ciclopentano formando ciclopentadieno e o iodeto de
hidrognio. Explique como cada um dos seguintes efeitos afeta o equilbrio (ou seja, o sentido do
deslocamento) e a quantidade de HI( g) presente na mistura reacional.
I2(g) + C5H8(g) C5H6(g) + 2HI(g) H= 92,5 kJ (Reao endotrmica)
a) Aumentando a temperatura da mistura; b) Introduzindo mais C5H6; C) Dobrando o volume do
recipiente; d) Adicionando um catalisador apropriado.
Anda mungkin juga menyukai
- 50-Trocador de Calor Casco TuboDokumen0 halaman50-Trocador de Calor Casco TuboJosue BrazBelum ada peringkat
- Tratamento de Lodos de Estações de Tratamento de ÁguaDari EverandTratamento de Lodos de Estações de Tratamento de ÁguaBelum ada peringkat
- Guia Geral PHD Do Brasil Atualizado 29.03.23 Corporal, Capilar e MicroDokumen40 halamanGuia Geral PHD Do Brasil Atualizado 29.03.23 Corporal, Capilar e MicroCarolina Kloster EvaristoBelum ada peringkat
- Planilha Controle de Desvios Maio 2021Dokumen63 halamanPlanilha Controle de Desvios Maio 2021Michel Santos da SilvaBelum ada peringkat
- NBR 11096 2000 TerminologiaDokumen25 halamanNBR 11096 2000 TerminologiaSandro CrouceBelum ada peringkat
- Segunda Prova de QG - Gabarito - Versão FinalDokumen3 halamanSegunda Prova de QG - Gabarito - Versão FinalThomas JacobsenBelum ada peringkat
- Lista de Exercicios Cinetica Quimica EQM061Dokumen13 halamanLista de Exercicios Cinetica Quimica EQM061Mariana DomicianoBelum ada peringkat
- Bases Da Mecânica e Da Termodinâmica Dos Meios Contínuos-Blog-Conhecimentovaleouro - Blogspot.com By@viniciusf666Dokumen175 halamanBases Da Mecânica e Da Termodinâmica Dos Meios Contínuos-Blog-Conhecimentovaleouro - Blogspot.com By@viniciusf666Adson RochaBelum ada peringkat
- Cap 9 Equilibrio Quimico 2009Dokumen37 halamanCap 9 Equilibrio Quimico 2009Pedro LessaBelum ada peringkat
- Lista Cinética PDFDokumen9 halamanLista Cinética PDFLeydiane Araujo BrandaoBelum ada peringkat
- Química Geral - Soluções, Cinética e EquilíbrioDokumen5 halamanQuímica Geral - Soluções, Cinética e Equilíbrioismaelsilva3692Belum ada peringkat
- Lista de Exercícios de Cinética QuímicaDokumen2 halamanLista de Exercícios de Cinética QuímicasheldonsingBelum ada peringkat
- Lista de exercícios de termodinâmica e cinética químicaDokumen5 halamanLista de exercícios de termodinâmica e cinética químicaJoice SchuhBelum ada peringkat
- 1a Lista de Exercícios - Química IIDokumen5 halaman1a Lista de Exercícios - Química IIAlmeida Malembe100% (1)
- TopD Reacoes em Solucao Aquosa e Estequiometria RESPOSTASDokumen7 halamanTopD Reacoes em Solucao Aquosa e Estequiometria RESPOSTASMaria AliceBelum ada peringkat
- Lista de Exercícios 1 - Química GeralDokumen7 halamanLista de Exercícios 1 - Química GeralMarry YoungBelum ada peringkat
- 3 Lista de Exercicios - Cinética Química e Equilíbrio Químico (Gabarito)Dokumen3 halaman3 Lista de Exercicios - Cinética Química e Equilíbrio Químico (Gabarito)Dvmr AnapBelum ada peringkat
- Engenharia Mecânica Química ExercíciosDokumen4 halamanEngenharia Mecânica Química ExercíciosPedro FerreiraBelum ada peringkat
- Equilibrios ConstantesDokumen6 halamanEquilibrios ConstantesFred DiasBelum ada peringkat
- Equilíbrio químico - Lista de exercíciosDokumen4 halamanEquilíbrio químico - Lista de exercíciosSamara CristinyBelum ada peringkat
- Exercícios de Cálculos Químicos e TermodinâmicaDokumen6 halamanExercícios de Cálculos Químicos e TermodinâmicaFernanda Abbate dos SantosBelum ada peringkat
- Lista 10 Geral 2023-2Dokumen6 halamanLista 10 Geral 2023-2yjb46zys2hBelum ada peringkat
- Lista de Exercicios 1Dokumen4 halamanLista de Exercicios 1Mariana MartinsBelum ada peringkat
- 51 20equil C3 ADbrio 20qu C3 ADmico 20ADokumen87 halaman51 20equil C3 ADbrio 20qu C3 ADmico 20AJhonny WalkerBelum ada peringkat
- Exercícios de equilíbrio químicoDokumen2 halamanExercícios de equilíbrio químicoedu_araujo_18Belum ada peringkat
- Topd Reacoes em Solucao Aquosa e EstequiometriaDokumen6 halamanTopd Reacoes em Solucao Aquosa e EstequiometriaTella GarciaBelum ada peringkat
- Equilíbrio químico - Constante de equilíbrio kcDokumen36 halamanEquilíbrio químico - Constante de equilíbrio kcbrandownBelum ada peringkat
- UNIRIO - Disciplina de Química Geral – Lista de exercícios 2Dokumen7 halamanUNIRIO - Disciplina de Química Geral – Lista de exercícios 2liviadiasrjBelum ada peringkat
- 7 Lista QGE2001 CineticaDokumen5 halaman7 Lista QGE2001 CineticaWashington RamosBelum ada peringkat
- VOD Química Exercícios Sobre Específicas Estequiometria 19-06-2020Dokumen6 halamanVOD Química Exercícios Sobre Específicas Estequiometria 19-06-2020MATEUS COSTA LOUBACHBelum ada peringkat
- EXAME 2ANO QuimicaDokumen3 halamanEXAME 2ANO QuimicaBruna MartinsBelum ada peringkat
- Lista de Equilíbrio QuímicoDokumen5 halamanLista de Equilíbrio QuímicoMÁRIO LIMABelum ada peringkat
- Ficha Cálculos EstequimétricosDokumen13 halamanFicha Cálculos EstequimétricosTomas PinhoBelum ada peringkat
- Lista de Exerccio 2 AvaliaoDokumen3 halamanLista de Exerccio 2 AvaliaoKaio PhillipBelum ada peringkat
- EXERCÍCIOS DE FÍSICOQUIMICA (KC)Dokumen2 halamanEXERCÍCIOS DE FÍSICOQUIMICA (KC)wagner amadoBelum ada peringkat
- Introdução à Química ExperimentalDokumen2 halamanIntrodução à Química ExperimentalmamaemtolokoBelum ada peringkat
- Equilibrio Quimico 2009Dokumen47 halamanEquilibrio Quimico 2009Pedro LessaBelum ada peringkat
- Estequiometria 1 PDFDokumen5 halamanEstequiometria 1 PDFEwerton LeonardoBelum ada peringkat
- Lista de Exercícios de Química GeralDokumen5 halamanLista de Exercícios de Química GeralLeonardo CarneiroBelum ada peringkat
- QUIB50-Lista 3Dokumen2 halamanQUIB50-Lista 3Thiago ThaylorBelum ada peringkat
- Disciplina: Eb932A - Química Geral Aplicada A Engenharia - Profa. Dra. Maria Aparecida Carvalho de MedeirosDokumen19 halamanDisciplina: Eb932A - Química Geral Aplicada A Engenharia - Profa. Dra. Maria Aparecida Carvalho de MedeirosGabriel Marinho RamosBelum ada peringkat
- Questionário sobre Química geral experimental (2021/1Dokumen5 halamanQuestionário sobre Química geral experimental (2021/1Abraao SantanaBelum ada peringkat
- Q1-Ficha de Trabalho Nº 1Dokumen5 halamanQ1-Ficha de Trabalho Nº 1Ana SilvaBelum ada peringkat
- Ficha GlobalDokumen5 halamanFicha Globaljmhenriques08Belum ada peringkat
- Exercicios de Fisico-QuimicaDokumen2 halamanExercicios de Fisico-QuimicaFellipe LimaBelum ada peringkat
- Introducao AQuantitativos - 094338Dokumen2 halamanIntroducao AQuantitativos - 094338Francisco silva cossaBelum ada peringkat
- Lista de Exercícios - Equilíbrio QuímicoDokumen6 halamanLista de Exercícios - Equilíbrio QuímicowalmaedBelum ada peringkat
- Equilíbrio Químico 3Dokumen6 halamanEquilíbrio Químico 3Milton LopesBelum ada peringkat
- Fun Cao Quadratic A 2012Dokumen2 halamanFun Cao Quadratic A 2012MÁRIO LIMABelum ada peringkat
- Equilíbrio químico e cálculos estequiométricosDokumen3 halamanEquilíbrio químico e cálculos estequiométricosnelson_honorioBelum ada peringkat
- 51 20equil C3 ADbrio 20qu C3 ADmico 20ADokumen49 halaman51 20equil C3 ADbrio 20qu C3 ADmico 20AJohn Vieira OliveiraBelum ada peringkat
- Lista 05Dokumen4 halamanLista 05Nicole PacíficoBelum ada peringkat
- Lista de exercícios de química com equilíbrio químico, ácido-base e eletroquímicaDokumen3 halamanLista de exercícios de química com equilíbrio químico, ácido-base e eletroquímicaAlmeida Malembe100% (1)
- Equilíbrios químicos e iônicosDokumen4 halamanEquilíbrios químicos e iônicosmailas33Belum ada peringkat
- Exercícios RevisãocalculoDokumen5 halamanExercícios RevisãocalculoEraclitoSL100% (5)
- Teste 3 - CeppeaDokumen4 halamanTeste 3 - CeppeaMartins AiupaBelum ada peringkat
- CálculosestequiométricoDokumen8 halamanCálculosestequiométricompedroleesilvaBelum ada peringkat
- 2a Lista de ExercíciosDokumen6 halaman2a Lista de Exercíciosramon7789Belum ada peringkat
- Fundamentos de Química - Propriedades dos Gases e Cinética QuímicaDokumen6 halamanFundamentos de Química - Propriedades dos Gases e Cinética QuímicaLaysa BebezinhaBelum ada peringkat
- Calculo Estequiometrico ExcessoDokumen16 halamanCalculo Estequiometrico ExcessoJorge Henrique DiasBelum ada peringkat
- 3 Lista de ExercÝcios 2022Dokumen3 halaman3 Lista de ExercÝcios 2022Mazini MzBelum ada peringkat
- Apostila Química Orgânica: Carbono, Dienos E AromáticosDari EverandApostila Química Orgânica: Carbono, Dienos E AromáticosBelum ada peringkat
- Apostila Química Orgânica: Terpenos E Rotas De SínteseDari EverandApostila Química Orgânica: Terpenos E Rotas De SínteseBelum ada peringkat
- Lecturenotes QFTI 2020Dokumen218 halamanLecturenotes QFTI 2020pedro alcantaraBelum ada peringkat
- Renata Corpo NegroDokumen19 halamanRenata Corpo Negropedro alcantaraBelum ada peringkat
- Lecturenotes QFTI 2020Dokumen218 halamanLecturenotes QFTI 2020pedro alcantaraBelum ada peringkat
- UFCE - Lista 3 de exercícios de QuímicaDokumen2 halamanUFCE - Lista 3 de exercícios de Químicapedro alcantara100% (1)
- Aula de Cinética QuímicaDokumen39 halamanAula de Cinética Químicapedro alcantaraBelum ada peringkat
- Artigo BalançaDokumen2 halamanArtigo Balançapedro alcantaraBelum ada peringkat
- Mecânica - Barcelos Neto PDFDokumen221 halamanMecânica - Barcelos Neto PDFpedro alcantaraBelum ada peringkat
- Alga - Lista 1Dokumen2 halamanAlga - Lista 1pedro alcantaraBelum ada peringkat
- 6 Lista FÍSICA 2017Dokumen2 halaman6 Lista FÍSICA 2017pedro alcantara100% (1)
- 6 Lista FÍSICA 2017 PDFDokumen2 halaman6 Lista FÍSICA 2017 PDFpedro alcantaraBelum ada peringkat
- Trabalho Sobre ConstantinoDokumen5 halamanTrabalho Sobre Constantinopedro alcantaraBelum ada peringkat
- Guia de Práticas de Química GeralDokumen83 halamanGuia de Práticas de Química Geralpedro alcantara100% (1)
- Acidos e BasesDokumen46 halamanAcidos e Basespedro alcantaraBelum ada peringkat
- Fundamentos Da Programação de ComputadoresDokumen436 halamanFundamentos Da Programação de ComputadoresBrenda sz'Belum ada peringkat
- Trabalho Sobre ConstantinoDokumen5 halamanTrabalho Sobre Constantinopedro alcantaraBelum ada peringkat
- TrabalhoDokumen5 halamanTrabalhopedro alcantaraBelum ada peringkat
- Del Vecchio - Dissertação Sobre PoincaréDokumen118 halamanDel Vecchio - Dissertação Sobre Poincarépedro alcantaraBelum ada peringkat
- Entendendo de Inflação - LivroDokumen19 halamanEntendendo de Inflação - LivroAdelma SilvaBelum ada peringkat
- Comprit - F51G 5 BRDokumen8 halamanComprit - F51G 5 BRYago OliveiraBelum ada peringkat
- Materiais Plásticos - PolímerosDokumen21 halamanMateriais Plásticos - Polímerosacsbaltazar4474Belum ada peringkat
- Suplemento Vit Thor TankDokumen1 halamanSuplemento Vit Thor TankJohnny Navarro100% (1)
- (32 ENEM) Cronograma Gratuito de 32 Semanas para o Enem 2024 Com o Ferretto-2Dokumen96 halaman(32 ENEM) Cronograma Gratuito de 32 Semanas para o Enem 2024 Com o Ferretto-2vivihgiovannaxBelum ada peringkat
- Aciaria - LD - MetaDokumen61 halamanAciaria - LD - MetaCleyton Faria50% (2)
- 2023-07-17 - 7ºano - SAS - Ciencias - AS - Capitulo 14Dokumen9 halaman2023-07-17 - 7ºano - SAS - Ciencias - AS - Capitulo 14julian.jjacademyBelum ada peringkat
- Cap VI - GasesDokumen6 halamanCap VI - GasesHélder ViegasBelum ada peringkat
- Refino de Petróleo: Processos e DerivadosDokumen20 halamanRefino de Petróleo: Processos e DerivadosAdriano ChagasBelum ada peringkat
- Caracterização química das ora-pro-nobisDokumen9 halamanCaracterização química das ora-pro-nobisAndré Luís Della VolpeBelum ada peringkat
- Parâmetros de controle de efluentes líquidosDokumen9 halamanParâmetros de controle de efluentes líquidosKelber MoraesBelum ada peringkat
- Síntese - de - Um - Sal - Duplo - Prática 8Dokumen2 halamanSíntese - de - Um - Sal - Duplo - Prática 8Letícia Parra SalvioniBelum ada peringkat
- Processos de fundição e acabamentoDokumen53 halamanProcessos de fundição e acabamentoleonardo finoket da silvaBelum ada peringkat
- Isoterma de Adsorção de LangmuirDokumen12 halamanIsoterma de Adsorção de LangmuirAmandaAllegrettiBelum ada peringkat
- 1 Prova-Engenharia de Materiais - Ftc-Ssa - 2017-1 Com RespostasDokumen6 halaman1 Prova-Engenharia de Materiais - Ftc-Ssa - 2017-1 Com RespostasJunior Prazeres0% (1)
- Chevron Multigear-EP-90-140-85W140 - BR-PT - 30jan2013Dokumen2 halamanChevron Multigear-EP-90-140-85W140 - BR-PT - 30jan2013DiegoTavaresBelum ada peringkat
- Bioisosterismo: conceito e aplicações na descoberta de novos fármacosDokumen16 halamanBioisosterismo: conceito e aplicações na descoberta de novos fármacosMayara Souza0% (1)
- Operações Unitárias - CAP 1 A 5Dokumen40 halamanOperações Unitárias - CAP 1 A 5Sarah Ferreira100% (1)
- Exergia e Balanço de ExergiaDokumen13 halamanExergia e Balanço de ExergiaNeow SaitoBelum ada peringkat
- Planificação Didática da Disciplina de Físico-Química 7o AnoDokumen7 halamanPlanificação Didática da Disciplina de Físico-Química 7o AnonunoBelum ada peringkat
- Tese Adriano - UFAL - RicardoLongoDokumen126 halamanTese Adriano - UFAL - RicardoLongoJosé Adriano SilvaBelum ada peringkat
- Aula 1 - Teoria Do FogoDokumen30 halamanAula 1 - Teoria Do FogomonicaBelum ada peringkat
- Sabão PDFDokumen19 halamanSabão PDFGuilherme Both100% (1)
- Fluxograma Engenharia MecânicaDokumen2 halamanFluxograma Engenharia MecânicaGabriel Batista PereiraBelum ada peringkat
- Bloco 2 Aula 16 Termoquímica Energia de LigaçãoDokumen5 halamanBloco 2 Aula 16 Termoquímica Energia de LigaçãoMax NunesBelum ada peringkat
- Polaridade e SolubilidadeDokumen15 halamanPolaridade e SolubilidadeRichael MarcosBelum ada peringkat
- Guanil HidrazonasDokumen47 halamanGuanil Hidrazonasvaz silvaBelum ada peringkat