Volumen Molar Parcial
Diunggah oleh
Isa UrbinaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Volumen Molar Parcial
Diunggah oleh
Isa UrbinaHak Cipta:
Format Tersedia
Objetivo
El alumno determinar volmenes molares parciales del agua y del cloruro de sodio
a diferentes concentraciones, a partir de densidades medidas con un picnmetro.
Gua de estudios
1. Defina volumen molar parcial.
El volumen molar parcial del componente x es el cambio diferencial en volumen
cuando se aade un mol de x puro a una cantidad infinita de solucin, a
temperatura y presin constante. Es equivalente a una composicin constante.
2. Mencione tres ejemplos de propiedades molares parciales.
Volumen molar parcial, entropa molar parcial y entalpa molar parcial.
3. Qu diferencia existe entre una propiedad extensiva y una intensiva?
Las propiedades extensivas dependen de la masa, mientras que las propiedades
intensivas son independientes de ella, cuando una propiedad extensiva se divide
entre la masa, se obtiene una propiedad intensiva, como por ejemplo el volumen
especfico.
4. Cmo se puede obtener el volumen molar parcial?
Se puede obtener mediante distintos mtodos como:
Mtodo de la pendiente: Para medir el volumen molar parcial del componente y,
se preparan disoluciones con el mismo nmero de moles del disolvente x pero
variando el nmero de moles del componente y trabajando a presin y
temperatura constantes. Una tangente de la curva del volumen total contra una
concentracin, representa el volumen parcial molar.
Mtodo de las ordenadas: Si el volumen molar se representa frente a la fraccin
molar del componente 2 de una mezcla binaria, una tangente a la curva en un
punto corta a la ordenada x y a la ordenada y. El mismo resultado se obtiene
representado el volumen especfico frente a la fraccin en peso. De esta forma se
obtiene el volumen especfico parcial y multiplicndolo por el peso molecular
obtenemos el volumen parcial molar. Y finalmente Si los datos se pueden expresar
en forma funcional se puede obtener por diferenciales parciales.
5. Cmo se puede obtener experimentalmente el volumen de un picnmetro?
Se pesa el picnmetro vaco y seco en la balanza, y se anota la masa. Despus se
llena completamente con agua, secamos perfectamente el exterior y volvemos a
pesar, anotamos nuevamente la masa. Se hace una resta entre la primera y la
segunda masa anotada, obteniendo as la masa del agua. As pues, el volumen del
picnmetro se podr calcular utilizando la densidad del agua, a la temperatura y
presin a las cuales se est trabajando, dividiendo la masa del agua entre la
densidad del agua.
6. Qu diferencia existe entre molalidad (m) y molaridad (M)?
La molaridad (M) es el nmero de moles de soluto por cada litro de disolucin, la
molalidad (m) es el nmero de moles de soluto por kilogramo de disolvente. La
diferencia entre molalidad y molaridad. Molalidad (m) est definida en trminos
de la masa del solvente, en cambio la molaridad (M) est definida en trminos del
volumen de la solucin. La molalidad de una solucin dada no vara con la
temperatura, porque las masas no varan con la temperatura. Sin embrago, la
molaridad cambia con la temperatura a causa de la expansin o contraccin de la
solucin.
7. Mencione tres tipos de concentracin de las disoluciones que sean independientes
de la temperatura y explique las razones
Porcentaje masa-masa (%m/m), partes por milln (ppm) y molalidad (m), ya que
estas propiedades dependen de la cantidad de masa nicamente, no varan con la
temperatura ni dependen de ella, en cambio las concentraciones que contienen
volmenes s dependen de la temperatura y presin, cuando ests cambian, el
volumen cambia con ellas.
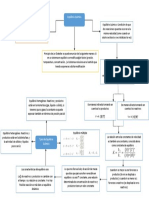
Metodologa
Pesar el picnmetro vaco y seco. Llenar con agua, secar
INICIO Anotar el peso como Wo. perfectamente el exterior y volver a
pesar. Anotar peso como Wa. Medir
1 2
la T del agua
2 3
1 1
Enjuagar el picnmetro con agua Llenar el picnmetro con la solucin Vaciar el picnmetro, enjugarlo con
destilada, despus con acetona y de NaCl 0.2 M y pesarlo. Anotar peso acetona y secarlo con aire (con ayuda
secar con ayuda del compresor. como Ws. del compresor).
5 4 3
1 5
7
4
Repetir el procedimiento para cada Recolectar los residuos en contenedor
disolucin de NaCl y anotar pesos. rotulado.
FIN
6 7
4 4
Bibliografa
UASLP. (2016) Volumen molar parcial. En Manual de prcticas del laboratorio de
termodinmica II. San Luis potos: FCQ
Robert W. Parry, Luke E. Steiner y Phyllis M. Dietz. (2013). Qumica fundamentos
experimentales. Mxico: Revert
Perry, J. H. (1992). Manual del Ingeniero Qumico (6 ed.). Mxico: Mc Graw-Hill.
Juan E. Joffr. (2000). Termodinmica Metalrgica. San Luis Potos: UASLP.
Smith, J. M., Van Ness, H. C. (2002). Introduccin a la Termodinmica en Ingeniera
Qumica (6 ed.). Mxico: McGraw-Hill.
Anda mungkin juga menyukai
- Volumen Molar - Fico2Dokumen35 halamanVolumen Molar - Fico2DanielBelum ada peringkat
- Balance 4Dokumen7 halamanBalance 4Adrian Alvarez SaltoBelum ada peringkat
- Laboratorio de fisicoquímica y balances de materiaDokumen18 halamanLaboratorio de fisicoquímica y balances de materiaEnrique Hernandez LiraBelum ada peringkat
- Equilibrio Liquido VaporDokumen20 halamanEquilibrio Liquido VaporDavid Alemán SánchezBelum ada peringkat
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDari EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaPenilaian: 5 dari 5 bintang5/5 (1)
- InformeDokumen6 halamanInformeFriedrich NietzscheBelum ada peringkat
- MJAE - Viscosidad Con T y PDokumen12 halamanMJAE - Viscosidad Con T y PEmmanuel MartínezBelum ada peringkat
- Guia de Ejercicios Fisicoquimica IIIDokumen1 halamanGuia de Ejercicios Fisicoquimica IIIMash_marialeBelum ada peringkat
- EQUILIBRIO DE SISTEMAS NO IDEALES EN DISOLUCIONES ACUOSASDokumen2 halamanEQUILIBRIO DE SISTEMAS NO IDEALES EN DISOLUCIONES ACUOSASIdania CazasBelum ada peringkat
- Volumen Molar Parcial y de ExcesoDokumen14 halamanVolumen Molar Parcial y de ExcesoMariaPaulaGonzalezRojasBelum ada peringkat
- Propiedades molares parciales en sistemas químicosDokumen43 halamanPropiedades molares parciales en sistemas químicosNico AgueroBelum ada peringkat
- Ejercicios Liquido-LiquidoDokumen2 halamanEjercicios Liquido-LiquidoCristian ConfortiBelum ada peringkat
- Manual de Practicas Cinetica Quimica PDFDokumen17 halamanManual de Practicas Cinetica Quimica PDFXochitl ArellanoBelum ada peringkat
- Problemas Destilacion Fraccionada 14vDokumen3 halamanProblemas Destilacion Fraccionada 14vFabioRangel100% (1)
- Practica 8 - Adsorción IDokumen8 halamanPractica 8 - Adsorción IAdriana BuendíaBelum ada peringkat
- Practica 1 PDFDokumen13 halamanPractica 1 PDFDiego Gpe Ac AcBelum ada peringkat
- Practica 5 Determinacion Del Hierro Mi GrupoDokumen13 halamanPractica 5 Determinacion Del Hierro Mi Grupoezequiel uzcateguiBelum ada peringkat
- Práctica 2 Bioinorgánica Equipo EDokumen8 halamanPráctica 2 Bioinorgánica Equipo EPaul Pacheco VazquezBelum ada peringkat
- Conductividad ElectrolíticaDokumen7 halamanConductividad ElectrolíticaLizeth LauraBelum ada peringkat
- Parte 1 AdsorptionDokumen108 halamanParte 1 AdsorptionDaniela Alejandra OsorioBelum ada peringkat
- Práctica 1.3 Calor de ReacciónDokumen7 halamanPráctica 1.3 Calor de ReacciónIván RamosBelum ada peringkat
- Borrador Informe TCTBADokumen13 halamanBorrador Informe TCTBAAlejandro MartinezBelum ada peringkat
- Ejercicio 7.3 preparación disoluciónDokumen10 halamanEjercicio 7.3 preparación disoluciónAlexis Alvarado CortezBelum ada peringkat
- Rompimiento Celular y Operaciones de Separación de BiomasaDokumen28 halamanRompimiento Celular y Operaciones de Separación de BiomasaCarlos M. ArizaBelum ada peringkat
- Absorción de Ácido Acético Con Carbón ActivadoDokumen8 halamanAbsorción de Ácido Acético Con Carbón ActivadoMariaElizabethSanchezBelum ada peringkat
- Parciales CineticaDokumen19 halamanParciales CineticaJocelyn BernabeBelum ada peringkat
- Problemas Fico LLDokumen4 halamanProblemas Fico LLLeonardo ValdiviaBelum ada peringkat
- Problema de Adsorción de GibbsDokumen4 halamanProblema de Adsorción de GibbsIsmael Cristóbal MarcosBelum ada peringkat
- Cinética Química: Factores que Gobiernan la Velocidad de ReacciónDokumen40 halamanCinética Química: Factores que Gobiernan la Velocidad de Reacciónnicolas acostaBelum ada peringkat
- INTRODUCCION A SISTEMAS COLOIDALES. PREPARACION - WatermarkDokumen12 halamanINTRODUCCION A SISTEMAS COLOIDALES. PREPARACION - WatermarkOz HdzBelum ada peringkat
- Taller FisicoquimicaDokumen5 halamanTaller FisicoquimicadavidBelum ada peringkat
- Caso de Estudio 3. Fenomenos de TransporteDokumen18 halamanCaso de Estudio 3. Fenomenos de TransporteAlly FortBelum ada peringkat
- HumidificacionDokumen3 halamanHumidificacionJose Baeza Vera33% (3)
- Practica 1 PDFDokumen1 halamanPractica 1 PDFOscar ReynosoBelum ada peringkat
- Acti #3 PADRON CALDERON JOSE RAULDokumen5 halamanActi #3 PADRON CALDERON JOSE RAULLUAR PADRONBelum ada peringkat
- Informe de Laboratorio Determinacion de La Constante Crioscopica de Un SolventeDokumen8 halamanInforme de Laboratorio Determinacion de La Constante Crioscopica de Un Solventejuan david acevedo cubidesBelum ada peringkat
- UNAM-FES-Cuautitlan-TermodinamicaDokumen2 halamanUNAM-FES-Cuautitlan-TermodinamicaEduardo GarciaBelum ada peringkat
- Volumen Molar ParcialDokumen11 halamanVolumen Molar ParcialJose Luis IGBelum ada peringkat
- Cinética descomposición cristal violeta efecto salinoDokumen14 halamanCinética descomposición cristal violeta efecto salinoAngel GrossBelum ada peringkat
- Transf - Masa - Reporte - Torre de BurbujeoDokumen7 halamanTransf - Masa - Reporte - Torre de BurbujeoKim Kaulitz100% (1)
- Equilibrio Líquido Vapor en Un Sistema No IdealDokumen6 halamanEquilibrio Líquido Vapor en Un Sistema No IdealIsa UrbinaBelum ada peringkat
- Aplicaciones de La Espectroscopia Infrarroja I 14Dokumen42 halamanAplicaciones de La Espectroscopia Infrarroja I 14FelipeSalinas100% (1)
- L B Volumenes Molares ParcialesDokumen7 halamanL B Volumenes Molares Parcialesfabrycio chBelum ada peringkat
- Preinforme Punto EutecticoDokumen4 halamanPreinforme Punto EutecticoJulián LeónBelum ada peringkat
- Práctica 15 de Electroquímica: Estudio comparativo del poder oxidante de pares redoxDokumen12 halamanPráctica 15 de Electroquímica: Estudio comparativo del poder oxidante de pares redoxMario FlorencioBelum ada peringkat
- 3.1 Parametros HumidificacionDokumen4 halaman3.1 Parametros HumidificacionLorena SNBelum ada peringkat
- DETERMINACIÓN DEL VOLUMEN MOLAR PARCIAL Chan ChanDokumen14 halamanDETERMINACIÓN DEL VOLUMEN MOLAR PARCIAL Chan ChanLUAR PADRONBelum ada peringkat
- Inactivacion de Catalizadores Por CoquizacionDokumen8 halamanInactivacion de Catalizadores Por CoquizacionFreddy Daniel Gomez MolinaBelum ada peringkat
- Pre 3 FQ2Dokumen8 halamanPre 3 FQ2Lesli RamirezBelum ada peringkat
- Serie Soluciones RealesDokumen6 halamanSerie Soluciones RealesDaniela GonzalezBelum ada peringkat
- Cuestionario 10 FluoresceínaDokumen2 halamanCuestionario 10 FluoresceínaAna Karen Pantaleón OrozcoBelum ada peringkat
- Guía de Problemas Equilibrio Líquido VaporDokumen4 halamanGuía de Problemas Equilibrio Líquido VaporGerson SilvaBelum ada peringkat
- Practica 11. Evidencias.Dokumen6 halamanPractica 11. Evidencias.Andrea Velasco OrtizBelum ada peringkat
- Cinetica Practica 2Dokumen12 halamanCinetica Practica 2Kristel ThomasBelum ada peringkat
- Problemario Unidad 2Dokumen25 halamanProblemario Unidad 2JOSTIN SANDOVALBelum ada peringkat
- Bbme U1 EaDokumen5 halamanBbme U1 EaLuis gallegosBelum ada peringkat
- CURVA DE CALIBRACIÓN Método Estándar Interno (24 ) - ResumenDokumen3 halamanCURVA DE CALIBRACIÓN Método Estándar Interno (24 ) - ResumenWENDY SERNAQUE VELASQUEZBelum ada peringkat
- Pre2 TERMO IIDokumen3 halamanPre2 TERMO IIivan GonzalezBelum ada peringkat
- Pre 2 Termo II Marcela AndradeDokumen4 halamanPre 2 Termo II Marcela AndradeMarcela AndradeBelum ada peringkat
- Pre2 JimenaReyes 342928Dokumen5 halamanPre2 JimenaReyes 342928Jimena ReyesBelum ada peringkat
- SacarificaciónDokumen6 halamanSacarificaciónIsa UrbinaBelum ada peringkat
- Potencial EstándarDokumen4 halamanPotencial EstándarIsa UrbinaBelum ada peringkat
- Condiciones para El Sistema de SeparaciónDokumen6 halamanCondiciones para El Sistema de SeparaciónIsa UrbinaBelum ada peringkat
- CentrífugaDokumen3 halamanCentrífugaIsa Urbina100% (1)
- VoltamperometríaDokumen5 halamanVoltamperometríaIsa UrbinaBelum ada peringkat
- Problemas KERNDokumen12 halamanProblemas KERNIsa Urbina100% (1)
- BibliografíaDokumen2 halamanBibliografíaIsa UrbinaBelum ada peringkat
- LevadurasDokumen5 halamanLevadurasIsa UrbinaBelum ada peringkat
- LevadurasDokumen5 halamanLevadurasIsa UrbinaBelum ada peringkat
- GalvanómetroDokumen3 halamanGalvanómetroIsa UrbinaBelum ada peringkat
- VERMICULITADokumen4 halamanVERMICULITAIsa UrbinaBelum ada peringkat
- Estadística 1Dokumen1 halamanEstadística 1Isa UrbinaBelum ada peringkat
- SeleccionModelosTermodinamicos UniSimDokumen14 halamanSeleccionModelosTermodinamicos UniSimrosanalauraBelum ada peringkat
- MINERIADokumen11 halamanMINERIAIsa UrbinaBelum ada peringkat
- VERMICULITADokumen4 halamanVERMICULITAIsa UrbinaBelum ada peringkat
- ELECTROQUÍMICADokumen5 halamanELECTROQUÍMICAIsa UrbinaBelum ada peringkat
- Sistemas de Alto ÍndiceDokumen3 halamanSistemas de Alto ÍndiceIsa UrbinaBelum ada peringkat
- Cinetica TeoriaDokumen19 halamanCinetica TeoriaIsa UrbinaBelum ada peringkat
- Tarea 1Dokumen6 halamanTarea 1Isa UrbinaBelum ada peringkat
- Caso 1Dokumen7 halamanCaso 1Isa UrbinaBelum ada peringkat
- Potencial EstándarDokumen4 halamanPotencial EstándarIsa UrbinaBelum ada peringkat
- Gravitacion UniversalDokumen3 halamanGravitacion UniversalIsa UrbinaBelum ada peringkat
- Tarea Quimica AnaliticaDokumen1 halamanTarea Quimica AnaliticaIsa UrbinaBelum ada peringkat
- Tarea Quimica AnaliticaDokumen1 halamanTarea Quimica AnaliticaIsa UrbinaBelum ada peringkat
- Ley de Gravitación UniversalDokumen4 halamanLey de Gravitación UniversalIsa Urbina100% (1)
- AlgoritmosDokumen2 halamanAlgoritmosIsa UrbinaBelum ada peringkat
- Equilibrio Líquido Vapor en Un Sistema No IdealDokumen6 halamanEquilibrio Líquido Vapor en Un Sistema No IdealIsa UrbinaBelum ada peringkat
- AlgoritmosDokumen2 halamanAlgoritmosIsa UrbinaBelum ada peringkat
- SeleccionModelosTermodinamicos UniSimDokumen14 halamanSeleccionModelosTermodinamicos UniSimrosanalauraBelum ada peringkat
- Solución Parcial # 1 Geo Vectorial 2018-01Dokumen2 halamanSolución Parcial # 1 Geo Vectorial 2018-01Estefania Betancur MuñozBelum ada peringkat
- Reglas de derivación e integrales inmediatasDokumen1 halamanReglas de derivación e integrales inmediatasSamira OjedaBelum ada peringkat
- Matrices Efe Efi y Foda 29163 PDFDokumen25 halamanMatrices Efe Efi y Foda 29163 PDFCuentas EstrategicasBelum ada peringkat
- Cómo cargar arreglos y matrices con números aleatorios en VBDokumen53 halamanCómo cargar arreglos y matrices con números aleatorios en VBJesús CedeñoBelum ada peringkat
- Sesion3.1 Modelos de ConteoDokumen48 halamanSesion3.1 Modelos de ConteoChristian Erick Orozco RodriguezBelum ada peringkat
- Taller InteractivoDokumen5 halamanTaller Interactivomeredith Gutierrez CardonaBelum ada peringkat
- Cantarell III - Memoria Fotografica - SPDokumen23 halamanCantarell III - Memoria Fotografica - SPArturo PérezBelum ada peringkat
- Experiencia 6 (Vitacura)Dokumen2 halamanExperiencia 6 (Vitacura)Diego SerráBelum ada peringkat
- Tanto Porciento IGV ITF Regla de InteresDokumen7 halamanTanto Porciento IGV ITF Regla de Interesisabellacerna2000Belum ada peringkat
- 01 AlgoritmosDokumen7 halaman01 AlgoritmosVictor H. Alarcon CubaBelum ada peringkat
- Juego Numeros Primos y CompuestosDokumen43 halamanJuego Numeros Primos y CompuestosAdrianaRuszelBelum ada peringkat
- Ejemplos de Escalas de MediciónDokumen3 halamanEjemplos de Escalas de MediciónArelyLopezBelum ada peringkat
- 3ro - RM ..Problemas-Sobre-EdadesDokumen2 halaman3ro - RM ..Problemas-Sobre-EdadesrafaelBelum ada peringkat
- Tipos de Cuadros InformativosDokumen14 halamanTipos de Cuadros InformativosOGdanielxSan100% (2)
- ConjuntosNuméricosYSusEjemplosDokumen2 halamanConjuntosNuméricosYSusEjemplosHillary NuñezBelum ada peringkat
- 6.secuencia Figuras Del EspacioDokumen5 halaman6.secuencia Figuras Del EspacioBarbara MachadoBelum ada peringkat
- Análisis competitivo generalDokumen13 halamanAnálisis competitivo generalRicardo Zaldivar BustamanteBelum ada peringkat
- Fuerzas en sistemas de cables y estructuras 2DDokumen5 halamanFuerzas en sistemas de cables y estructuras 2DCesar Javier Lucas Heras0% (1)
- Campo magnético de una espira con corriente vs imán estáticoDokumen4 halamanCampo magnético de una espira con corriente vs imán estáticoSTEPHANIE SANCHEZ CASTRILLONBelum ada peringkat
- Informe de Estadística DescriptivaDokumen7 halamanInforme de Estadística Descriptiva28pablo1995100% (1)
- PIMA Calculo Integral Barrera Ludeña Bruno Fernando 20192686HDokumen20 halamanPIMA Calculo Integral Barrera Ludeña Bruno Fernando 20192686HBRUNO FERNANDO BARRERA LUDEÑA100% (1)
- 3 Buenos Apuntes Del Teorema Fundamental Del CalculoDokumen2 halaman3 Buenos Apuntes Del Teorema Fundamental Del CalculoCesar RafaelBelum ada peringkat
- L6-1 Empujes Terreno MurosDokumen24 halamanL6-1 Empujes Terreno MurosJose Leonardo Perez PerezBelum ada peringkat
- Esfuerzos en 3D PDFDokumen11 halamanEsfuerzos en 3D PDFjpablo69Belum ada peringkat
- Reporte - Ecuaciones Diferenciales - Fracciones Parciales .Saul HTDokumen4 halamanReporte - Ecuaciones Diferenciales - Fracciones Parciales .Saul HTEdgarBelum ada peringkat
- Triángulos y Cuadriláteros - ADUNIDokumen1 halamanTriángulos y Cuadriláteros - ADUNI123456Belum ada peringkat
- Sistema de MedidasDokumen28 halamanSistema de MedidasAnnys SalazarBelum ada peringkat
- Propuesta Didáctica para La Enseñanza de La Parábola en Ingeniería CivilDokumen2 halamanPropuesta Didáctica para La Enseñanza de La Parábola en Ingeniería CivilMaría Del Pilar Moncaleano CasallasBelum ada peringkat
- Práctica 2Dokumen13 halamanPráctica 2Carlos ChavezBelum ada peringkat