Pauli, Hunt y Aufbau
Diunggah oleh
victorHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pauli, Hunt y Aufbau
Diunggah oleh
victorHak Cipta:
Format Tersedia
Principio de exclusión de Pauli
El principio de exclusión de Pauli es una regla de la mecánica cuántica enunciada por
Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus
números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema
cuántico. Formulado inicialmente como principio, posteriormente se comprobó que era
derivable de supuestos más generales: de hecho, es una consecuencia del teorema de la
estadística del espín.
El principio de exclusión de Pauli solamente aplica para los fermiones, no para los bosones.
En un experimento realizado por investigadores de la Rice University se utilizaron dos
átomos de Litio, uno de los cuales es un bosón (Litio-7) y el otro un fermion (Litio-6). Se
enfriaron los átomos hasta temperaturas cercanas al cero absoluto. Lo que se puede apreciar
es como la nube del bosón se va compactando sin embargo, la nube del fermion casi no sufre
cambios debido a la repulsión de los fermiones establecida por el principio de Pauli.
Esto significa que dos electrones (fermiones) que se encuentren en un átomo no podrán
poseer a la vez iguales números cuánticos. Este hecho explicaría que los electrones se
dispersen en capas o niveles en torno al núcleo del átomo y por lo cual, los átomos que posean
mayor número de electrones ocupen mayor espacio, debido a que aumenta el número de
capas de las que consta el átomo.
Regla de Hund
La regla de Hund es un principio empírico formulado en 1927 por el físico alemán Friedrich
Hund, a partir del estudio de los espectros atómicos y la distribución de elementos en la tabla
periódica. La regla se enuncia como sigue:
Al llenar orbitales de igual energía (los tres
orbitales p, los cinco d, o los siete f) los electrones
se distribuyen, siempre que sea posible, con sus
espines paralelos, llenando los orbitales con la
multiplicidad mayor. La configuración atómica es
más estable (es decir, tiene menos energía) cuanto
más electrones desapareados (espines paralelos)
posee.
También se denomina así a la numeración lógica de
la multiplicidad de Hund.
Cuando varios electrones están descritos por
orbitales degenerados, la mayor estabilidad
energética es aquella en donde los espines electrónicos están desapareados (correlación de
espines).
Para comprender la regla de Hund, hay que saber que todos los orbitales en una subcapa
deben estar ocupados por lo menos por un electrón y deben ser apareables antes de que se le
asigne un segundo. Es decir, todos los orbitales deben estar llenos y todos los electrones en
paralelo antes de que un orbital gane un segundo electrón. Y cuando un orbital gana un
segundo electrón, éste deberá estar apareado del primero (espines opuestos o antiparalelos).
Por ejemplo:
3 electrones en el orbital 2p; px1 py1 pz1 (vs) px2 py1 pz0
(px2 py1 pz0 = px0 py1 pz2 = px1 py0 pz2= px2 py0 pz1=....)
Así, los electrones en un átomo son asignados progresivamente, usando una configuración
ordenada con el fin de asumir las condiciones energéticas más estables. El principio de
Aufbau explica las reglas para llenar orbitales de manera que no se viole la Regla de Hund.
En resumen, como existen orbitales equivalentes, primeramente se completa los electrones
al máximo que se pueda y posteriormente se pasa a emparejar.
La regla de Hund complementa al principio de exclusión de Pauli permitiendo la dilucidación
completa de la estructura electrónica de los átomos.
Principio de Aufbau
Se denomina principio de construcción (Aufbau) al procedimiento para deducir la
configuración electrónica de un átomo, y consiste en seguir un orden para el llenado de los
diferentes orbítales, basado en los diferentes valores de la energía de cada uno de ellos. Para
recordarlo se utiliza el diagrama de Möller o de las diagonales, así como la regla de la mínima
energía (n+l).
Regla del serrucho
Para llenar los orbitales correctamente, siga la
dirección de la flecha tal como se muestra en la gráfica.
Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y
baja a 4s. En este punto, el siguiente nivel de energía
más bajo no es 4p, sino que sube a 3d para luego bajar
a 4p y 5s. Y así, sucesivamente.
Se le llama la regla del serrucho, debido a la acción de
subir y bajar del modo descrito: 1s 2s 2p 3s 3p 3d 4s 4p
4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d 7f
Anda mungkin juga menyukai
- Cifras Significativas y RedondeoDokumen12 halamanCifras Significativas y RedondeoBrayan Jossep Huajalsaico CespedesBelum ada peringkat
- 01 Magnitudes, Analisis Dimensional y Conversión de UnidadesDokumen37 halaman01 Magnitudes, Analisis Dimensional y Conversión de UnidadesYerick Blanco SalazarBelum ada peringkat
- Física Iii Universidad Nacional de IngenieriaDokumen15 halamanFísica Iii Universidad Nacional de IngenieriaJosue LopezBelum ada peringkat
- Tarea DomiciliariaDokumen6 halamanTarea DomiciliariaMIRELLY SHUAN HIDALGO0% (1)
- UNIDAD 3 ProbabilidadDokumen12 halamanUNIDAD 3 ProbabilidadJose CortesBelum ada peringkat
- Ejercicio de Cinematica 1DDokumen5 halamanEjercicio de Cinematica 1DEliomar RieraBelum ada peringkat
- Exposicion - PENDULOS 1Dokumen22 halamanExposicion - PENDULOS 1Andres NavarroBelum ada peringkat
- Quimica Organica I PDFDokumen8 halamanQuimica Organica I PDFBoris Milton Mamani IchutaBelum ada peringkat
- Ecuaciones DiferencialesDokumen31 halamanEcuaciones DiferencialesortsantacreuBelum ada peringkat
- Ejericios 07Dokumen1 halamanEjericios 07NohelyBadilloBelum ada peringkat
- Informe2 - Kobe Bryan Gonzales Balderrama - Lab. FísicaDokumen5 halamanInforme2 - Kobe Bryan Gonzales Balderrama - Lab. FísicaJorge LlaveBelum ada peringkat
- Método de Gauss JordanDokumen10 halamanMétodo de Gauss JordanEdwinBelum ada peringkat
- Cinematica U4Dokumen5 halamanCinematica U4Orlando Alvarez100% (1)
- Práctica 4. MOMENTOS DE INERCIA CUERPOS GEOMÉTRICOSDokumen5 halamanPráctica 4. MOMENTOS DE INERCIA CUERPOS GEOMÉTRICOSJULIO ROMANBelum ada peringkat
- Taller Calor Especifico y Dilatacion LinealDokumen5 halamanTaller Calor Especifico y Dilatacion LinealVale ElhayekBelum ada peringkat
- Clase 1Dokumen14 halamanClase 1JIMENEZ AREVALO SAUL ARMANDOBelum ada peringkat
- Tipos de Matrices Elementales 1Dokumen5 halamanTipos de Matrices Elementales 1KIMBERLI VAZQUEZBelum ada peringkat
- Pendulo SimpleDokumen10 halamanPendulo Simpleoneyver rodriguezBelum ada peringkat
- Semana 7 JUAN SISA - 2400Dokumen23 halamanSemana 7 JUAN SISA - 2400juan100% (1)
- Mate 2 Funciones VectorialesDokumen37 halamanMate 2 Funciones VectorialesCarlosmMezaBelum ada peringkat
- Movimiento Circular UniformeDokumen10 halamanMovimiento Circular UniformeNicolás Melgarejo Sabelle100% (1)
- Lab N10Dokumen2 halamanLab N10Domenica ChisaguanoBelum ada peringkat
- Movimiento Ondulatorio UpcDokumen14 halamanMovimiento Ondulatorio UpcMelky NavarroBelum ada peringkat
- PRACTICA 2. Ley de CoulombDokumen13 halamanPRACTICA 2. Ley de Coulombelkin garciaBelum ada peringkat
- Tarea Derivación VectorialDokumen18 halamanTarea Derivación Vectorialcristiansaigua11Belum ada peringkat
- EXAMEN SUPLETORIO 2018 ResueltoDokumen5 halamanEXAMEN SUPLETORIO 2018 ResueltoYesy Constante100% (1)
- Guía Módulo Sistema de Partículas 2020-2Dokumen6 halamanGuía Módulo Sistema de Partículas 2020-2Mariana MosqueraBelum ada peringkat
- Informe Cosenos DirectoresDokumen4 halamanInforme Cosenos DirectoresJusset PeñalozaBelum ada peringkat
- Espacios Vectoriales AlgebraDokumen10 halamanEspacios Vectoriales AlgebraAniita MuñozBelum ada peringkat
- RECTAS PARALELAS Y ORTOGONALES Angulo r3Dokumen5 halamanRECTAS PARALELAS Y ORTOGONALES Angulo r3luis fernandoBelum ada peringkat
- Fuerzas ConservativasDokumen2 halamanFuerzas ConservativasGino BustamanteBelum ada peringkat
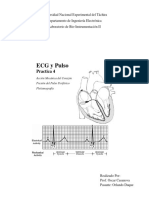
- Practica 4 - ECG y PulsoDokumen17 halamanPractica 4 - ECG y PulsoMaykerr MontoyaBelum ada peringkat
- Investigación de La Unidad 5, Métodos Numéricos (Método de Euler)Dokumen8 halamanInvestigación de La Unidad 5, Métodos Numéricos (Método de Euler)Jesús Alexander MejíazBelum ada peringkat
- Sistemas FísicosDokumen4 halamanSistemas Físicosmasterpoleo50% (2)
- Capitulo IV (Ecuaciones Diferenciales Transformables A Variabls Separables)Dokumen11 halamanCapitulo IV (Ecuaciones Diferenciales Transformables A Variabls Separables)Luis GuaytaBelum ada peringkat
- Guía 3 Mec DatosDokumen10 halamanGuía 3 Mec DatosBJR destrodBelum ada peringkat
- TALLER FISICA - ElectrostáticaDokumen7 halamanTALLER FISICA - ElectrostáticaJhony CastroBelum ada peringkat
- Taller HidrostaticaDokumen21 halamanTaller HidrostaticaSebasthian RomeroBelum ada peringkat
- Lab Efecto DopplerDokumen3 halamanLab Efecto DopplerAndrea RamosBelum ada peringkat
- 2 Tipos de Función CoolDokumen2 halaman2 Tipos de Función CoolRebecca DuránBelum ada peringkat
- Probabilidad: Serie de Los Temas II y IIIDokumen4 halamanProbabilidad: Serie de Los Temas II y IIIAxel SalazarBelum ada peringkat
- TALLER 03 Miguelangel GarcíaDokumen15 halamanTALLER 03 Miguelangel GarcíaMiguelangel Garcia CastilloBelum ada peringkat
- Informe 7Dokumen16 halamanInforme 7Jose GarciaBelum ada peringkat
- Page 52Dokumen1 halamanPage 52Rafael Eligio Figueroa MercadoBelum ada peringkat
- Practica 6 Electricidad y Magnetismo ESIQIE IPNDokumen5 halamanPractica 6 Electricidad y Magnetismo ESIQIE IPNPaola HernándezBelum ada peringkat
- Suma Analítica de Vectores 10° PDFDokumen2 halamanSuma Analítica de Vectores 10° PDFAngel ArrietaBelum ada peringkat
- Taller 4 Teoria Cuantica Convertido 2Dokumen5 halamanTaller 4 Teoria Cuantica Convertido 2dayanaBelum ada peringkat
- EP1.Carlos Daniel de Leon Ramos.4BDokumen4 halamanEP1.Carlos Daniel de Leon Ramos.4BCARLOS DANIEL DE LEÓN RAMOS100% (1)
- Aplicaciones de Las Ecuaciones Diferenciales de Primer OrdenDokumen5 halamanAplicaciones de Las Ecuaciones Diferenciales de Primer OrdenMiltonAngelinoAychoFlores0% (1)
- Espirales ArquimedesDokumen17 halamanEspirales ArquimedesLeonardo CorredorBelum ada peringkat
- Cap-004 Dinamica Leyes Del Movimiento de NewtonDokumen26 halamanCap-004 Dinamica Leyes Del Movimiento de NewtonAnderson GutierrezBelum ada peringkat
- Ud2 t2 Combinaciones Lineales en RNDokumen9 halamanUd2 t2 Combinaciones Lineales en RNakelionBelum ada peringkat
- Solución A Problema 1.32 Fisica Universitaria Sears ZemanskyDokumen1 halamanSolución A Problema 1.32 Fisica Universitaria Sears Zemanskyphoenix eastwoodBelum ada peringkat
- Producto EscalarDokumen4 halamanProducto EscalarAna RodriguezBelum ada peringkat
- Principo de AufbauDokumen8 halamanPrincipo de AufbauBraulio LamperagueBelum ada peringkat
- La Configuración ElectrónicaDokumen2 halamanLa Configuración ElectrónicaJosselyn CarolinaBelum ada peringkat
- Principio de Exclusion de PauliDokumen3 halamanPrincipio de Exclusion de PauliNelson VelasquezBelum ada peringkat
- Principio de AUFBAUDokumen5 halamanPrincipio de AUFBAUmarianaBelum ada peringkat
- Principio de Exclusión de PauliDokumen3 halamanPrincipio de Exclusión de PauliheryBelum ada peringkat
- Trazos y Mitos de Una UtopiaDokumen285 halamanTrazos y Mitos de Una UtopiavictorBelum ada peringkat
- RESISTENCIASDokumen3 halamanRESISTENCIASvictorBelum ada peringkat
- Transformaciones LinealesDokumen2 halamanTransformaciones LinealesvictorBelum ada peringkat
- Transformaciones LinealesDokumen3 halamanTransformaciones LinealesvictorBelum ada peringkat
- MatrizDokumen4 halamanMatrizvictorBelum ada peringkat
- Ventajas de Un PLCDokumen2 halamanVentajas de Un PLCvictorBelum ada peringkat
- Proyecto de FisicaDokumen7 halamanProyecto de FisicavictorBelum ada peringkat
- Poder EstadísticoDokumen4 halamanPoder EstadísticoMario MorochoBelum ada peringkat
- 2 Taller PRONOSTICOS REGRESION LINEALDokumen10 halaman2 Taller PRONOSTICOS REGRESION LINEALHolman Ferney RINCON VARGASBelum ada peringkat
- CLASE 3.2 - Coeficiente de Determinación R2Dokumen5 halamanCLASE 3.2 - Coeficiente de Determinación R2Armando AlmaBelum ada peringkat
- WILCOXOSDokumen16 halamanWILCOXOSEneili Tarrillo CajoBelum ada peringkat
- TP Variables AleatoriasDokumen4 halamanTP Variables AleatoriasLeuchte BleichBelum ada peringkat
- Dickey Fuller 1981Dokumen21 halamanDickey Fuller 1981Fabiola PadillaBelum ada peringkat
- 6 11Dokumen13 halaman6 11Fabricio CalapiñaBelum ada peringkat
- Presentación Teoría MecanocuánticaDokumen34 halamanPresentación Teoría MecanocuánticaSofia Pilar Mondaca SepúlvedaBelum ada peringkat
- 2° FormularioDokumen1 halaman2° FormularioRosita HernándezBelum ada peringkat
- C.Administración (415) ESTADISTICA IDokumen3 halamanC.Administración (415) ESTADISTICA IYorfreiderBelum ada peringkat
- Actividad 3.1 Estadistica HarryDokumen15 halamanActividad 3.1 Estadistica HarryHarry GarciaBelum ada peringkat
- Estadistica InferencialDokumen23 halamanEstadistica InferencialmitsyBelum ada peringkat
- Niveles de LandauDokumen3 halamanNiveles de LandauCamilo GonzálezBelum ada peringkat
- Actividad 3.1 Cuestionario de La Unidad III TERMINADODokumen5 halamanActividad 3.1 Cuestionario de La Unidad III TERMINADOAmelia Eunice Aboites MorenoBelum ada peringkat
- Examen Estadística II Especialización BDokumen8 halamanExamen Estadística II Especialización BMateo Pérez100% (1)
- COSMOLOGÍADokumen3 halamanCOSMOLOGÍAJohn J Quintero Ar.Belum ada peringkat
- Regresion Lineal 34165Dokumen26 halamanRegresion Lineal 34165juan rodolfo soncco apafataBelum ada peringkat
- Ejercicios Normal ClaseDokumen2 halamanEjercicios Normal ClaseJose Luis SanchezBelum ada peringkat
- Guia 1Dokumen4 halamanGuia 1Liz Serrano YujraBelum ada peringkat
- Estadísticas de La RegresiónDokumen5 halamanEstadísticas de La RegresiónPatys CervantesBelum ada peringkat
- Élie Cartan - Wikipedia, La Enciclopedia LibreDokumen3 halamanÉlie Cartan - Wikipedia, La Enciclopedia LibreFreddy RodriguezBelum ada peringkat
- Sociología Del Conflicto y El FuncionalismoDokumen19 halamanSociología Del Conflicto y El FuncionalismoROMÁN SILVA KALIA GABRIELABelum ada peringkat
- Cuantica en La Vida CotidianaDokumen2 halamanCuantica en La Vida CotidianaYEFREI GEOVANY SIERRA ALVAREZBelum ada peringkat
- Af 02 16Dokumen13 halamanAf 02 16daniel pazBelum ada peringkat
- Aproximación Normal A Binomial y Prueba de HipotesisDokumen26 halamanAproximación Normal A Binomial y Prueba de HipotesisDavid HernandezBelum ada peringkat
- Probabilidad - Equipo 5Dokumen31 halamanProbabilidad - Equipo 5Monroy Sotomayor Alberto ArturoBelum ada peringkat
- Análisis Exploratorio y Ajuste de Modelo Al Comportamiento de Una Variable de EstudioDokumen18 halamanAnálisis Exploratorio y Ajuste de Modelo Al Comportamiento de Una Variable de EstudioAgustin del BlancoBelum ada peringkat
- Programa EconometriaDokumen4 halamanPrograma EconometriaEdsonBelum ada peringkat
- Familia de Diseños para Comparar TratamientosDokumen24 halamanFamilia de Diseños para Comparar TratamientosAlejandro Soberano Morales71% (24)
- Ei: Actividad 3 A Realizar: (Procedimiento Completo, en Vertical)Dokumen3 halamanEi: Actividad 3 A Realizar: (Procedimiento Completo, en Vertical)JJ AbrahamBelum ada peringkat