Péptidos y Proteinas
Diunggah oleh
jose0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
50 tayangan10 halamanquimica orgánica
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Iniquimica orgánica
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
50 tayangan10 halamanPéptidos y Proteinas
Diunggah oleh
josequimica orgánica
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 10
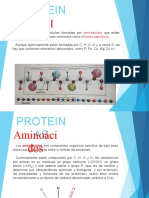
Proteinas
Definición: Son macromoléculas biopoliméricas constituidas por muchas
unidades de α-AA (monómeros) unidos a través de enlaces amida
(peptídico).
Diferencia entre Péptidos y Proteinas: Si el número de α-AA no es mayor
que 10, Oligopéptido, si es mayor que 10 y menor que 50, Péptido y si
contiene un número superior a 50 α-AA, Proteína.
Fuente natural: Se encuentran en todos los organismos vivos cumpliendo
diversas funciones biológicas. Constituyen la mitad del peso en seco de la
célula.
Las fuentes dietéticas de proteínas incluyen carne, huevos, legumbres,
frutos secos, cereales, verduras y productos lácteos tales como queso o
yogur. Tanto las fuentes proteínas animales como los vegetales poseen los
20 aminoácidos necesarios para la alimentación humana.
Composición: Están constituidas fundamentalmente por C, H, N y O. En
algunos casos contienen S y P ó metales como el Fe, Mg, I, Cu y Zn.
Enlace peptídico: Es un enlace entre el grupo amino (–NH2) de un α-AA y el
grupo carboxilo (–COOH) de otro α-AA, para formar los péptidos y
proteínas.
El enlace peptídico implica la pérdida de una molécula de agua y la
formación de un enlace covalente CO-NH (amida sustituido).
Estructura primaria: Es la forma de organización más básica de las
proteínas. Está determinada por la secuencia de los α-AA de la cadena
proteica, es decir, por el número de α-AA presentes y por el orden en que
están enlazados por medio de enlaces peptídicos.
Estructura secundaria: Es el plegamiento regular local entre residuos α-AA
cercanos de la cadena polipeptídica a través del espacio.
Este tipo de estructura se adopta gracias a la formación de enlaces de
hidrógeno entre los grupos carbonilo (-CO-) y amino (-NH-) de los carbonos
involucrados en los enlaces peptídicos. También se encuentran en forma de
espiral aplana.
Enlaces disulfuro: También conocidos como puente disulfuro o enlace SS
(enlace azufre-azufre). Es un enlace covalente fuerte entre grupos tiol (-SH)
de dos cisteínas. Este enlace es muy importante en la estructura,
plegamiento y función de las proteínas.
Es un enlace reversible y puede producirse en una única cadena para formar
un anillo o entre dos cadenas separadas para formar un puente
intermolecular. Los puentes disulfuro ayudan a estabilizar muchos
polipéptidos y proteínas. Este tipo de enlace se encuentra presente en las
estructuras terciarias de las proteínas.
Estructura terciaria: Se forma por la capacidad de la estructura secundaria
de un polipéptido de plegarse sobre sí misma originando una conformación
globular tridimensional.
Esta estructura se mantiene estable a través de enlaces entre los radicales
R de los α-AA, de puentes de hidrógeno, de los puentes disulfuro (entre las
cisteínas) y por las fuerzas hidrófobas de los sustituyentes R de los α-AA.
De esta estructura se derivan muchas propiedades biológicas de las
proteínas, puesto que la disposición en el espacio de los diferentes grupos
funcionales de la proteína, condiciona su capacidad de interacción con
otros grupos y ligandos.
Estructura cuaternaria: Se genera mediante la unión de varias cadenas
polipeptídicas con estructura terciaria, a través de enlaces débiles, para
formar un complejo proteico (ó agregado de varias subunidades). Cada una
de estas cadenas polipeptídicas (ó subunidades), recibe el nombre de
protómero.
Resumen de las estructuras de las proteínas:
Clasificación de las proteínas:
(i) Según su composición, las proteínas se pueden clasificar en dos (2) tipos.
1.- Simples u holoproteínas: En su hidrólisis solo producen aminoácidos. Ej.
La insulina y el colágeno.
2.- Conjugadas o heteroproteínas: A demás de contener cadenas
polipeptídicas, también contienen una porción no aminoacídica (no
proteica) denominada grupo prostético. Estos pueden ser un ácido
nucleico, un lípido, un azúcar o ion inorgánico. Ej. La mioglobina,
hemoglobina y los citocromo.
Las proteínas conjugadas a su vez se clasifican de acuerdo a la naturaleza
de su grupo prostético:
- Nucleoproteínas: Su grupo prostético son los ácidos nucleicos.
- Lipoproteínas: Su grupo prostético son los fosfolípidos, colesterol y
triglicéridos.
- Metaloproteínas: El grupo prostético está formado por metales.
- Cromoproteínas: Son proteínas conjugadas por un grupo cromóforo
(sustancia coloreada que contiene un metal).
- Glucoproteínas: El grupo prostético está formado por carbohidratos.
- Fosfoproteinas: Son proteínas conjugadas con un radical que contiene
fosfato, distinto de un ácido nucleico o de un fosfolípido.
(ii) Según su forma, las proteínas se clasifican en tres (3) tipos
1. Proteínas fibrosas: Su estructura es de cadenas largas y filamentosas (ó
fibrilar) y no son hidrosolubles. Tienen funciones estructurales, por eso se
encuentran en la α- y la β-queratina (piel, uñas, garras, cabello, plumas), en
elastinas, en la fibroina (sedas, telaraña y capullos), y en el colágeno
(cartílagos, tendones y vasos sanguíneos).
2. Proteínas globulares: Su cadena polipeptídica se encuentra enrollada de
manera esférica “ovillo” sobre sí misma. Sus grupos hidrófobos se
acomodan hacia adentro (como las micelas) y los hidrofílicos hacia afuera,
por ello son hidrosolubles. Típicamente están presentes en las enzimas,
anticuerpos, algunas hormonas, albúmina y proteínas de transporte.
3. Mixtas: Poseen una parte fibrilar (comúnmente en el centro de la
proteína) y otra parte globular (en los extremos). Ej. Fibrinógeno y miosina.
Funciones de las proteínas: Desempeñan un papel fundamental para la
vida celular, siendo las biomoléculas más versátiles y diversas de toda la
serie. Son imprescindibles para el crecimiento de cada organismo,
realizando diversas funciones como:
Estructural. Da resistencia y elasticidad lo que permite formar tejidos Ej.
Colágeno. También da soporte a otras estructuras, como la tubulina que
se encuentra en el citoesqueleto.
Contráctil. (actina y miosina). En los músculos.
Enzimática. Catalizan las reacciones bioquímicas del metabolismo (Ej.
sacarasa y pepsina).
Homeostática. Colaboran en el mantenimiento del pH del organismo
(actúan como un tampón químico).
Protectora o defensiva. Se encargan de defender el organismo de
cuerpos extraños. Ej. Anticuerpos ó inmunoglobulinas; trombina y
fibrinógeno en la sangre, queratina en la piel).
Transducción de señales. (Ej. Rodopsina en los bastoncillos).
Reguladoras. Ayudan a que exista un equilibrio entre las funciones que
realiza el cuerpo (funciones hormonales). Ej. La insulina; se encarga de
regular la glucosa que se encuentra en la sangre.
Transporte. Llevan sustancias a través del organismo a donde sean
requeridas. Ej. La hemoglobina (O2) a través de la sangre.
Receptoras. Se encuentran en la membrana celular y se encargan de
recibir señales para que la célula pueda realizar su función. Ej. La
acetilcolina, que recibe señales para producir la contracción.
Desnaturalización de las proteínas: Consiste en la pérdida de la estructura
(primaria, secundaria, terciaria ó cuaternaria) de las proteínas, provocadas
por acción del pH, temperatura, polaridad de solventes o presencia de
iones.
Este proceso puede ser reversible, cuando el efecto que trate de modificar
la estructura de la proteína no se genera de manera permanente (se
mantiene la función biológica); Ej. Alaciado del cabello rizado. Es
irreversible si la modificación de la estructura de la proteína es permanente
(pérdida total de la función biológica). Ej. Huevo crudo-huevo cocido.
La reversibilidad o irreversibilidad del proceso depende de la acción o
efecto aplicado a la proteína.
Anda mungkin juga menyukai
- Clase Practica 17Dokumen9 halamanClase Practica 17Kenya SantacruzBelum ada peringkat
- Taller 1Dokumen4 halamanTaller 1joseBelum ada peringkat
- TEMA 4 ProteinasDokumen13 halamanTEMA 4 ProteinasDanielys PerezBelum ada peringkat
- 5 Biología - ProteínasDokumen8 halaman5 Biología - ProteínasCarlos LaraBelum ada peringkat
- Bloque 4Dokumen7 halamanBloque 4luciaBelum ada peringkat
- Guia de Estudio de Segundo Corte de BiomoleculasDokumen16 halamanGuia de Estudio de Segundo Corte de BiomoleculasDaniela OrtizBelum ada peringkat
- ProteínasDokumen5 halamanProteínasAlonZzio MoOnrroyyBelum ada peringkat
- PROTEÍNASDokumen6 halamanPROTEÍNASDylan santamariaBelum ada peringkat
- Síntesis de Las BiomoleculasDokumen16 halamanSíntesis de Las BiomoleculasOscar Leal60% (5)
- Propiedades Generales de Las Moléculas de Los AlimentosDokumen30 halamanPropiedades Generales de Las Moléculas de Los Alimentostutyzuu67% (3)
- Quimica 11 ProteinasDokumen31 halamanQuimica 11 Proteinasestherjilapa172Belum ada peringkat
- Proteínas - DiapositivasDokumen21 halamanProteínas - DiapositivasAnibal PariaBelum ada peringkat
- Clase 4 ProteinasDokumen19 halamanClase 4 Proteinasgchumbe100% (2)
- Resumen 3 Modulo II (FB)Dokumen6 halamanResumen 3 Modulo II (FB)endless hellBelum ada peringkat
- TEMA 4 Proteinas 1Dokumen4 halamanTEMA 4 Proteinas 1Karine moraBelum ada peringkat
- PROTEÍNASDokumen29 halamanPROTEÍNASLuz Elena Collado ArapaBelum ada peringkat
- IV B-Macromol. 2da Parte ALUMNOSDokumen14 halamanIV B-Macromol. 2da Parte ALUMNOSDayan CespedesBelum ada peringkat
- Estructura de Las ProteínasDokumen8 halamanEstructura de Las ProteínasAleydaBelum ada peringkat
- Tema 6 ProteínasDokumen20 halamanTema 6 ProteínasAlex Ramos maqueraBelum ada peringkat
- 2 Proteinas Parte 2Dokumen72 halaman2 Proteinas Parte 2KAREN ANDREA CACERES HUACARPUMABelum ada peringkat
- Unidad 1 Tema 4 (Autoguardado)Dokumen20 halamanUnidad 1 Tema 4 (Autoguardado)Eliza PadillaBelum ada peringkat
- TEMA 4 ProteinasDokumen4 halamanTEMA 4 ProteinasYeniffer MontilvaBelum ada peringkat
- Trabajo Practico de ProteínasDokumen5 halamanTrabajo Practico de Proteínasvillegascamila256Belum ada peringkat
- PROTEÍNASDokumen4 halamanPROTEÍNASPerlaBelum ada peringkat
- Tema 4 ProteínasDokumen6 halamanTema 4 Proteínasagustinagonzalez525Belum ada peringkat
- Proteinas Quimica OrganicaDokumen39 halamanProteinas Quimica OrganicaLuis Daniel Gaitan Lopez67% (3)
- Peptidos Y Proteinas: Ing.M.Sc. Roxana Trujillo ValderramaDokumen18 halamanPeptidos Y Proteinas: Ing.M.Sc. Roxana Trujillo ValderramaAdrian MillerBelum ada peringkat
- MGMD R33 03Dokumen4 halamanMGMD R33 03mayra dayana mamani gonzalesBelum ada peringkat
- Informe de Las ProteínasDokumen7 halamanInforme de Las ProteínasEmanuel SáezBelum ada peringkat
- ProteínasDokumen14 halamanProteínasANA KAREN SALAS ROLDANBelum ada peringkat
- Las Proteínas Son Biomoléculas Formadas Básicamente Por CarbonoDokumen3 halamanLas Proteínas Son Biomoléculas Formadas Básicamente Por CarbonowandaBelum ada peringkat
- La Palabra Proteína Proviene Del GriegoDokumen3 halamanLa Palabra Proteína Proviene Del GriegoGarcia Lopez Maria LuisiBelum ada peringkat
- Instituto Superior Pedagogico Publico de JuliacaDokumen15 halamanInstituto Superior Pedagogico Publico de JuliacaAngel Rodriguez MendizabalBelum ada peringkat
- 5.-Proteinas y Petidos.Dokumen26 halaman5.-Proteinas y Petidos.Alondra ApolinarioBelum ada peringkat
- ProteinasDokumen21 halamanProteinasAngel RuizBelum ada peringkat
- Proteínas - Concepto, Tipos, para Qué Sirven y AlimentosDokumen8 halamanProteínas - Concepto, Tipos, para Qué Sirven y AlimentosLorenzo JimenezBelum ada peringkat
- ProteínasDokumen6 halamanProteínasAquetzali LópezBelum ada peringkat
- Clasificacion y Estructuras de Las ProteinasDokumen5 halamanClasificacion y Estructuras de Las ProteinasAna BequisBelum ada peringkat
- Que Es Una ProteínaDokumen5 halamanQue Es Una ProteínaGuillermina OrdoñoBelum ada peringkat
- Actividad 12 - ProteinasDokumen6 halamanActividad 12 - ProteinasDylan Vasquez9Belum ada peringkat
- ProteinasDokumen5 halamanProteinasleyla.n.frachiBelum ada peringkat
- 20210516110538Dokumen26 halaman20210516110538camila tang pradoBelum ada peringkat
- ProteínasDokumen2 halamanProteínasluisinaBelum ada peringkat
- Proteinas CarmenDokumen50 halamanProteinas CarmenMaría Nathalie Hidálgo González BBelum ada peringkat
- PROTEÍNASDokumen5 halamanPROTEÍNASMagaly Arellano GuerreroBelum ada peringkat
- Aminoácidos y PéptidosDokumen5 halamanAminoácidos y Péptidosnacm2714Belum ada peringkat
- Las ProteínasDokumen11 halamanLas ProteínasGreth settaBelum ada peringkat
- ProteinasDokumen5 halamanProteinasDanielaBelum ada peringkat
- Estructura y Clasificación de Las ProteínasDokumen3 halamanEstructura y Clasificación de Las Proteínasmaureth coronadoBelum ada peringkat
- ProteínasDokumen21 halamanProteínasALEXIS ESTEBAN VALOR ARROYOBelum ada peringkat
- Documento PDFDokumen17 halamanDocumento PDFYasmin Marrous ChagtabBelum ada peringkat
- Proteinas 2Dokumen14 halamanProteinas 2Andreina ZambranoBelum ada peringkat
- 2.3. Proteínas-1Dokumen32 halaman2.3. Proteínas-1Dentistryuv 2020Belum ada peringkat
- ProteínasDokumen8 halamanProteínasLamato247Belum ada peringkat
- Guía 1 4º BiologíaDokumen4 halamanGuía 1 4º BiologíaNintendo112Belum ada peringkat
- G2 - ProteinasDokumen10 halamanG2 - ProteinasRicardo Bermeo MolinaBelum ada peringkat
- Proteinas - AuroraDokumen19 halamanProteinas - AuroraIRMA MARTINEZ NOLEBelum ada peringkat
- Proteína y Sus EstructurasDokumen8 halamanProteína y Sus Estructurasgigi collanteBelum ada peringkat
- AA y ProteinasDokumen16 halamanAA y ProteinasCosette Perez penaBelum ada peringkat
- GQGL R33Dokumen5 halamanGQGL R33LeoBelum ada peringkat
- PROTEÍNASDokumen5 halamanPROTEÍNASFiorelaToAlBelum ada peringkat
- Pendiente 0.00013 Intercepto 0.052 ConcentraciónDokumen5 halamanPendiente 0.00013 Intercepto 0.052 ConcentraciónjoseBelum ada peringkat
- Santiago de CaliDokumen2 halamanSantiago de CalijoseBelum ada peringkat
- UltravioletaDokumen1 halamanUltravioletajoseBelum ada peringkat
- MemofichassDokumen6 halamanMemofichassjoseBelum ada peringkat
- muestra λ (600 nm) AbsorbanciaDokumen2 halamanmuestra λ (600 nm) AbsorbanciajoseBelum ada peringkat
- FormatoDokumen9 halamanFormatojoseBelum ada peringkat
- Datos Practica Determinacion Espectrofotometrica de Fe en Producto Farmaceutico.Dokumen6 halamanDatos Practica Determinacion Espectrofotometrica de Fe en Producto Farmaceutico.joseBelum ada peringkat
- Deriv GrapherDokumen15 halamanDeriv GrapherHenry AguilarBelum ada peringkat
- Leeme TutorialDokumen1 halamanLeeme TutorialjoseBelum ada peringkat
- Capitulo 1Dokumen1 halamanCapitulo 1joseBelum ada peringkat
- Planilla de Excel para El Calculo de Integral y DerivadaDokumen40 halamanPlanilla de Excel para El Calculo de Integral y DerivadajoseBelum ada peringkat
- Concentrado de Tabla de ConversionesDokumen5 halamanConcentrado de Tabla de ConversionesGustavo ValenciaBelum ada peringkat
- Parcial EstadisticaDokumen3 halamanParcial EstadisticajoseBelum ada peringkat
- Lab Analisis Instrumental Datos Practica 1Dokumen6 halamanLab Analisis Instrumental Datos Practica 1joseBelum ada peringkat
- Pruebas de SignificaciónDokumen27 halamanPruebas de SignificaciónjoseBelum ada peringkat
- Lab Analisis Instrumental Datos Practica 2Dokumen3 halamanLab Analisis Instrumental Datos Practica 2joseBelum ada peringkat
- DerivdDokumen3 halamanDerivdjoseBelum ada peringkat
- Plan Till A 1Dokumen2 halamanPlan Till A 1MIguel San romanBelum ada peringkat
- FormatoDokumen9 halamanFormatojoseBelum ada peringkat
- LeemeDokumen1 halamanLeemejoseBelum ada peringkat
- LabDokumen6 halamanLabjoseBelum ada peringkat
- Santiago de CaliDokumen2 halamanSantiago de CalijoseBelum ada peringkat
- Quiz 1 de FisicoquímicaDokumen1 halamanQuiz 1 de FisicoquímicajoseBelum ada peringkat
- Quiz 2 de FisicoquímicaDokumen1 halamanQuiz 2 de FisicoquímicajoseBelum ada peringkat
- Trabajo FinalDokumen7 halamanTrabajo FinaljoseBelum ada peringkat
- Divulgacion MusicaDokumen4 halamanDivulgacion MusicajoseBelum ada peringkat
- Caso ExitosoDokumen1 halamanCaso ExitosojoseBelum ada peringkat
- Problemas Resueltos Tema5 PDFDokumen17 halamanProblemas Resueltos Tema5 PDFLuis MoralesBelum ada peringkat
- S16Dokumen15 halamanS16SERGIO7-S100% (1)
- Clase EnzimasDokumen55 halamanClase Enzimasadolfo moralesBelum ada peringkat
- Biomoléculas Proteínas IiDokumen3 halamanBiomoléculas Proteínas IiOdalisJ BohorquezRBelum ada peringkat
- Taller NucleotidosDokumen6 halamanTaller NucleotidosEstefani Cardona VillaBelum ada peringkat
- Direccionamiento de ProteínasDokumen17 halamanDireccionamiento de ProteínasIvvi Varchavsky100% (11)
- 6.aminoácidos y ProteínasDokumen106 halaman6.aminoácidos y Proteínasyurd leidyBelum ada peringkat
- El ADN, Portador Del Mensaje GenéticoDokumen18 halamanEl ADN, Portador Del Mensaje GenéticoGabrielBelum ada peringkat
- Proteinas LacteasDokumen2 halamanProteinas LacteasAnibal ChavezBelum ada peringkat
- Dispo 1893 17 AnmatDokumen14 halamanDispo 1893 17 AnmatFrancoBelum ada peringkat
- Exposicion de ProteinasDokumen9 halamanExposicion de Proteinasjhamer rivera nuñezBelum ada peringkat
- C4 - MacromoleculasDokumen6 halamanC4 - MacromoleculasMarcos NovoBelum ada peringkat
- MolecularDokumen8 halamanMolecularmf.ariasBelum ada peringkat
- Tabla ComparativaDokumen2 halamanTabla ComparativaAidee HernándezBelum ada peringkat
- Ciclo Celular NotasDokumen2 halamanCiclo Celular NotasAdrian Navarro HdezBelum ada peringkat
- 4to Informe - Grupo 2Dokumen16 halaman4to Informe - Grupo 2Emmanuel Oscar ALBINES SECLENBelum ada peringkat
- Problemario 3 EnzimáticaDokumen9 halamanProblemario 3 EnzimáticaDenisse SoriaBelum ada peringkat
- 9° Apunte de Cátedra Biologia Humana Retículo Endoplasmático Y Complejo de Golgi Tráfico VesicularDokumen11 halaman9° Apunte de Cátedra Biologia Humana Retículo Endoplasmático Y Complejo de Golgi Tráfico VesiculardanitzaBelum ada peringkat
- Ejercicios EVAU Acidos NucleicosDokumen3 halamanEjercicios EVAU Acidos NucleicosTomas TurbadoBelum ada peringkat
- Cinética e Inhibición EnzimáticaDokumen5 halamanCinética e Inhibición EnzimáticaArévaloBelum ada peringkat
- InflamaciónDokumen1 halamanInflamaciónGloria Melissa Aguilar AlvaradoBelum ada peringkat
- Síntesis y Degradación de MacromoléculasDokumen21 halamanSíntesis y Degradación de MacromoléculasSamantha SantosBelum ada peringkat
- BiomoleculasDokumen3 halamanBiomoleculasDaniela IbarraBelum ada peringkat
- Síntesis de ProteínasDokumen8 halamanSíntesis de ProteínasAriel Alejandra MugiwaraBelum ada peringkat
- Enzimas de RestricciónDokumen13 halamanEnzimas de RestricciónCosme Damian Martinez RodriguezBelum ada peringkat
- Taller de PCR.2020-g1Dokumen8 halamanTaller de PCR.2020-g1Yeimi villalbaBelum ada peringkat
- Receptores FarmacologicosDokumen1 halamanReceptores FarmacologicosNaomi CentenoBelum ada peringkat
- Vectores de Expresión Abril 2017Dokumen41 halamanVectores de Expresión Abril 2017Katty ReyBelum ada peringkat
- Replicacion de ADNDokumen19 halamanReplicacion de ADNCarla CaizaBelum ada peringkat
- Michaelis MentenDokumen30 halamanMichaelis MentenLAURA NATALIA BERDUGO GUAUQUEBelum ada peringkat
- Técnicas de ADN RecombinanteDokumen4 halamanTécnicas de ADN RecombinanteDaniela Perdomo QuijanoBelum ada peringkat