Cuestionario 7
Diunggah oleh
Eduardo SalinasJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Cuestionario 7
Diunggah oleh
Eduardo SalinasHak Cipta:
Format Tersedia
CUESTIONARIO
1. Escriba las tres reacciones en las que se fundamenta la experiencia.
3C2H5OH(ac) + 4HCrO4-(ac) + 16H+ → 3CH3COOH(ac) + 4Cr+3(ac) + 13H2O
Naranja Verde
2HCrO4-1(ac) + 6I- + 14H+ → 3I2(ac) + 2Cr+3(ac) + 8H2O(l)
I2(ac) + 2Na2S2O3(ac) → 2NaI(ac) + Na2S4O6(ac)
2. Explique de manera breve, cual es la función del Na2S2O3 y por qué su
concentración debe ser lo exacta posible.
La función del Na2S2O3 es hallar la concentración del otro reactivo con
el que se está titulando, su concentración debe ser exacta ya que
actúa como una solución estándar, es decir se usa para titular otras
soluciones y así determinar las concentraciones exactas de dichas
soluciones.
3. Uno de los factores que aumenta la velocidad de reacción es la
temperatura. Explique, de manera sencilla, como se podría demostrar
este efecto en la experiencia de laboratorio.
Para demostrar este efecto en la experiencia del laboratorio se
podría calentar la solución determinada en una cocinilla medidos a
una cierta temperatura, luego titulamos y nos daremos cuenta que se
usa menos volumen que cuando no se calentó para un tiempo
determinado, de esta manera podríamos demostrar que a mayor
temperatura la velocidad de reacción aumenta.
4. Experimentalmente, en la descomposición del ácido 2,3
- dibromobutanodioico (COO-CHBr-CHBr-COOH, PF=276) se
encontraron los siguientes datos:
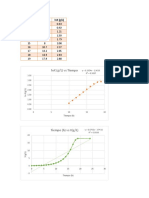
Tiempo(min) 0 10 20 30 40 50
g de Ac. residual 5,11 3,77 2,74 2,02 1,48 1,08
Encontrar la ecuación cinética y el valor de k (constante cinética)
𝑊
[𝑀] = Dónde: PF= peso formula (276) V=1L(base)
𝑃𝐹𝑥𝑉
W=g de Ac. residual
Tiempo(min) [M] Ln [M]
0 1.85x10-2 -3.98998455
10 1.36x10-2 -4.29768549
20 0.99x10-2 -4.61320236
30 0.73x10-2 -4.91851201
40 0.53x10-2 -5.2287913
50 0.39x10-2 -5.5442179
Tiempo(m)
0
0 10 20 30 40 50 60
-1
ln[COO-CHBr-CHBr-COOH]
-2
-3
-3.989984547
-4 -4.297685486
-4.613202358
-4.918512005
-5 -5.228791304
-5.544217905
-6
La grafica Ln [COO-CHBr-CHBr-COOH] vs t es una recta cuando se
transforma a logaritmo natural, entonces la reacción es de primer
orden.
DETERMINACION DE k GRAFICAMENTE:
Relación de la concentración con el tiempo para primer orden:
ln[ ]𝑓 = −𝑘𝑡 + ln[ ]0
Ecuación de la recta: y = mx + b Donde: m=pendiente
m = -k
De la gráfica: y = -0.0311x – 3.989
kconstante cinética = 0.0311
DETERMINACION DE k NUMERICAMENTE:
De la ecuación para n=1 ln[ ]𝑓 = −𝑘𝑡 + ln[ ]0
ln[ ]0 −ln[ ]𝑓
Despejando k: 𝑘=
∆𝑡
−3.9899−(−4.2976)
Para k1→ 𝑘1 = → k1=0.0307
10
−4.2976−(−4.6132)
Para k2→ 𝑘2 = → k2=0.0315
10
−4.6132−(−4.9185)
Para k3→ 𝑘3 = → k3=0.0305 kconstante cinética=0.0311
10
−4.9185−(−5.2287)
Para k4→ 𝑘4 = → k4=0.0310
10
−5.2287−(−5.5442)
Para k5→ 𝑘5 = → k5=0.0315
10
ECUACION CINETICA: V = k[COOH-CHBr-CHBr-COOH]
V = 0.0311[COOH-CHBr-CHBr-COOH]
5. En la descomposición del NO2 a 383°C se encontraron los siguientes
datos:
Tiempo en s 0 5 10 15
[NO2] 0,10 0,017 0,009 0,0062
Demuestre que la descomposición del NO2 obedece a una reacción de
segundo orden.
Demostración Grafica:
Reacción de 2do orden
180 Tiempo [NO2]
161.2
160
0 0.10
140
5 0.017
111.1
10 0.009
120
15 0.0062
100
1/[NO2]
80
58.8 Tiempo 1/[NO2]
60
0 10
40
5 58.8
20 10
10 111.1
0
0 2 4 6 8 10 12 14 16 15 161.2
TIEMPO (S)
Demostración Numérica:
Relación de la concentración con el tiempo para segundo orden:
1 1
= 𝑘𝑡 +
[ ]𝑓 [ ]0
1 1
[ ]𝑓
−[ ]
0
Despejando k: 𝑘=
∆𝑡
58.8−10
Para k1→ 𝑘1 = 5
→ k1=9.76
111.1−58.8
Para k2→ 𝑘2 = → k2=10.46
5
161.2−111.1
Para k3→ 𝑘3 = → k3=10.02
5
Los valores de k no son constantes y tienen una pequeña diferencia se
demuestra que es de segundo orden.
Anda mungkin juga menyukai
- Cementacion Fiqui2Dokumen6 halamanCementacion Fiqui2JOAN RODOLFO PURIS CoNDORBelum ada peringkat
- Taller 2 Cinética QuímicaDokumen2 halamanTaller 2 Cinética QuímicaVicky RuBelum ada peringkat
- Tarea 4, Cinetica QG FinalDokumen14 halamanTarea 4, Cinetica QG FinalDaisy FuentesBelum ada peringkat
- Ejercicios - Tratamiento Termico de Alimentos (1) ImpDokumen27 halamanEjercicios - Tratamiento Termico de Alimentos (1) ImpRamiro LlaveBelum ada peringkat
- Practica No6Dokumen15 halamanPractica No6Karla Chavolla SalomonBelum ada peringkat
- Tarea Previa Al Examen DepartamentalDokumen8 halamanTarea Previa Al Examen DepartamentalGameplays Of Games PcBelum ada peringkat
- Modelación de la concentración de NO2 en función del tiempo siguiendo órdenes de reacción cero, primero y segundo para determinar el orden de la reacción químicaDokumen6 halamanModelación de la concentración de NO2 en función del tiempo siguiendo órdenes de reacción cero, primero y segundo para determinar el orden de la reacción químicaBrandon Octavio González HernándezBelum ada peringkat
- CQC Rep 5 PDFDokumen12 halamanCQC Rep 5 PDFAdrián León PachecoBelum ada peringkat
- Reporte 2. CInética de Saponificación Del Acetato de EtiloDokumen14 halamanReporte 2. CInética de Saponificación Del Acetato de EtiloLuis Ocampo ElizaldeBelum ada peringkat
- METODOSTAREADokumen4 halamanMETODOSTAREAReech Dirt EpBelum ada peringkat
- Ejercicios Vida de Anaquel AceleradaDokumen101 halamanEjercicios Vida de Anaquel AceleradaCrisBelum ada peringkat
- Tarea 5-Rodriguez Lopez Pedro ArturoDokumen13 halamanTarea 5-Rodriguez Lopez Pedro ArturoMafer Mabel GalarzaBelum ada peringkat
- Informe 2 Labo 3Dokumen7 halamanInforme 2 Labo 3Gustavo Balarezo InumaBelum ada peringkat
- Introducción a los reactores químicos: Orden de reacciones y constantes de velocidadDokumen10 halamanIntroducción a los reactores químicos: Orden de reacciones y constantes de velocidadNatalia GómezBelum ada peringkat
- Cinetica Ej.1Dokumen14 halamanCinetica Ej.1Ale FloresBelum ada peringkat
- Taller 1 - CINÉTICA QUÍMICA 2021Dokumen5 halamanTaller 1 - CINÉTICA QUÍMICA 2021Roberto Eduardo Quispe MamaniBelum ada peringkat
- Ejercicios-Biotecnologia 83 y 84Dokumen36 halamanEjercicios-Biotecnologia 83 y 84Jenny Daniela Cruz VelizBelum ada peringkat
- Cálculos Práctica 2Dokumen4 halamanCálculos Práctica 2Uriel de Jes�s Vel�zquez Hern�ndezBelum ada peringkat
- IR1 ADA3 Azcorra Martin SegoviaDokumen69 halamanIR1 ADA3 Azcorra Martin Segoviaalfredo azcorraBelum ada peringkat
- Calculos y Conclusiones I.3Dokumen4 halamanCalculos y Conclusiones I.3HELEN DAYANA ZERDA RODRIGUEZBelum ada peringkat
- Lab Fisica 2. Momento Inercia, Pendulo SimpleDokumen3 halamanLab Fisica 2. Momento Inercia, Pendulo SimpleFelix Alberto100% (1)
- Problemas Resueltos - CQ PDFDokumen7 halamanProblemas Resueltos - CQ PDFMicky MartinezBelum ada peringkat
- Tarea 1 Ing. de ReaccionesDokumen8 halamanTarea 1 Ing. de ReaccionesSalvador EspinozaBelum ada peringkat
- 2do Laboratorio de Física III de AnaDokumen12 halaman2do Laboratorio de Física III de AnaMari MaribelBelum ada peringkat
- Clase 2 - Tarea - Opu Ii - Meza Lujan Angie Saraith - Epia - Secc. ADokumen13 halamanClase 2 - Tarea - Opu Ii - Meza Lujan Angie Saraith - Epia - Secc. ADilan ValdiviaBelum ada peringkat
- Ventura Atalaya Juan CarlosDokumen46 halamanVentura Atalaya Juan CarlosJuan Carlos VenturaBelum ada peringkat
- Briseño-Andrade-Melisa-Tarea 9Dokumen7 halamanBriseño-Andrade-Melisa-Tarea 9melisa.09.16.01Belum ada peringkat
- Informe LixiviacionDokumen5 halamanInforme LixiviacionCHRISTIAN COLLAZOS PARDAVEBelum ada peringkat
- Examen ParcialDokumen5 halamanExamen Parcialrosa sofiaBelum ada peringkat
- Corrección de ejercicios de topografía UNPRG 2019Dokumen6 halamanCorrección de ejercicios de topografía UNPRG 2019Villalobos Villanueva50% (2)
- Laboratorio #1 - CineticaDokumen16 halamanLaboratorio #1 - CineticaPaul Vicente Candia TorresBelum ada peringkat
- Cinetica Quimica-1Dokumen13 halamanCinetica Quimica-1cocacolaaaaaaBelum ada peringkat
- Guia de Problemas de Introduccion Al Analisis de Datos de Velocidad-1Dokumen22 halamanGuia de Problemas de Introduccion Al Analisis de Datos de Velocidad-1rodry zuritaBelum ada peringkat
- Balance de Masa en Un ReactorDokumen9 halamanBalance de Masa en Un ReactorKenia VilchisBelum ada peringkat
- Efecto de La Temperatura Sobre La Rapidez de La Reacción.....Dokumen9 halamanEfecto de La Temperatura Sobre La Rapidez de La Reacción.....saul corona100% (1)
- Práctica 2 de Cinética QuímicaDokumen8 halamanPráctica 2 de Cinética QuímicaFrancisco Javier Cárdenas TorresBelum ada peringkat
- ZOA-enriquecimientoDokumen12 halamanZOA-enriquecimientoJose Daniel Ballestero MontielBelum ada peringkat
- FISICOQUIMICA Bedersini..Dokumen9 halamanFISICOQUIMICA Bedersini..BEDER LUNA BARRETOBelum ada peringkat
- AdsorcionDokumen9 halamanAdsorcionDiego RoqueBelum ada peringkat
- Grupo 6Dokumen39 halamanGrupo 6Marcos SamaniegoBelum ada peringkat
- Tarea 1 Jesus LopezDokumen6 halamanTarea 1 Jesus LopezJesus LopezBelum ada peringkat
- Tarea 1 Jesus LopezDokumen6 halamanTarea 1 Jesus LopezJesus LopezBelum ada peringkat
- Reporte N°3Dokumen3 halamanReporte N°3ANNY MARIAM MARCHAND ARNADOBelum ada peringkat
- Examen ResueltoDokumen3 halamanExamen ResueltoYordy QuecañoBelum ada peringkat
- Segundo Parcial-4Dokumen3 halamanSegundo Parcial-4luisBelum ada peringkat
- Tarea ReaccionesDokumen6 halamanTarea ReaccionesNaysha LicuonaBelum ada peringkat
- Tercer Tutorial - Grupo 5Dokumen12 halamanTercer Tutorial - Grupo 5Amed Enrique Ortega MonteroBelum ada peringkat
- Práctica CalificadacineticaDokumen2 halamanPráctica CalificadacineticaLuis APBelum ada peringkat
- Tipo C 2Dokumen19 halamanTipo C 2Haggy QuiñonesBelum ada peringkat
- Cinetica QuimicaDokumen13 halamanCinetica QuimicacocacolaaaaaaBelum ada peringkat
- Problemario 2Dokumen8 halamanProblemario 2XgrtBelum ada peringkat
- Cinética de LixiviaciónDokumen10 halamanCinética de LixiviaciónKen Barrios MontalvoBelum ada peringkat
- 3 Medio AgostoDokumen2 halaman3 Medio Agosto5211241Belum ada peringkat
- Pendulo Fisico InformeDokumen9 halamanPendulo Fisico Informecristian garciaBelum ada peringkat
- Serie 3 Cinetica QuímicaDokumen5 halamanSerie 3 Cinetica QuímicaRAFAEL PATLANI MARTINEZBelum ada peringkat
- Tarea 6-Rodriguez Lopez Pedro ArturoDokumen8 halamanTarea 6-Rodriguez Lopez Pedro ArturoMafer Mabel GalarzaBelum ada peringkat
- Ejercicio de SismoDokumen9 halamanEjercicio de SismoRamós Girón CarlosBelum ada peringkat
- Tarea - 3 CinéticaDokumen11 halamanTarea - 3 CinéticaShyrma Sanmay Cerda OntanedaBelum ada peringkat
- calculos practica 4Dokumen4 halamancalculos practica 4Leslie ObregónBelum ada peringkat
- Métodos Matriciales para ingenieros con MATLABDari EverandMétodos Matriciales para ingenieros con MATLABPenilaian: 5 dari 5 bintang5/5 (1)
- Fenómenos Ópticos - EXPO-A. InstruDokumen14 halamanFenómenos Ópticos - EXPO-A. InstruEduardo SalinasBelum ada peringkat
- Exposicion Derecho LaboralDokumen16 halamanExposicion Derecho LaboralEduardo SalinasBelum ada peringkat
- CC. SS. 2023 Tema 2Dokumen19 halamanCC. SS. 2023 Tema 2Eduardo SalinasBelum ada peringkat
- Evolución Mipyme formales Perú 2012-2017Dokumen15 halamanEvolución Mipyme formales Perú 2012-2017Judith CastilloBelum ada peringkat
- Rossana MostajoDokumen58 halamanRossana MostajoVirna JessicaBelum ada peringkat
- Tema 1 Contaminación GaseosaDokumen10 halamanTema 1 Contaminación GaseosaEduardo SalinasBelum ada peringkat
- Revisión Histórica Del Concepto de InteligenciaDokumen21 halamanRevisión Histórica Del Concepto de InteligenciaAnonymous 5SUTrLIKRoBelum ada peringkat
- Acido Sulfurico FinalDokumen16 halamanAcido Sulfurico FinalEduardo SalinasBelum ada peringkat
- Objetivos. AletasDokumen4 halamanObjetivos. AletasEduardo SalinasBelum ada peringkat
- Literatura PeruanaDokumen9 halamanLiteratura PeruanaEduardo SalinasBelum ada peringkat
- Tema 1 Contaminación SólidaDokumen46 halamanTema 1 Contaminación SólidaEduardo SalinasBelum ada peringkat
- Hostigamiento LaboralDokumen32 halamanHostigamiento LaboralEduardo SalinasBelum ada peringkat
- Devanlay - LacosteDokumen11 halamanDevanlay - LacosteEduardo SalinasBelum ada peringkat
- Tema 1 Contaminación RadiaciónDokumen9 halamanTema 1 Contaminación RadiaciónEduardo SalinasBelum ada peringkat
- 1,1 Dietil 3 Benzoiltiourea (Autoguardado) 123Dokumen11 halaman1,1 Dietil 3 Benzoiltiourea (Autoguardado) 123Eduardo Salinas0% (1)
- Grafico Del Crecimiento de Población LogísticoDokumen1 halamanGrafico Del Crecimiento de Población LogísticoEduardo SalinasBelum ada peringkat
- Estrategias de La Bohemia y El Dandismo en ValdeloamrDokumen382 halamanEstrategias de La Bohemia y El Dandismo en ValdeloamrEduardo SalinasBelum ada peringkat
- Instrumentos de Política MonetariaDokumen4 halamanInstrumentos de Política MonetariaEduardo SalinasBelum ada peringkat
- BOLETIN N05 Feminicidio 2017 v.3Dokumen30 halamanBOLETIN N05 Feminicidio 2017 v.3José Manuel SalasBelum ada peringkat
- Idcp Resumen - Ejecutivo PDFDokumen96 halamanIdcp Resumen - Ejecutivo PDFEduardo SalinasBelum ada peringkat
- Propuesta Silabo Unmsm 18Dokumen3 halamanPropuesta Silabo Unmsm 18Eduardo SalinasBelum ada peringkat
- Matriz de AlternativasDokumen3 halamanMatriz de AlternativasEduardo SalinasBelum ada peringkat
- Plan de Gobierno de César AcuñaDokumen97 halamanPlan de Gobierno de César Acuñafnmp11Belum ada peringkat
- Minsa Encuesta Violencia Contra La MujerDokumen38 halamanMinsa Encuesta Violencia Contra La MujerJahnavi ObandoBelum ada peringkat
- Guía periodística violencia mujeresDokumen26 halamanGuía periodística violencia mujeresEduardo SalinasBelum ada peringkat
- Informe Estadistico 01 PNCVFS UGIGCDokumen6 halamanInforme Estadistico 01 PNCVFS UGIGCEduardo SalinasBelum ada peringkat
- Violencia en TVDokumen133 halamanViolencia en TVEduardo SalinasBelum ada peringkat
- Mof Facultad de Ciencias Sociales PDFDokumen87 halamanMof Facultad de Ciencias Sociales PDFEduardo SalinasBelum ada peringkat
- Estatuto UNMSM 2016 PDFDokumen90 halamanEstatuto UNMSM 2016 PDFEduardo SalinasBelum ada peringkat
- Estudios culturales urbanos: una perspectiva interdisciplinarDokumen10 halamanEstudios culturales urbanos: una perspectiva interdisciplinarEduardo SalinasBelum ada peringkat
- Medios 3DDokumen15 halamanMedios 3DDayana PardoBelum ada peringkat
- InformaticoDokumen11 halamanInformaticoHector Israel CC50% (2)
- F. Tecnica ImperioDokumen2 halamanF. Tecnica ImperioYilver Bello GarzonBelum ada peringkat
- Proyecto InfoDokumen2 halamanProyecto InfoGERARDO EMIR VALDEZ CABRERABelum ada peringkat
- Puentes - Obras de ArteDokumen10 halamanPuentes - Obras de ArteDiego Torres LeonardoBelum ada peringkat
- Banco de Credito RetencionDokumen1 halamanBanco de Credito RetencionsuavenitaBelum ada peringkat
- Manual Educacion FinancieraDokumen116 halamanManual Educacion FinancieraMarcos Besteiro López100% (16)
- Tecnologías Emergentes en El Procesamiento de AlimentosDokumen29 halamanTecnologías Emergentes en El Procesamiento de AlimentosElfer Orlando Obispo GavinoBelum ada peringkat
- Plan 25Dokumen7 halamanPlan 25merly lucilaBelum ada peringkat
- 2018 AwsDokumen1 halaman2018 AwsDiego EliasBelum ada peringkat
- Equilibrio químico CoCl2-H2ODokumen4 halamanEquilibrio químico CoCl2-H2OColores FalangeBelum ada peringkat
- Ejercicios de MatlabDokumen6 halamanEjercicios de MatlabDali Ripa PielagoBelum ada peringkat
- Marco Teorico 12345Dokumen6 halamanMarco Teorico 12345gaby2018Belum ada peringkat
- JonathanPrieto Act2-Evidencia2Dokumen4 halamanJonathanPrieto Act2-Evidencia2Jonathan Prieto100% (2)
- Inmovilización A Motos Se Les Acabó La Mina de o 2Dokumen1 halamanInmovilización A Motos Se Les Acabó La Mina de o 2candelaria693Belum ada peringkat
- AcetonitriloDokumen9 halamanAcetonitriloarmando jeffryBelum ada peringkat
- Clase 4 TEORÍADokumen4 halamanClase 4 TEORÍARos BarbozaBelum ada peringkat
- Ejercicios Sobre Magnitudes ProporcionalesDokumen3 halamanEjercicios Sobre Magnitudes ProporcionalesJesus Peña LopezBelum ada peringkat
- Juegos Matemáticos para Educación InfantilDokumen13 halamanJuegos Matemáticos para Educación InfantilMiguel Santos100% (2)
- Sesión - Comunicación-12 - AbrilDokumen5 halamanSesión - Comunicación-12 - AbrilDina Padilla SotoBelum ada peringkat
- Efecto CoronaDokumen57 halamanEfecto CoronaIvan Andres Moreno SuarezBelum ada peringkat
- Circuitos ElectricosDokumen19 halamanCircuitos ElectricosAndres DamianBelum ada peringkat
- Informe de CervezaDokumen17 halamanInforme de CervezaLucho LuisBelum ada peringkat
- Anexo 1 Formulario de Reporte de NO ConformidadDokumen1 halamanAnexo 1 Formulario de Reporte de NO ConformidadGerardo Valencia100% (1)
- Planeacion 08 de Agosto MartesDokumen7 halamanPlaneacion 08 de Agosto Martesyudis kodinaBelum ada peringkat
- Tarea Sem 15 Salazar Flores DenilsonDokumen8 halamanTarea Sem 15 Salazar Flores Denilsondenilson.salazarBelum ada peringkat
- Bases Conductivas para Implementar Un Sistema de Control EficazDokumen7 halamanBases Conductivas para Implementar Un Sistema de Control EficazSteven LopezBelum ada peringkat
- AritméticaDokumen26 halamanAritméticaluis palacios manriqueBelum ada peringkat
- 50.1 Componentes Del Costo de Los Inventarios (NIC 2) DUO PRACTICUMDokumen88 halaman50.1 Componentes Del Costo de Los Inventarios (NIC 2) DUO PRACTICUMEymiCristinaBelum ada peringkat
- Diseño de sistemas de transporte para maximizar tráfico y minimizar costosDokumen55 halamanDiseño de sistemas de transporte para maximizar tráfico y minimizar costosKevin Aldair Castillo IturrietaBelum ada peringkat