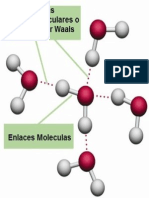
Fuerzas de Van Der Waals
Diunggah oleh
NycSandovalCandiaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Fuerzas de Van Der Waals
Diunggah oleh
NycSandovalCandiaHak Cipta:
Format Tersedia
Fuerzas de Van der Waals
Las fuerzas de atracción o repulsión entre entidades moleculares (o entre grupos dentro de
la misma entidad molecular) diferentes de aquellas que son debidas a la formación de
enlace o la interacción electroestática de iones o grupos iónicos unos con otros o con
moléculas neutras.
Estudiemos los tipos principales:
Fuerza entre dipolos permanentes
Si la molécula de la sustancia contiene un dipolo permanente (debido a la polaridad de uno
o más de sus enlaces covalentes), entonces podemos fácilmente ver como esas moléculas
se atraen unas a otras: el lado positivo del dipolo de una molécula atrae al lado negativo
del dipolo de la otra molécula. Esta fuerza existe, por tanto, entre moléculas polares (μ total ≠
0).
Fuerzas de London o fuerzas de dispersión:
Es cuando las moléculas no contienen dipolos (son apolares). Entonces, como es que
logran atraerse? Pensemos en una molécula como una entidad no estática, pero
conteniendo electrones en constante movimiento; es razonable pensar que en un
determinado momento la distribución en esa molécula puede no ser perfectamente
simétrica y aparecen entonces pequeños dipolos instantáneos en este momento.
Esos dipolos desaparecerán en muy poco tiempo, pudiendo llevar a una molécula neutra o
a otros dipolos, inclusive contrarios, pero en un corto espacio de tiempo en que ellos existen
pueden inducir a la formación de dipolos contrarios en la molécula vecina, llevando a las
dos a atraerse mutuamente.
Ejemplo:
Enlaces de Hidrógeno o Puentes de Hidrógeno:
El átomo de hidrógeno tiene propiedades especiales por ser un átomo muy pequeño, sin
electrones en el interior: por dentro de la capa de valencia existen apenas el núcleo del
átomo y el protón.
Una de las propiedades que solo el átomo de hidrógeno presenta es la capacidad de ejercer
una fuerza de atracción intermolecular llamada enlace de hidrógeno, o puente de hidrógeno.
El enlace de hidrógeno solo puede ocurrir cuando el hidrógeno estuviese enlazado a un
átomo pequeño y muy electronegativo: apenas F, O, N satisface las condiciones
necesarias.
Cuando el hidrógeno esta enlazado a un átomo muy electronegativo, la densidad
electrónica en torno del protón se establece bastante baja, esta parte de la molécula es
entonces fuertemente atraída por los pares de electrones del F, O, N de otra molécula,
estableciendo el enlace de hidrógeno.
Ejemplo:
Los enlaces de hidrógeno representan un importante papel tanto en las propiedades
especiales del agua como en moléculas de extrema importancia para los seres vivos: ellas
determinan la forma de las proteínas y consitutyen la fuerza que une los hélices del ADN.
Anda mungkin juga menyukai
- Fuerzas intermoleculares: dipolo-dipolo, ion-dipolo, London y Van der WaalsDokumen7 halamanFuerzas intermoleculares: dipolo-dipolo, ion-dipolo, London y Van der WaalsLuz Marina Peña MorajxkfjjkkzkfBelum ada peringkat
- BrayanDokumen12 halamanBrayanBrayan Ayna RamosBelum ada peringkat
- Fuerzas IntermolecularesDokumen12 halamanFuerzas IntermolecularesRenzoBelum ada peringkat
- Enlace MetálicoDokumen3 halamanEnlace MetálicoJorge LeivaBelum ada peringkat
- Monografia de QuimicaDokumen8 halamanMonografia de QuimicaJoa King Chaupis AdrianoBelum ada peringkat
- Fuerzas intermolecularesDokumen11 halamanFuerzas intermolecularesirisevangelinajerezBelum ada peringkat
- Fuerzas de Van Der WaalsDokumen4 halamanFuerzas de Van Der WaalsSailly Johana Saurith CandelarioBelum ada peringkat
- Fuerzas IntermolecularesDokumen4 halamanFuerzas IntermolecularesMarcos Muñoz CardonaBelum ada peringkat
- AntecedentesDokumen17 halamanAntecedentesJosafat VidalBelum ada peringkat
- Enlaces QuímicosDokumen46 halamanEnlaces QuímicosCindy GutiérrezBelum ada peringkat
- Fuerzas Intermoleculares: Tipos y EjemplosDokumen9 halamanFuerzas Intermoleculares: Tipos y EjemploslauraosoriocBelum ada peringkat
- Fuerzas IntermolecularesDokumen4 halamanFuerzas IntermolecularesNicolas Meza OrtegaBelum ada peringkat
- Fuerzas de Atracción de Sólidos y LíquidosDokumen8 halamanFuerzas de Atracción de Sólidos y LíquidosJiancarlo O. HidalgoBelum ada peringkat
- Enlacescovalentepolar 141213222144 Conversion Gate02Dokumen10 halamanEnlacescovalentepolar 141213222144 Conversion Gate02Dhalma BorborBelum ada peringkat
- Fuerzas IntermolecularesDokumen6 halamanFuerzas IntermolecularesVickyBelum ada peringkat
- Fuerzas de Van Der WaalsDokumen15 halamanFuerzas de Van Der WaalsRoberto ReyesBelum ada peringkat
- Teorias Valencias Fuerzas Intermoleculares.Dokumen10 halamanTeorias Valencias Fuerzas Intermoleculares.Shirley BustamanteBelum ada peringkat
- Contenido para El DocenteDokumen46 halamanContenido para El DocenteJosi Rivera TorresBelum ada peringkat
- UNIONESDokumen3 halamanUNIONESJazmin VelizBelum ada peringkat
- Fuerzas IntermolecularesDokumen7 halamanFuerzas IntermolecularesecmBelum ada peringkat
- Química-Fuerzas IntermolecularesDokumen3 halamanQuímica-Fuerzas IntermoleculareskatihuscatoalaBelum ada peringkat
- Fuerzas Inter e IntramolecularesDokumen5 halamanFuerzas Inter e IntramolecularesJean ManuelBelum ada peringkat
- Fuerzas Intermoleculares Dipolo - DipoloDokumen2 halamanFuerzas Intermoleculares Dipolo - DipoloLaura BazánBelum ada peringkat
- Colegio Militarizado Legión de Honor BachilleratoDokumen14 halamanColegio Militarizado Legión de Honor BachilleratoJuan David MelendezBelum ada peringkat
- Seminario #3Dokumen13 halamanSeminario #3Kristell QuezadaBelum ada peringkat
- Enlaces QuimicosDokumen10 halamanEnlaces QuimicosAndres RangelBelum ada peringkat
- Tipos de enlaces químicos: covalente, iónico, metálico y másDokumen15 halamanTipos de enlaces químicos: covalente, iónico, metálico y másMartha Alex ReyesBelum ada peringkat
- Fuerzas de Van Der WaalsDokumen7 halamanFuerzas de Van Der WaalsareacienciasBelum ada peringkat
- Fuerzas IntermolecularesDokumen13 halamanFuerzas Intermoleculareserick joelBelum ada peringkat
- 2° Taller de Química OrgánicaDokumen4 halaman2° Taller de Química OrgánicaAldair ARBelum ada peringkat
- Muestra Tema 43Dokumen8 halamanMuestra Tema 43LngBelum ada peringkat
- Tipos de FuerzasDokumen2 halamanTipos de FuerzasMex MondragonBelum ada peringkat
- Fuerzas de Van Der Waals PDFDokumen3 halamanFuerzas de Van Der Waals PDFYesica CascoBelum ada peringkat
- Numero 2Dokumen4 halamanNumero 2skyfire aaBelum ada peringkat
- Practica Laboratorio 4 - Villafuerte Duran Brigith ClarisaDokumen14 halamanPractica Laboratorio 4 - Villafuerte Duran Brigith ClarisaClarisa Villafuerte DuranBelum ada peringkat
- Fuerzas de Van der Waals y puentes de hidrógenoDokumen2 halamanFuerzas de Van der Waals y puentes de hidrógenoJosé Daniel García ZalapaBelum ada peringkat
- Fuerzas intermoleculares: Van der Waals, puentes de hidrógeno y dipolo-dipoloDokumen4 halamanFuerzas intermoleculares: Van der Waals, puentes de hidrógeno y dipolo-dipoloMARIA ELDA PAZ TOLEDOBelum ada peringkat
- Enlace Van Der WaalsDokumen2 halamanEnlace Van Der Waalsalejandro romero capuñayBelum ada peringkat
- Enlaces químicos y fuerzas intermolecularesDokumen28 halamanEnlaces químicos y fuerzas intermolecularesEDUCAMOS BarillasBelum ada peringkat
- Teoría Lewis, Ley de Octeto y OxidaciónDokumen9 halamanTeoría Lewis, Ley de Octeto y OxidaciónMARIA MARCELA NOELLER SANDOVAL100% (1)
- Quimica TareaDokumen2 halamanQuimica TareaAbraham QuinteroBelum ada peringkat
- Trabajouu Quimica 1Dokumen6 halamanTrabajouu Quimica 1Juan Camilo Cardenas DuranBelum ada peringkat
- Prop FisicasDokumen11 halamanProp Fisicasnbbq4trtzgBelum ada peringkat
- Trabajo QuimicaDokumen4 halamanTrabajo QuimicaVicente AcostaBelum ada peringkat
- Enlaces químicosDokumen9 halamanEnlaces químicosPablo Martin OrozcoBelum ada peringkat
- 4 Fuerzas IntermolecularesDokumen2 halaman4 Fuerzas IntermolecularesCami Arce GariBelum ada peringkat
- Que Es Gen 2 Elementos BioquimicoDokumen137 halamanQue Es Gen 2 Elementos BioquimicoGisel GomezBelum ada peringkat
- Fuerzas IntermolecularesDokumen7 halamanFuerzas IntermolecularesCarmeny NavaBelum ada peringkat
- Química General UdeSDokumen10 halamanQuímica General UdeSAndrea ZuñigaBelum ada peringkat
- Fuerzas IntermolecularesDokumen4 halamanFuerzas IntermolecularesAgustina RiveroBelum ada peringkat
- Polaridad, Simetría, Propiedades Físicas y Química de Los Compuestos OrgánicosDokumen10 halamanPolaridad, Simetría, Propiedades Físicas y Química de Los Compuestos OrgánicosEliezer TorresBelum ada peringkat
- En LacesDokumen40 halamanEn LacesFernanda Ruiz Razo100% (1)
- Fuerzas intermolecularesDokumen1 halamanFuerzas intermolecularesMangleBelum ada peringkat
- Clasificación y tipos de enlaces químicosDokumen12 halamanClasificación y tipos de enlaces químicosArturo AlvaradoBelum ada peringkat
- Tipos de EnlaceDokumen3 halamanTipos de EnlaceIrving CuadraBelum ada peringkat
- Fuerzas Intermolecularez 2018Dokumen3 halamanFuerzas Intermolecularez 2018Emilse GonzalezBelum ada peringkat
- T8 Cristian Uriel Cruz CarbarinDokumen6 halamanT8 Cristian Uriel Cruz CarbarinCristian Uriel Cruz CarbarinBelum ada peringkat
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDari EverandTeoría electromagnética para estudiantes de ingeniería: Notas de clasePenilaian: 4.5 dari 5 bintang4.5/5 (7)
- Farmacos - DopaminergicosDokumen6 halamanFarmacos - DopaminergicosNycSandovalCandiaBelum ada peringkat
- Cirugía IIDokumen13 halamanCirugía IINycSandovalCandiaBelum ada peringkat
- Clave RojaDokumen21 halamanClave RojaNycSandovalCandiaBelum ada peringkat
- Complicaciones de quimioterapia y radioterapia en cáncer: una breve introducciónDokumen19 halamanComplicaciones de quimioterapia y radioterapia en cáncer: una breve introducciónNycSandovalCandiaBelum ada peringkat
- Cirugía IIDokumen13 halamanCirugía IINycSandovalCandiaBelum ada peringkat
- Proyecto de Investigación IIIDokumen14 halamanProyecto de Investigación IIINycSandovalCandiaBelum ada peringkat
- FISIOLOGÍADokumen16 halamanFISIOLOGÍANycSandovalCandiaBelum ada peringkat
- PostTEST - Farmacos Artrtis ReumatoideDokumen2 halamanPostTEST - Farmacos Artrtis ReumatoideNycSandovalCandiaBelum ada peringkat
- Proyecto de Investigación IIIDokumen14 halamanProyecto de Investigación IIINycSandovalCandiaBelum ada peringkat
- FISIOLOGÍADokumen16 halamanFISIOLOGÍANycSandovalCandiaBelum ada peringkat
- Administración en Salud IDokumen8 halamanAdministración en Salud INycSandovalCandiaBelum ada peringkat
- TESISDokumen11 halamanTESISNycSandovalCandiaBelum ada peringkat
- BIOQUÍMICADokumen12 halamanBIOQUÍMICANycSandovalCandiaBelum ada peringkat
- Administración en Salud IDokumen8 halamanAdministración en Salud INycSandovalCandiaBelum ada peringkat
- BIOQUÍMICADokumen12 halamanBIOQUÍMICANycSandovalCandiaBelum ada peringkat
- TESISDokumen11 halamanTESISNycSandovalCandiaBelum ada peringkat
- Obstetric I ADokumen13 halamanObstetric I ANycSandovalCandiaBelum ada peringkat
- Medicina IIIDokumen16 halamanMedicina IIINycSandovalCandiaBelum ada peringkat
- Pediatria IDokumen14 halamanPediatria INycSandovalCandiaBelum ada peringkat
- Medicina LegalDokumen8 halamanMedicina LegalNycSandovalCandiaBelum ada peringkat
- Pediatria IDokumen14 halamanPediatria INycSandovalCandiaBelum ada peringkat
- Medicina IIIDokumen16 halamanMedicina IIINycSandovalCandiaBelum ada peringkat
- Medicina LegalDokumen8 halamanMedicina LegalNycSandovalCandiaBelum ada peringkat
- Obstetric I ADokumen13 halamanObstetric I ANycSandovalCandiaBelum ada peringkat
- Proyecto de Investigacion IIDokumen6 halamanProyecto de Investigacion IIpaolo111Belum ada peringkat
- Medicina Familiar y Comunitaria IIIDokumen8 halamanMedicina Familiar y Comunitaria IIIfsilvaf93Belum ada peringkat
- Genética IIDokumen18 halamanGenética IIfsilvaf93Belum ada peringkat
- Proyecto de Investigacion IIDokumen6 halamanProyecto de Investigacion IIpaolo111Belum ada peringkat
- Embriología IIDokumen11 halamanEmbriología IINycSandovalCandiaBelum ada peringkat
- Embriología IIDokumen11 halamanEmbriología IINycSandovalCandiaBelum ada peringkat
- Taller 1Dokumen38 halamanTaller 1Víctor Manuel Patiño Cañas83% (12)
- Cálculo de Pérdidas Con Uso de PiezómetrosDokumen22 halamanCálculo de Pérdidas Con Uso de PiezómetrosRodrigo Oswaldo Martinez Almonacid71% (7)
- MTDokumen192 halamanMTjoseBelum ada peringkat
- Booster 88323639Dokumen1 halamanBooster 88323639luis armando100% (1)
- Cuadernillo de DatosDokumen18 halamanCuadernillo de DatosMaría José López ThienelBelum ada peringkat
- NORMA NTE INEN 2221 Paneles de Acero Proyecto Actualizacion - 30 de JunioDokumen18 halamanNORMA NTE INEN 2221 Paneles de Acero Proyecto Actualizacion - 30 de JunioWilinton OrtizBelum ada peringkat
- 13.1 Turbina de VaporDokumen3 halaman13.1 Turbina de VaporLuis Enrique Corchado RamosBelum ada peringkat
- Trabajo de Mecánica de Fluidos. 2017-I PDFDokumen7 halamanTrabajo de Mecánica de Fluidos. 2017-I PDFJoseBelum ada peringkat
- Geomalla biaxial P-BX11 y P-BX12 para refuerzo de suelosDokumen2 halamanGeomalla biaxial P-BX11 y P-BX12 para refuerzo de suelosanelka30000% (1)
- Puente Trasero de La TransmisionDokumen4 halamanPuente Trasero de La TransmisionElvis SaBelum ada peringkat
- Taller %0Dokumen6 halamanTaller %0ArmusickVentasBogBelum ada peringkat
- LAB 3 Fenol AguaDokumen2 halamanLAB 3 Fenol AguaSebastián MachucaBelum ada peringkat
- Extraccion Con SolventesDokumen9 halamanExtraccion Con SolventesNitgma DcBelum ada peringkat
- Periodic - Table - Large Es Updated 2018Dokumen1 halamanPeriodic - Table - Large Es Updated 2018JAIRO ORLANDO PEÑARANDA GUZMANBelum ada peringkat
- Tricrómica de PollackDokumen3 halamanTricrómica de Pollackalejandro perez sanchezBelum ada peringkat
- Ley de Ohm en Circuitos RLC e Importancia Del Algebra FasorialDokumen3 halamanLey de Ohm en Circuitos RLC e Importancia Del Algebra FasorialRodrigo RivasBelum ada peringkat
- Clase 3 - Iei - II Parcial - Canalizaciones y Cajas de RegistroDokumen24 halamanClase 3 - Iei - II Parcial - Canalizaciones y Cajas de RegistroIsaac TerceroBelum ada peringkat
- PDFDokumen602 halamanPDFjamara7475% (8)
- Manual de Instrucciones Digital Medidor de Resistencia de Puesta A Tierra (ESP)Dokumen7 halamanManual de Instrucciones Digital Medidor de Resistencia de Puesta A Tierra (ESP)cesarBelum ada peringkat
- Guia de Clase 1Dokumen5 halamanGuia de Clase 1ManuelAlvaradoAlvaBelum ada peringkat
- Acustica - Di MarcoDokumen498 halamanAcustica - Di MarcoAlekos Dat100% (2)
- Sierra CaladoraDokumen10 halamanSierra CaladoraRowina Wamani100% (1)
- Clase de HidrostaticaDokumen35 halamanClase de HidrostaticaBryant RousBelum ada peringkat
- Tesis Master Cristina Ubeda BernabeDokumen68 halamanTesis Master Cristina Ubeda BernabeRoger Chira SedanoBelum ada peringkat
- Satucesa Big BagsDokumen16 halamanSatucesa Big BagsDavid Fernando Tirado Ariza100% (1)
- TALLERDokumen1 halamanTALLERdayanna celisBelum ada peringkat
- Columnas en ingeniería civilDokumen17 halamanColumnas en ingeniería civilColdplay Izquierdo VargasBelum ada peringkat
- Quiz 1Dokumen9 halamanQuiz 1PAULA SANCHEZ DIAZBelum ada peringkat
- Cmb-8000 p5126 ManualDokumen147 halamanCmb-8000 p5126 ManualJonathan Jara RiquelmeBelum ada peringkat