Quimi
Diunggah oleh
JorgeJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Quimi
Diunggah oleh
JorgeHak Cipta:
Format Tersedia
Equilibrio químico
1 de Octubre de 2010 Publicado por Mónica González
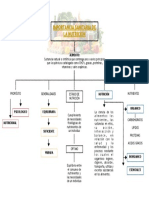
Se le llama equilibrio químico al estado de un sistema donde no se observan cambios en la
concentración de reactivos o productos, al transcurrir el tiempo, éstas se mantienen
constantes. Esto se da en reacciones reversibles, donde la velocidad de la reacción de
reactivos a productos es la misma que de productos a reactivos.
Un equilibrio químico puede ser representado de la siguiente manera:
Siendo A y B, los reactivos, S y T los productos, y las letras griegas delante de cada uno,
sus respectivos coeficientes estequiométricos.
La constante del equilibrio K puede definirse como siendo la relación entre el producto
entre las concentraciones de los productos (en el equilibrio) elevadas a sus
correspondientes coeficientes estequiométricos, y el producto de las concentraciones de
los reactivos (en el equilibrio) elevadas en sus correspondientes coeficientes
estequiométricos. Esta constante sufre variaciones con la temperatura.
Existen varios factores que pueden alterar el estado de equilibrio químico, los más
importantes son la temperatura, la presión y la concentración de los reactivos o productos.
La manera en que estos factores pueden alterar el equilibro químico se pude predecir
cualitativamente según el principio de Le Chatelier, que establece lo siguiente: si se modifica
alguno de los factores capaces de alterar el equilibrio químico (temperatura, presión,
concentración) el sistema se desplazará de manera de contrarrestar la modificación.
Efecto de la temperatura. Un aumento de la temperatura causará un desplazamiento del
equilibrio en el sentido de la reacción que absorba calor, es decir, en el sentido endotérmico
de la reacción. Por el contrario, una disminución en la temperatura causará un
desplazamiento en el sentido exotérmico de la reacción.
Efecto de la presión: Si aumenta la presión, el equilibrio se desplazará hacia el lado de la
reacción donde haya menor número de moles gaseosos, contrarrestando de esta manera la
disminución de volumen. Si la presión disminuye, ocurrirá lo contrario.
Efecto de la concentración: El aumento de la concentración de los reactivos causará un
desplazamiento del equilibrio hacia la formación de productos. Un aumento en la
concentración de productos determinará un desplazamiento del equilibrio hacia la formación
de reactivos. La disminución en la concentración de reactivos o productos causa un
desplazamiento hacia la formación de mayor cantidad de reactivos o productos,
respectivamente.
A continuación, tenemos un ejemplo concreto de equilibrio químico, el ácido acético disuelto
en agua y la formación de iones acetato e hidronio:
Donde la constante de equilibrio estaría dada por la siguiente fórmula:
J.W. Gibbs sugirió en el año1873 que se alcanzaría el estado de equilibrio químico cuando
la energía libre de Gibbs se encuentra en su valor mínimo, siempre y cuando la presión sea
constante. Si la mezcla de reactivos y productos no están en equilibrio, el exceso de energía
de Gibbs hace que la reacción se desplace hasta lograr un equilibrio. La constante de
equilibrio se puede relacionar con el cambio de energía libre de Gibbs mediante la siguiente
ecuación:
Donde R representa la constante universal de los gases, y T la temperatura en grados
Kelvin.
https://quimica.laguia2000.com/reacciones-quimicas/equilibrio-quimico
http://rabida.uhu.es/dspace/handl
En el sistema Ag-Fe-S las relaciones se determinaron de 700 a 150 ° C mediante
experimentos de extinción con el uso de tubos de sílice sellados y vacíos como
recipientes de reacción; Estos datos luego se usaron para interpretar varios aspectos de
las ocurrencias naturales de minerales de Ag-Fe (por ejemplo, "pirita argentífera"). Los
conjuntos Ag 2 S + Fe 1- xS y Ag 2 S + FeS 2 se estabilizan, con temperatura decreciente, a
622 ± 2 ° y 607 ± 2 ° C, respectivamente; sus establecimientos implican condiciones
ternarias invariables. Las tres fases condensadas Ag 2 S + Fe 1- x S + FeS 2 se estabilizan
juntas a 532 ± 2 ° C a través de una reacción eutéctica terciaria cerca de Ag 2S en
composición. Una reacción invariante a 248 ± 8 ° C da como resultado la formación
del par Ag + FeS 2 del conjunto Ag 2 S + Fe 7 S 8 , que es estable a temperaturas más
altas. Las asociaciones de plata nativa y pirita se encuentran en ciertos depósitos de
sulfuros masivos, mientras que la coexistencia natural de argentita y pirrotita no ha sido
documentada. Los experimentos demuestran la viabilidad del reequilibrio retrógrado en
los minerales para producir el par de plata + pirita de argentita + pirrotita. Menos de
0.05 y 0.1 at.% Ag son solubles en FeS 2 y Fe 1 x S, respectivamente, a 600 ° C y menos
de 0.8 at.% Fe en Ag 2S a 500ºC. La plata no afecta de forma apreciable
los valores d 10.2 de Fe 1- x S o la dimensión de celda de FeS 2 ( a 25 ° C = 5.4175 ± 0.0001
Å). Este estudio también demuestra que a bajas temperaturas, los datos de fugacidad
binaria son aplicables a conjuntos ternarios del sistema Ag-Fe-S debido a estas
solubilidades muy limitadas. La presencia de Fe Reduce la fcc ⇆ bcc temperatura de
inversión de Ag 2 S más de 50 ° C; la cantidad exacta de descenso depende de las fases
asociadas de Ag-Fe-S. El bcc⇆ mono. la temperatura de inversión, sin embargo, no se
ve mensurablemente afectada. No se encontraron fases sólidas por encima de 150ºC. El
calentamiento de muestras minerales de starbergita y argentopirita (ambos AgFe 2 S 3 )
muestra inestabilidad a 152 ° C (por ejemplo, degradación parcial de la estrella de mar
en 405 días); los estudios de tasas muestran que un aumento de 10 ° C en
aproximadamente un aumento de 5 veces en la tasa de descomposición.
Palabras clave
Ensamblaje mineral de Pirita DepósitoEutéctico de Sulfuro Masivo Depósito de
Sulfuro
Estas palabras clave fueron agregadas por máquina y no por los autores. Este
proceso es experimental y las palabras clave pueden actualizarse a medida que
mejore el algoritmo de aprendizaje.
resumen
Para la interpretación de minerales naturales de Ag-Fe-S (por ejemplo, pirita
que contiene plata), las relaciones de fase en el sistema Ag-Fe-S se investigan
mediante experimentos de "inactivación" a temperaturas de 700 ° a 150 °
C. Los tubos de vidrio de cuarzo evacuados y sellados sirven como recipientes
de reacción. Las asociaciones de fase Ag 2 S + Fe 1- x S (+ Argentit pyrrhotite) y
Ag 2 S + FeS 2 (Argentit + pirita) son estables con la disminución de
temperatura a 622 ± 2 ° C y 607 ± 2 ° C. Su formación es posible solo en
condiciones ternarias e invariables. A 532 ± 2 ° C, Ag 2 S + Fe 1- x S + FeS se
forman como fases estables mediante reacción eutéctica (cerca de
la composición de Ag 2 S)2 . A 248 ± 8 ° C, Ag 2 S + Fe 7 S 8 , que son estables
entre temperaturas de 292 ° C a 248 ° C, reaccionan a Ag + FeS 2 . La
paragénesis de la plata sólida + pirita ocurre en algunos depósitos de sulfuros
masivos; la paragénesis argentita + grava magnética, por otro lado, aún no se
ha observado. Los resultados experimentales previos sugieren un reequilibrio
retrógrado del equilibrio plata esterérica + pirita de grava magnética argentita
+. A 600 ° C, <0.05% y 0.1% Ag, respectivamente, son solubles en FeS 2 y
Fe 1 x S. A 500 ° C, <0,8% Fe se disuelve en Ag 2 S. Las constantes celulares de la
grava magnética (medida como d 10.2) y de pirita ( a 25 ° C = 5.4175 ± 0.0001 Å) no
son mensurablemente afectados por la absorción de Ag. Los resultados actuales
muestran que las fugacidades a bajas temperaturas a lo largo de las secciones
binarias Fe-S y Ag-S también se pueden aplicar al sistema ternario Ag-Fe-S,
debido a que solo existen miscibilidades muy limitadas. La presencia de Fe
disminuye la temperatura de inversión de fcc ⇆ bcc para Ag 2 S en más de 50 °
C. La temperatura de inversión exacta está determinada por las fases de Ag-Fe-
S asociadas. El BCC ⇆ mono. La temperatura de inversión, sin embargo, no se
ve mensurablemente afectada. Por encima de 150 ° C no se observan fases
ternarias. Sternbergita y Argentopirita (ambas AgFe2 S 3 minerales) se vuelven
inestables por encima de 152 ° C (por ejemplo, Sternbergita se descompone
parcialmente después de 405 días). Un aumento de la temperatura de
aproximadamente 10 ° C aumenta la tasa de descomposición en un factor de
cinco.
https://link.springer.com/article/10.1007%2FBF00207005
https://es.dreamstime.com/imág
https://prezi.com/m/6zfkdu-klw2i/distribucion-de-los-elementos-quimicos/
http://www.geovirtual2.cl/geologiageneral/ggcap04f.htm
Anda mungkin juga menyukai
- Huaura Curso Promoción 2019-II CrudoDokumen45 halamanHuaura Curso Promoción 2019-II CrudoJorgeBelum ada peringkat
- Isótopos de AzufreDokumen8 halamanIsótopos de AzufreJorgeBelum ada peringkat
- Manguitos FichaDokumen11 halamanManguitos FichaJorgeBelum ada peringkat
- 014 Silicatos IIDokumen64 halaman014 Silicatos IIFredy Solano PimentelBelum ada peringkat
- Conclusion EsDokumen1 halamanConclusion EsJorgeBelum ada peringkat
- Isótopos de AzufreDokumen8 halamanIsótopos de AzufreJorgeBelum ada peringkat
- TunelDokumen2 halamanTunelJorgeBelum ada peringkat
- Boletín 6-H Hidrogeología de La Cuenca Río Ilo-MoqueguaDokumen296 halamanBoletín 6-H Hidrogeología de La Cuenca Río Ilo-MoqueguaJhudit Eva CondoriBelum ada peringkat
- Rid 1173353033578 1884866542 14260Dokumen1 halamanRid 1173353033578 1884866542 14260Luis Vilchez CabreraBelum ada peringkat
- Traducción Del 1016-1030Dokumen14 halamanTraducción Del 1016-1030JorgeBelum ada peringkat
- Economía para No Economistas - CompletoDokumen353 halamanEconomía para No Economistas - CompletoChipi Busson100% (5)
- 1) Hilario Razo Acantilados Agua DulceDokumen18 halaman1) Hilario Razo Acantilados Agua DulceJorgeBelum ada peringkat
- QuimicaDokumen19 halamanQuimicaJorgeBelum ada peringkat
- Choro PampaDokumen3 halamanChoro PampaJorgeBelum ada peringkat
- Derechos de Transferencia LaboralDokumen11 halamanDerechos de Transferencia LaboralMiguel Flores SilvaBelum ada peringkat
- Equipos Minería SubterráneaDokumen5 halamanEquipos Minería SubterráneaJorgeBelum ada peringkat
- Carta Nacional Del Perú Vista GeneralDokumen1 halamanCarta Nacional Del Perú Vista GeneralWilliam Castellares Paucar100% (4)
- Parada 1Dokumen2 halamanParada 1JorgeBelum ada peringkat
- Equipos Minería SubterráneaDokumen5 halamanEquipos Minería SubterráneaJorgeBelum ada peringkat
- BOULANGERITADokumen8 halamanBOULANGERITAJorgeBelum ada peringkat
- Parada 1Dokumen2 halamanParada 1JorgeBelum ada peringkat
- Distribución Ingreso EC ExposDokumen17 halamanDistribución Ingreso EC ExposMiguel Flores SilvaBelum ada peringkat
- Cálculo Del Capital Intelectual PDFDokumen31 halamanCálculo Del Capital Intelectual PDFJorgeBelum ada peringkat
- Formato PRSDokumen5 halamanFormato PRSJorgeBelum ada peringkat
- LavoiserDokumen1 halamanLavoiserJorge80% (5)
- Parte I IntroducciónDokumen5 halamanParte I IntroducciónJorgeBelum ada peringkat
- Choro PampaDokumen3 halamanChoro PampaJorgeBelum ada peringkat
- Choro PampaDokumen3 halamanChoro PampaJorgeBelum ada peringkat
- Dos Grandes Preguntas de La EconomíaDokumen12 halamanDos Grandes Preguntas de La EconomíaJorge100% (1)
- A0 Mapa Topografico de CampoDokumen1 halamanA0 Mapa Topografico de CampoJorgeBelum ada peringkat
- Clase 10 OvinosDokumen19 halamanClase 10 OvinosPAUL FRANKLIN QUISPE JURADOBelum ada peringkat
- FI U1 A2 JABS ParadigmasDokumen3 halamanFI U1 A2 JABS ParadigmasGratis VentasBelum ada peringkat
- Todo Sobre La Cocina de AutorDokumen2 halamanTodo Sobre La Cocina de AutorPedro D. AlvaradoBelum ada peringkat
- Sistema Hidroneumaticos 2Dokumen13 halamanSistema Hidroneumaticos 2aventur18Belum ada peringkat
- Resumen Ejecutivo Muro de Contension Gaviones TerrameshDokumen6 halamanResumen Ejecutivo Muro de Contension Gaviones Terrameshjose luisBelum ada peringkat
- Comprendemos La Influencia Del Microbiota en La Salud de Las PersonasDokumen3 halamanComprendemos La Influencia Del Microbiota en La Salud de Las PersonasGustavo Aldo Rivera0% (1)
- Sesion de Aprendizaje 2019Dokumen2 halamanSesion de Aprendizaje 2019grocioquevedo riosBelum ada peringkat
- Tema 1 Introduccion, Clasificacion Materiales y PropiedadesDokumen24 halamanTema 1 Introduccion, Clasificacion Materiales y PropiedadesAzel ZaldivarBelum ada peringkat
- Refractometría & PolarimetríaDokumen17 halamanRefractometría & PolarimetríaAlisonValera100% (1)
- 15 Caso Clinico Puerperio (2) Salud MujerDokumen5 halaman15 Caso Clinico Puerperio (2) Salud MujerMilagros Camila100% (1)
- BursitisDokumen5 halamanBursitisJorge ramirezBelum ada peringkat
- Tecnicas de Relajacion e ImagineriaDokumen60 halamanTecnicas de Relajacion e ImagineriaRossana Contreras LeytonBelum ada peringkat
- Proyecto QFDDokumen40 halamanProyecto QFDOsvaldo BenitezBelum ada peringkat
- Cine BDDokumen28 halamanCine BDEmith HernandezBelum ada peringkat
- Soluciones en Lean Management & Kaizen (PDFDrive)Dokumen90 halamanSoluciones en Lean Management & Kaizen (PDFDrive)Nancy ChavezBelum ada peringkat
- 1 - Presentación de La Materia - NutriciónDokumen19 halaman1 - Presentación de La Materia - Nutricióncatupecu91Belum ada peringkat
- Vivir y Comer BienDokumen175 halamanVivir y Comer BienJoel VillaBelum ada peringkat
- La Imagen de La Divina Pastora de Cantillana P Álvaro Román VillónDokumen183 halamanLa Imagen de La Divina Pastora de Cantillana P Álvaro Román VillónLuis Pilar MorenoBelum ada peringkat
- Modulo 1111Dokumen13 halamanModulo 1111damaris arias cletoBelum ada peringkat
- Proyecto Afro-Coquimbo La Historia Después Del OlvidoDokumen103 halamanProyecto Afro-Coquimbo La Historia Después Del OlvidoClaudio ReyesBelum ada peringkat
- PC1 EticaDokumen3 halamanPC1 EticaJhenny Romero GamarraBelum ada peringkat
- Semana 3 (01.03) - Esi - Equipo 1Dokumen18 halamanSemana 3 (01.03) - Esi - Equipo 1Mercedes Amaya RosalesBelum ada peringkat
- Repaso de RN Puerto RicoDokumen50 halamanRepaso de RN Puerto Rico6ydwtzjc8yBelum ada peringkat
- Salud Fisica y MentalDokumen7 halamanSalud Fisica y MentalSamuel Beb chubBelum ada peringkat
- 6°A 6°B Lenguaje Unidad 1 Cuento Narradores PPT Mayo PDFDokumen17 halaman6°A 6°B Lenguaje Unidad 1 Cuento Narradores PPT Mayo PDFmagaly ortizBelum ada peringkat
- Casos de EstudioDokumen45 halamanCasos de EstudioDiana Cerdas CamposBelum ada peringkat
- Adaptación Curricular Ciencias Sociales Camila HenaoDokumen26 halamanAdaptación Curricular Ciencias Sociales Camila HenaoLina Marcela Tapia MartinezBelum ada peringkat
- C.E Diagrama de Flujo LápizDokumen4 halamanC.E Diagrama de Flujo LápizJack Ecu0% (1)
- Mapaconceptual Adrian CotaDokumen1 halamanMapaconceptual Adrian CotaAdrian Cota Gallegos100% (1)