Insensibilidad Congénita Al Dolor Con Anhidrosis Asociada A Síndrome Miasténico Congénito
Diunggah oleh
Andrés MacasJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Insensibilidad Congénita Al Dolor Con Anhidrosis Asociada A Síndrome Miasténico Congénito
Diunggah oleh
Andrés MacasHak Cipta:
Format Tersedia
NOTA CLÍNICA
Insensibilidad congénita al dolor con anhidrosis
asociada a síndrome miasténico congénito
M. Raspall-Chaure a, M. Del Toro-Riera a, M. Gratacós b, E. Cuenca-León a,
I. Ferrer c, Y. Indo d, M. Roig-Quilis a, A. Macaya-Ruiz a
CONGENITAL INSENSITIVITY TO PAIN WITH ANHIDROSIS
ASSOCIATED WITH CONGENITAL MYASTHENIC SYNDROME
Summary. Introduction. Congenital insensitivity to pain with anhidrosis (CIPA) or hereditary sensory and autonomic neuropathy
type IV (HSAN IV) is a rare autosomal recessive disorder featuring recurrent fever episodes, inability to sweat, absent response
to noxious stimuli, self mutilating behavior and mental retardation. It has been associated with mutations in the NTRK1 gene,
located in 1q21-22 and encoding a high-affinity NGF receptor. Case report. An 8-year-old boy, the first son of consanguineous
parents, presented with hypotonia, episodic hyperpyrexia and global developmental delay since the neonatal period. In addition
to these signs, typical of CIPA, he displayed some other not previously described in this disease, such as facial dysmorphism, a
severe swallowing disorder and a myogenic EMG pattern, that led to the initial suspicion of a muscle disorder. Molecular
genetics studies uncovered a mutation c.C2011T in exon 15 of the NTRK1 gene. Genetic counselling was possible in the
following pregnancy of the couple, where the female fetus was found to harbour the mutation in heterozygosity. The subsequent
diagnosis of a congenital myasthenic syndrome in this sister led to neurophysiological re-evaluation of the probandus, in whom a
myasthenic pattern of muscle activation was also found. Conclusions. A patient with CIPA and congenital myasthenic syndrome
is described. CIPA must be the first diagnostic hypothesis when assessing a patient with insensitivity to pain, anhidrosis and self-
mutilation. Given the rather homogeneous presentation of CIPA, the occurrence of atypical myopathic manifestations should
raise the suspicion of a concurrent disorder. The present consanguineous kindred illustrates a rare instance of transmission of two
mutated alleles giving rise to two unrelated, infrequent neurological syndromes. [REV NEUROL 2005; 41: 218-22]
Key words. Anhidrosis. CIPA. Congenital myasthenic syndrome. Dysphagia. Myopathy. Prenatal diagnosis.
INTRODUCCIÓN CASO CLÍNICO
La insensibilidad congénita al dolor con anhidrosis (CIPA, del Paciente varón de 8 años de edad, producto de una primera gestación de pa-
inglés congenital insensitivity to pain with anhidrosis) o neuro- dres sanos consanguíneos (primos hermanos), controlado en nuestra sec-
patía hereditaria sensitivoautonómica de tipo IV (HSAN IV) es ción desde el período neonatal por hipotonía y trastorno de la deglución.
un raro trastorno hereditario autosómico recesivo caracterizado Embarazo bien controlado y de curso normal. Parto vaginal a las 42 sema-
por episodios recurrentes de fiebre, anhidrosis, ausencia de sen- nas, distócico, instrumentado con fórceps. Apgar 1/6/6, reanimación con
oxígeno y ambú; pH de cordón umbilical normal. Precisa ventilación mecá-
sibilidad al dolor y retraso mental [1,2]. El trastorno se ha aso-
nica durante las primeras 48 horas de vida por presentar apneas e inestabili-
ciado a mutaciones en el gen NTRK1 (neurotrophic tyrosine re- dad hemodinámica. En la exploración inicial destaca un peso de 2.600 g,
ceptor kinase 1, antes conocido como TRKA), localizado en el fenotipo peculiar con hirsutismo e implantación baja del pelo, microrretrog-
cromosoma 1q21-22, que codifica el dominio tirosincinasa del natia, paladar ojival, hendiduras palpebrales pequeñas, tórax con un diáme-
receptor de alta afinidad del factor de crecimiento nervioso [3]. tro anteroposterior aumentado y clavículas hipoplásicas. Se evidencia un
Las mutaciones en el gen NTRK1 determinan el fracaso de la adecuado contacto con el entorno, hipotonía axial aguda, rigidez de ex-
diferenciación y migración de las células de la cresta neural y tremidades, reflejos miotáticos presentes y simétricos y un trastorno de
deglución que obliga a alimentación por sonda nasogástrica; no se eviden-
consecuentemente la ausencia completa de las fibras mieliniza-
cia debilidad ni fatiga. Durante las primeras semanas de vida presenta múl-
das pequeñas y de las no mielinizadas, encargadas de la percep- tiples episodios de irritabilidad acompañados de hipertermia (39-40 °C) sin
ción del dolor y la temperatura así como de la inervación de las que se detecte un origen infeccioso. Se mantiene ingresado en la Unidad de
glándulas sudoríparas [4-7]. Neonatología de nuestro centro hasta el mes y medio de vida; se realizan las
Presentamos un paciente afecto de CIPA cuya sintomatolo- siguientes exploraciones, todas con resultado normal: hemograma y bioquí-
gía a lo largo de los primeros meses de vida sugería un proceso mica general, creatincinasas (CK) plasmáticas, estudio inmunitario, hor-
miopático. monas tiroideas, estudio metabólico (estatus redox, amonio y aminoácidos
plasmáticos, ácidos orgánicos en orina), cariotipo, serie esquelética, EEG,
ecografía y RM cerebrales, fondo de ojo, TC torácica, tránsito esofágico,
laringoscopia directa y ecocardiografía. El estudio de deglución revela re-
Aceptado: 21.02.05. flujo a nasofaringe.
a
Sección de Neurología Infantil. b Servicio de Neurofisiología. Hospital Desde el período neonatal persiste un grave trastorno de la deglución que
Universitari Vall d’Hebron. Barcelona. c Unidad de Neuropatología. Servi- obliga a mantener la alimentación mediante SNG hasta los 6 meses de vida
cio de Anatomía Patológica. Hospital de Bellvitge. L’Hospitalet de Llobre- (Fig. 1a). En el estudio neurofisiológico, practicado durante el período neo-
gat, Barcelona, España. d Department of Pediatrics. Kumamoto University natal y repetido a los 6 meses de vida por la persistencia de una marcada
School of Medicine. Kumamoto, Japón. hipotonía, el EMG muestra presencia de unidades motoras de baja ampli-
Correspondencia: Dr. Alfons Macaya Ruiz. Sección de Neurología Infantil. tud, polifásicas y breves tanto en EESS como EEII, sin evidencia de activi-
Grup de Recerca de Malalties Neurometabòliques. Hospital Universitari Ma- dad espontánea, compatible con afectación miógena difusa; las neurografí-
terno Infantil Vall d’Hebron. Passeig de la Vall d’Hebron, 119-129. E-08035 as motora y sensitiva son normales; no se puede valorar la respuesta simpá-
Barcelona. Fax: +34 932 746 837. E-mail: amacaya@vhebron.net tica cutánea. La biopsia de músculo cuádriceps a los 6 meses demuestra
© 2005, REVISTA DE NEUROLOGÍA cambios inespecíficos, con un leve aumento de tejido conectivo.
218 REV NEUROL 2005; 41 (4): 218-222
CIPA Y SÍNDROME MIASTÉNICO
a b En la actualidad, el paciente tiene 8 años de edad y en la exploración des-
tacan un retraso mental moderado, microcefalia con perímetro craneal en
–2,5 DE, hipotonía axial con fuerza y reflejos miotáticos conservados, y
ausencia de movimientos anormales. Acude a un centro de educación espe-
cial y sigue tratamiento con neurolépticos por un grave trastorno de conduc-
ta, que incluye una llamativa ausencia de la sensación de peligro, con varios
intentos de precipitación.
Durante la siguiente gestación de la pareja se llevó a cabo un diagnóstico
prenatal, que excluía la enfermedad al encontrarse la mutación c.C2011T en
heterocigosis en el ADN extraído de vellosidades coriales. La hermana del
paciente, producto de dicha gestación y que actualmente tiene 6 años de edad,
no ha desarrollado ninguno de los signos de la CIPA. Sin embargo, presenta
desde el período neonatal inmediato signos de insuficiencia ventilatoria, hipo-
tonía, ptosis palpebral y dificultades de deglución. Varios estudios neurofisio-
lógicos han mostrado hallazgos propios de una alteración de la transmisión en
la placa motora. La clínica de la paciente ha mejorado progresivamente con la
edad y bajo tratamiento con 3,4 diaminopiridina. Estos hallazgos han motiva-
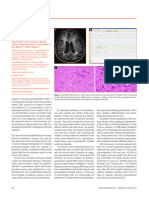
Figura 1. a) Fotografía del paciente a los 6 meses de edad. Nótese la fa- do la práctica de un nuevo estudio neurofisiológico en el probando a los 8
cies peculiar con hipomimia, ligera ptosis palpebral y la presencia de la años de edad. La estimulación repetitiva a 3 Hz de nervio cubital con registro
sonda nasogástrica que requirió hasta esa edad por el trastorno de deglu- hipotenar muestra decrementos del 23 al 28% en amplitud y área, respectiva-
ción; b) A la edad de 14 meses eran notorias las anomalías dentarias, mente. En el músculo nasal los decrementos son del 26 y 37%. El EMG es
tórax longilíneo y lesiones ulceradas en dedos de las manos. normal. Persiste normalidad de la neurografía motora y sensitiva convencio-
nal y se constata ausencia de la respuesta simpática cutánea en extremidades
derechas tanto en reposo como en respuesta al estímulo eléctrico y acústico.
Alrededor de los 9 meses se detecta una franca indiferencia a los estímu- El blink reflex, con estímulo único o doble, muestra ausencia de respuesta.
los dolorosos (golpes, caídas) o a las temperaturas elevadas (agua caliente)
así como conductas autolesivas que incluyen mordeduras de la lengua con
mutilación de la punta, lesiones por rozamiento constante de los dedos y
DISCUSIÓN
úlceras en los dedos de las manos y pies por traumas repetidos o introduc-
ción en la cavidad oral. Por ello, resulta necesario efectuar limado de dien- El caso presentado combina los signos clínicos de insensibili-
tes caninos y colocación de fundas para evitar las autolesiones. A los 14 dad al dolor, anhidrosis y automutilación, sugestivos del diag-
meses se realiza el test de metacolina, que no induce miosis. La inspección nóstico de CIPA, el cual se confirma por los estudios molecula-
con lupa de la lengua muestra la presencia normal de papilas fungiformes. res efectuados. Sin embargo, los rasgos fenotípicos peculiares
La dentición decidua presenta una morfología llamativa, con incisivos del
presentes desde el período neonatal, el grave trastorno de la
tamaño de la dentición definitva (Fig. 1b).
La constatación, a partir del año de edad, de signos sugestivos de insensi- deglución y el patrón miógeno en los estudios neurofisiológicos
bilidad al dolor, crisis de hipertermia con anhidrosis, retraso psicomotor y son hallazgos atípicos de esta entidad y se interpretaron inicial-
lesiones por automutilación conduce a la sospecha de CIPA. Se practica mente como manifestaciones todavía no descritas de la enfer-
biopsia de nervio sural que muestra una ausencia de fibras mielínicas pe- medad. No obstante, tras el diagnóstico del síndrome miasténi-
queñas y fibras amielínicas, con conservación de los axones mielínicos de co en los dos hermanos, puede suponerse que se deban a la co-
grueso y mediano calibre (Fig. 2). Se remite ADN del paciente para análisis existencia en nuestro paciente de las dos enfermedades.
mutacional del gen NTRK1 (Kumamoto University, Japón). El estudio reve-
la que el paciente es homocigoto para una mutación c.C2011T en el exón
La CIPA quedó inicialmente descrita por Swanson en 1963
15, causante de un cambio de aminoácido p.R643W, y que ambos progeni- [1]. El cuadro clínico es homogéneo y aparece precozmente en
tores son heterocigotos para la citada mutación (Fig. 3). El análisis molecu- forma de episodios inexplicables de hiperpirexia que pueden ser
lar detallado de la familia se ha publicado previamente [8]. graves y llevar a la muerte del paciente. Alrededor de los 9-12
Hasta los 18 meses de edad el paciente sigue presentando episodios fre- meses suele detectarse la ausencia de sudoración y de sensibili-
cuentes de irritabilidad e hipertermia con una llamativa ausencia de sudo- dad a estímulos dolorosos, un retraso global de adquisiciones y
ración que acompaña a dichos episodios. Posteriormente desaparece la una conducta automutilativa [9,10]. En nuestro paciente las cri-
hipertermia relacionada con el llanto y la irritabilidad, pero persiste ocasio-
nalmente en relación con temperaturas ambientales elevadas.
sis de hiperpirexia aparecen ya durante el período neonatal y se
Durante los primeros dos años se pone de manifiesto un importante re- repiten frecuentemente durante los primeros 18 meses de vida;
traso pondoestatural y una deceleración de la velocidad de crecimiento ce- a partir de esa edad los ha presentado muy ocasionalmente y
fálico. Se evidencia también un retraso global de adquisiciones, con inicio siempre en relación con aumentos de la temperatura ambiental.
de la ambulación autónoma a los 2 años y 11 meses. Una segunda RM ce- A medida que los individuos afectos crecen, son frecuentes
rebral, a los 12 meses de edad, evidencia tan sólo un discreto retraso en la las lesiones accidentales que provocan múltiples cicatrices y
mielinización. lesiones osteoarticulares que facilitan la aparición de infeccio-
Durante el seguimiento del paciente han aparecido diversas complicacio-
nes. Ha presentado diversos episodios de queratitis que le han provocado
nes graves en forma de osteomielitis. En casos extremos pueden
opacidades corneales periféricas así como múltiples lesiones osteoarticula- provocar la amputación de dedos o extremidades. La acroosteo-
res, que no se han acompañado de sintomatología dolorosa en ninguno de lisis de los dedos de las manos, evidenciable ya durante el pri-
los casos: fractura diafisaria del fémur izquierdo a los 21 meses que requirió mer año de vida, suele ser la primera manifestación osteoarticu-
reducción y colocación de yeso pelvipédico; fractura metatarsiana en el pie lar [11]. El factor de crecimiento nervioso parece estimular la
izquierdo a los 4 años; fractura supracondílea del húmero derecho (tipo III diferenciación de las células osteoblásticas y se ha sugerido que
de Garland) a los 6 años tratada con reducción cerrada y fijación percutánea
defectos en la vía FCN/NTRK1 podrían contribuir a la mala con-
con dos agujas de Kirschner. Esta última fractura provoca una sección del
nervio radial que no recupera tras 18 meses de observación y que ha llevado
solidación de las fracturas observada en algunos pacientes [12].
recientemente a la práctica de un injerto nervioso. En ninguna de las tres En nuestro caso, las tres fracturas han consolidado de forma
ocasiones en las se le ha sometido a una intervención quirúrgica se han correcta y no se han acompañado de complicaciones infeccio-
observado complicaciones en relación con la anestesia. sas. No hemos objetivado de momento la aparición de acroos-
REV NEUROL 2005; 41 (4): 218-222 219
M. RASPALL-CHAURE, ET AL
Figura 3. Genotipación de la familia del paciente para la mutación c.
C2011T en el exón 15 del gen NTRK1. En la electroforesis sobre agarosa
de los productos de PCR se observa que la mutación causa la desapari-
ción de una diana de restricción al digerir el ADN con la enzima Hph I.
1: marcador tamaño molecular; 2,3: ADN control; 4,5: probando; 6,7: pa-
dre; 8,9: madre; 10-13: hermana, biopsia corial y confirmación posnatal
(+, – : presencia o no de enzima de restricción).
rregulación y el metabolismo anormal de las catecolaminas que
se ha sugerido en estos pacientes son aspectos que considerar en
el manejo anestésico de los afectos de CIPA. En las series de
Tomioka y Okuda, el tratamiento anestésico convencional, si se
presta especial atención al mantenimiento de un ambiente térmi-
Figura 2. a) Microfotografía de biopsia de nervio sural normal, cortes
ultrafinos, que muestra la presencia de fibras mielínicas de pequeño co adecuado, resulta bien tolerado [21,22]. Rozentsveig et al tam-
tamaño (flecha); b) Nervio sural del paciente que demuestra la ausencia poco observan trastorno de la termorregulación durante la aneste-
de fibras mielínicas de pequeño tamaño y de las amielínicas, con conser-
vación de los axones de grueso y mediano tamaño.
sia, pero sí un 37,5% de trastornos cardiovasculares en forma de
bradicardia y/o hipotensión [23]. En las tres ocasiones en que
nuestro paciente ha requerido de intervención quirúrgica bajo
teolisis o artropatía de Charcot, complicación asociada frecuen- anestesia general, ésta se ha realizado sin mayores incidencias.
temente a esta enfermedad [11,13]. Las lesiones corneales de No es extraño que el estudio de velocidades de conducción
curso tórpido, la automutilación de la lengua y las anomalías nerviosa haya resultado repetidamente normal en pacientes con
bucodentarias evidenciadas en nuestro paciente son otras mani- CIPA, puesto que no ofrece información sobre las fibras mielíni-
festaciones características de la CIPA [14-16]. cas pequeñas y las amielínicas. La ausencia de respuesta simpáti-
Recientemente se ha sugerido que mutaciones en el NTRK1 ca cutánea que hemos observado en nuestro paciente, aunque poco
determinarían defectos de señalización en los linfocitos B y faci- específica, apunta a la existencia de una disfunción autonómica.
litarían las infecciones graves [17]. Aunque el 23% de los pacien- Shorer et al demostraron la ausencia de esta respuesta en todos sus
tes de la serie de Shorer et al fallecen directamente por causa pacientes e incluso apuntaron la posibilidad de que esta técnica
infecciosa, ésta no se refiere como una causa frecuente de muerte sustituyera a la biopsia de nervio periférico en el diagnóstico de la
en otras series y tampoco nuestro paciente ha sufrido infecciones CIPA [18]. El hallazgo de una alteración de la vía aferente trige-
graves sugestivas de ningún defecto inmunitario [18]. minal en el reflejo de parpadeo como el existente en nuestro pa-
El grave trastorno de deglución observado en nuestro pacien- ciente resultó comunicado por Esteban-García et al, que reco-
te durante sus primeros meses de vida no es propio de la CIPA, miendan la práctica sistemática de este estudio en la valoración de
aunque se ha descrito excepcionalmente en la HSAN II [19]. El pacientes afectos de neuropatías con alteración de fibras finas y de
trastorno de deglución en el lactante puede ser un signo dominan- mediano tamaño [24]. Sin embargo, el patrón miógeno observado
te en patologías bilaterales de la región perisilviana, en la disge- en nuestro paciente no se ha descrito anteriormente asociado a la
nesia del tronco encefálico (sindrómica o no), que suele cursar CIPA. No hemos detectado aumento de CK plasmáticas y los ha-
con hipotonía neonatal y afectación de múltiples pares craneales llazgos descritos de la biopsia muscular fueron inespecíficos, con
[20], y en varias enfermedades neuromusculares. En nuestro caso un leve aumento de colágeno en relación a la edad.
no se observan signos de vías largas ni de afectación de los pares El estudio mediante microscopio electrónico del nervio sural
craneales no relacionados con la deglución. La normalidad de la mostró la característica ausencia de fibras mielínicas pequeñas y
neuroimagen y de los potenciales evocados de tronco, así como de las amielínicas, encargadas de la percepción del dolor y la
los hallazgos poco específicos de la biopsia muscular, no permi- temperatura [6]. En los casos en los que se ha realizado estudio
ten establecer con certeza el origen de dicho trastorno. ultraestructural de la piel se han observado unas glándulas sudorí-
La ausencia de sensibilidad al dolor, el trastorno de la termo- paras de aspecto normal, pero con ausencia de las fibras encarga-
220 REV NEUROL 2005; 41 (4): 218-222
CIPA Y SÍNDROME MIASTÉNICO
das de su inervación [5,7]. La ausencia de inervación de las glán- dio genético, debido al gran tamaño del gen NTRK1 y a la varie-
dulas sudoríparas explica la ausencia de sudoración en respuesta dad de mutaciones descritas, puede resultar muy complejo. To-
a la iontoforesis con pilocarpina [18]. La anhidrosis y los episo- mando esta dificultad en consideración, Bonkowsky et al consi-
dios de hipertermia parecen debidas a este defecto, aunque no deran diagnóstica la combinación de las manifestaciones clíni-
puede excluirse un trastorno central de la termorregulación [7]. cas sugestivas, la normalidad de las velocidades de conducción
La microcefalia es un hallazgo frecuente en la CIPA, pero (para descartar la existencia de otras neuropatías periféricas) y
no las anomalías fenotípicas apreciadas en nuestro paciente des- el hallazgo de la ausencia de inervación de la epidermis y de las
de el período neonatal (Fig. 1). Éstas no se han considerado ca- glándulas sudoríparas en la biopsia de piel [14].
racterísticas de ningún síndrome dismorfológico específico y el La hipotonía y el trastorno de la deglución son manifesta-
estudio citogenético no ha demostrado anomalías. ciones atípicas de la CIPA, que en el presente caso dificultaron
El retraso mental, aunque de gravedad variable, es un hallaz- más, si cabe, el diagnóstico y obligaron inicialmente al diagnós-
go constante. En una revisión de 32 casos, la valoración del CI se tico diferencial con miopatías de debut neonatal. El diagnóstico
situó entre 41-78; la mayoría se encontraba alrededor de 60 [10]. posterior de un síndrome miasténico congénito hace suponer
Se ha sugerido que la hiperpirexia, especialmente en casos agu- que no se deban a mutaciones en el gen NTRK1, sino a la coe-
dos y recurrentes, puede contribuir al retraso mental [14]. xistencia de las dos enfermedades. Esta situación debe interpre-
El defecto genético responsable de la CIPA se conoce desde tarse como fortuita, ya que no se conoce función alguna del gen
1996 y el diagnóstico molecular se ha podido llevar a cabo en en la unión neuromuscular y, al tratarse de una mutación pun-
unos 80 casos [14]. Consiste en mutaciones en el gen NTRK1 y tual, tampoco apunta a que se trate de un síndrome de contigüi-
el estudio del mismo nos ha permitido confirmar el diagnóstico dad genética. Nuestro paciente ilustra la situación muy poco
de nuestro paciente así como prestar consejo genético a sus pro- frecuente de transmisión de dos alelos mutados, causantes de
genitores. El análisis de los exones codificantes del gen NTRK1 dos enfermedades neurológicas supuestamente monogénicas, a
identificó una nueva mutación consistente en una transición de un mismo individuo dentro de una familia consanguínea. En
citosina a timina en el nucleótido 2011 del exón 15, la cual pro- estas circunstancias, el reconocimiento precoz del fenotipo y la
voca una sustitución de arginina por triptófano en el aminoácido confirmación molecular del diagnóstico son de capital impor-
643 de la proteína [8], mutación que determina una disminución tancia para la prevención de algunas de las complicaciones pro-
de la autofosforilación de la proteína TRKA [25]. Pero el estu- pias de la CIPA y para un adecuado consejo genético.
BIBLIOGRAFÍA
1. Swanson AG. Congenital insensitivity to pain with anhidrosis. A unique 14. Bonkowsky JL, Johnson J, Carey J, Smith AG, Swoboda KJ. An infant
syndrome in two male siblings. Arch Neurol 1963; 8: 299-306. with primary tooth loss and palmar hyperkeratosis: a novel mutation in
2. Dyck PJ. Neuronal atrophy and degeneration predominantly affecting the NTRK1 gene causing congenital Insensitivity to pain with anhidro-
peripheral sensory and autonomic neurons. In Dyck PJ, Griffin PK, sis. Pediatrics 2003;112: 237-41.
Low PA, Poduslo JF, eds. Peripheral neuropathy. Philadelphia: WB 15. Yagev R, Levy J, Shorer Z, Lifshitz T. Congenital insensitivity to pain
Saunders; 1993. p. 1065-93. with anhidrosis: ocular and systemic manifestations. Am J Ophthalmol
3. Indo Y, Tsuruta M, Hayashida Y, Karim MA, Ohta K, Kawano T, et al. 1999; 127: 322-6.
Mutations in the TRKA/NGF receptor gene in patients with congenital 16. Bodner L, Woldenberg Y, Pinsk V, Levy J. Orofacial manifestations of
insensitivity to pain with anhidrosis. Nat Genet 1996;13: 485-88. congenital insensitivity to pain with anhidrosis: a report of 24 cases.
4. Swanson AG, Buchan GC, Alvord EC. Anatomic changes in congenital ASDC J Dent Child 2002; 69: 293-6.
insensitivity to pain: absence of small primary sensory neurons in gan- 17. Melamed I, Levy J, Parvari R, Gelfand EW. A novel lymphocyte sing-
glia, roots and Lissauer’s tract. Arch Neurol 1965; 12: 12-8. naling defect: TRKA mutation in the syndrome of congenital insensi-
5. Langer J, Goebel HH, Veit S. Eccrine sweat glands are not innervated tivity to pain and anhidrosis (CIPA). J Clin Immunol 2004; 24: 441-8.
in hereditary sensory neuropathy type IV. An electron microscopic 18. Shorer Z, Moses SW, Hershkovitz E, Pinsk V, Levy J. Neurophysiolog-
study. Acta Neuropathol (Berl) 1981; 54: 199-202. ic studies in congenital insensitivity to pain with anhidrosis. Pediatr
6. Rafel E, Alberca R, Bautista J, Navarrete M, Lazo J. Congenital insen- Neurol 2001; 25: 397-400.
sitivity to pain with anhidrosis. Muscle Nerve 1980; 3: 216-20. 19. Axelrod FB, Iyer K, Fish I, Pearson J, Sein ME, Spielholz N. Progres-
7. Ismail EA, Al-Shammari N, Anim JT, Moosa A. Congenital insensitiv- sive sensory loss in familial dysautonomia. Pediatrics 1981; 67: 517-22.
ity to pain with anhidrosis: lack of eccrine sweat gland innervation 20. Roig M, Gratacos M, Vázquez E, Del Toro M, Foguet A, Ferrer I, et al.
confirmed. J Child Neurol 1998; 13: 243-6. Brainstem dysgenesis: report of five patients with congenital hypoto-
8. Mardy S, Miura Y, Endo F, Matsuda I, Sztriha L, Frossard P, et al. Con- nia, multiple cranial nerve involvement, and ocular motor apraxia. Dev
genital insensitivity to pain with anhidrosis: novel mutations in the Med Child Neurol 2003; 45: 489-93.
TRKA (NTRK1) gene encoding a high-affinity receptor for nerve 21. Tomioka T, Awaya Y, Nihei K, Sekiyama H, Sawamura S, Hanaoka K.
growth factor. Am J Hum Genet 1999; 64: 1570-9. Anesthesia for patients with congenital insensitivity to pain and anhidro-
9. Nagasako EM, Oaklander AL, Dworkin RH. Congenital insensitivity sis: a questionnaire study in Japan. Anesth Analg 2002; 94: 271-4.
to pain: an update. Pain 2003; 101: 213-9. 22. Okuda K, Arai T, Miwa T, Hiroki K. Anaesthetic management of chil-
10. Rosemberg S, Marie SK, Kliemann S. Congenital insensitivity to pain dren with congenital insensitivity to pain with anhidrosis. Paediatr
and anhidrosis (hereditary sensory and autonomic neuropathy type IV). Anaesth 2000; 10: 545-8.
Pediatr Neurol 1994; 11: 50-6. 23. Rozentsveig V, Katz A, Weksler N, Schwartz A, Schilly M, Klein M, et
11. Schulman H, Tsodikow V, Einhorn M, Levy Y, Shorer Z, Hertzanu Y. al. The anaesthetic management of patients with congenital insensitiv-
Congenital insensitivity to pain with anhidrosis (CIPA): the spectrum ity to pain with anhidrosis. Paediatr Anaesth 2004; 14: 344-8.
of radiological findings. Pediatr Radiol 2001; 31: 701-5. 24. Esteban-García A, Salinero-Paniagua E, Traba A, Prieto-Montalvo J, Po-
12. Toscano E, della Casa R, Mardy S, Gaetaniello L, Sadile F, Indo Y, et lo-Arrondo AP, Godes-Medrano B, et al. Neuropatías sensitivas auto-
al. Multisystem involvement in congenital insensitivity to pain and an- nómicas hereditarias. Dos casos con insensibilidad congénita al dolor;
hidrosis (CIPA), a nerve growth factor receptor (TRKA) –related dis- aspectos neurofisiológicos y patológicos. Rev Neurol 2004; 39: 525-9.
order. Neuropediatrics 2000; 31: 39-41. 25. Mardy S, Miura Y, Endo F, Matsuda I, Indo Y. Congenital insensitivity
13. Mazar A, Herold HZ, Vardy PA. Congenital sensory neuropathy with to pain with anhidrosis (CIPA): effect of TRKA (NTRK1) missense
anhidrosis: orthopedic complication and management. Clin Orthop Re- mutations on autophosphorylation of the receptor tyrosine kinase for
lat Res 1976; 118: 184-7. nerve growth factor. Hum Mol Genet 2001;10: 179-88.
REV NEUROL 2005; 41 (4): 218-222 221
M. RASPALL-CHAURE, ET AL
INSENSIBILIDAD CONGÉNITA AL DOLOR CON ANHIDROSIS INSENSIBILIDADE CONGÉNITA À DOR COM ANIDROSE
ASOCIADA A SÍNDROME MIASTÉNICO CONGÉNITO ASSOCIADA AO SÍNDROMA MIASTÉNICO CONGÉNITO
Resumen. Introducción. La insensibilidad congénita al dolor con an- Resumo. Introdução. A insensibilidade congénita à dor com ani-
hidrosis (CIPA) o neuropatía hereditaria sensitivoautonómica de drose (CIPA) ou neuropatia hereditária sensitivo-autonómica de
tipo IV (HSAN IV) es un raro trastorno autosómico recesivo caracte- tipo IV (HSAN IV) é uma alteração autossómica recessiva rara,
rizado por episodios recurrentes de fiebre, anhidrosis, ausencia de caracterizada por episódios recorrentes de febre, anidrose, ausên-
sensibilidad al dolor y retraso mental de gravedad variable. Se aso- cia de sensibilidade à dor e atraso mental de gravidade variável.
cia a mutaciones en el gen NTRK1, localizado en el cromosoma Associa-se a mutações no gene NTRK1, localizado no cromossoma
1q21-22, que codifica uno de los receptores del factor de crecimien- 1q21-22, que codifica um dos receptores do factor de crescimento
to nervioso. Caso clínico. Describimos el caso de un niño de 8 años nervoso. Caso clínico. Descrevemos o caso de uma criança de 8
de edad, primer hijo de padres consanguíneos, que presenta hipoto- anos de idade, primeiro filho de pais consanguíneos, que apresenta
nía, episodios de hiperpirexia y retraso global desde el período neo- hipotonia, episódios de hiperpirexia e atraso global desde o perío-
natal, manifestaciones típicas de la CIPA, además de signos previa- do neonatal, manifestações típicas da CIPA, além de sinais previa-
mente no descritos en esta enfermedad como son anomalías fenotí- mente não descritos nesta doença como são anomalias fenotípicas,
picas, un grave trastorno de deglución durante los primeros meses uma grave alteração de deglutição durante os primeiros meses de
de vida y un patrón miógeno en el estudio neurofisiológico, que con- vida e um padrão miógeno no estudo neurofisiológico, que conduzi-
dujeron a la sospecha inicial de proceso miopático. El estudio gené- ram à suspeita inicial de processo miopático. O estudo genético
tico molecular detectó una mutación c.C2011T en el exón 15 del gen molecular detectou uma mutação c.C2011T no exão 15 do gene
NTRK1. El hallazgo de dicha mutación en heterocigosidad en la NTRK1. O resultado da dita mutação em heterozigoticidade na
hermana menor del paciente permitió efectuar consejo genético. Sin irmã mais nova do doente permitiu efectuar aconselhamento gené-
embargo, el diagnóstico de un síndrome miasténico congénito en tico. No entanto, o diagnóstico de uma síndroma miasténica congé-
esta hermana y la posterior observación de hallazgos neurofisioló- nita nesta irmã e a posterior observação de resultados neurofisioló-
gicos miasteniformes también en nuestro paciente permiten explicar gicos miasteniformes também no nosso doente permitem explicar a
la existencia de estas manifestaciones atípicas de la CIPA. Conclu- existência destas manifestações atípicas da CIPA. Conclusões.
siones. Presentamos un paciente afecto de CIPA y síndrome miasté- Apresentamos um doente afectado com CIPA e síndroma miasténi-
nico congénito. Debe considerarse la posibilidad de CIPA como pri- ca congénita. Deve considerar-se a possibilidade de CIPA como
mera hipótesis diagnóstica en la valoración de un paciente con primeira hipótese diagnóstica na avaliação de um doente com
insensibilidad al dolor, anhidrosis y automutilación. Dada la consi- insensibilidade à dor, anidrose e automutilação. Dada a considerá-
derable homogeneidad clínica de la CIPA, la aparición de signos vel homogeneidade clínica da CIPA, o aparecimento de sinais atípi-
atípicos miopáticos debe despertar la sospecha de algún otro tras- cos miopáticos deve despertar a suspeita de alguma outra altera-
torno asociado. La familia consanguínea que presentamos ilustra la ção associada. A família consanguínea que apresentamos ilustra a
situación muy poco frecuente de transmisión de dos alelos mutados, situação muito pouco frequente de transmissão dos alelos mutados,
causantes de dos enfermedades neurológicas supuestamente mono- causadores de duas doenças neurológicas supostamente monogéni-
génicas, a un mismo individuo. [REV NEUROL 2005; 41: 218-22] cas, a um mesmo indivíduo. [REV NEUROL 2005; 41: 218-22]
Palabras clave. Anhidrosis. CIPA. Diagnóstico prenatal. Miopatía. Palavras chave. Alteração de deglutição. Anidrose. CIPA. Diagnós-
Síndrome miasténico congénito. Trastorno de deglución. tico pré-natal. Miopatia. Síndroma miasténico congénito.
222 REV NEUROL 2005; 41 (4): 218-222
Anda mungkin juga menyukai
- Hot Cross Bun SignDokumen4 halamanHot Cross Bun SignHenrique OliveiraBelum ada peringkat
- CorrespndenceDokumen1 halamanCorrespndenceTajul TajBelum ada peringkat
- SCIENTIFIC LETTERS: Meningoencephalitis as a Presentation of Behçet's DiseaseDokumen2 halamanSCIENTIFIC LETTERS: Meningoencephalitis as a Presentation of Behçet's DiseaseAndys Mayest BuntanusBelum ada peringkat
- Mixed Hypotonia and Cerebellar Atrophy in Infantile Neuroaxonal DystrophyDokumen4 halamanMixed Hypotonia and Cerebellar Atrophy in Infantile Neuroaxonal DystrophyPablo HernandezBelum ada peringkat
- A New Case of Confirmation of Diagnosis On Molecular Genetic TudiesDokumen5 halamanA New Case of Confirmation of Diagnosis On Molecular Genetic TudiesMariela Judith UCBelum ada peringkat
- Antibody Mediated Autoimmune Encephalitis in ChildhoodDokumen11 halamanAntibody Mediated Autoimmune Encephalitis in ChildhoodTessa CruzBelum ada peringkat
- Isolated Propriospinal Myoclonus As A Presentation of Cervical Myelopathy.Dokumen2 halamanIsolated Propriospinal Myoclonus As A Presentation of Cervical Myelopathy.arturomarticarvajalBelum ada peringkat
- Encefalite Herpética 4 Casos Rev Neurol 2002Dokumen6 halamanEncefalite Herpética 4 Casos Rev Neurol 2002Ana SopaBelum ada peringkat
- KernicterusDokumen8 halamanKernicterusHiguera Diaz Sandra MilenaBelum ada peringkat
- Encefalomielitis Diseminada AgudaDokumen7 halamanEncefalomielitis Diseminada AgudasamBelum ada peringkat
- Del Toro 2006Dokumen5 halamanDel Toro 2006NATALIA MARTINEZ CORDOBABelum ada peringkat
- Pedia: NeuroDokumen4 halamanPedia: Neuroapi-37045620% (1)
- Journal of Child Neurology 11Dokumen5 halamanJournal of Child Neurology 11NEUROLAB ESCALÓNBelum ada peringkat
- Perinatal/Neonatal Case PresentationDokumen5 halamanPerinatal/Neonatal Case PresentationAnkit sharmaBelum ada peringkat
- Acute Encephalopathy Preceding Infection: ShigellaDokumen2 halamanAcute Encephalopathy Preceding Infection: ShigellaOasis LimitedBelum ada peringkat
- 0717 9227 RCHNP 57 03 0283Dokumen12 halaman0717 9227 RCHNP 57 03 0283Araceli PerezBelum ada peringkat
- E110 FullDokumen2 halamanE110 FullLuther ThengBelum ada peringkat
- Epilepsy Syndromes inDokumen24 halamanEpilepsy Syndromes inEdwin AlvarezBelum ada peringkat
- Epileptic Encephalopathies SYNGAP1Dokumen7 halamanEpileptic Encephalopathies SYNGAP1Saya OtonashiBelum ada peringkat
- BH 010060 ENGDokumen2 halamanBH 010060 ENGCarlosBelum ada peringkat
- 2017 32 3 264 267 EngDokumen4 halaman2017 32 3 264 267 Engemmanuellagrace06Belum ada peringkat
- Encefalitis LimbicaDokumen11 halamanEncefalitis LimbicaRandy UlloaBelum ada peringkat
- 4485 16580 2 PBDokumen4 halaman4485 16580 2 PBishu sBelum ada peringkat
- Sarnat 1976Dokumen10 halamanSarnat 1976João Paulo RaposoBelum ada peringkat
- Panencefalitis Esclerosante Subaguda Forma FulminanteDokumen4 halamanPanencefalitis Esclerosante Subaguda Forma FulminantethevintageBelum ada peringkat
- Cidp ParaneoDokumen8 halamanCidp ParaneoPablo MarinBelum ada peringkat
- 445 Fulltext 1529 3 10 20210404Dokumen8 halaman445 Fulltext 1529 3 10 20210404Kiều HuỳnhBelum ada peringkat
- Megalencephaly, polymicrogyria, polydactyly syndrome with rare MR findingsDokumen3 halamanMegalencephaly, polymicrogyria, polydactyly syndrome with rare MR findingsAnonymous x4Ba2BBelum ada peringkat
- Pid 1 86Dokumen9 halamanPid 1 86SandraBelum ada peringkat
- Loss of The N-Myc Oncogene in A Patient With A Small Interstitial Deletion of The Short Arm of ChromosomeDokumen5 halamanLoss of The N-Myc Oncogene in A Patient With A Small Interstitial Deletion of The Short Arm of ChromosomeantonioopBelum ada peringkat
- Congenital Hypotonia Is There An AlgorithmDokumen4 halamanCongenital Hypotonia Is There An AlgorithmEvelyn HerreraBelum ada peringkat
- Kikuchi's Disease Case ReportDokumen3 halamanKikuchi's Disease Case Reportzulfikar adiBelum ada peringkat
- Chickenpox Leads to Acute Disseminated EncephalomyelitisDokumen2 halamanChickenpox Leads to Acute Disseminated EncephalomyelitisCorneliu VladBelum ada peringkat
- Enterovirus ImagingDokumen7 halamanEnterovirus ImagingMomeneo NeoBelum ada peringkat
- A Diagnostic Algorithm for Patients with Intracranial CalcificationsDokumen8 halamanA Diagnostic Algorithm for Patients with Intracranial CalcificationshengkileonardBelum ada peringkat
- Genetic and Therapeutic Review of Progressive Myoclonic EpilepsiesDokumen10 halamanGenetic and Therapeutic Review of Progressive Myoclonic EpilepsieschintanBelum ada peringkat
- A Child With Myoclonus-Dystonia (DYT11) Misdiagnosed As Atypical Opsoclonus Myoclonus SyndromeDokumen3 halamanA Child With Myoclonus-Dystonia (DYT11) Misdiagnosed As Atypical Opsoclonus Myoclonus SyndromeStephen AttardBelum ada peringkat
- Neonatal Seizures: Dr. Venkatesh Postgraduate Dept of Pediatrics S V Medical CollegeDokumen43 halamanNeonatal Seizures: Dr. Venkatesh Postgraduate Dept of Pediatrics S V Medical CollegeManju ManjunathBelum ada peringkat
- Estado Epiléptico Parcial No Convulsivo Como Síntoma de Presentación de Encefalitis LímbicaDokumen4 halamanEstado Epiléptico Parcial No Convulsivo Como Síntoma de Presentación de Encefalitis LímbicaNathaly CantorBelum ada peringkat
- TPNEDokumen8 halamanTPNENelson AlvarengaBelum ada peringkat
- Vertigo-An Overview: PG Dhanya, VG Pradeep KumarDokumen4 halamanVertigo-An Overview: PG Dhanya, VG Pradeep KumarDebby Mulya Rahmy100% (1)
- ACNS Guideline Continuous Electroencephalography Monitoring in NeonatesDokumen7 halamanACNS Guideline Continuous Electroencephalography Monitoring in NeonatesShanaHBelum ada peringkat
- An Atypical Presentation of Kikuchi-Fujimoto Disease Mimicking Systemic Lupus Erythematosus: Case Report and Literature ReviewDokumen5 halamanAn Atypical Presentation of Kikuchi-Fujimoto Disease Mimicking Systemic Lupus Erythematosus: Case Report and Literature Reviewzulfikar adiBelum ada peringkat
- Multiple-System AtrophyDokumen15 halamanMultiple-System AtrophyNathasia SuryawijayaBelum ada peringkat
- Convulsion NeonataleDokumen15 halamanConvulsion NeonataleBookie BonishelliBelum ada peringkat
- Acute Disseminated Encephalomyelitis in Children: ObjectiveDokumen9 halamanAcute Disseminated Encephalomyelitis in Children: ObjectivecarlaBelum ada peringkat
- Meningitis - Bacterial Causes, Symptoms, Diagnosis and TreatmentDokumen3 halamanMeningitis - Bacterial Causes, Symptoms, Diagnosis and TreatmentDiana Fadhilah SariBelum ada peringkat
- Spectrum of Mri Findings in Pediatric Epilepsy Medical and Surgical Causes of Epilepsy in Children and Its Radiological CorrelatioDokumen4 halamanSpectrum of Mri Findings in Pediatric Epilepsy Medical and Surgical Causes of Epilepsy in Children and Its Radiological CorrelatioImroatul hafidzahBelum ada peringkat
- What you need to know about limbic encephalitisDokumen6 halamanWhat you need to know about limbic encephalitisNathaly CantorBelum ada peringkat
- Nokura 1997Dokumen7 halamanNokura 1997Luis CsrBelum ada peringkat
- 2020 Épileptogenèse Et Neuro InflammationDokumen22 halaman2020 Épileptogenèse Et Neuro InflammationFlorian LamblinBelum ada peringkat
- 1 PBDokumen7 halaman1 PBsahrirBelum ada peringkat
- Convulsiones y HemianopsiaDokumen2 halamanConvulsiones y HemianopsiadianisvillarrealBelum ada peringkat
- Influenza Virus and Reye's Syndrome Adults: VeteransDokumen6 halamanInfluenza Virus and Reye's Syndrome Adults: Veteransmayra alejandra pinilla guerreroBelum ada peringkat
- Asne-06-0617 BonDokumen4 halamanAsne-06-0617 BonCelebre MualabaBelum ada peringkat
- Expanded Mo Bius Syndrome: David Peleg, MD, Gina M. Nelson, MD, PHD, Roger A. Williamson, MD, and John A. Widness, MDDokumen4 halamanExpanded Mo Bius Syndrome: David Peleg, MD, Gina M. Nelson, MD, PHD, Roger A. Williamson, MD, and John A. Widness, MDLUTHIEN orquideaBelum ada peringkat
- Cardiac Involvement in Nonketotic HyperglycinemiaDokumen4 halamanCardiac Involvement in Nonketotic HyperglycinemiaDanny Bolaño MartinezBelum ada peringkat
- Evaluation and Management of The Dizzy Patient: L M LuxonDokumen8 halamanEvaluation and Management of The Dizzy Patient: L M LuxonCarolina Sepulveda RojasBelum ada peringkat
- Panencefalitis Esclerosante SubagudaDokumen5 halamanPanencefalitis Esclerosante SubagudaVictor Euclides Briones MoralesBelum ada peringkat
- Neurometabolic Hereditary Diseases of AdultsDari EverandNeurometabolic Hereditary Diseases of AdultsAlessandro P. BurlinaBelum ada peringkat
- Princes of the Apocalypse Locations IndexDokumen2 halamanPrinces of the Apocalypse Locations IndexPedroManzelaDuarteBelum ada peringkat
- Perspective in PharmacyDokumen3 halamanPerspective in PharmacyAgniez Hannah Permites100% (4)
- Unit 1 DinosaurDokumen5 halamanUnit 1 DinosaurAnamika ShabnamBelum ada peringkat
- Introduction To Pharmacy ManagementDokumen28 halamanIntroduction To Pharmacy ManagementSirry HidayaniBelum ada peringkat
- Shaft Deflection in Centrifugal PumpsDokumen2 halamanShaft Deflection in Centrifugal PumpsPieter van der WaltBelum ada peringkat
- Arp ReflectionDokumen3 halamanArp Reflectionapi-317806307Belum ada peringkat
- v072n10p257 PDFDokumen8 halamanv072n10p257 PDFLmf DanielBelum ada peringkat
- Edgar Allan Poe's "The RavenDokumen3 halamanEdgar Allan Poe's "The RavenЖанна ФодееваBelum ada peringkat
- Ra 6770Dokumen8 halamanRa 6770Jamiah Obillo HulipasBelum ada peringkat
- Brah, Revisting IntersectionalityDokumen12 halamanBrah, Revisting IntersectionalityhalimamuslimaBelum ada peringkat
- Armas Calisterio Vs CalisterioDokumen1 halamanArmas Calisterio Vs CalisterioAngie DouglasBelum ada peringkat
- Karakteristik Morfologik Kambing Spesifik Lokal Di Kabupaten Samosir Sumatera UtaraDokumen6 halamanKarakteristik Morfologik Kambing Spesifik Lokal Di Kabupaten Samosir Sumatera UtaraOlivia SimanungkalitBelum ada peringkat
- Practical 1Dokumen3 halamanPractical 1Paulus DorlenBelum ada peringkat
- Differential and Integral Calculus FormulasDokumen33 halamanDifferential and Integral Calculus FormulasKim Howard CastilloBelum ada peringkat
- Bagpipe Student Manual PDFDokumen116 halamanBagpipe Student Manual PDFRhonda Seiter75% (4)
- Tech - Speed Strength Endurance in 400Dokumen7 halamanTech - Speed Strength Endurance in 400jeyBelum ada peringkat
- Scenography Speaks Conversations of Jark PDFDokumen2 halamanScenography Speaks Conversations of Jark PDFshaily068574Belum ada peringkat
- Capoeira and The Politics of InequalityDokumen411 halamanCapoeira and The Politics of InequalityPipoca AngoleraBelum ada peringkat
- GEY 102-Introduction To Geology 1-Lecture Slides - Prof. M.E. NtonDokumen44 halamanGEY 102-Introduction To Geology 1-Lecture Slides - Prof. M.E. Ntonabuabdmuqseet2001Belum ada peringkat
- 211 - Organizational Behaviour-Pearson Education Limited (2020)Dokumen5 halaman211 - Organizational Behaviour-Pearson Education Limited (2020)mozam haqBelum ada peringkat
- An Investigation of The Reporting of Questionable Acts in An International Setting by Schultz 1993Dokumen30 halamanAn Investigation of The Reporting of Questionable Acts in An International Setting by Schultz 1993Aniek RachmaBelum ada peringkat
- Berkman Classics: Lawrence Lessig'S Ilaw CourseDokumen1 halamanBerkman Classics: Lawrence Lessig'S Ilaw CourseJoe LimBelum ada peringkat
- International Computer School Outlook RevisionDokumen5 halamanInternational Computer School Outlook RevisionJia Hui JoanaBelum ada peringkat
- Father Seraphim Rose and GeocentrismDokumen5 halamanFather Seraphim Rose and GeocentrismDan Constantin67% (6)
- Con Men ScamsDokumen14 halamanCon Men ScamsTee R TaylorBelum ada peringkat
- The General RetiresDokumen17 halamanThe General Retiresfo100% (1)
- 11th Commerce Mathematics and Statistics Part II Maharashtra BoardDokumen10 halaman11th Commerce Mathematics and Statistics Part II Maharashtra BoardTanmay Gholap100% (3)
- Touw 1982 Roses MedievalDokumen14 halamanTouw 1982 Roses MedievalВладан СтанковићBelum ada peringkat
- Present Tense Review for Motorcycle RepairDokumen2 halamanPresent Tense Review for Motorcycle RepairFaheemuddin Veterans50% (2)