Tarea 1,2 y 3
Diunggah oleh
Jhair André Choco ParedesJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Tarea 1,2 y 3
Diunggah oleh
Jhair André Choco ParedesHak Cipta:
Format Tersedia
TAREA 1-3 DE TERMODINAMICA APLICADA A LOS MINERALES
ALUMNO: GUERRERO FLORES, HERNAN RICARDO
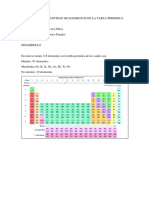
I. ELEMENTOS QUÍMICOS EXISTENTES
Átomo: Porción material menor de un elemento químico que interviene en las
reacciones químicas y posee las propiedades características de dicho elemento.
Elementos químicos: Elemento químico, o solamente elemento, es una sustancia
formada por átomos que tienen igual cantidad de protones en el núcleo, este
número se conoce como el número atómico del elemento. Los elementos químicos
no pueden ser descompuestos, mediante una reacción química, en otros más
simples.
La tabla periódica fue hecha para clasificar y dividir los elementos químicos,
partiendo de sus propiedades y características, básicamente su función es
establecer un orden a partir de la clasificación de los elementos. La tabla periódica
se divide en grupos, existen 18 grupos en total. Diez de estos grupos son
considerados elementos cortos, y ocho grupos restantes son conocidos como
grupos largos.
II. CAPACIDAD CALORÍFICA DE LOS COMPUESTOS
La capacidad calorífica o capacidad térmica de un cuerpo es el cociente entre la
cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso
cualquiera y el cambio de temperatura que experimenta. En una forma más
rigurosa, es la energía necesaria para aumentar la temperatura de una determinada
sustancia en una unidad de temperatura. Indica la mayor o menor dificultad que
presenta dicho cuerpo para experimentar cambios de temperatura bajo el
suministro de calor.
Donde:
Q es el calor ganado o perdido en julios o kilojulios (kJ)
m es la masa (kg),
ΔT es el cambio en la temperatura (K o °C)
Cp es el calor específico (kJ/kg °C) o (J/kg °C). El subíndice p significa "a presión
constante".
III. ELEMENTOS DE INTERÉS, FASE MINERAL Y FORMULA QUÍMICA
Cobre (Cu)
El cobre es un elemento químico de aspecto metálico, rojizo de número atómico 29
y con posición 29 en la tabla periódica. Su símbolo es Cu y pertenece al grupo de los
metales de transición y su estado habitual en la naturaleza es sólido. La mayor parte
del cobre del mundo se obtiene de los sulfuros minerales como la calcocita, covelita,
calcopirita, bornita y enargita. Los minerales oxidados son la cuprita, tenorita,
malaquita, azurita, crisocola y brocantita. El cobre es el primer elemento del
subgrupo Ib de la tabla periódica y también incluye los otros metales de acuñación,
plata y oro. Su átomo tiene la estructura electrónica 1s22s22p63s23p63d104s1. El bajo
potencial de ionización del electrón 4s1 da por resultado una remoción fácil del
mismo para obtener cobre(I), o ion cuproso, Cu+, y el cobre(II), o ion cúprico, Cu2+,
se forma sin dificultad por remoción de un electrón de la capa 3d. El peso atómico
del cobre es 63.546; tiene dos isótopos naturales estables 63Cu y 65Cu. También se
conocen nueve isótopos inestables (radiactivos).
El Cu se combina químicamente en alguno de sus posibles estados de valencia. La
valencia más común es la de 2+ (cúprico), pero 1+ (cuproso) es también frecuente;
la valencia 3+ ocurre sólo en unos cuantos compuestos inestables.
Anda mungkin juga menyukai
- Solicitud de Correo InstitucionalDokumen2 halamanSolicitud de Correo InstitucionalJhair André Choco ParedesBelum ada peringkat
- Optimizacion de La Molienda Mediante La ImplementacionDokumen22 halamanOptimizacion de La Molienda Mediante La ImplementacionJhair André Choco ParedesBelum ada peringkat
- Temas Basicos de Expertos de MoliendaDokumen9 halamanTemas Basicos de Expertos de MoliendaJhair André Choco ParedesBelum ada peringkat
- Actividad 2 TermodinamicaDokumen1 halamanActividad 2 TermodinamicaJhair André Choco ParedesBelum ada peringkat
- Tratados de Libre ComercioDokumen11 halamanTratados de Libre ComercioJhair André Choco ParedesBelum ada peringkat
- Plataf 1Dokumen53 halamanPlataf 1Jhair André Choco ParedesBelum ada peringkat
- TITLE-1 (1) .En - EsDokumen3 halamanTITLE-1 (1) .En - EsJhair André Choco ParedesBelum ada peringkat
- Actividad 1 TermodinamicaDokumen1 halamanActividad 1 TermodinamicaJhair André Choco ParedesBelum ada peringkat
- Indicar Comparaciones Entre CaolinitaDokumen3 halamanIndicar Comparaciones Entre CaolinitaJhair André Choco ParedesBelum ada peringkat
- Simulacro de Mineralogia y PetrologiaDokumen1 halamanSimulacro de Mineralogia y PetrologiaJhair André Choco ParedesBelum ada peringkat
- Manual para Indicadores PDFDokumen147 halamanManual para Indicadores PDFAlejandro BetancurBelum ada peringkat
- Indicadores de GestionDokumen76 halamanIndicadores de GestionJhonatan Mamani CañasacaBelum ada peringkat
- Tratados de Libre ComercioDokumen3 halamanTratados de Libre ComercioJhair André Choco ParedesBelum ada peringkat
- 42-47 2m305 - ES - 72dpi PDFDokumen6 halaman42-47 2m305 - ES - 72dpi PDFJhair André Choco ParedesBelum ada peringkat
- Tecnologia de Procesos e InnovacionDokumen8 halamanTecnologia de Procesos e InnovacionCristian Castelo TaipeBelum ada peringkat
- Tecnología de La Información Gerencial 2 JhairDokumen14 halamanTecnología de La Información Gerencial 2 JhairJhair André Choco ParedesBelum ada peringkat
- Tecnologias Limpia para La Mineria (Procesos Industriales) PDFDokumen28 halamanTecnologias Limpia para La Mineria (Procesos Industriales) PDFmarilyn acosta barzolaBelum ada peringkat
- Innovacion en Mineria 170816Dokumen18 halamanInnovacion en Mineria 170816Jhair André Choco ParedesBelum ada peringkat
- Metodología de La Investigación PDFDokumen12 halamanMetodología de La Investigación PDFJan ACBelum ada peringkat
- Tejidos Meristemales ApicalesDokumen7 halamanTejidos Meristemales ApicalesJhair André Choco ParedesBelum ada peringkat
- Hipotesis, Leyes y ModelosDokumen13 halamanHipotesis, Leyes y ModelosJhair André Choco ParedesBelum ada peringkat
- Tratados de Libre ComercioDokumen3 halamanTratados de Libre ComercioJhair André Choco ParedesBelum ada peringkat
- HipotesisDokumen4 halamanHipotesisGiovanniNevarezBelum ada peringkat
- El Conocimiento CientificoDokumen16 halamanEl Conocimiento CientificoOrtiz JavierBelum ada peringkat
- 01 El Conocimiento CientificoDokumen2 halaman01 El Conocimiento CientificoJhair André Choco ParedesBelum ada peringkat
- Tecnología de La Información Gerencial 2 JhairDokumen14 halamanTecnología de La Información Gerencial 2 JhairJhair André Choco ParedesBelum ada peringkat
- Como Escribir Una Tesis - Umberto EcoDokumen51 halamanComo Escribir Una Tesis - Umberto EcoCECADI29100% (1)
- Tecnología de La Información GerencialDokumen12 halamanTecnología de La Información GerencialJhair André Choco ParedesBelum ada peringkat
- Trabajo Final de Tecnología de La Información Gerencial (Aporte de Jhair)Dokumen26 halamanTrabajo Final de Tecnología de La Información Gerencial (Aporte de Jhair)Jhair André Choco ParedesBelum ada peringkat
- Curso de Recubrimientos AnticorrosivosDokumen24 halamanCurso de Recubrimientos AnticorrosivosAdrián JerezBelum ada peringkat
- Ejercicios Volumetrias Acido-BaseDokumen10 halamanEjercicios Volumetrias Acido-BaseJuan Jose Arias MezaBelum ada peringkat
- GCS 8BDokumen6 halamanGCS 8BAlexander George Madden PavónBelum ada peringkat
- Conversiones Coeficientes de Transferencia de MasaDokumen2 halamanConversiones Coeficientes de Transferencia de MasaL0L highlghtsBelum ada peringkat
- Aplicaciones de la electroterapia en tratamientos masotéuticosDokumen57 halamanAplicaciones de la electroterapia en tratamientos masotéuticosManuel Enrique Alarcon CastilloBelum ada peringkat
- Fuentes Reales de CorrienteDokumen8 halamanFuentes Reales de CorrienteAc AryanBelum ada peringkat
- Cocina Mejorada para PresentarDokumen50 halamanCocina Mejorada para PresentarJasmin Yanina Solis SantiagoBelum ada peringkat
- Los Amteriales Se Calientan3Dokumen5 halamanLos Amteriales Se Calientan3Rosa L. Condori CrispinBelum ada peringkat
- Catalogo 3M Fire BarrierDokumen8 halamanCatalogo 3M Fire Barrierperuavanza2014Belum ada peringkat
- Procedimiento de Carga Utilizado en El Mantenimiento Del Sistema de Aire AcondicionadoDokumen16 halamanProcedimiento de Carga Utilizado en El Mantenimiento Del Sistema de Aire AcondicionadoJorge Alfonso RodriguezBelum ada peringkat
- Principios de IngenieriaDokumen30 halamanPrincipios de IngenieriaMarianny FernandezBelum ada peringkat
- Determinación de Las Propiedades de Los Gases Ideales y Reales en Una MezclaDokumen6 halamanDeterminación de Las Propiedades de Los Gases Ideales y Reales en Una MezclaCataleya MoreBelum ada peringkat
- Apuntes de Fisicoquimica IIDokumen110 halamanApuntes de Fisicoquimica IIMary Espinosa100% (3)
- Defectos de Fundicion22Dokumen59 halamanDefectos de Fundicion22Carlos GutierrezBelum ada peringkat
- Mat PelDokumen6 halamanMat PelPedro PozoBelum ada peringkat
- Tabletas PlaceboDokumen15 halamanTabletas PlaceboMackrino'z Mkz100% (2)
- Informe de SoldaduraDokumen46 halamanInforme de SoldaduraCharly Loor L PrimosBelum ada peringkat
- Genes Y Genomas: Actividad ColaborativaDokumen9 halamanGenes Y Genomas: Actividad ColaborativaUnicornio bonitoBelum ada peringkat
- Upos Activantes y Desactivantes Del BencenoDokumen6 halamanUpos Activantes y Desactivantes Del BencenoJuan Luis Pérez Salas100% (2)
- Practica 10 CalorimetriaDokumen3 halamanPractica 10 CalorimetriaJuan Luis Ramírez AgudeloBelum ada peringkat
- Guia de Ejercicios N5 7Dokumen11 halamanGuia de Ejercicios N5 7KIHARA LIZETH MILLALDEO SAAVEDRABelum ada peringkat
- Gas IdealDokumen10 halamanGas IdealAlejandra ChacónBelum ada peringkat
- Manual de Riesgos y Medidas de Control y Prevención en La Operación de Cámaras de FumigaciónDokumen20 halamanManual de Riesgos y Medidas de Control y Prevención en La Operación de Cámaras de FumigacióndavoreinaBelum ada peringkat
- Practica 4 Ley de HessDokumen2 halamanPractica 4 Ley de HessAnyi Vanessa Muñoz CampoBelum ada peringkat
- Biospore Ficha TecnicaDokumen2 halamanBiospore Ficha TecnicadeysiBelum ada peringkat
- Funciones y metabolismo de los peroxisomas enDokumen39 halamanFunciones y metabolismo de los peroxisomas enJuan Pablo MassauBelum ada peringkat
- Cementos Portland normalizadosDokumen5 halamanCementos Portland normalizadosPercy Guevara DelgadoBelum ada peringkat
- Cuestionario FinalDokumen17 halamanCuestionario FinalLuis Montenegro SamaniegoBelum ada peringkat
- Tanques de Almacenamiento Fuel OilDokumen10 halamanTanques de Almacenamiento Fuel OilAndres Foffano100% (1)
- Influencia de las calizas en la calidad del óxido de calcioDokumen46 halamanInfluencia de las calizas en la calidad del óxido de calcioJunior VasquezBelum ada peringkat