Guia USal
Diunggah oleh
DENNYS AVILA CABRERAJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Guia USal
Diunggah oleh
DENNYS AVILA CABRERAHak Cipta:
Format Tersedia
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
INSTITUCIÓN EDUCATIVA PRIVADA
“EUCLIDES” E.I.R.L
R.D.R. Nº 01805
CALLE MIRAFLORES Nº 128- PILLCO MARCA
CEL. 962074825 - RPM: #962074825
QUIMICA: Composición
Centesimal OBS.: Dada la composición centesimal en
masa se puede hallar la relación
molecular del compuesto y con ello
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
Es la relación en porcentaje de un elemento obtener una relación aproximada de la
respecto del compuesto del cual forma parte. fórmula del compuesto.
Eje: En un Óxido de azufre cuya composición
• COMPOSICIÓN MOLECULAR. - Es cuando
del oxígeno en masa es 60%. Hallar la
la relación está dada con el número de átomos
formula.
gramo del compuesto.
Considerando 100 gr del óxido
Ejemplo: Del compuesto CH4
O = 60 gr y S = 40 gr como PA (O) = 16 y
1 PA (S) = 32
%C = 60
5 Oxígeno = 3,75
16
4
%H = moles
5
% C + % H= 1
40
Azufre = 1,25
32
moles
Oxígeno 3,75
H = = 3
H Azufre 1,25 1
c
Por cada mol de azufre tenemos 3 de oxígeno
SO3
H H EJERCICIOS DE APLICACIÓN
1) Hallar la composición en masa del Fe en FeO
• COMPOSICIÓN EN MASA. - Es cuando la en %
relación está dada con respecto a las masas de
los elementos del compuesto. a) 70,7 b) 85,7 c) 77,7
d) 98,7 e) 12
Ejemplo: Del compuesto CH4
2) Hallar la composición molecular del oxígeno en
Peso el monóxido de nitrógeno en %
atómico Peso Átomos Masa
del atómico gr. (gr)
a) 20 b) 30 c) 40
elemento
d) 50 e) 60
C 12 1 12
H 1 4 4 3) Hallar la composición en masa del litio en el óxido
TOTAL 16 de litio en % PA (O) = 16 PA(Li) = 6,9
% C= 12 = 3
16 4 a) 30,5 b) 54,8 c) 62,7
%H= 4 = 1 d) 46,3 e) N.A.
16 4
4) Del problema anterior dar la composición
% C + % H= 1
molecular del litio.
a) 1/3 b) 2/3 c) 4/3
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -1-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
d) 1 e) 3/4 d) 0,9 e) N.A.
5) Hallar la composición en masa del oxígeno en 13) Hallar la valencia de M en el problema 11
el óxido férrico en %.
a) 1 b) 2 c) 3
a) 34,3 b) 65,2 c) 46,2 d) 4 e) N.A.
d) 23,9 e) 18,4
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
6) En el problema anterior dar la composición 14) ¿Cuántos gramos de M existen en 240 gr del
molecular del fierro. óxido del problema 11?
a) 0,2 b) 0,25 c) 0,3 a) 192 b) 122 c) 150
d) 0,5 e) 0,65 d) 180 e) 212
7) Si 1/4 es la composición molecular del azufre 15) En la alúmina (Al2O3) la composición en
hallar el óxido del cual forma parte masa del aluminio es: PA (Al) = 27 PA
(O) = 16
a) SO b) SO2 c) SO3
d) SO4 e) N.A. a) 0,53 b) 0,37 c) 0,46
d) 0,85 e) 0,78
8) En el problema anterior la composición en
masa del oxígeno es: 16) Determinar la composición centesimal de los
a) 0,5 b) 0,6 c) 0,7 elementos en los siguientes compuestos.
d) 0,8 e) 0,9 • Dióxidos de carbono
9) La composición molecular del cloro es 2/9.
Hallar el anhídrido del cual forma parte.
a) Cl2O b) Cl2O3 c) Cl2O5 • Monóxido de carbono
d) Cl2O7 e) N.A.
10) Del problema anterior la composición en
masa del cloro es: PA (Cl) = 35,5 PA
(O) = 16 • Hidruro de litio
a) 0,39 b) 0,73 c) 0,09
d) 0,54 e) 0,18
11) Un elemento M produce un óxido que tiene • Hidróxido de calcio
a 80 como masa molecular. Si la composición
molecular del oxígeno es 1/3 hallar la masa
atómica de M.
• Óxido ferroso
a) 28 b) 34 c) 40
d) 26 e) 32
12) Del problema anterior la composición en • Óxido de aluminio (III)
masa del M es:
a) 0,6 b) 0,7 c) 0,8
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -2-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
QUIMICA: Unidades Química
E P.A. E P.A.
de Masa I
H 1 Na 23
Introducción C 12 Mg 25
N 14 Al 27
En química es común hablar de ciertas unidades
O 16 S 32
elementales de materia como átomo, molécula,
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
ion, fotón, etc. pero un experimentador químico E P.A. E P.A.
tratará de practicar o experimentar con un solo P 31 Cl 35,5
átomo, o una sola molécula o un solo ion.
K 39 Cu 63
Definitivamente que no; es imposible y será inútil
por el tamaño extremadamente pequeña que no Ca 40 Ag 108
se puede medir directamente por los instrumentos
Fe 56 Au 197
del laboratorio. Por el contrario, tratar con
cantidades mayores es más fácil y útil. Ejemplo:
La unidad numérica de conteo en química en el
Mol; pero antes de definir la mol, definiremos
Masa Atómica, masa molecular, masa formula.
Para medir la masa relativa de átomos y 2. Peso Molecular ( M ).- Es el peso relativo
moléculas se utiliza una unidad de masa muy promedio de un compuesto y resulta de sumar
pequeña, llamada unidad de masa atómica sus pesos atómicos según sus cantidades.
(U.M.A.)
M xa y = a P.A. (x) + b P.A. (y)
b
1 UMA = viene a ser la masa de la 1 parte del
12
átomo de carbono -12, el isótopo 12C es el átomo Ejm.:
patrón para determinar la escala de pesos
atómicos. MH 2O = 2 x P.A. (H) + 1 x P.A. (O) = 2 x
1 + 1 x 16 = 18 u.m.a.
masa C12 = 1
uma
ÁTOMO
MH2SO =
PATRÓN 4
1 uma = 1,66 x 10-24
g
MO2 =
Definiciones Químicas
1. Peso o Masa Atómica (P.A.): MC12H22O11 =
W 1 átomo (E)
P.A. (E) =
1 W 1 átomo 12C
12 M C 2H5OH =
W 1 átomo 12C 2 x 10-23 g
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -3-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
3. Átomo Gramo (at-g).- El átomo gramo de un
elemento es su peso atómico expresado en n = 272 → n=8
34
gramos.
1 at-g(E) = P.A.(E) ................... g EJERCICIOS DE APLICACIÓN
1. Hallar el peso molecular del HNO3. (H = 1; N
1 at-g (H) = 1 g = 14; O = 16)
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
a) 33 u.m.a. b) 53 c) 63
1 at-g(C) = d) 73 e) 36
1 at-g(S) =
2. Determinar el peso molecular del H3PO4 (P =
4. Mol Gramo (mol-g).- Es el proceso molecular
31)
de una sustancia expresado en gramos.
a) 68 u.m.a. b) 86 c) 98
1 mol-g(C) = M(C) ....................... g d) 108 e) 64
1 mol − g(H ) =2 g 3. Indique cual posee menor peso molecular. (C
2
1 mol − g(H O) = = 12 , N = 14 , H = 1)
2
1 mol − g(H S) =
2 a) CH4 b) NO2 c) NO
5. Número de Átomo Gramo (# at-g).- d) CO e) CO2
# at - g = W 4. Halle el peso molecular del carbonato de
P.A amonio (NH4)2 CO3 (N = 14 , H = 1 , C = 12)
Dónde: W = Peso; P.A. = Peso atómico a) 196 b) 198 c) 146
d) 90 e) 96
Ejm: Determinar el número de at-g contenidos
5. Un átomo gramo es:
en 64 g de oxígeno.
a) Peso molecular expresado en gramos.
Solución:
b) Gramos expresados en átomos.
64 g
# at − g = → # at-g = 4 c) Peso atómico expresado en gramos.
16 g
d) Ninguna
6. Número de Moles (n).-
e) Todas
n= W 6. Halle la masa de 2 at-g de cloro. (Cl = 35,5)
M
a) 70 b) 71 c) 35,5
d) 38 e) 49
Dónde: W = Peso M = Peso Molecular
7. Calcule la masa de 3 at-g de azufre. (S = 32)
Ejm.: Determinar el número de moles
contenidos en 272 g de ácido sulfhídrico (H2S) a) 32 b) 64 c) 96
d) 69 e) 99
Solución:
8. ¿Cuántos átomos gramo existen en 4000 g de
MH S = 34 calcio metálico? (Ca = 40)
2
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -4-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
a) 10 b) 100 c) a) 128 b) 156 c) 284
1000 d) 220 e) 120
d) 10000 e) 40
15. Señalar “V” o “F” según corresponda:
9. Determinar cuántos at-g de azufre existen en
160 g de dicho elemento en polvo. El peso de un átomo es igual al peso
atómico
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
a) 50 b) 5 c) 15 ( )
d) 0,5 e) 55
1 Mol equivale a 6,023 x 1023 unidades
10. Hallar el peso atómico de un elemento químico ( )
que presenta a isótopos cuyos números de
masa son 50 y 52 con abundancias del 60% y
1 at-g es igual al peso molecular
40% respectivamente.
expresado en gramos
( )
a) 51 b) 52,8 c) 50,8
d) 51,2 e) 50,5 El peso molecular del Oxígeno es 16
( )
11. Un elemento “x” tiene dos isótopos que 1 Mol – g contiene 6,023 x 1023 moléculas
presentan números de masa 42 y 43. Si por ( )
cada 5 átomos ligeros existen 3 átomos
pesados. ¿Cuál es el P.A. de dicho
El número de Avogadro puede
elemento?
aproximarse a 6 x 1023
( )
a) 42,825 b) 42,375 c) 42,125
d) 43,626 e) N.A. El peso molecular es igual al peso de una
molécula ( )
12. El peso atómico de un elemento con 3 Si P.A. (Fe) = 56 y P.A.(O) = 16, entonces
isótopos es 25, 7. Sabiendo que dos de ellos el peso molecular de FeO es 72
tienen números de masa 25 y 26 con un 50% ( )
y 40% de abundancia ¿Cuál es el número de
masa del tercer isótopo?
a) 23 b) 24 c) 28
d) 29 e) 30
13. Determinar el peso molecular de C6H4(NO2)2
(C = 12, H = 1, N = 14, O = 16)
a) 336 b) 168 c) 324
d) 228 e) 122
14. Sabiendo que el peso molecular del Fe3Ox
es 232. Hallar el peso molecular del PxO6.
P.A. : [Fe = 56 ; P = 31]
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -5-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
QUIMICA: Unidades EJERCICIOS DE APLICACIÓN
Químicas de Masa II
1. ¿Cuántos átomos existen en 80 g de calcio?
Ca = 40
Concepto de Mol
a) No b) 2 No c) 2,5
Las personas, para cuantificar los materiales No
utilizan ciertas unidades de conteo, como la
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
d) 1,5 No e) 5 No
docena (12 u), el millar (1000 u), etc. Los
químicos para contar partículas constituyentes de 2. ¿Cuántos átomos existen en 64 g de oxigeno?
la materia utilizan el mol. O = 16g
El término Mol significa el número de átomos que a) 2No b) 3 No c) 4 No
están contenidos en un at-g; o el número de d) 5 No e) 6 No
moléculas en un mol-g de un compuesto.
(Llamado número de Avogadro; NA) 3. ¿Cuántas moléculas existen en 392 g de ácido
sulfúrico (H2SO4)?
NA = No = 6,023x10 23 átomos = 6,023x10 23 moléculas
at − g mol − g a) No b) 2 No c) 3
No
Relaciones Importantes d) 4 No e) 5 No
4. ¿Cuántas moléculas existen en 272 g de ácido
W = # átomos W = # moléculas
P.A. No No sulfhídrico (H2S)? (S = 32)
M
... (1) ...
(2) a) 2 No b) 4 No c) 6 No
d) 7 No e) 8 No
Ejm: 5. ¿Cuántos átomos se tendrá en 9,85 g de oro
(Au = 197)?
– Su masa es 98 g
– Contiene 6,023 x 1023 a) 3 . 1022 b) 2 . 1024 c) 7 . 1029
moléculas de H2SO4 d) 7,35 . 1025 e) N.A.
1 mol-g
– Contiene No moléculas
(H2SO4)
=
de H2SO4 6. ¿Cuántos mol - g existen en 1400 g de cal viva
– Contiene 2 g(H) 2 (CaO)?
98
at-g(H) 2 No
átomos (H) a) 5 b) 10 c) 15
– Contiene 32 g(S) 1 d) 20 e) 25
at-g(S) 1 No
átomos (S) 7. La leche de magnesia contiene hidróxido de
– Contiene 64 g(O) 4 magnesio Mg(OH)2. ¿Cuántos gramos de este
compuesto están contenidos en 2 mol - g de
at-g(O) 4 No
este compuesto? P.A(Mg = 24)
átomos (O)
a) 116 g b) 54 g c) 41 g
d) 82 g e) 123 g
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -6-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
8. Se sabe que 2 mol - g de A2B3 pesan 210 g. 14. ¿Cuánto pesan 4,5 x 1023 moléculas de ácido
Determine el peso molecular del compuesto sulfúrico (H2SO4)? P.A. (S = 32, O =
A2B3. 16, H = 1)
a) 210 uma b) 105 uma c) 212 uma
d) 21 uma e) 65 uma
a) 49 g b) 73, 5 c) 98
9. ¿Cuántos átomos de oxígeno existen en 0,3 d) 196 e) 24,5
moles de H2SO4? (No = 6 . 1023)
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
15. Determinar el peso de 3 átomos de aluminio.
a) 3 No b) 4 No c) 5 No
P.A. (Al) = 27
d) 6 No e) 1,2 No
a) 1,35 x 10-23 g d) 1,35 x 10-24 g
10. Hallar el número de átomos gramo (at – g) b) 1, 35 x 10-22 g e) N.A.
que hay en una muestra que contiene 120 g de c) 1,35 x 10-21 g
carbono y 280 g de Hierro. P.A. (Fe =
56 , C = 12)
a) 20 b) 25 c) 30
d) 10 e) 15
11. ¿Cuántos átomos existen en 1300 g de zinc?
P.A. (Zn) = 65. No = 6 x 1023
a) 10No b) 2No c) 20No
d) 18No e) 30No
12. ¿Cuál es el peso de una muestra que contiene
2 x 1011 átomos de magnesio? P.A.
(Mg) = 24
a) 8 x 1011 g b) 8 x 10-12 g c) 8 x 10-13 g
d) 8 x 10-14 g e) 8 x 10-15 g
13. Si el átomo de un elemento “x” pesa 1,2 x 10-
22
g ¿Cuál es el peso atómico de dicho
elemento?
a) 72,2 b) 52,5 c) 720,1
d) 80, 4 e) 40,8
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -7-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
1. H2 + O2 → H2O
QUIMICA: Reacciones 2. N2 + O2 → NH3
Quimicas I
3. Ca + O2 → CaO
Reacciones Químicas.- b. Reacción de Descomposición.-
AB A + B
Son procesos químicos, donde la
materia sufrecambios estructurales para dar
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
= calor
origen a nuevas sustancias químicas.
Un compuesto por defecto de energía se
descompone en 2 o más sustancias.
Ecuación Química.-
H2O H2 + O2
Es la forma abreviada de escribir que es
lo que sucede en una reacción química. A las CaCO3 CaO + CO2
sustancias iniciales se les denomina
KClO3 KCl + O2
Reactantes o Reaccionantes y a las que se
obtiene se denominan Productos o
c. Reacción de Desplazamiento Simple ó
Resultantes.
Simple Sustitución
A + BC → AC + B
Zn H2
1. Zn + HCl → ZnCl2 + H2
2. Fe + Al2O3 → Fe2O3 + Al
3. Na + H2O → NaOH + H2
HCl
4. Mg + HCl → MgCl2 + H2
ZnCl2
d. Reacción de Doble Desplazamiento
(Metátesis)
HCl (ac) + Zn(s) → ZnCl2 (s) + H2 (g)
AB + CD → AD + BC
Reactantes Productos
Reaccionantes Resultantes
1. AgNO3 + HCl → AgCl + HNO3
Tipos de Reacciones Químicas 2. AgNO3 + NaCl → AgCl + NaNO3
3. 2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Las reacciones químicas se clasifican 4. 2 NaOH + CaCO3 → Na2CO3 +
atendiendo a diversos criterios, entre los Ca(OH)2
principales tenemos:
e. Reacción de Combustión.-
a. Reacción de Composición, Adición o
Síntesis.- Se refiere a las reacciones que realizan los
compuestos orgánicos con el oxígeno.
A + B → AB
El compuesto orgánico actúa como
Se combinan 2 o más sustancias para formar combustible.
un solo compuesto. El oxígeno actúa como comburente.
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -8-
¡EUCLIDES, TU MEJOR OPCIÓN EN FORMACIÓN ACADÉMICA…!
Combustión Completa.- Los productos de la 5. ¿Cuál no es una reacción redox?
reacción son : CO2 + H2O
a) Zn + O2 → ZnO
CxHy + O2 → CO2 + H2O
b) Fe + O2 → FeO
Ejm.: oxígeno en exceso c) NaOH + H2SO4 → NaSO4 + H2O
d) HCl + KOH → KCl + H2O
C8H8 + O2 → CO2 + H2O e) c y d
En Euclides … “La sabiduría es la aplicación del conocimiento matemático”
C2H5OH + O2 → CO2 + H2O
6. Dar 4 ejemplos de reacción de metátesis.
Combustión Incompleta.- Los productos de
la reacción son: CO + H2O debido a la
• -------------------------------------------------
deficiencia de oxígeno; si es muy deficiente los
• …………………………………………..
productos son:
C + H2O • …………………………………………..
• …………………………………………..
CxHy + O2 → CO + H2O
7. Balancear por tanteo:
CxHy + O2 → C + H2O
a) C10H22 + O2 → CO2 + H2O
Hollín b) C10H10 + O2 → CO + H2O
Ejm. :
C8H18 + O2 → CO + H2O c) C3H8O3 + O2 → CO2 + H2O
C3H18 + O2 → CO + H2O d) C8H16O + O2 → CO2 + H2O
e) C12H22O11 + O2 → CO2 + H2O
EJERCICIOS DE APLICACIÓN
1. Las reacciones químicas de combustión
completa e incompleta respectivamente tienen
como producto a :
2. En toda reacción exotérmica se libera :
a) Protones b) Electrones c) Átomos
d) Energía e) Moléculas
3. ¿Cuál es una reacción de adición?
a) N2 + H2 → NH b) C + O2 → CO2
c) H2 + O2 → H2O d) F + Cl2 → FeCl3
e) Todas
4. Nombrar 5 ejemplos cotidianos de reacción
química.
COLEGIO MATEMÁTICO “EUCLIDES” AÑO ESCOLAR 2018
Pág. -9-
Anda mungkin juga menyukai
- Composición Centesimal para Primero de SecundariaDokumen3 halamanComposición Centesimal para Primero de SecundariaAnonymous wQ4ReuHBelum ada peringkat
- Composición Centesimal para Primero de SecundariaDokumen3 halamanComposición Centesimal para Primero de SecundariaChyvety Flores RangelBelum ada peringkat
- Composición centesimal y fórmulas químicasDokumen3 halamanComposición centesimal y fórmulas químicaschideleon0% (1)
- Tipos de Composicion para Tercero de SecundariaDokumen3 halamanTipos de Composicion para Tercero de SecundariaRotsen ZelopBelum ada peringkat
- QUIMICA5 SESION4 IIIBim.Dokumen3 halamanQUIMICA5 SESION4 IIIBim.Ariana FSBelum ada peringkat
- QuimicaDokumen4 halamanQuimicaMiguel ValleBelum ada peringkat
- Composición Centesimal para Primero de SecundariaDokumen4 halamanComposición Centesimal para Primero de SecundariaInforlink Impresiones0% (1)
- Composición Centesimal para Primero de SecundariaDokumen4 halamanComposición Centesimal para Primero de SecundariaMarco LeonBelum ada peringkat
- Composición centesimal y fórmulas químicasDokumen4 halamanComposición centesimal y fórmulas químicasMauricio PessoaBelum ada peringkat
- Teoría y Practica - Composición CentesimalDokumen3 halamanTeoría y Practica - Composición CentesimalRodolfo Castro MirandaBelum ada peringkat
- Ficha de Formulas QuimicasDokumen2 halamanFicha de Formulas QuimicasMarco MenesesBelum ada peringkat
- Guía # 3 Formulas QuimicasDokumen4 halamanGuía # 3 Formulas QuimicasEukarys SáenzBelum ada peringkat
- Fórmulas QuímicasDokumen3 halamanFórmulas Químicaspradamaria328Belum ada peringkat
- Composiciones Porcentuales Y Formulas QuimicasDokumen7 halamanComposiciones Porcentuales Y Formulas QuimicasAna Felicia Rodriguez MartinezBelum ada peringkat
- Boletin 3Dokumen7 halamanBoletin 3Ixchel Ameyalli Reyna SierraBelum ada peringkat
- Fórmulas Químicas - Deymar Andrés PradoDokumen6 halamanFórmulas Químicas - Deymar Andrés PradoCarlos Andrés Prado IbarraBelum ada peringkat
- Capitulo XV - MezclasDokumen4 halamanCapitulo XV - MezclasVES18Belum ada peringkat
- Ciclo Verano 2022: Grado: 2 Do SecundariaDokumen21 halamanCiclo Verano 2022: Grado: 2 Do SecundariaJorge TorresBelum ada peringkat
- Taller de Refuerzo 2 - 9Dokumen4 halamanTaller de Refuerzo 2 - 9Valentina Tejedor sotoBelum ada peringkat
- Tipos de Composicion para Tercero de SecundariaDokumen3 halamanTipos de Composicion para Tercero de SecundariaKennedy FloresBelum ada peringkat
- Composicion Empirica y MolecularDokumen6 halamanComposicion Empirica y MolecularANGEL CORDOVABelum ada peringkat
- Ciclo VDokumen7 halamanCiclo VMei-MarquezBelum ada peringkat
- Composicion CentesimalDokumen2 halamanComposicion CentesimalKennedy FloresBelum ada peringkat
- Estequiometría IDokumen4 halamanEstequiometría IlisaracelicrBelum ada peringkat
- Cap 8 Quimica 4to AñoDokumen17 halamanCap 8 Quimica 4to AñoPaul CRBelum ada peringkat
- Ejemplo 4toa B C Composicion QuimicaDokumen6 halamanEjemplo 4toa B C Composicion QuimicaJose TorresBelum ada peringkat
- ESTEQUIOMETRIADokumen12 halamanESTEQUIOMETRIAnancy100% (1)
- Compocisión PorcentualDokumen4 halamanCompocisión PorcentualRonnyer Farith Ruiz MarquezBelum ada peringkat
- Laboratorio N°5Dokumen11 halamanLaboratorio N°5JhonatanLidioMenachoAnguloBelum ada peringkat
- Relaciones de Masa en Las Reacciones QuímicasDokumen21 halamanRelaciones de Masa en Las Reacciones QuímicasHilda Marizol Choque EstañaBelum ada peringkat
- Repaso Mol, Numero Avogadro y Formulas QuimicasDokumen6 halamanRepaso Mol, Numero Avogadro y Formulas QuimicasJairo Alexis QuinteroBelum ada peringkat
- Composición CentesimaDokumen4 halamanComposición CentesimaAURELIO BAZAN ROJASBelum ada peringkat
- Fórmula Empírica, Molecular y PorcentualDokumen3 halamanFórmula Empírica, Molecular y PorcentualFabián Andrés QuinteroBelum ada peringkat
- Fórmula empírica, molecular, porcentajes, estequiometríaDokumen3 halamanFórmula empírica, molecular, porcentajes, estequiometríaAna María LópezBelum ada peringkat
- Composición Porcentual y Formulas Empiricas y MolecularesDokumen6 halamanComposición Porcentual y Formulas Empiricas y MolecularesDavid DeelavillaBelum ada peringkat
- S03.s1 Tarea Calificada 2 JoelChireDokumen5 halamanS03.s1 Tarea Calificada 2 JoelChirejoelchireBelum ada peringkat
- Clase 7 - Aritmetica QuímicaDokumen54 halamanClase 7 - Aritmetica QuímicaMilagros RabanalBelum ada peringkat
- 2da ASIGNACION, I PARCIAL QUIMICA IIDokumen5 halaman2da ASIGNACION, I PARCIAL QUIMICA IInazarethlainezhernandezBelum ada peringkat
- Producto 29Dokumen5 halamanProducto 29Alejandra PBelum ada peringkat
- Sesion 7 Aritmetica QuimicaDokumen31 halamanSesion 7 Aritmetica Quimicachristianpe1Belum ada peringkat
- Composición PorcentualDokumen2 halamanComposición PorcentualCarlos Oswaldo García ParedesBelum ada peringkat
- La masa atómica y molecular: definición y cálculo de fórmulas empíricasDokumen19 halamanLa masa atómica y molecular: definición y cálculo de fórmulas empíricaskakakakakaka123Belum ada peringkat
- Qu - Mica 9 - Gu - A 5Dokumen14 halamanQu - Mica 9 - Gu - A 5UNAD VIRTUALBelum ada peringkat
- Clase 15 - Formulas QuimicasDokumen7 halamanClase 15 - Formulas QuimicasJuan Jose MedinaBelum ada peringkat
- Teoria y Ejercicios de Composicion Porcentual 3° CVMDokumen6 halamanTeoria y Ejercicios de Composicion Porcentual 3° CVMWaldo Lino Palma Soriano100% (2)
- s03.s1 - MaterialDokumen18 halamans03.s1 - MaterialLuisa GallegoBelum ada peringkat
- Estequiomatria Camila PDFDokumen6 halamanEstequiomatria Camila PDFmas mabelBelum ada peringkat
- Composición CentesimalDokumen4 halamanComposición CentesimalVictor Barreda100% (1)
- La Composición PorcentualDokumen10 halamanLa Composición PorcentualCarlos Velasquez Borda100% (1)
- Teo Mat Doc Resumen Unidad Espacio ProDokumen3 halamanTeo Mat Doc Resumen Unidad Espacio ProEva ChacónBelum ada peringkat
- Formula EmpiricaDokumen4 halamanFormula EmpiricaVanessa SaavedraBelum ada peringkat
- Fisico Quimica DensidadDokumen14 halamanFisico Quimica DensidadLuis Miguel Pauca ChoquehuaytaBelum ada peringkat
- Guia Quimica Formulas Quimicas 11ADokumen2 halamanGuia Quimica Formulas Quimicas 11Acristian humberto avella alarconBelum ada peringkat
- Lectura de AGADokumen1 halamanLectura de AGADaniela Nichole Choquepuma CanchariBelum ada peringkat
- Composiciones Porcentuales Y Fórmulas Químicas 10Dokumen8 halamanComposiciones Porcentuales Y Fórmulas Químicas 10arca94Belum ada peringkat
- Clase 7 - Fórmula Empírica y MolecularDokumen21 halamanClase 7 - Fórmula Empírica y MolecularLuis Renato ChirobogaBelum ada peringkat
- Formulacion Organica Revisada 10-4-12Dokumen29 halamanFormulacion Organica Revisada 10-4-12Ángel Mateo GómezBelum ada peringkat
- Formulas y MoleculasDokumen12 halamanFormulas y MoleculasJuan Pablo Urbano UrbanoBelum ada peringkat
- Formulas QuimicasDokumen9 halamanFormulas Quimicasapi-294786513Belum ada peringkat
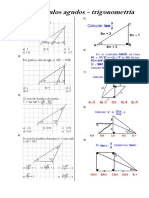
- Ángulo Trigonométrico 3ro de SecDokumen2 halamanÁngulo Trigonométrico 3ro de SecDENNYS AVILA CABRERABelum ada peringkat
- Sistema Sexagesimal 3roDokumen2 halamanSistema Sexagesimal 3roDENNYS AVILA CABRERABelum ada peringkat
- PROBABILIDADESDokumen2 halamanPROBABILIDADESDENNYS AVILA CABRERABelum ada peringkat
- Resolución de problemas de movimiento de móvilesDokumen17 halamanResolución de problemas de movimiento de móvilesjunior sandonBelum ada peringkat
- Longitud de Arco y Área Del Sector Circular - 3ro de SecDokumen2 halamanLongitud de Arco y Área Del Sector Circular - 3ro de SecDENNYS AVILA CABRERABelum ada peringkat
- Razones Trig de Ang AgudosDokumen2 halamanRazones Trig de Ang AgudosDENNYS AVILA CABRERABelum ada peringkat
- Primer Examen de Segundo AñoDokumen1 halamanPrimer Examen de Segundo AñoDENNYS AVILA CABRERABelum ada peringkat
- Ángulo Trigonométrico 2do SecDokumen1 halamanÁngulo Trigonométrico 2do SecDENNYS AVILA CABRERABelum ada peringkat
- Ángulos trigonométricos básicosDokumen2 halamanÁngulos trigonométricos básicosDENNYS AVILA CABRERABelum ada peringkat
- DS #001-2019-Minedu y AnexosDokumen57 halamanDS #001-2019-Minedu y AnexosCPPeru100% (1)
- Operadores Matemáticos CuartelDokumen1 halamanOperadores Matemáticos CuartelDENNYS AVILA CABRERABelum ada peringkat
- REQUISITOSDokumen12 halamanREQUISITOSwilliam hurtado casaverde0% (1)
- Estatica y DinamicaDokumen4 halamanEstatica y DinamicaDENNYS AVILA CABRERABelum ada peringkat
- Ejercicios Sel2x2Dokumen1 halamanEjercicios Sel2x2DENNYS AVILA CABRERABelum ada peringkat
- Estatica y DinamicaDokumen3 halamanEstatica y DinamicaDENNYS AVILA CABRERABelum ada peringkat
- Razones Trig de Ang Agudos IIDokumen2 halamanRazones Trig de Ang Agudos IIDENNYS AVILA CABRERABelum ada peringkat
- Ficha 03-Área IiiDokumen3 halamanFicha 03-Área IiiDENNYS AVILA CABRERABelum ada peringkat
- Razones Trig de Ang AgudosDokumen1 halamanRazones Trig de Ang AgudosDENNYS AVILA CABRERABelum ada peringkat
- FICHA 01-1ro Analítica IDokumen2 halamanFICHA 01-1ro Analítica IDENNYS AVILA CABRERABelum ada peringkat
- Tarea 01-3er Trimestre PreDokumen1 halamanTarea 01-3er Trimestre PreDENNYS AVILA CABRERABelum ada peringkat
- Ficha 02-2do Año T3Dokumen3 halamanFicha 02-2do Año T3DENNYS AVILA CABRERABelum ada peringkat
- Ficha 02-2do Año T3Dokumen3 halamanFicha 02-2do Año T3DENNYS AVILA CABRERABelum ada peringkat
- Figuras lógicas y analogías en prueba psicotécnicaDokumen4 halamanFiguras lógicas y analogías en prueba psicotécnicaDENNYS AVILA CABRERABelum ada peringkat
- Ficha 02-Geometría Anlítica 1ro SecDokumen1 halamanFicha 02-Geometría Anlítica 1ro SecDENNYS AVILA CABRERABelum ada peringkat
- Tarea 01-3er Trimestre PreDokumen1 halamanTarea 01-3er Trimestre PreDENNYS AVILA CABRERABelum ada peringkat
- Primera ComunionDokumen1 halamanPrimera ComunionDENNYS AVILA CABRERABelum ada peringkat
- FICHA 01-1ro Analítica IDokumen2 halamanFICHA 01-1ro Analítica IDENNYS AVILA CABRERABelum ada peringkat
- Tarea 1 Alg - PreDokumen1 halamanTarea 1 Alg - PreDENNYS AVILA CABRERABelum ada peringkat
- Semana IDokumen10 halamanSemana IDENNYS AVILA CABRERABelum ada peringkat
- Examen ParcialDokumen1 halamanExamen ParcialDENNYS AVILA CABRERABelum ada peringkat
- Nomenclatura QuimicaDokumen14 halamanNomenclatura QuimicaMONICA YINETH RODRIGUEZ ESCOBARBelum ada peringkat
- Practica 6 Nitracion de La Tirosina 2.00Dokumen8 halamanPractica 6 Nitracion de La Tirosina 2.00Montse HortaBelum ada peringkat
- TesisDokumen52 halamanTesisLuis Enrique Cardenas ArzapaloBelum ada peringkat
- Clase 8 Evapotranspiración PotencialDokumen41 halamanClase 8 Evapotranspiración PotencialDAYANBelum ada peringkat
- Elementos Tabla PeriódicaDokumen4 halamanElementos Tabla PeriódicaLuis UlakiaBelum ada peringkat
- Geología Ebau Murcia 2018Dokumen5 halamanGeología Ebau Murcia 2018Nina Romero RicciBelum ada peringkat
- Mezclas Alcalinas - Colin PortilloDokumen15 halamanMezclas Alcalinas - Colin PortilloAlejandra TapiaBelum ada peringkat
- Marco TeoricoDokumen6 halamanMarco TeoricoRoxanna ArreguiBelum ada peringkat
- Proy Estud SuelosDokumen17 halamanProy Estud SuelosLeslie Selene Leandro TimoteoBelum ada peringkat
- Andrea Liseth Muñoz Torres. Tec Produccion de Petroleo Y Gas. Determinacion de Salinidad Blanco. InicioDokumen2 halamanAndrea Liseth Muñoz Torres. Tec Produccion de Petroleo Y Gas. Determinacion de Salinidad Blanco. InicioAndrea muñozBelum ada peringkat
- 5.2 Construcción PilasDokumen30 halaman5.2 Construcción PilasJJ Salgado IIBelum ada peringkat
- Materiales TareaDokumen23 halamanMateriales Tareadiego quevedoBelum ada peringkat
- Ejercitario ElectrostaticaDokumen2 halamanEjercitario ElectrostaticaPalazzus :0Belum ada peringkat
- Exposicion Las SolucionesDokumen8 halamanExposicion Las SolucionesJose Julian Duran CalderonBelum ada peringkat
- Informe 1 CSDokumen10 halamanInforme 1 CSSara Rojas AgudeloBelum ada peringkat
- Electro EstáticaDokumen12 halamanElectro EstáticaEsmeralda AguilarBelum ada peringkat
- Ficha Tecnica R-18aDokumen2 halamanFicha Tecnica R-18aEduardo José García PérezBelum ada peringkat
- Balance de Materia Energia VCMDokumen48 halamanBalance de Materia Energia VCMHenryJhoelSaldañaBustamanteBelum ada peringkat
- 5.2 Síntesis Del AmoníacoDokumen10 halaman5.2 Síntesis Del AmoníacoMoztazaMerloBelum ada peringkat
- Dinámica puntoDokumen19 halamanDinámica puntoDiana Wagner WinterBelum ada peringkat
- Fundamentos de La EspectroscopíaDokumen17 halamanFundamentos de La EspectroscopíaGaby CampoverdeBelum ada peringkat
- Libro 3ro. Secundaria 2021 Módulo 1Dokumen23 halamanLibro 3ro. Secundaria 2021 Módulo 1Rene CastroBelum ada peringkat
- Riles 7Dokumen4 halamanRiles 7Carlitos WayBelum ada peringkat
- Ejercicios de Actividad EnzimaticaDokumen5 halamanEjercicios de Actividad EnzimaticaCarlos A. Olivares SalasBelum ada peringkat
- Procesos de coagulación y floculación en el tratamiento de aguasDokumen6 halamanProcesos de coagulación y floculación en el tratamiento de aguasAlejandro CangiBelum ada peringkat
- Clasificacion de La MateriaDokumen4 halamanClasificacion de La MateriaCarlosBelum ada peringkat
- LINKS Coleccion MIRDokumen10 halamanLINKS Coleccion MIRYustthy LB100% (2)
- Tablas Dinamica de FluidosDokumen11 halamanTablas Dinamica de FluidosRicardo CruzBelum ada peringkat
- Examen práctico de química general con cálculos de reacciones químicasDokumen1 halamanExamen práctico de química general con cálculos de reacciones químicasraul rocha mejiaBelum ada peringkat
- Ppa6 - 3° Zona CoxcatlanDokumen51 halamanPpa6 - 3° Zona Coxcatlanventas.ml.soluciones.tiBelum ada peringkat