RPP Kesetimbangan Kimia
Diunggah oleh
Muhamad Saepul Anwar0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
74 tayangan12 halamanFaktor-faktor Kesetimbangan kimia
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniFaktor-faktor Kesetimbangan kimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
74 tayangan12 halamanRPP Kesetimbangan Kimia
Diunggah oleh
Muhamad Saepul AnwarFaktor-faktor Kesetimbangan kimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 12
RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Muhamad Saepul Anwar
Sekolah : SMA 1162080044
Mata Pelajaran : Kimia
Kelas/Semester : XI IPA/Satu
Materi Pokok : Faktor Kesetimbangan Kimia
Alokasi Waktu : 1 x 25 Menit
A. Tujuan Pembelajaran
Melalui model pembelajaran Inkuiri terbimbing, siswa dapat merancang dan melakukan
percobaan mengenai pengaruh faktor kesetimbangan berdasarkan konsentrasi dan suhu, juga
dapat menyajikan serta menyimpulkan hasil percobaan mengenai pengaruh faktor
kesetimbangan tersebut berdasarkan arah pergeserannya, sehingga siswa memiliki sikap
kritis, jujur, tanggung jawab, dan kerja sama.
B. Kompetensi Dasar dan Indikator Pencapaian Kompetensi
Kompetensi Dasar (KD) Indikator Pencapaian Kompetensi (IPK)
4.9 Merancang, melakukan, dan 4.9.1 Siswa dapat merancang percobaan
menyimpulkan serta menyajikan pengaruh faktor konsentrasi dan suhu
hasil percobaan faktor-faktor yang terhadap pergeseran kesetimbangan
mempengaruhi pergeseran arah berdasarkan wacana dengan tepat
kesetimbangan 4.9.2 Siswa dapat melakukan percobaan
pengaruh faktor konsentrasi dan suhu
terhadap pergeseran kesetimbangan
berdasarkan wacana dengan tepat
4.9.3 Siswa dapat menyajikan hasil diskusi
mengenai pengaruh faktor konsentrasi
dan suhu terhadap pergeseran
kesetimbangan dengan tepat
berdasarkan percobaan
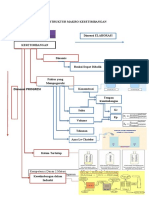
C. Materi Pembelajaran
Materi prasyarat: Reaksi Kimia
Materi Faktual
Pada tahun 1884, Henri Louis Le Chalteler berhasil menyimpulkan pengaruh faktor luar
terhadap kesetimbangan.
Materi Konseptual
Faktor-faktor yang mempengaruhi kesetimbangan:
1. Pengaruh Perubahan Konsentrasi Terhadap Kesetimbangan kimia.
2. Pengaruh Perubahan Suhu Terhadap Kesetimbangan.
Secara kualitatif pengaruh suhu dalam kesetimbangan kimia terkait langsung dengan
jenis reaksi eksoterm atau reaksi endoterm. Reaksi eksothermis adalah reaksi bersifat
spontan, tidak memerlukan energi melainkan justru menghasilkan energi (H reaksi
negatif), sedangkan Reaksi endothermis adalah reaksi yang membutuhkan
energi/kalor untuk bisa bereaksi (H positif). Sistem kesetimbangan yang bersifat
eksothermis ke arah kanan dan endothermis ke arah kiri.
3. Pengaruh Perubahan Tekanan atau Volume Terhadap Kesetimbangan.
Materi Prinsip
1. Jika konsentrasi salah satu zat ditambah, maka sistem akan bergeser dari arah zat
tersebut. Jika konsentrasi salah satu zat dikurangi, maka sistem akan bergeser ke arah
zat tersebut.
2. Jika suhu dinaikkan, maka reaksi akan bergeser ke kiri yaitu reaksi yang bersifat
endotermis. Sebaliknya bila suhu reaksi diturunkan maka reaksi akan bergeser ke
kanan yaitu reaksi yang bersifat eksotermis. Menaikan suhu, sama artinya kita
meningkatkan kalor atau menambah energi ke dalam sistem, kondisi ini memaksa
kalor yang diterima sistem akan dipergunakan, oleh sebab itu reaksi semakin bergerak
menuju arah reaksi endoterm. Begitu juga sebaliknya.
3. Menurut hukum gas ideal, bahwa tekanan berbanding lurus dengan jumlah mol gas
dan berbanding terbalik dengan volum. Jika tekanan diperbesar maka jumlah mol
juga bertambah, dan volume akan mengecil maka kesetimbangan akan bergeser ke
arah reaksi yang jumlah molnya lebih kecil. Begitu juga sebaliknya jika tekanan
diperkecil maka jumlah mol juga akan kecil, dan volume akan besar maka
kesetimbangan akan bergeser ke arah reaksi yang jumlah molnya lebih besar.
Materi Inti
1. Azas Le Chatelier
Henry Louis Le Chatelier (1850-1936) berpendapat bahwa: jika suatu kesetimbangan
menerima suatu aksi maka sistem kesetimbangan akan mengadakan reaksi sehingga
pengaruh dari aksi tersebut terhadap sistem menjadi sekecil-kecilnya.
2. Faktor yang mempengaruhi kesetimbangan adalah:
a. Pengaruh Konsentrasi
Sesuai dengan asas Le Chatelier (reaksi = -aksi), jika konsentrasi salah satu
komponen diperbesar, maka reaksi sistem adalah mengurangi komponen tersebut.
sebaliknya, jika konsentrasi salah satu komponen diperkecil, maka reaksi sistem adalah
menambah komponen itu. Oleh karena itu, pengaruh konsentrasi terhadap kesetimbangan
adalah sebagai berikut:
Tabel pengaruh konsentrasi terhadap kesetimbangan
No Aksi Reaksi Cara sistem
bereaksi
1 Menambah konsentrasi pereaksi Mengurangi Bergeser ke kanan
konsentrasi pereaksi
2 Mengurangi konsentrasi pereaksi Menambah Bergeser ke kiri
konsentrasi pereaksi
3 Memperbesar konsentrasi produk Mengurangi Bergeser ke kiri
konsentrasi produk
4 Mengurangi konsentrasi produk Memperbesar Bergeser ke kanan
konsentrasi produk
5 Mengurangi konsentrasi total Memperbesar Bergeser ke arah
konsentrasi total yang jumlah
molekulnya
terbesar
b. Pengaruh Suhu
Sesuai dengan prinsip La Chatelier, jika suhu sistem kesetimbangan dinaikkan,
maka reaksi sistem adalah menurunkan suhu, kesetimbangan akan bergeser ke pihak
reaksi yang menyerap kalor (ke pihak reaksi endoterm). Sebaliknya jika suhu diturunkan,
maka kesetimbangan akan bergeser ke pihak reaksi eksoterm.
Jika suhu dinaikkan, kesetimbangan akan bergeser ke arah reaksi endoterm
Jika suhu diturunkan, kesetimbangan akan bergeser ke arah reaksi eksoterm.
c. Pengaruh Tekanan/Volum
Penambahan tekanan dengan cara memperkecil volum akan memperbesar
konsentrasi semua komponen. Sesuai asas Le Chatelier, maka sistem akan bereaksi
dengan mengurangi tekanan. Sebagaimana diketahui, tekanan gas bergantung pada
jumlah molekul dan tidak bergantung pada jenis gas. Oleh karena itu, untuk mengurangi
tekanan, maka reaksi kesetimbangan akan bergeser kearah yang jumlah koefisiennya
lebih kecil. Sebaliknya, jika tekanan dikurangi dengan cara memperbesar volum, maka
sistem akan bereaksi dengan menambah tekanan dengan cara menambah jumlah molekul.
Reaksi akan bergeser ke arah yang jumlah koefisiennya lebih besar.
Jika tekana diperbesar (volum diperkecil), kesetimbangan akan bergeser ke arah yang
jumlah koefisiennya terkecil
Jika tekanan diperkecil (volum diperbesar) kesetimbangan akan bergeser ke arah yang
jumlah koefisiennya terbesar.
D. Strategi Pembelajaran
Model : Pembelajaran berbasis inkuiri terbimbing
Metode : Diskusi, praktikum dan tanya jawab
Pendekatan : Saintifik
E. Media Pembelajaran
Papan tulis, Power Point, LCD, Proyektor, LKS, Alat dan Bahan Percobaan
F. Sumber Belajar
Purba, M. 2006. Kimia Untuk SMA Kelas XI Jilid 2A. Erlangga. Jakarta.
Susilowati, Endang. 2012. Kimia Untuk Kelas X SMA dan MA. Surakarta: PT. Tiga Serangkai
Pustaka Mandiri.
G. Langkah Pembelajaran
Kegiatan Alokasi
Langkah-langkah Pembelajaran
Pembelajaran Waktu
Kegiatan Pendahuluan
Awal o Siswa menjawab salam dan berdo’a.
o Siswa diperiksa kehadirannya oleh guru.
Apersepsi
o Siswa meninjau kembali materi pada pertemuan sebelumnya
mengenai faktor kesetimbangan dan tetapan kesetimbangan.
”Pada pelajaran sebelumnya, kalian telah mempelajari mengenai faktor
kesetimbangan berdasarkan arah pergeserannya, juga dapat
menentukan nilai tetapan kesetimbangan (Kc) berdasarkan suatu
percobaan. Tentu kalian masih ingat, coba sebutkan apa saja faktor-
faktor yang dapat mempengaruhi pergeseran kesetimbangan?
Jawaban yang diharapkan oleh murid:
“faktor yang mempengaruhi pergeseran kesetimbangan kimia yaitu
konsentrasi, suhu, Tekanan dan volume”
5 Menit
“Baik, betul sekali. Selanjutnya jika bapak mempunyai sebuah soal”
o Guru menuliskan soal di papan tulis:
Pada suhu 425°C dalam ruangan 1 liter terdapat kesetimbangan antara
gas-gas HI, H2, dan I2 menurut persamaan :
2HI(g) H2(g) + I2(g)
Setelah kesetimbangan tercapai, didalam ruang terdapat 0,8 mol HI,
0,1 mol H2 dan 0,1 mol I2. Coba tentukan nilai tetapan
kesetimbangannya!
o Salah satu siswa mengerjakan soal dengan benar
Motivasi
o Guru mengaitkan pembelajaran dengan kehidupan sehari-hari
“Tahu nggak anak-anak, kapan bapak bisa dikatakan setimbang atau
stabil? Ya, bapak bisa dikatakan stabil apabila bapak menjalankan
tugas bapak dengan baik begitu juga dengan kalian, contoh kecilnya
bapak sebagai seorang guru memiliki tugas untuk mengajar,
memberikan ilmu pengetahuan kapada kalian, adapun kalian sebagai
seorang murid memiliki tugas untuk belajar dan menerima pelajaran
dengan baik. Namun sebagai manusia tentu dalam menjalankan tugas
tersebut adakalanya timbul suatu faktor atau permasalahan yang dapat
menganggu aktivitas kita, sehingga tugas yang kita jalankan tidak
berjalan dengan baik. Begitupun dalam reaksi kimia dalam reaksi
kesetimbangan, terdapat beberapa faktor yang dapat mempengaruhi
kesetimbangan kimia, salah satunya seperti yang teman anda sebutkan
tadi yaitu konsentrasi dan suhu”
“Jadi, pada pertemuan kali ini, kita akan membuktikan bagaimana
pengaruh faktor-faktor tersebut dalam mempengaruhi pergeseran
kesetimbangan melalui percobaan.”
o Guru menyampaikan tujuan pembelajaran
“Sehingga setelah pembelajaran ini, bapak harap kalian dapat
merancang dan melakukan percobaan mengenai pengaruh faktor
kesetimbangan berdasarkan konsentrasi dan suhu, juga dapat
menyajikan serta menyimpulkan hasil percobaan mengenai pengaruh
faktor kesetimbangan tersebut berdasarkan arah pergeserannya.”
Kegiatan Inti Mengamati 2 Menit
“Bapak sudah memberikan lembar kerja, disana terdapat sebuah
wacana ya? Coba oleh kalian baca amati wacana tersebut!”
o Siswa mengamati wacana yang disediakan oleh guru dalam lembar
kerja
Menanya 4 Menit
“Setelah kalian membaca wacana tersebut, silahkan apakah ada yang
ingin bertanya? Coba tuliskan dalam rumusan masalah ya!”
(Merumuskan masalah)
o Siswa mengajukan pertanyaan dalam rumusan masalah
Pertanyaan atau rumusan masalah yang diharapkan:
1. Bagaimana pengaruh konsentrasi terhadap pergeseran
kesetimbangan?
2. Bagaimana pengaruh suhu terhadap pergeseran kesetimbangan?
“Sekarang, berdasarkan rumusan masalah yang sudah kalian buat coba
tuliskan hipotesisnya!” (Merumuskan hipotesis)
1. Pengaruh konsentrasi terhadap pergeseran kesetimbangan, jika
konsentrasi reaktan ditambah maka reaksi akan bergeser ke kanan atau
produk. Jika pada reaktan dikurangi maka bergeser ke kiri atau ke zat
yang dikurangi tersebut.
2. Pengaruh suhu terhadap pergeseran kesetimbangan, Jika suhu
dinaikkan, kesetimbangan akan bergeser ke arah reaksi endoterm dan
jika suhu diturunkan, kesetimbangan akan bergeser ke arah reaksi
eksoterm.
Mengumpulkan Data 8 Menit
“Nah, sekarang untuk menguji hipotesis yang telah kalian buat, yuk
kita mulai saja percobaannya. Pertama, coba rancanglah terlebih
dahulu percobaannya berdasarkan wacana yang telah kalian baca.
Tuliskan alat dan bahan yang akan digunakan begitupun dengan
prosedurnya, silahkan dimulai dengan mengucapkan Bismillah terlebih
dahulu. Jika ada sesuatu yang ingin ditanyakan, tanyakan saja ya!”
o Siswa mulai merancang percobaan untuk mengetahui pengaruh
faktor konsentrasi dan suhu terhadap pergeseran kesetimbangan.
“Setelah menuliskan alat dan bahan beserta prosedur yang akan
digunakan, sekarang ayo kita mulai saja percobaannya!”
o Siswa mulai melakukan percobaan untuk mengetahui pengaruh
faktor konsentrasi dan suhu terhadap pergeseran kesetimbangan.
o Siswa lain mengamati hasil percobaan dan menuliskannya dalam
data pengamatan
Mengasosiasi 2 Menit
“Bagaimana seru percobaannya? Nah sekarang berdasarkan data yang
kalian peroleh, coba diskusikan dengan teman kelompok kalian
mengenai hasil percobaan kalian dan jawablah pertanyaan- pertanyaan
yang ada di lembar kerja (Menguji hipotesis)
1. Tuliskan persamaan reaksi kesetimbangan berdasarkan percobaan
yang telah dilakukan!
2. Pada percobaan konsentrasi, apa pengaruh penambahan FeCl3 dan
KSCN terhadap warna larutan? Lalu bagaimana arah
pergeserannya?
3. Pada percobaan suhu, termasuk kedalam reaksi jenis apa
pemanasan CuSO4.5H2O? Bagaimana arah pergeserannya?
o Siswa berdiskusi mengenai hasil percobaannya
o Siswa menjawab pertanyan dan menghubungkan dengan hipotesis
yang telah dibuat dan materi yang terdapat dalam buku ajar.
Mengkomunikasikan 4 Menit
“Bagaimana, apakah sudah anak-anak? Baik sekarang silahkan bapak
ingin dari kalian untuk mencoba menyampaikan jawaban dari
perntanyaan tersebut”. (Merumuskan Kesimpulan)
Salah satu siswa menyampaikan jawabannya.
Jawaban yang diharapkan:
1. Tuliskan persamaan reaksi kesetimbangan berdasarkan percobaan
yang telah dilakukan!
Jawaban: Fe3+(aq) + SCN-(aq) ⇄ FeSCN2+(aq) (Konsentrasi)
CuSO45H2O(s) ⇄ CuSO4 (s) + 5 H2O(g) (Suhu)
2. Pada percobaan konsentrasi, apa pengaruh penambahan FeCl3 dan
KSCN terhadap warna larutan? Lalu bagaimana arah
pergeserannya?
Jawaban: “Pengaruh penambahan FeCl3 dan KSCN terhadap warna
larutan dapat dilihat dalam data pengamatan berikut:
No. Bahan Warna Arah
Larutan Pergeseran
1. Larutan FeCl3 + KSCN Merah hati Digunakan
sebagai
pembanding
2. Larutan FeCl3 + Merah Bergeser ke
KSCN+ 1 tetes KSCN Pekat arah produk
3. Larutan FeCl3 + Merah Bergeser ke
KSCN+ 1 tetes FeCl3 pekat arah produk
Adapun arah pergeserannya,
- Pada tabung 1, tidak dilakukan penambahan zat apapun karena
digunakan sebagai pembanding.
- Pada tabung 2, ditambahkan konsentrasi KSCN, dimana reaksi
bergeser ke arah produk sehingga warna larutan menjadi merah
pekat.
- pada tabung 3, ditambahkan konsentrasi FeCl3, dimana rekasi
bergeser ke arah produk sehingga warna larutan menjadi merah
pekat.”
o kelompok lain diberikan kesempatan untuk menanggapi.
3. Pada percobaan suhu, termasuk kedalam reaksi jenis apa
pemanasan CuSO4.5H2O? Bagaimana arah pergeserannya?
Jawaban: “Reaksi pemanasan CuSO4.5H2O merupakan reaksi
penguraian CuSO4.5H2O yang menghasilkan CuSO4 dalam bentuk
serbuk dan H2O dalam bentuk gas. Dimana reaksi penguraian
CuSO4.5H2O ini merupakan reaksi endoterm yaitu reaksi yang
menyerap kalor. Adapun arah pergeserannya, ketika suhu tersebut
dinaikan maka kesetimbangan bergeser ke arah reaksi endoterm.”
o kelompok lain diberikan kesempatan untuk menanggapi.
“Baik, bagus sekali anak-anak. Dengan demikian kita sudah
melaksanakan tujuan pembelajaran kita, untuk itu pembelajaran hari ini
kita cukupkan sampai disini”
Penutup o Guru mengkonfirmasikan kegiatan pembelajaran yang telah 1 Menit
dilakukan
“Baik anak-anak, setelah kita belajar, apa yang telah kita pelajari
hari ini?”
o Guru memberikan soal evaluasi untuk dikerjakan oleh siswa.
o Siswa memperoleh informasi materi pembelajaran yang akan
datang
o Siswa menjawab salam
Lampiran 1. Kisi-Kisi Soal Evaluasi
Level
Indikator Soal Soal Skor Jawaban
Kognitif
Siswa dapat 1. Agar pada reaksi C-4 2 Menambahkan konsentrasi
menganalisis kesetimbangan: pada N2 atau H2, dapat juga
pengaruh N2(g) + 3H2(g) ⇌ dengan memperkecil
konsentrasi dan 2NH3(g) ΔH = -92kj volume.
volume Jumlah gas NH3 yang
terhadap dihasilkan maksimal.
pergeseran Maka tindakan yang
kesetimbangan diperlukan adalah ...
2. Tulislah rumus tetapan C-4 3
kesetimbangan dari
reaksi berikut:
1. N2(g) + 3H2(g) ⇄ 2NH3(g)
Siswa dapat
2. COCl2(g) ⇄CO(g) + Cl2(g)
merumuskan
3. Fe3+(aq) + SCN-(aq)⇄
dan menentukan
FeSCN2+(aq)
nilai tetapan
4. Dalam reaksi C-4 5 D. 10,67
kesetimbangan
kesetimbangan:
2CO(g) + O2(g) ⇄ 2CO2(g)
Dalam ruang 2 liter direaksikan
5 mol CO dan 5 mol O2. Jika
pada saat setimbangterdapat 4
mol gas CO2, maka besarnya
Kc adalah
A. 0,09
B. 1,067
C. 9
D. 10,67
E. 90
Anda mungkin juga menyukai
- OPTIMASI LAJU ALIRDokumen16 halamanOPTIMASI LAJU ALIRRobi'atul AdawiyahBelum ada peringkat
- STRUKTUR MAKRO KESETIMBANGANDokumen3 halamanSTRUKTUR MAKRO KESETIMBANGANElla Nur AnisaBelum ada peringkat
- Struktur AtomDokumen19 halamanStruktur AtomAnik nur rokhmahBelum ada peringkat
- Yang Terjadi Pada Protein - FitriDokumen10 halamanYang Terjadi Pada Protein - FitriFitri MeliniasariBelum ada peringkat
- Elektrometri Analisis Metode PotensialDokumen12 halamanElektrometri Analisis Metode Potensialwidya nurul ainiBelum ada peringkat
- Panduan Praktikum Kimia KoordinasiDokumen24 halamanPanduan Praktikum Kimia KoordinasiMuhamad Syaiful AmpriBelum ada peringkat
- Sifat-Sifat Koligatif Larutan Berdasarkan Titik DidihDokumen18 halamanSifat-Sifat Koligatif Larutan Berdasarkan Titik DidihLawrence DavisBelum ada peringkat
- StatistikaDokumen20 halamanStatistikaElsa ListiaBelum ada peringkat
- Mekanisme Reaksi Reduksi EsterDokumen3 halamanMekanisme Reaksi Reduksi EsterZelisa Nudia FitriBelum ada peringkat
- LKPD_VIRTUAL_LABDokumen141 halamanLKPD_VIRTUAL_LABRiduanBelum ada peringkat
- REAKSI INTIDokumen6 halamanREAKSI INTISanti PangaribuanBelum ada peringkat
- CBR Auf 2 Harris Siburian-1Dokumen45 halamanCBR Auf 2 Harris Siburian-1Harris Jhonny SiburianBelum ada peringkat
- Ukb Kimia-2.09.09-1Dokumen20 halamanUkb Kimia-2.09.09-1erdy0% (1)
- Metode Adisi StandarDokumen3 halamanMetode Adisi StandarEira FuRoersBelum ada peringkat
- Laporan Praktikum Modul 04: Spektrofotometri Serapan Atom (AAS)Dokumen12 halamanLaporan Praktikum Modul 04: Spektrofotometri Serapan Atom (AAS)Naufal Hanif KusumaBelum ada peringkat
- Larutan Elektrolit Dan NonDokumen24 halamanLarutan Elektrolit Dan NonAynie Chem'sBelum ada peringkat
- Kimia Organik RevDokumen8 halamanKimia Organik RevLavita selviBelum ada peringkat
- RPP Sifat Koligatif LarutanDokumen23 halamanRPP Sifat Koligatif Larutanfahdnul byuBelum ada peringkat
- Rencana Pelaksanaan Pembelajaran IpaDokumen13 halamanRencana Pelaksanaan Pembelajaran IpaSupriyatiBelum ada peringkat
- KESETIMBANGAN KIMIADokumen6 halamanKESETIMBANGAN KIMIAChairanie AzaBelum ada peringkat
- PERKEMBANGAN SISTEM PERIODIKDokumen21 halamanPERKEMBANGAN SISTEM PERIODIKyulianaBelum ada peringkat
- 16 - Soal-Jawab - Kinetik-kimia-Nop - Bahan UASDokumen53 halaman16 - Soal-Jawab - Kinetik-kimia-Nop - Bahan UASJessica Zivani W100% (1)
- ΔG PENENTU SPONTANITASDokumen2 halamanΔG PENENTU SPONTANITASDewi El DezaBelum ada peringkat
- RPP Sets Senyawa KarbonDokumen10 halamanRPP Sets Senyawa KarbonFaZa Asy'SyirbanBelum ada peringkat
- Uts BiokimiaDokumen14 halamanUts BiokimiaSyahrul Amin100% (2)
- 2Dokumen2 halaman2bagus setiawanBelum ada peringkat
- RPS HeterosiklikDokumen11 halamanRPS HeterosiklikNoona PiahBelum ada peringkat
- Kimia AnalisaDokumen15 halamanKimia AnalisaIbnu CahyoBelum ada peringkat
- TP Pertemuan 4 5 (Setengah)Dokumen49 halamanTP Pertemuan 4 5 (Setengah)Muhamad Mahfudin Ibn BadriBelum ada peringkat
- Menguraikan konsep perubahan entalpi reaksi pada tekanan tetapDokumen1 halamanMenguraikan konsep perubahan entalpi reaksi pada tekanan tetapUlil AmbriBelum ada peringkat
- Soal Pre TestDokumen2 halamanSoal Pre TestAgustina ItinBelum ada peringkat
- RPP KD 3.8 - AnnisyaNfaDokumen8 halamanRPP KD 3.8 - AnnisyaNfaAnnisya NfaBelum ada peringkat
- Lapres Ketengikan Minyak JagungDokumen29 halamanLapres Ketengikan Minyak JagungAlvira DwiBelum ada peringkat
- NMR ProtonDokumen12 halamanNMR ProtonSilvana AbdullahBelum ada peringkat
- Rencana Kimia StoikiometriDokumen30 halamanRencana Kimia StoikiometriTasya BelinaBelum ada peringkat
- Kafein BundelanDokumen20 halamanKafein BundelanPutri AzzahraBelum ada peringkat
- KATALIS TEKNOLOGIDokumen4 halamanKATALIS TEKNOLOGIPriska SaraswatiBelum ada peringkat
- Pendekatan Chemo EntrepreneurshipDokumen8 halamanPendekatan Chemo EntrepreneurshipAmir Ibnu HusseinBelum ada peringkat
- Struktur dan Mekanisme Kimia OrganikDokumen32 halamanStruktur dan Mekanisme Kimia OrganikFitri NurkhasanahBelum ada peringkat
- Latihan Soal Kimia Katalis Untuk UtsDokumen7 halamanLatihan Soal Kimia Katalis Untuk UtsGina Ai NurohmahBelum ada peringkat
- Proposal Tri Ulandari A25117034Dokumen31 halamanProposal Tri Ulandari A25117034Wulan AstharingBelum ada peringkat
- Contoh Soal HOTSsssDokumen8 halamanContoh Soal HOTSsssMela Ripa JummaroBelum ada peringkat
- Mempahami MekanismeDokumen29 halamanMempahami MekanismeTri oktarinaBelum ada peringkat
- Kimia F11 - Hidrolis GaramDokumen21 halamanKimia F11 - Hidrolis GaramDina Ma'rifahBelum ada peringkat
- Uji Kualitatif Asam AminoDokumen2 halamanUji Kualitatif Asam AminoRizky RismayantiBelum ada peringkat
- CNC ArsitekturDokumen69 halamanCNC ArsitekturIbnu AwallaBelum ada peringkat
- Tugas Bahan AjarDokumen5 halamanTugas Bahan AjarfajarkarinaBelum ada peringkat
- Laporan PraktikumDokumen9 halamanLaporan PraktikumFahmi Maulana YanuarBelum ada peringkat
- Pembahasan Destilasi FraksinasiDokumen3 halamanPembahasan Destilasi FraksinasiBintang Benarivo MangengkeBelum ada peringkat
- Katalis HeterogenDokumen14 halamanKatalis HeterogenusepBelum ada peringkat
- RPP Kelas Xi KD 3.2Dokumen9 halamanRPP Kelas Xi KD 3.2Wayan GraciasBelum ada peringkat
- LKS TariDokumen4 halamanLKS TariVheevhee Rhiee SevTaBelum ada peringkat
- Laporan Natrium SilikatDokumen17 halamanLaporan Natrium SilikatHasna R SyarifBelum ada peringkat
- LAJU REAKSIDokumen24 halamanLAJU REAKSIsantiBelum ada peringkat
- Sap 13,14,15Dokumen8 halamanSap 13,14,15suci indah sariBelum ada peringkat
- Laporan Praktikum KSPDokumen6 halamanLaporan Praktikum KSPRaysaBelum ada peringkat
- Makalah Biosensor SmartphoneDokumen17 halamanMakalah Biosensor SmartphoneMaery ArjaniBelum ada peringkat
- Adimetha - 223020208019 - Tugas 1 Analisis Materi Pada Kurikulum 2013 Dan Kurikulum MerdekaDokumen7 halamanAdimetha - 223020208019 - Tugas 1 Analisis Materi Pada Kurikulum 2013 Dan Kurikulum MerdekaMC JambulBelum ada peringkat
- Micro Teaching UjianDokumen12 halamanMicro Teaching UjianMuhamad Saepul AnwarBelum ada peringkat
- RPP Kimia Kelas XI-2Dokumen29 halamanRPP Kimia Kelas XI-2Elsa zuldya annisaBelum ada peringkat
- Benar Atau SalahDokumen1 halamanBenar Atau SalahMuhamad Saepul AnwarBelum ada peringkat
- MAKALAH KLP 6 Pengelolaan PendidikanDokumen21 halamanMAKALAH KLP 6 Pengelolaan PendidikanMuhamad Saepul AnwarBelum ada peringkat
- PRESTASI KSN-KDokumen22 halamanPRESTASI KSN-KMuhamad Saepul AnwarBelum ada peringkat
- MBS MakalahDokumen25 halamanMBS MakalahMuhamad Saepul AnwarBelum ada peringkat
- STRATEGI PENGELOLAANDokumen24 halamanSTRATEGI PENGELOLAANMuhamad Saepul AnwarBelum ada peringkat
- MAKALAH Pengelolaan Keuangan SekolahDokumen15 halamanMAKALAH Pengelolaan Keuangan SekolahMuhamad Saepul AnwarBelum ada peringkat
- Analisis KonsepDokumen5 halamanAnalisis KonsepMuhamad Saepul AnwarBelum ada peringkat
- AngketValidasiLKPSProyekLimbahKulitNagaMerahDokumen1 halamanAngketValidasiLKPSProyekLimbahKulitNagaMerahMuhamad Saepul AnwarBelum ada peringkat
- RPP Ikatan Kimia FiksDokumen13 halamanRPP Ikatan Kimia FiksMuhamad Saepul AnwarBelum ada peringkat
- Properti Antiviral BroadDokumen5 halamanProperti Antiviral BroadMuhamad Saepul AnwarBelum ada peringkat
- STRATEGI PENGELOLAANDokumen24 halamanSTRATEGI PENGELOLAANMuhamad Saepul AnwarBelum ada peringkat
- RPP Kesetimbangan KimiaDokumen12 halamanRPP Kesetimbangan KimiaMuhamad Saepul AnwarBelum ada peringkat
- Form Penilaian Praktik TilawahDokumen1 halamanForm Penilaian Praktik TilawahMuhamad Saepul AnwarBelum ada peringkat
- ENZIM KonsepDokumen1 halamanENZIM KonsepSri WijiBelum ada peringkat
- Naskah Skenario Bimbingan Dan KonselingDokumen3 halamanNaskah Skenario Bimbingan Dan KonselingMuhamad Saepul AnwarBelum ada peringkat
- PortofolioDokumen2 halamanPortofolioMuhamad Saepul AnwarBelum ada peringkat
- PsikotropikaDokumen10 halamanPsikotropikaMuhamad Saepul AnwarBelum ada peringkat
- Analisis Kuantitatif LipidDokumen7 halamanAnalisis Kuantitatif LipidMuhamad Saepul AnwarBelum ada peringkat
- Makalah Zat Aditif Yang DilarangDokumen19 halamanMakalah Zat Aditif Yang DilarangMuhamad Saepul AnwarBelum ada peringkat
- DEGRADASI ASAM AMINODokumen21 halamanDEGRADASI ASAM AMINOMuhamad Saepul AnwarBelum ada peringkat
- Bahan AjarDokumen13 halamanBahan AjarMuhamad Saepul AnwarBelum ada peringkat
- Makalah Zat Aditif Yang DilarangDokumen19 halamanMakalah Zat Aditif Yang DilarangMuhamad Saepul AnwarBelum ada peringkat
- Lembar Kerja SiswaDokumen2 halamanLembar Kerja SiswaMuhamad Saepul AnwarBelum ada peringkat
- DEGRADASI ASAM AMINODokumen21 halamanDEGRADASI ASAM AMINOMuhamad Saepul AnwarBelum ada peringkat
- Micro Teaching UjianDokumen12 halamanMicro Teaching UjianMuhamad Saepul AnwarBelum ada peringkat
- Daftar Kelompok Muhadhoroh Putra Season 15Dokumen1 halamanDaftar Kelompok Muhadhoroh Putra Season 15Muhamad Saepul AnwarBelum ada peringkat
- Micro Teaching UjianDokumen12 halamanMicro Teaching UjianMuhamad Saepul AnwarBelum ada peringkat
- Teori atom RutherfordDokumen3 halamanTeori atom RutherfordMuhamad Saepul AnwarBelum ada peringkat
- SteviaDokumen12 halamanSteviaRizca Dwi JayantiBelum ada peringkat