MASYKU
Diunggah oleh
ElvinYudhaP0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan5 halamanYO
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniYO
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan5 halamanMASYKU
Diunggah oleh
ElvinYudhaPYO
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 5
A.
Judul: Pembuatan Larutan
B. Hari : Kamis
Tanggal : 15 November 2018
Jam : 12.30 – 14.00
C. Tujuann Pustaka
1. Membuat larutan K2Cr2O7, CH3COOH, dan Ca(OH)2
D. Tinjauan Pustaka
Larutan didefinisikan sebagai larutan homogen antara zat terlarut
(solvent) dan pelarut (solute). Homogen artinya memiliki susunan yang
sangat ragam sehingga tidak dapat diamati adanya bagian-bagian yang
berlainan, bahkan dengan mikroskop optik sekalipun (Kreenan, 1999).
Pelarut yang umum digunakan adalah air. Larutan air dari senyawa-senyawa
tertentu merupakan penghantar yang baik bagi arus listrik karena hadirnya
ion-ion positif dan negatif (Day, 1986).
Adanya gaya tarik dalam masing-masing senyawa menyebabkan
molekul/ionnya tetap bersatu. Sebaliknya juga terjadi gaya tarik menarik
antara pelarut dan zat terlarut yang membantu proses pelarutan terjadi dua
hal pada waktu padatan melarut:
Molekul solute dipisahkan, yang memerlukan energi
Molekul solute bergabung dengan molekul pelarut, dengan melepas
energi.
Penggabungan atara molekul pelarut dengan molekul solute disebut solulasi.
Jika pelarutnya air disebut hidrat (Utami, 2004)
Konsentrasi larutan adalah jumlah zat terlarut yang terdapat di dalam
sejumlah tertentu pelarut atau larutan. Jenis-jenis satuan konsentrasi antara
lain, persen berdasarkan massa, molaritas (M), molalitas (m). Salah satu
satuan konsentrasi molar yaitu, jumlah mol zat terlarut dalam 1 liter larutan.
Molalitas dapat didefinisikan oleh persamaan berikut
𝒎𝒐𝒍 𝒛𝒂𝒕 𝒕𝒆𝒓𝒍𝒂𝒓𝒖𝒕
M = molaritas = 𝒍𝒊𝒕𝒆𝒓 𝒍𝒂𝒓𝒖𝒕𝒂𝒏
Selain molaritas terdapat juga molalitas dan fraksi mol. Molalitas
(m) adalah nisbah massa dan ini tidak tergantung pada suhu yang
merupakan banyaknya mol zat terlarut yang dilarutkan dalam 1Kg (1000g)
pelarut, artinya:
𝒎𝒐𝒍 𝒛𝒂𝒕 𝒕𝒆𝒓𝒍𝒂𝒓𝒖𝒕
Molalitas = 𝒎𝒂𝒔𝒔𝒂 𝒑𝒆𝒍𝒂𝒓𝒖𝒕 (𝑲𝒈)
Sedangkan fraksi mol suatu zat dalam campuran ialah jumlah mol
zat itu dibagi jumlah keseluruhan mol yang ada. Istilah ini diperkenalkan
dalam pembahasan campuran gas dan hukum dalton. Dalam campuran yang
biner yang mengandung n1 mol spesies 1 dan n2 mol spesies 2, fraksi mol
X1 dan X2 adalah:
𝒏𝟏
X1 = 𝒏𝟏+𝒏𝟐
𝒏𝟐
X2 = 𝒏𝟏+𝒏𝟐 = 1- X1
Fraksi mol semua spesies yang ada harus berjumlah 1
Pengenceran adalah prosedur untuk penyiapan larutan yang kurang
pekat dari larutan yang lebih pekat. Larutan pekat sering disimpan
dilaboratorium dalam ruang penyimpanan stok bahan kimia untuk
digunakan sesuai keperluan. Dalam melarutkan proses pengenceran, perlu
diingat bahwa penambahan lebih banyak pelarut ke dalam sejumlah tertentu
larutan stok akan merubah (mengurangi) konsentrasi larutan tanpa
mengubah jumlah mol zat terlarut yang terdapat dalam larutan
Mol zat terlarut (sebelum) = Mol zat terlarut (setelah)
Karena molaritas didefinisikan sebagai mol zat terlarut dalam 1 liter larutan,
kita lihat mol zat terlarut adalah:
𝒎𝒐𝒍 𝒛𝒂𝒕 𝒕𝒆𝒓𝒍𝒂𝒓𝒖𝒕
x volume larutan (dalam liter) = mol zat terlarut
𝒍𝒊𝒕𝒆𝒓 𝒍𝒂𝒓𝒖𝒕𝒂𝒏
M V
Atau MV = mol zat terlarut
Karena semua zat terlarut berasal dari larutan stok awal, kita dapat
menyimpulkan bahwa:
Mawal .Vawal (sebelum) = Makhir.Vakhir (setelah)
Larutan gas dibuat dengan mencampurkan suatu gas dengan gas
lainnya. Karena semua gas bercampur dalam semua perbandingan, maka
setiap campuran gas adalah hoogen ia merupakan larutan. Larutan cairan
disebut dengan melarutkan gas, cairan atau padatan dalam suatu cairan. Jika
sebagian cairan adalah air, maka larutan disebut larutan berair. Larutan
padatan adalah padatan-padatan dalam mana suatu komponen terdistribusi
tak beraturan pada atom atau molekul dari komponen lainnya (Syukri, 1999)
Suatu larutan dengan jumlah maksimum zat terlarut pada tempertur
tertemtu disebut larutan jenuh. Sebelum mencapai titik jenuh larutan tidak
jenuh.
Banyaknya zat terlarut yang mengjhasilkan larutan jenuh, dalam
jumlah tertentu pelarut pada temperatur konstan disebut kelarutan.
Kelarutan siuatu zat bergantung pada sifat zat itu, molekul pelarut,
temperatur dan tekanan. Meski pun larutan dapat mengandung banyak
komponen, tetapi pada tinjauan ini hanya dibahas larutan yang mengan dung
dua komponen dari larutan biner. Komponen dari larutan biner yaitu pelarut
dan zat terlarut.
Faktir-faktor yang mempengaruhi kelrutan yaitu temperatur, sifat
pelarut, efek ion sejenis, pH, hidrolisis, pengaruh komplees, dan lain-lain
(khopkar, 2003).
E. Alat dan Bahan
Alat-alat:
Labu ukur 250 ml : 1 buah
Gelas kimia 100 ml : 2 buah
Gelas ukur 25 ml : 1 buah
Corong kaca : 1 buah
Pipet tetes : 3 buah
Kaca arloji : 1 buah
Spatula : 1 buah
Neraca analitik : 1 buah
Bahan
Aquades : secukupnya
K2Cr2O7 padat : secukupnya
Asam Asetat ( CH3COOH ) pekat 100% : secukupnya
Ca(OH)2 padat : secukupnya
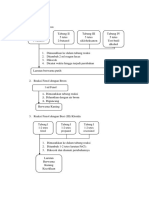
F. Cara Pembuatan
I. Membuat larutan K2Cr2O7 0,1 M
1. Dihitung massa K2Cr2O7 padatan untuk membuat larutan 250ml
K2Cr2O7 0,1M
2. Padatan K2Cr2O7 dilarutkan pada gelas kimia 100ml sebanyak 3 kali
3. Dituang ke labu ukur 250ml
4. Labu ukur digoyangkan sebanyak 21 kali
5. Ditambah aquades sampai batas miniskus
6. Labu ukur digoyangkan sebanyak 21 kali
7. Dipindahkan ke botol reagen
8. Jadilah 250ml K2Cr2O7 0,1 M
II. Membuat larutan K2Cr2O7 0,1 M
1. Dihitung volume CH3COOH 0,5M yang dibutuhkan untuk
membuat larutan 250ml CH3COOH 0,5 M
2. CH3COOH 0,5 M dimasukkan ke dalam labu ukur 250ml
3. Ditambah aquades sampai ½ bagian labu ukur 250ml
4. Labu ukur 250ml digoyangkan sebanyak 21 kali
5. Ditambah aquades sampai tanda batas miniskus
6. Labu ukur 250ml digoyangkan 21 kali
7. Dipindah ke botol reagen
8. Jadilah 250ml CH3COOH 0,5 M
III. Membuat larutan Ca(OH)2 0,5 M
1. Dihitung massa Ca(OH)2 padatan untuk membuat larutan 250ml
Ca(OH)2 0,5 M
2. Padatan Ca(OH)2 dilarutkan pada gelas kimia 100ml sebanyak 3 kali
3. Dituang ke labu ukur 250ml
4. Labu ukur digoyangkan sebanyak 21 kali
5. Ditambah aquades sampai batas miniskus
6. Labu ukur digoyangkan sebanyak 21 kali
7. Dipindahkan ke botol reagen
8. Jadilah 250ml Ca(OH)2 0,5 M
G. Hasil
H. Pelabelan
I. Daftar Pustaka
Anda mungkin juga menyukai
- Fix LaporanDokumen30 halamanFix LaporanElvinYudhaPBelum ada peringkat
- LucasDokumen4 halamanLucasElvinYudhaPBelum ada peringkat
- Lagu PKKMBDokumen2 halamanLagu PKKMBElvinYudhaPBelum ada peringkat
- Lagu PKKMBDokumen2 halamanLagu PKKMBElvinYudhaPBelum ada peringkat
- Alkohol EoDokumen4 halamanAlkohol EoElvinYudhaPBelum ada peringkat