1 Guía Estructura de Lewis
Diunggah oleh
Liliana HernándezHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
1 Guía Estructura de Lewis
Diunggah oleh
Liliana HernándezHak Cipta:
Format Tersedia
INSTITUCIÓN EDUCATIVA RURAL PORFIRIO BARBA JACOB
SAN PABLO – SANTA ROSA DE OSOS
NIT - 811043759-8
ESTRUCTURA DE LEWIS
DOCENTE: ALBA LILIANA HERNÁNDEZ RICO
INFORMACIÓN GENERAL
IDENTIFICACIÓN DE LA GUÍA: Estructura de Lewis.
Grado: 11º
OBJETIVO DE APRENDIZAJE:
Identificar la estructura de lewis.
Elaborar diferentes representaciones de elementos y compuestos químicos con estructuras de Lewis.
DESARROLLO DE LA GUÍA
INTRODUCCIÓN: El físico y químico norteamericano Gilbert Newton Lewis (1875-1946) se encarga del estudio de los
electrones periféricos de los átomos, del que dedujo, en 1916, una interpretación de la covalencia y en 1926, el nombre de
fotón para el cuanto de energía radiante.
Representación de Lewis: El físico y químico norteamericano
Gilbert Newton Lewis (1875-1946) se encarga del estudio de los
electrones periféricos de los átomos, del que dedujo, en 1916, una
interpretación de la covalencia y en 1926, el nombre de fotón para el
cuanto de energía radiante. El químico Lewis introdujo la llamada notación de Lewis para representar los átomos
y sus enlaces. Para representar un átomo, escribimos el símbolo del elemento y lo rodeamos de tantos puntos
como electrones de valencia tenga.
Para representar una molécula, colocamos los electrones del
enlace (Electrones de valencia) entre los átomos que lo forman:
Es frecuente sustituir los pares electrónicos por guiones. De la
siguiente manera:
Actividad: Apreciado estudiante responda las siguientes preguntas en su cuaderno de química:
1. Elabore un resumen de esta guía.
2. Realicen las representaciones de Lewis de los siguientes elementos: zinc, francio, helio, bario y wolframio.
3. Grafiquen la estructura de Lewis del óxido de dicloro (Cl2O).
4. Escriba el texto en su cuaderno, posteriormente lealo:
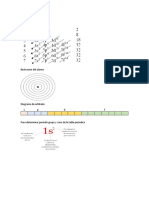
Formación de enlaces y estructuras de Lewis: Las estructuras de Lewis permiten mostrar de forma sencilla los
enlaces químicos. El físico y químico Gilbert Newton Lewis sugirió que los átomos pueden alcanzar la estructura
estable de gas noble compartiendo pares de electrones. En la estructura de Lewis, el elemento se representa por su
símbolo químico, rodeado de pequeños puntos (•) o equis (x) que corresponden al número de electrones presentes
en la capa de valencia. Para escribir las estructuras de Lewis, se deben considerar las siguientes reglas: 1. Debe
elegirse un átomo central, que debe ser el menos electronegativo, exceptuando el hidrógeno que es átomo terminal
porque solo puede formar un enlace. 2. Alrededor del átomo central se ubican los demás átomos de la manera más
simétrica posible. 3. Se escribe el número total de electrones de valencia. 4. Para cada enlace que se forma, se debe
tener en cuenta un par de electrones. 4. Todos los átomos de los elementos involucrados en el enlace deben tener
ocho electrones a su alrededor para completar la regla del octeto. 6. Dibujar para cada átomo sus electrones de
valencia y conectar en pares de
electrones formando enlaces.
5. De acuerdo con la tabla, la
estructura de Lewis que representa
una molécula de YW 2 es:
Anda mungkin juga menyukai
- 7° Saber Quimica 13 de Junio Estructura Tabla PeriodicaDokumen1 halaman7° Saber Quimica 13 de Junio Estructura Tabla PeriodicaHФЛΞЏ ŁФvΞЏBelum ada peringkat
- Taller Tabla Periodica y Termodinamica OctavoDokumen2 halamanTaller Tabla Periodica y Termodinamica OctavoJuan Pablo JiménezBelum ada peringkat
- Atmomos PDFDokumen2 halamanAtmomos PDFVianis AriasBelum ada peringkat
- Taller 11Dokumen12 halamanTaller 11Yo No MasBelum ada peringkat
- Guia y Taller de Grado 9 PDFDokumen3 halamanGuia y Taller de Grado 9 PDFdavid gonzales100% (2)
- Tabla PeriodicaDokumen4 halamanTabla PeriodicaRufina TamayoBelum ada peringkat
- Taller Recuper Quimica 8Dokumen4 halamanTaller Recuper Quimica 8gotisamiBelum ada peringkat
- Examen Quimica Once Grado Segundo PeriodoDokumen4 halamanExamen Quimica Once Grado Segundo PeriodonicolasprofecolecrisBelum ada peringkat
- Guia 1-8-Composición Porcentual-Formula Empirica y MolecularDokumen6 halamanGuia 1-8-Composición Porcentual-Formula Empirica y MolecularGerson Moreno EllesBelum ada peringkat
- Guias Quimica Grado Séptimo Tercer PeriodoDokumen15 halamanGuias Quimica Grado Séptimo Tercer PeriodoLIDIBETH MARTINEZ GARCIABelum ada peringkat
- Lectura y Actividad Nomenclatura Parte 1Dokumen9 halamanLectura y Actividad Nomenclatura Parte 1María Esther Sandoval TorresBelum ada peringkat
- Distribucion Electronica Colombia AprendeDokumen8 halamanDistribucion Electronica Colombia AprendeMarcela Reyes Guio0% (1)
- Guia Quimica Grado Septimo 2021 P1Dokumen9 halamanGuia Quimica Grado Septimo 2021 P1BuarBelum ada peringkat
- Taller 1 Elementos y Compuestos QuímicosDokumen6 halamanTaller 1 Elementos y Compuestos QuímicosAlejandra CalleBelum ada peringkat
- Taller Compuestos OctavoDokumen5 halamanTaller Compuestos OctavoJannelly MorenoBelum ada peringkat
- Cuestionarios Ph-Poh y Oxido-ReduccionDokumen3 halamanCuestionarios Ph-Poh y Oxido-ReduccionSoy YoBelum ada peringkat
- Guia 3 Periodo 3 Sexto Tabla PeriódicaDokumen5 halamanGuia 3 Periodo 3 Sexto Tabla PeriódicaYudica AndreaBelum ada peringkat
- Examen de Recuperacion de 7c y 7bDokumen3 halamanExamen de Recuperacion de 7c y 7bddanovis0629Belum ada peringkat
- Examen 8° Química8Dokumen3 halamanExamen 8° Química8DINA MARIEL FLORBelum ada peringkat
- Taller de Grado NovenoDokumen4 halamanTaller de Grado NovenoLizardo AmadoBelum ada peringkat
- Actividad Grado OctavoDokumen3 halamanActividad Grado Octavovelkyviviana100% (3)
- 9 PreicfesDokumen3 halaman9 PreicfesOrlando PayaresBelum ada peringkat
- Taller Configuración ElectrónicaDokumen2 halamanTaller Configuración ElectrónicaCB Hank100% (1)
- Evaluacion de QuimicaDokumen4 halamanEvaluacion de Quimicamprm2579Belum ada peringkat
- Ficha de Estudio 1 Cqu 210 Particulas SubatómicasDokumen2 halamanFicha de Estudio 1 Cqu 210 Particulas SubatómicasadrianitayanyBelum ada peringkat
- Tabla Periódica Nº 2Dokumen3 halamanTabla Periódica Nº 2Hugo ArandaBelum ada peringkat
- Apunte de Estados de Oxidación y Nomenclatura de Compuestos InorgánicosDokumen12 halamanApunte de Estados de Oxidación y Nomenclatura de Compuestos InorgánicosaleinBelum ada peringkat
- Taller Estados de OxidaciónDokumen2 halamanTaller Estados de OxidaciónIngri BaronBelum ada peringkat
- TALLER Iones y Moleculas 2016Dokumen2 halamanTALLER Iones y Moleculas 2016Paula Diaz Mancilla100% (1)
- Competencias Específicas Del ÁreaDokumen4 halamanCompetencias Específicas Del Áreaanibal ariasBelum ada peringkat
- Guía de Aprendizaje Química DécimoDokumen3 halamanGuía de Aprendizaje Química DécimoMarlon Galviz Villa100% (1)
- Examen de Naturales Quinto Primer PeriodoDokumen2 halamanExamen de Naturales Quinto Primer PeriodoAlenis Guisella Llanos MartinezBelum ada peringkat
- Evaluacion Ley de Charles ProcesoDokumen3 halamanEvaluacion Ley de Charles ProcesoStephania SaavedraBelum ada peringkat
- Guia N2 Movimiento Armonico SimpleDokumen9 halamanGuia N2 Movimiento Armonico SimpleNathalyBelum ada peringkat
- Una Fiesta ElementalDokumen1 halamanUna Fiesta ElementalCarlarox Martinez100% (1)
- Guia Enlaces Quimicos GRADO OctavoDokumen4 halamanGuia Enlaces Quimicos GRADO OctavoKarla Castrillón0% (1)
- Colombia Aprende CompuestosDokumen41 halamanColombia Aprende CompuestosANITACHOK22Belum ada peringkat
- Guia Estructura Del AtomoDokumen3 halamanGuia Estructura Del AtomoFandaghiro GaBelum ada peringkat
- Guia N 1 COnceptos BasicosDokumen4 halamanGuia N 1 COnceptos BasicoslisshiBelum ada peringkat
- Taller # 6. Numeros Cuanticos y Configuracion ElectronicaDokumen5 halamanTaller # 6. Numeros Cuanticos y Configuracion Electronicamauricio duranBelum ada peringkat
- Química - Guía Ii-1er Periodo 11°Dokumen7 halamanQuímica - Guía Ii-1er Periodo 11°Yulieth CarmonaBelum ada peringkat
- Taller Plan de Mejoramiento 10Dokumen6 halamanTaller Plan de Mejoramiento 10MiguelBelum ada peringkat
- Taller de 10 CARGAS E ISOTOPOSDokumen4 halamanTaller de 10 CARGAS E ISOTOPOSMARIA ALEJANDRA MARINO RODRIGUEZBelum ada peringkat
- 10 Guia Taller 1 Enlaces QuímicosDokumen6 halaman10 Guia Taller 1 Enlaces Químicosnn CastroBelum ada peringkat
- Guia Fisica Octavo GradoDokumen3 halamanGuia Fisica Octavo GradoYuliana JineteBelum ada peringkat
- Taller de Quimica 7 PDFDokumen6 halamanTaller de Quimica 7 PDFdarwin bonilla palacios0% (1)
- Guia Tabla Periodica NovenoDokumen3 halamanGuia Tabla Periodica Novenoyiham bonillaBelum ada peringkat
- Cuestionario Sobre Tabla PeriodicaDokumen2 halamanCuestionario Sobre Tabla PeriodicaTorres SamuelBelum ada peringkat
- Guia 1 Estructura AtomicaDokumen1 halamanGuia 1 Estructura AtomicaTeresa Rosero OBelum ada peringkat
- Taller de Numero AtómicoDokumen3 halamanTaller de Numero AtómicoBalanceFenomenosPetroleos-uis0% (1)
- Taller PeriodicidadDokumen4 halamanTaller Periodicidadapi-241769574Belum ada peringkat
- Taller de Repaso de Química Ii Periodo 11 °Dokumen4 halamanTaller de Repaso de Química Ii Periodo 11 °Quimica SebastianaBelum ada peringkat
- Plan Mejoramiento QuimicaDokumen2 halamanPlan Mejoramiento QuimicaJosé Nicolás Díaz Velásquez40% (5)
- Repaso Quimica 7moDokumen7 halamanRepaso Quimica 7moMiguel Lemus Guzmán0% (1)
- Guia Taller 7Dokumen7 halamanGuia Taller 7adrianaBelum ada peringkat
- Segundo Examen Quimica 1 Semestral 2017Dokumen5 halamanSegundo Examen Quimica 1 Semestral 2017isidoroBelum ada peringkat
- Guia N°2 Enlace QuimicoDokumen5 halamanGuia N°2 Enlace QuimicoJake Mate100% (1)
- 10º Guía 8 Estructura de Lewis 2021Dokumen2 halaman10º Guía 8 Estructura de Lewis 2021Liliana HernándezBelum ada peringkat
- 1 Guía Estructura de LewisDokumen2 halaman1 Guía Estructura de LewisLiliana HernándezBelum ada peringkat
- Tarea de Las Paginas 83,87,88Dokumen3 halamanTarea de Las Paginas 83,87,88Ana LopezBelum ada peringkat
- Guía 1 Plan de Estudio de CN 6º-2023Dokumen1 halamanGuía 1 Plan de Estudio de CN 6º-2023Liliana HernándezBelum ada peringkat
- Agenda Segunda Semana Santa 2023Dokumen1 halamanAgenda Segunda Semana Santa 2023Liliana HernándezBelum ada peringkat
- Resolucion Rectoral Oo1 Asignación Académica 2023Dokumen4 halamanResolucion Rectoral Oo1 Asignación Académica 2023Liliana Hernández100% (1)
- Horario San PabloDokumen11 halamanHorario San PabloLiliana HernándezBelum ada peringkat
- Guía 1 Plan de Estudio de CN 7º-2023Dokumen1 halamanGuía 1 Plan de Estudio de CN 7º-2023Liliana HernándezBelum ada peringkat
- Zonas Acompañamiento 2023Dokumen7 halamanZonas Acompañamiento 2023Liliana HernándezBelum ada peringkat
- La-Gravedad 6°Dokumen7 halamanLa-Gravedad 6°Liliana HernándezBelum ada peringkat
- 1 Plan de Mejoramiento Académico 2023 Octavo 1P - 2022Dokumen1 halaman1 Plan de Mejoramiento Académico 2023 Octavo 1P - 2022Liliana HernándezBelum ada peringkat
- 3 Plan de Mejoramiento Académico 2023 Octavo 3P - 2022.Dokumen1 halaman3 Plan de Mejoramiento Académico 2023 Octavo 3P - 2022.Liliana HernándezBelum ada peringkat
- Poa 2023Dokumen6 halamanPoa 2023Liliana HernándezBelum ada peringkat
- MANUAL DE CONVIVENCIA 2022 Versión Del 28-11-2022Dokumen99 halamanMANUAL DE CONVIVENCIA 2022 Versión Del 28-11-2022Liliana HernándezBelum ada peringkat
- Organización de Calendario de Clases CN 2022Dokumen28 halamanOrganización de Calendario de Clases CN 2022Liliana HernándezBelum ada peringkat
- 2 Plan de Mejoramiento Académico 2023 Octavo 2P - 2022Dokumen1 halaman2 Plan de Mejoramiento Académico 2023 Octavo 2P - 2022Liliana HernándezBelum ada peringkat
- Agenda Semana Desarrollo Institucional Nov-2022Dokumen1 halamanAgenda Semana Desarrollo Institucional Nov-2022Liliana HernándezBelum ada peringkat
- Resolucion Rectoral Modificación CargaDokumen4 halamanResolucion Rectoral Modificación CargaLiliana HernándezBelum ada peringkat
- Tipos de Ácidos para Tercer Grado de SecundariaDokumen3 halamanTipos de Ácidos para Tercer Grado de SecundariaIsrael BackusBelum ada peringkat
- Las Estrellas y El Sistema Solar para Primer Grado de SecundariaDokumen4 halamanLas Estrellas y El Sistema Solar para Primer Grado de SecundariaElizabeth Milene Ccorimanya Alvarez100% (1)
- Orientaciones para La Prevención de Violencia Sexual en Entornos Escolares.Dokumen10 halamanOrientaciones para La Prevención de Violencia Sexual en Entornos Escolares.Estefania SánchezBelum ada peringkat
- Tipos de Nomenclatura para Tercer Grado de SecundariaDokumen4 halamanTipos de Nomenclatura para Tercer Grado de SecundariavictorBelum ada peringkat
- Nomenclatura Inorgánica y Estado de Oxidación para Segundo Grado de SecundariaDokumen4 halamanNomenclatura Inorgánica y Estado de Oxidación para Segundo Grado de SecundariaJoselyn Karina100% (1)
- Manual de ConvivenciaDokumen82 halamanManual de ConvivenciaLiliana Hernández100% (1)
- Protocolo de Bioseguridad 2022Dokumen9 halamanProtocolo de Bioseguridad 2022Liliana HernándezBelum ada peringkat
- Primera Sem y HorarioDokumen9 halamanPrimera Sem y HorarioLiliana HernándezBelum ada peringkat
- Función Óxidos y Peróxidos para Tercer Grado de SecundariaDokumen4 halamanFunción Óxidos y Peróxidos para Tercer Grado de Secundariavictor100% (1)
- Agenda Semana de Desarrollo Institucional Octubre 2022Dokumen1 halamanAgenda Semana de Desarrollo Institucional Octubre 2022Liliana HernándezBelum ada peringkat
- Guía 1 La Célula 2022-1Dokumen2 halamanGuía 1 La Célula 2022-1Liliana Hernández100% (1)
- 14 Reporte Fin de Año de Cada CursoDokumen2 halaman14 Reporte Fin de Año de Cada CursoLiliana HernándezBelum ada peringkat
- Guía PRAE 3 - 11º..Dokumen2 halamanGuía PRAE 3 - 11º..Liliana HernándezBelum ada peringkat
- Agenda Semana Desarrollo Institucional Enero 2022Dokumen1 halamanAgenda Semana Desarrollo Institucional Enero 2022Liliana Hernández0% (1)
- Guía PRAE 3 - 11º..Dokumen2 halamanGuía PRAE 3 - 11º..Liliana HernándezBelum ada peringkat
- Tabla de Valoracion de Conductas y ActitudesDokumen3 halamanTabla de Valoracion de Conductas y ActitudesEnrique JimenezBelum ada peringkat
- Formatos Piar Matematicas 2021Dokumen30 halamanFormatos Piar Matematicas 2021yanuss100% (1)
- Formato Acta de AsambleaDokumen1 halamanFormato Acta de AsambleaAntonio Rafael BritoBelum ada peringkat
- Unidad 2 Panoramica de Los Estados FinancierosabatinoDokumen47 halamanUnidad 2 Panoramica de Los Estados FinancierosabatinoRoberto RamosBelum ada peringkat
- Tarea 1. Comercio ExteriorDokumen3 halamanTarea 1. Comercio ExteriorJose Ignacio SaldarriagaBelum ada peringkat
- Controla Tu LenguaDokumen4 halamanControla Tu LenguaAlexia RosiBelum ada peringkat
- Tesis Publicadas El 2 de Septiembre de 2016 Respecto Con AmparoDokumen32 halamanTesis Publicadas El 2 de Septiembre de 2016 Respecto Con AmparoGerardo Clara CastilloBelum ada peringkat
- Hojade Vida 2023Dokumen5 halamanHojade Vida 2023Stiven AvendañoBelum ada peringkat
- Biografia Leonel MessiDokumen16 halamanBiografia Leonel MessiFilial TrujilloBelum ada peringkat
- Los Intelectuales en La Edad Media Le GoffDokumen11 halamanLos Intelectuales en La Edad Media Le GoffGuilhem W LiberalimartinBelum ada peringkat
- Tipos de Contratación PublicaDokumen8 halamanTipos de Contratación PublicaJOHANNA ARACELY ROSAS GUILLENBelum ada peringkat
- Curso Master en JAVA 450 Horas FiuxyDokumen10 halamanCurso Master en JAVA 450 Horas FiuxyneptalgBelum ada peringkat
- Cronograma para La Campaã - ADokumen4 halamanCronograma para La Campaã - AMiranda CorralesBelum ada peringkat
- Sexo en PlantasDokumen10 halamanSexo en PlantasRubenFrancoBelum ada peringkat
- Batalla Del NiloDokumen4 halamanBatalla Del NiloMarco AntonioBelum ada peringkat
- De Resistencia Al CorteDokumen7 halamanDe Resistencia Al CorteOscuridaxBelum ada peringkat
- 2 Casos GeriatriaDokumen4 halaman2 Casos GeriatriaNoe VásquezBelum ada peringkat
- Delucca, Norma Edith, Petriz, Graciel (..) (2007) - DIMENSIONES DE LA PARENTALIDAD PDFDokumen4 halamanDelucca, Norma Edith, Petriz, Graciel (..) (2007) - DIMENSIONES DE LA PARENTALIDAD PDFIvonne Alpaca DezaBelum ada peringkat
- Resumen Informe de BelmontDokumen6 halamanResumen Informe de BelmontGeraldine GuerreroBelum ada peringkat
- Intoxicación Con PropanoDokumen2 halamanIntoxicación Con PropanoDavid EduardoBelum ada peringkat
- Relación de La Ecología Con Otras DisciplinasDokumen10 halamanRelación de La Ecología Con Otras DisciplinasKarla P. SanmorBelum ada peringkat
- Lectura Comprensiva Los OsosDokumen1 halamanLectura Comprensiva Los OsosTiti LbsBelum ada peringkat
- Informe Mitigacion Diego Cuesta V.1.0Dokumen38 halamanInforme Mitigacion Diego Cuesta V.1.0Shirley PeñaBelum ada peringkat
- Sesión Indagacion CientificaDokumen4 halamanSesión Indagacion CientificaJave Lara PulacheBelum ada peringkat
- La Conexion Pagana Por Michael RoodDokumen74 halamanLa Conexion Pagana Por Michael Roodjhesmiptr100% (3)
- Caso Clínico DiabetesDokumen21 halamanCaso Clínico DiabetesKarla Paola Murrieta MartínezBelum ada peringkat
- Caída de Las Torres Gemélas Según La BibliaDokumen4 halamanCaída de Las Torres Gemélas Según La BibliaElihassBelum ada peringkat
- ComunicadoDokumen2 halamanComunicadoEdwin Ivan Cubas DiazBelum ada peringkat
- Tarea 5 EcenicaDokumen5 halamanTarea 5 EcenicaBrenda RuizBelum ada peringkat
- Claudio Araya - Paula MorenoDokumen18 halamanClaudio Araya - Paula MorenoAmante Del DelirioBelum ada peringkat