Digital - 20360797 PR Salmi Hayati PT Konimex
Diunggah oleh
akbarwahyud1Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Digital - 20360797 PR Salmi Hayati PT Konimex
Diunggah oleh
akbarwahyud1Hak Cipta:
Format Tersedia
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KONIMEX PHARMACEUTICAL LABORATORIES
DESA SANGGRAHAN, GROGOL,
SUKOHARJO , JAWA TENGAH
PERIODE 12 SEPTEMBER - 04 NOVEMBER 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
SALMI HAYATI, S.Farm.
1006835500
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER - DEPARTEMEN FARMASI
DEPOK
DESEMBER 2011
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KONIMEX PHARMACEUTICAL LABORATORIES
DESA SANGGRAHAN, GROGOL,
SUKOHARJO , JAWA TENGAH
PERIODE 12 SEPTEMBER - 04 NOVEMBER 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Ditujukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
SALMI HAYATI, S.Farm.
1006835500
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER - DEPARTEMEN FARMASI
DEPOK
DESEMBER 2011
i
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa penulis persembahkan,
karena kasih, anugerah, kebaikan dan hikmat yang diberikanNya sehingga penulis
dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT
Konimex Pharmaceutical Laboratories, untuk memenuhi salah satu persyaratan
guna menyelesaikan pendidikan Profesi Apoteker Departemen Farmasi Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Dalam penulisan laporan ini, penulis tidak terlepas dari bimbingan, arahan,
bantuan serta dukungan dari berbagai pihak. Untuk itu pada kesempatan ini
penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Ibu Prof. Dr. Yahdiana Harahap, MS., Apt selaku Ketua Departemen Farmasi
FMIPA UI.
2. Bapak Dr. Harmita, Apt selaku Ketua Program Profesi Apoteker Departemen
Farmasi FMIPA UI.
3. Bapak Drs. Hayun, M.Si., Apt selaku pembimbing yang telah memberikan
bimbingan dan arahan kepada penulis selama penulisan Laporan Praktek
Kerja Profesi Apoteker.
4. Bapak Drs. Lodewyk Heumasse, Apt selaku Pembimbing dari PT Konimex
Pharmaceutical Laboratories, yang telah memberikan bimbingan dalam
pelaksanaan PKPA dan penyusunan Laporan Praktek Kerja Profesi Apoteker.
5. Bapak Drs. J. Sunarto, Apt selaku Apoteker Penanggung jawab di PT
Konimex yang telah memberikan bimbingan dalam pelaksanaan PKPA.
6. Seluruh counterpart PT. Konimex Pharmaceutical Laboratories atas ilmu dan
pengalamannya
7. Ibu Rini atas kesabarannya dalam membantu segala hal di PT. Konimex
Pharmaceutical Laboratories
8. Keluarga tercinta. Terima kasih atas doa, dukungan dan bantuan moril
maupun materil yang selama ini sudah kalian berikan sehingga pelaksanaan
PKPA dan penyelesaian laporan dapat berjalan lancar.
iii
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
9. Seluruh sahabat dan teman-teman dari Program Apoteker Universitas
Indonesia Angkatan 73 serta semua pihak yang telah memberikan bantuan
dan semangat kepada penulis selama pelaksanaan PKPA ini.
10. Teman-teman Program Pendidikan Profesi Apoteker Fakultas Farmasi
Universitas Gadjah Mada dan Sanata Dharma Yogyakarta atas kebersamaan
dan kerja samanya di PT. Konimex Pharmaceutical Laboratories selama
PKPA.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat
banyak kekurangan dan kesalahan. Oleh karena itu, penulis sangat mengharapkan
kritik dan saran. Akhir kata, penulis berharap semoga pengetahuan dan
pengalaman yang penulis peroleh selama menjalani Praktek Kerja Profesi
Apoteker ini dapat memberikan manfaat bagi semua pihak.
Penulis
2011
iv
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR ISI
HALAMAN JUDUL .............................................................................................i
HALAMAN PENGESAHAN ................................................................................ii
KATA PENGANTAR ...........................................................................................iii
DAFTAR ISI .........................................................................................................v
DAFTAR GAMBAR .............................................................................................vii
DAFTAR TABEL ................................................................................................viii
BAB 1 PENDAHULUAN.....................................................................................1
1.1 Latar belakang................................................................................. 1
1.2 Tujuan …........................................................................................ 2
BAB 2 TINJAUAN PUSTAKA ...........................................................................3
2.1 Industri Farmasi.................................................................................3
2.2 PT. Konimex .....................................................................................4
2.3 Cara Pembuatan Obat yang Baik (CPOB)...................................... 9
2.4 Human Resources Organization (HRO)......................................... 18
BAB 3 KEGIATAN DI INDUSTRI.....................................................................22
3.1 Pemastian Mutu................................................................................. 22
3.1.1 Bagian GMP .............................................................................22
3.1.2 Validasi ....................................................................................27
3.1.3 Pengawasan Mutu .....................................................................37
3.1.4 Pengendalian Dokumen ............................................................38
3.2 Penelitian Produk dan Pengembangan Proses .....................................40
3.2.1 Pengembangan Formulasi .........................................................43
3.2.2 Pengembangan Kemasan ..........................................................44
3.2.3 Registrasi Produk......................................................................45
3.2.4 Standarisasi...............................................................................49
3.3 Product Planning Inventory Control (PPIC) .......................................50
3.4 Bagian Produksi .................................................................................52
3.4.1 Produksi Farmasi I (Paramex Line)...........................................54
3.4.2 Produksi Farmasi 2 ................................................................ 57
3.4.3 Produksi Farmasi 3 ................................................................ 61
3.4.4 Produksi Natural Product .........................................................62
3.5 Bagian Logistik ..................................................................................62
3.6 Bagian Teknik.................................................................................. 63
3.6.1 Total Productive Maintenance (TPM)............................ ..... 63
3.6.2 Sistem Air.................................................................................67
3.6.3 Sistem Pengkondisian Udara (HVAC)............................ ..... 72
3.6.4 Sistem Udara Bertekanan ..........................................................75
3.7 Sistem Pengelolaan Lingkungan Hidup...............................................76
3.7.1 Pengelolaan Limbah Padat................................................ 78
3.7.2 Pengelolaan Limbah cair ...........................................................79
3.7.3 Pengelolaan Limbah Udara/Suara..................................... 80
v Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
3.8 Keselamatan dan Kesehatan Kerja ......................................................81
BAB 4 PEMBAHASAN .....................................................................................86
4.1 Manajemen Mutu.............................................................................. 86
4.2 Personalia ........................................................................ .............. 86
4.3 Bangunan dan Fasilitas ..................................................................... 88
4.4 Peralatan ........................................................................................... 91
4.5 Sanitasi dan Higiene ......................................................................... 93
4.6 Produksi ................................................................................ ........... 94
4.7 Pengawasan Mutu ............................................................................ 96
4.8 Inspeksi Diri dan Audit Mutu........................................................... 99
4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat,
Obat Kembalian .............................................................................. 100
4.10 Dokumentasi ................................................................................. 101
4.11 Kualifikasi dan Validasi ............................................................... 102
BAB 5 KESIMPULAN ........................................................................................ 104
5. 1 Kesimpulan..................................................................................... 104
5. 2 Saran................................................................................................. 104
105
DAFTAR REFERENSI .......................................................................................
vi Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR GAMBAR
Gambar 2.1 Struktur organisasi bagian HRO................................................ 19
Gambar 3.1 Mekanisme audit GMP................................................................ 25
Gambar 3.2 Konsep validasi........................................................................... 29
Gambar 3.3 V-Model “Direct Impact” System.............................................. 32
Gambar 3.4 Skema pengembangan produk................................................. 41
Gambar 3.5 Dokumentasi skema pengembangan produk........................... 42
Gambar 3.6 Skema proses evaluasi............................................................. 46
Gambar 3.7 Alur Pra registrasi Obat........................................................... 48
Gambar 3.8 Alur Registrasi Obat................................................................ 48
Gambar 3.9 Alur permintaan barang ke bagian produksi............................ 58
Gambar 3.10 Alur permintaan barang........................................................... 63
Gambar 3.11 Ilustrasi sebuah mesin.............................................................. 64
Gambar 3.12 Skema Sumber Air Baku......................................................... 67
Gambar 3.13 Proses Multimedia filter.......................................................... 69
Gambar 3.14 Carbon Filter........................................................................... 70
Gambar 3.15 Aliran udara laminair............................................................... 75
Gambar 3.16 Sistem manajemen keselamatan dan kesehatan kerja............. 82
vii Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR TABEL
Tabel 3.1 Manajemen validasi pada proses produksi .................................... 30
Tabel 3.2 Kualifikasi peralatan berdasarkan impact terhadap produk............. 31
Tabel 3.3 Pendekatan kualifikasi peralatan .................................................... 33
Tabel 3.4 Jenis dokumen dan bagian pengendali teknis di PT Konimex....... 39
Tabel 3.5 Kelengkapan Dokumen Pra-registrasi............................................ 47
Tabel 3.6 Air Quality Classes menurut ISO 8573-1....................................... 76
Tabel 3.7 Air Quality Classes menurut ISO 8573-1....................................... 76
Tabel 3.8 Contoh limbah dan sumbernya....................................................... 78
Tabel 3.9 Laporan analisa kualitas udara ambien........................................... 81
viii Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Industri farmasi sebagai produsen produk obat memiliki peranan yang
cukup besar dalam hal pengadaan obat-obatan, sehingga memerlukan pengawasan
dan pengaturan. Oleh karena itu diperlukan suatu pedoman yang meliputi seluruh
aspek produksi dan pengendalian mutu sehingga setiap obat yang dihasilkan
selalu memenuhi ketentuan mutu yang telah ditetapkan.
Cara Pembuatan Obat Baik (CPOB) adalah pedoman pembuatan obat bagi
industri farmasi di Indonesia yang bertujuan untuk memastikan agar mutu obat
yang dihasilkan sesuai persyaratan dan tujuan penggunaannya. CPOB
menyangkut keseluruhan aspek produksi mulai dari personalia, bangunan dan
fasilitas, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi diri,
penanganan keluhan terhadap obat, penarikan kembali obat dan penanganan obat
kembalian serta dokumentasi. Semua industri farmasi harus menerapkan CPOB
dalam seluruh aspek dan rangkaian kegiatan pembuatan obat.
Dalam hal ini, di Industri farmasi seorang apoteker mempunyai peranan
penting untuk menerapkan aspek – aspek yang tercantum dalam CPOB tersebut.
Untuk memenuhi persyaratan yang tercantum dalam CPOB tersebut, apoteker
bertanggung jawab untuk menghasilkan obat yang bermutu, aman dan berkhasiat.
Oleh karena itu penyediaan tenaga apoteker yang handal mutlak diperlukan untuk
menghasilkan tenaga apoteker yang profesional. Untuk mewujudkan hal tersebut,
dibutuhkan dukungan dan peran aktif dari berbagai pihak yang salah satunya
adalah industri farmasi.
Pembekalan berupa praktek kerja secara langsung sangat diperlukan untuk
mendapatkan gambaran mengenai fungsi dan tanggung jawab apoteker di industri
farmasi, yang mana hal ini berkaitan dengan penerapan CPOB.
Praktek Kerja Profesi Apoteker (PKPA) merupakan salah satu sarana bagi
calon apoteker untuk mendapatkan pengalaman kerja dan pemahaman yang lebih
dalam tentang tugas dan fungsi Apoteker di industri farmasi. Oleh karena itu
1 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
2
program pendidikan Apoteker Universitas Indonesia menjalin kerjasama dengan
PT. Konimex untuk memberikan kesempatan kepada calon Apoteker
menyelenggarakan PKPA yang dilaksanakan mulai tanggal 12 September sampai
dengan 4 November 2011.
1.2 Tujuan Praktek Kerja
Praktek Kerja Profesi Apoteker yang dilaksanakan di industri farmasi adalah
sebagai berikut:
a. Memahami CPOB dan mengetahui penerapannya di PT. Konimex
b. Mengetahui dan memahami peran Apoteker di industri farmasi.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 2
TINJAUAN UMUM
2.1 Industri Farmasi
Berdasarkan Surat Keputusan Menteri Kesehatan Nomor
1799/Menkes/PER/XII/2010 Bab 1 pasal 1, yang dimaksud dengan industri
farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk
melakukan kegiatan pembuatan obat atau bahan obat. Suatu industri farmasi wajib
mempunyai izin usaha industri farmasi sebelum memulai proses produksinya. Izin
usaha industri farmasi diberikan kepada pemohon yang telah siap berproduksi
sesuai persyaratan CPOB. Untuk mendapatkan izin usaha industri farmasi,
sebelumnya harus melalui tahap persetujuan prinsip. Persetujuan prinsip ini
diberikan kepada industri farmasi untuk melakukan persiapan-persiapan dan usaha
pembangunan, pengadaan dan pemasangan instalasi peralatan. Persetujuan prinsip
tersebut berlaku selama jangka waktu 3 tahun dan dapat diperpanjang untuk
paling lama 1 tahun. Perusahaan yang bersangkutan wajib menyampaikan
informasi kemajuan pembangunan proyeknya setiap 6 bulan sekali kepada
Direktur Jendral Pembinaan Kefarmasian dan Alat Kesehatan (Binfar Alkes)
dengan tembusan kepada kepada Kepala Badan Pengawas Obat dan Makanan
(BPOM) dan kepala dinas kesehatan provinsi. Bagi industri farmasi yang
melakukan penambahan kapasitas produksi atau penambahan bentuk sediaan tidak
memerlukan izin perluasan. Izin usaha industri farmasi berlaku untuk seterusnya
selama perusahaan industri farmasi yang bersangkutan berprodusksi.
Untuk mendapatkan izin usaha, maka industri farmasi yang ada di
Indonesia harus memenuhi beberapa persyaratan yang telah telah ditetapkan oleh
pemerintah. Beberapa persyaratan tersebut seperti tercantum dibawah ini:
a. Berbadan usaha berupa perseroan terbatas
b. Memiliki rencana investasi dan kegiatan pembuatan obat
c. Memiliki nomor pokok wajib pajak (NPWP)
d. Memiliki secara tetap paling sedikit 3 orang apoteker Warga Negara
Indonesia masing – masing sebagai penanggung jawab pemastian mutu,
produksi dan pengawasan mutu
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
4
e. Komisaris dan direksi tidak pernah terlibat, baik langsung maupun tidak
langsung dalam pelanggaran peraturan perundang – undangan di bidang
kefarmasian
Kewajiban yang harus dilakukan oleh perusahaan farmasi yang telah
memperoleh Izin Usaha Industri Farmasi, yaitu:
a. Membuat jumlah laporan dan nilai produksinya sekali dalam 6 (enam) bulan.
Sedangkan untuk laporan lengkap wajib dilaporkan sekali dalam setahun.
b. Menyalurkan produksinya sesuai dengan ketentuan perundang-undangan
yang berlaku.
c. Melaksanakan upaya keseimbangan dan kelestarian serta mencegah
pencemaran lingkungan.
d. Melaksanakan keamanan dan keselamatan alat, bahan baku, proses, hasil
produksi, pengangkutan dan keselamatan kerja.
e. Melakukan Analisis Mengenai Dampak Lingkungan (AMDAL) berupa
Upaya Pengelolaan Lingkungan (UKL) dan Upaya Pemantauan Lingkungan
(UPL).
2.2 PT. Konimex
2.2.1 Sejarah dan Perkembangan
PT. Konimex Pharmaceutical Laboratories berdiri pada tanggal 8 Juni
1967 oleh Djoenaedi Joesoef. Sebelumnya nama PT Konimex adalah PT Kondang
Sewu yang bergerak dalam bidang perdagangan obat-obatan, bahan kimia, alat
laboratorium dan alat kedokteran. Pada tahun 1971, dengan dukungan fasilitas
dari Penanaman Modal Dalam Negeri (PMDN), PT. Konimex memulai
memproduksi obat-obat sendiri. Perkembangan usaha PT. Konimex cukup
berkembang sejalan dengan pertumbuhan ekonomi di Indonesia. Tahun 1972,
usaha bisnis terkonsentrasi pada produksi farmasi OTC dengan kemasan 4 tablet
yang berlangsung sampai sekarang. Bisnis lainnya seperti alat kesehatan, dental
equipment dan hospital packing products tidak dilanjutkan lagi
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
5
Pada tahun 1977, PT. Konimex mulai bekerja sama dengan konsultan
untuk memulai melakukan pembenahan struktur dan sistem manajemen,
melaksanakan program pelatihan, serta merekrut tenaga profesional.
Pada tahun 1979, PT. Konimex membangun pabrik baru di Sanggrahan,
sekitar lima kilometer barat daya Surakarta. Pada tahun 1980, di kompleks ini
didirikan pabrik kembang gula Nimm’s. Didirikannya pabrik kembang gula
Nimm’s merupakan awal diversifikasi PT. Konimex ke industri makanan. Divisi
farmasi merupakan tulang punggung kelompok usaha PT. Konimex dan telah
memiliki lebih dari 121 merek produk. Pada awalnya PT. Konimex hanya
memproduksi obat-obat bebas (OTC), namun saat ini PT. Konimex juga
mengembangkan obat-obat dengan resep dokter (ethical) serta produk non kuratif,
seperti food supplement dan vitamin. Pada tahun 1980, adanya peraturan
pemerintah yang mengharuskan pemisahan antara produsen obat dengan
distributornya maka PT. Konimex mendirikan PT. Sinar Intermark. Kemudian
untuk memperluas jangkauan distribusi dan sejalan dengan semakin banyaknya
produk yang dipasarkan oleh PT. Konimex maka pada tahun 1980 PT. Konimex
mendirikan distributor kedua yaitu PT. Marga Nusantara Jaya. PT. Sinar
Intermark memiliki cabang-cabang yg berpusat di Solo serta melayani distribusi
untuk wilyah Indonesia bagian timur dan sebagian Indonesia bagian tengah. PT.
Marga Nusantara Jaya memiliki cabang-cabang dengan kantor pusat di Jakarta
yang melayani distribusi untuk wilayah Indonesia bagian barat dan sebagaian
Indonesia bagian tengah. Tahun 1993, PT. Konimex mendirikan PT. Solonat yang
memproduksi berbagai makanan ringan khusus dari bahan kacang-kacangan. Dan
pada tahun 1994, pabrik biskuit dan coklat Sobisco didirikan.
Saat ini produk-produk Konimex ini sudah mulai diekspor ke luar negeri,
seperti Singapura, Malaysia, Myanmar, Vietnam, Saudi Arabia, dan Nigeria. PT.
Konimex telah menerima 21 sertifikat CPOB dan 6 sertifikat CPOTB dari Badan
Pengawasan Obat dan Makanan Departemen Kesehatan Republik Indonesia
berdasarkan jenis dan bentuk sediaannya.
Di bidang keorganisasian, PT. Konimex mendukung inisitaif karyawan,
antara lain pembentukan Paguyuban Keluarga Berencana (PKB), Unit Kerja
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
6
Serikat Pekerja Seluruh Indonesia (SPSI), Koperasi Karyawan Mandiri
”SEHAT.”, TPO (Tunjangan Pengobatan), AMAG (Asuransi Multi Arta Guna),
Jamsostek, poliklinik, dokter perusahaan, program pinjaman individual, program
pelatihan atau diklat, dana pensiun, perpustakaan, kesempatan untuk menunaikan
ibadah haji, mushola, kantin, koperasi, paguyuban keluarga sejahtera,
PORKAMEX, social event, serikat pekerja (SPSI) dan Panitia Pembinaan
Keselamatan dan Kesehatan Kerja (K3). Dari segi jumlah, pada tahun 1967 PT.
Konimex memiliki 70 karyawan, sedangkan kini 2011 telah berkembang menjadi
1650 karyawan.
2.2.2 Nilai-nilai Dasar PT. Konimex
Nilai-nilai dasar yang dimiliki oleh PT. Konimex yaitu:
K : Konsisten, tekun, ulet dalam meningkatkan kompetensi diri
O : Optimis dan berpikir positif dalam menghadapi tantangan
N : Nyata dalam memberi contoh dan keteladanan
I : Inisiatif, integritas, intelligent (cerdik) dalam segala tindakan
M : Mutu sebagai landasan dalam berkarya
E : Efektif dalam upaya mewujudkan kepuasan stake holder
X : Xtra upaya dalam mewujudkan etos “hidup bahagia”
2.2.3 Falsafah Usaha PT. Konimex
Sebelum sampai ke tangan konsumen, produk-produk PT. Konimex telah
melewati mata rantai pemasaran yang panjang. Sejak dari tahap produksi,
distribusi hingga promosi, semuanya direncanakan secara terpadu. Semua unsur
pemasaran tersebut mengacu pada falsafah usaha 3 MU Konimex yaitu
menghasilkan produk-produk yang bermutu tinggi, mudah diperoleh, serta relatif
murah harganya bagi sebagian besar masyarakat Indonesia.
2.2.4 Visi dan Misi
Visi yang dimiliki PT. Konimex yaitu Menjadi pemimpin pasar di
Indonesia dan regional serta menjadi pemain aktif di pasar internasional dalam
produk kesehatan dan makanan berdasarkan riset iptek dan riset pasar untuk
kepuasan semua stake holder. Sedangkan misi dari PT. Konimex sendiri telah
dijabarkan di divisi masing - masing.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
7
2.2.5 Lokasi dan Sarana Produksi
Lokasi PT. Konimex berada di Desa Sanggrahan, Kecamatan Grogol,
Kabupaten Sukoharjo, Jawa Tengah. Lokasi pabrik di PT. Konimex terpisah
menjadi 3 daerah produksi yaitu daerah manufacturing plant pharmaceuticals,
natural products dan food. PT. Konimex memiliki sarana produksi yang
digunakan untuk membuat sediaan tablet, tetes mata, cair dan semisolid, produk
natural, serta biskuit dan permen. PT. Konimex juga memperhatikan masalah
penanganan limbah dan polusi udara agar sedapat mungkin tidak merugikan
lingkungan pemukiman sekitar.
Bangunan yang terdapat di PT Konimex terdiri dari gedung kantor, gedung
produksi, teknik, gudang, dan sarana pendukung seperti pengolahan limbah,
lapangan parkir, koperasi, dan kantin.
PT. Konimex memiliki 7 bagian produksi, yaitu:
a. Produksi Pharma I; khusus memproduksi Paramex yang menjadi produk
unggulan PT. Konimex
b. Produksi Farmasi II; untuk memproduksi tablet selain Paramex seperti Inza,
Konidin, Feminax, dll.
c. Produksi Farmasi III; yaitu untuk memproduksi sediaan semisolid dan liquid,
seperti Fit Up, Zero Pain, Fungiderm, dll.
d. Produksi Natpro; yaitu untuk memproduksi Natural Product seperti
Konicare, Herba drink, dll.
e. Produksi Food I; yaitu untuk memproduksi permen, seperti Frozz, Hexos,
Nano-nano, dll.
f. Produksi Food II; yaitu untuk memproduksi biskuit, seperti Choco mania,
TWB, dll.
g. Produksi Food III; yaitu untuk memproduksi sediaan tablet efervecent, seperti
Jesscool, Protecal, dll.
Untuk menunjang proses produksi, PT.Konimex telah memiliki gudang
bahan baku, barang jadi, sistem HVAC dan unit pengolahan limbah yang dikelola
dengan baik.
2.2.6 Jenis Produk PT. Konimex
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
8
Sejak tahun tujuh puluh, pemerintah telah melaksanakan pembangunan
diberbagai sektor sehingga meningkatkan kesejahteraan masyarakat. Peningkatan
kesejahteraan menyebabkan penuntutan terhadap peningkatan kualitas hidup. Hal
ini merupakan tantangan tersendiri bagi PT. Konimex. Sehingga, PT. Konimex
selain memperkuat industri farmasi juga memperluas usaha ke beberapa bidang
lain yang masih dekat dengan usaha intinya.
2.2.6.1 Divisi Farmasi
Sekarang ini divisi farmasi PT. Konimex merupakan divisi farmasi yang
diunggulkan dimana telah memiliki 121 merek produk. Mula-mula PT. Konimex
memproduksi obat OTC (over the counter), dan sekarang PT. Konimex mulai
mengembangkan obat-obat dengan resep dokter (ethical) serta produk non kuratif,
antara lain vitamin. Sediaan yang pertama dibuat hanya sediaan tablet, namun kini
telah dibuat berbagai macam variasi sediaan seperti sirup, salep, krim, kapsul,
serta tablet effervescent. Beberapa merek produk farmasi PT. Konimex yang
populer di masyarakat antara lain Konidin, Neo Napacin, Inza, Inzana, Paramex,
Termorex, Anakonidin, Feminax, Fungiderm, Siladex, Jesscool, Protecal, dan
Braito.
2.2.6.2 Kembang Gula
Produk kembang gula menjadi pilihan pertama pada saat PT. Konimex
melakukan diversifikasi usaha ke industri makanan sehat. Pilihan ini
mempertimbangan faktor peluang pasar dan mempertimbangkan manajemen
produksi kembang gula tidak jauh beda dengan farmasi. Produk kembang gula
yang dikembangkan oleh Nimm’s antara lain hard candy, chew candy, deposit
candy, dan compressed candy. Untuk mengantisipasi perkembangan permintaan
pasar yang dinamis maka Divisi kembang gula Nimm’s telah dilengkapi dengan
mesin-mesin yang canggih dan mutakhir. Selain, pengembangan peralatan
produksi, divisi kembang gula Nimm’s juga melakukan inovasi dalam rasa. Saat
ini divisi ini telah menghasilkan berbagai variasi kembang gula rasa unik dan
sangat digemari oleh masyarakat antara lain Hexos, Nano-Nano, Eski, dan Frozz.
2.2.6.3 Produk Alami
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
9
Selain melakukan diversifikasi usaha ke industri makanan, PT. Konimex
juga melakukan penelitian dan pengembangan produk kesehatan yang berbasiskan
bahan-bahan alami. Hal ini disebabkan masyarakat yang cenderung beralih ke
pengobatan tradisional menggunakan bahan alami. Hingga saat ini telah ada 23
produk berbasis bahan alami yang sudah dipasarkan antara lain Konicare Minyak
Telon, Konicare Minyak Kayu Putih, Virugon, Herba Drink Sari Jahe, Sari
Temulawak dan Kunir Asam. Dengan demikian, usaha ”ikut menyehatkan
bangsa” semakin mendekati kenyataan.
2.2.6.4 Makanan Ringan
Pada tahun 1994 PT. Konimex mendirikan Sobisco sebagai langkah untuk
pemekaran usaha ke industri makanan. Sobisco adalah pabrik biskuit dan coklat
yang dilengkapi dengan fasilitas mesin-mesin canggih berkapasitas besar. Di
antara produk-produk Sobisco yang terkenal di masyarakat antara lain Snips
Snaps, Tini Wini Biti Choco Mania dan Diasweet Litebite.
2.3 Cara Pembuatan Obat yang Baik (CPOB)
Cara Pembuatan Obat yang Baik (CPOB) menyangkut seluruh aspek
produksi dan pengendalian mutu dan bertujuan untuk menjamin bahwa produk
obat dibuat senantiasa memenuhi persyaratan mutu yang telah ditentukan sesuai
dengan penggunaannya. CPOB merupakan pedoman yang bertujuan untuk
memastikan agar sifat dan mutu obat yang dihasilkan sesuai dengan yang
dikehendaki, bila perlu dapat dilakukan penyesuaian dengan syarat bahwa standar
mutu obat yang telah ditentukan tetap dapat dicapai. CPOB merupakan bagian
dari sistem pemastian mutu yang mengatur dan memastikan obat diproduksi dan
mutunya dikendalikan secara konsisten sehingga produk yang dihasilkan
memenuhi persyaratan mutu yang ditetapkan sesuai tujuan penggunaan poduk
disamping persyaratan lainnya.
Berdasarkan Keputusan Menteri Kesehatan Republik Indonesia nomor
43/MENKES/SK/II/1988 tentang Pedoman Cara Pembuatan Obat yang Baik
(CPOB) maka setiap industri farmasi harus menerapkan persyaratan yang
tercantum dalam CPOB tersebut. CPOB adalah bagian dari sistem pemastian
mutu pemastian mutu yang memastikan bahwa obat dibuat dan dikendalikan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
10
secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan
penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB
mencakup seluruh aspek produksi dan pengawasan mutu.
Badan POM RI selaku regulator industri farmasi nasional, mencanangkan
penerapan CPOB edisi tahun 2006 (CPOB Terkini) bagi industri farmasi di
Indonesia mulai 01 Januari 2007 dengan surat keputusan Kepala Badan POM
Nomor HK.00.053.0027 tahun 2006.
Penerapan CPOB 2006 ini juga bertujuan, antara lain:
a. meningkatkan kemampuan industri farmasi Indonesia sesuai dengan standar
internasional agar lebih kompetitif baik untuk pasar domestik maupun untuk
pasar ekspor
b. mendorong industri farmasi Indonesia agar lebih efisien dan fokus dalam
pelaksanaan produksi obat, termasuk pemilihan fasilitas produksi yang paling
layak untuk dikembangkan, sehingga produk obat industri farmasi Indonesia
mampu menembus pasar dunia karena khasiat dan mutu obat lebih terjamin
c. peningkatan citra perusahaan dan volume pasar
d. menghindari produk yang tidak memenuhi syarat dan pemborosan biaya
e. menghindari resiko regulasi serta lebih menjamin waktu pemasaran.
Diharapkan dengan penerapan CPOB 2006 ini industri farmasi di
Indonesia akan siap menghadapi globalisasi pasar farmasi yang sudah di depan
mata.
Pada tahun 2009, BPOM menerbitkan Suplemen I 2009 Pedoman CPOB
2006. Penerbitan suplemen ini dimaksudkan untuk pemutakhiran Pedoman CPOB
2006 dan penambahan persyaratan sesuai Standar Internasional yang berlaku.
Dalam suplemen ini diperbaharui mengenai Bab 1 tentang Manajemen Mutu dan
Aneks 1 tentang Pembuatan Produk Steril serta menambahkan beberapa aspek
yang belum tercantum dalam Pedoman CPOB 2006.
2.3.1 Manajemen Mutu
Dalam manajemen mutu Industri farmasi harus membuat obat sedemikian
rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang
tercantum dalam dokumen izin edar dan tidak menimbulkan resiko yang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
11
membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif.
Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu
kebijakan mutu yang memerlukan partisipasi dan komitmen dari semua jajaran di
semua departemen dalam perusahaan, para pemasok dan para distributor. Unsur
dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat
mencakup struktur organisasi, prosedur, proses dan sumber daya serta pemastian
mutu.
Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan
tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan
tujuan penggunaanya. Sedangkan pengawasan mutu adalah bagian dari CPOB
yang berhubungan dengan pengambilan sampel, spesifikasi, dan pengujian, serta
dengan organisasi, dokumentasi dan prosedur pelulusan. Setiap industri farmasi
hendaklah mempunyai fungsi pengawasan mutu. Dalam bab manajemen mutu,
dijelaskan pula mengenai pengkajian mutu produk. Pengakajian mutu produk
dilakukan secara berkala terhadap semua obat terdaftar, termasuk ekspor dengan
tujuan membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal,
bahan pengemas dan obat jadi untuk melihat tren dan mengidentifikasi perbaikan
yang diperlukan untuk produk dan proses.
2.3.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan
sisten pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh
sebab itu industri farmasi bertanggung-jawab untuk menyediakan personil yang
terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap
personil hendaklah memahami tanggung jawab masing-masing dan dicatat.
Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan
awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan
dengan pekerjaan.
Personil kunci mencakup kepala bagian produksi, kepala bagian
pengawasan mutu dan kepala bagian manajemen mutu (pemastiaan mutu).
Kepala produksi dan manajeman mutu hendaklah seorang apoteker yang terdaftar
dan terkualifikasi dan memiliki pengalaman praktis. Kepala bagian pengawasan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
12
mutu hendaklah diutamakan seorang terkualifikasi dan lebih diutamakan seorang
apoteker. Dalam CPOB 2006 dijelaskan bahwa dalam struktur organisasi industri
farmasi bagian produksi, manajemen mutu atau pengawasan mutu dipimpin oleh
orang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain.
Mengenai pelatihan, industri farmasi hendaklah memberikan pelatihan bagi
seluruh personil yang karena tugasnya harus berada di dalam area produksi,
gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan, dan
petugas kebersihan) dan personil lain yang kegiatannya akan berdampak pada
mutu produk. Pelatihan diberikan secara berkesinambungan dan efektif
penerapannya serta dinilai secara berkala.
2.3.3 Bangunan dan fasilitas
Mengenai bangunan dan fasilitas CPOB menjelaskan ketentuan-ketentuan
bangunan dan fasilitas pada area penimbangan, area produksi, area penyimpanan,
area pengawasan mutu, serta sarana pendukung (ruang istirahat, kantin, mengganti
pakaian kerja, toilet, bengkel perbaikan dan perawatan peralatan). Bangunan dan
fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak
yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk
memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan
harus dibuat sedemikian rupa untuk memperkecil resiko terjadinya kekeliruan,
pencemaran silang, dan kesalahan lain, dan memudahkan pembersihan, sanitasi
dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan
debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
2.3.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi
yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan
tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan
untuk memudahkan pembersihan serta perawatan. Dalam bab peralatan
menjelaskan mengenai ketentuan desain dan konstruksi, pemasangan dan
penempatan peralatan serta perawatan. Peralatan hendaknya didesain dan
dikonstruksikan sesuai dengan tujuannya. Peralatan yang bersentuhan dengan
bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi,
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
13
absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian. Peralatan
ditempatkan sedemikian rupa untuk memperkecil kemungkinan terjadinya
pencemaran silang antar bahan diarea yang sama. Peralatan satu sama lain
ditempatkan pada jarak yang cukup untuk menghindari kesesakan serta
memastikan tidak terjadi kekeliruan dan campu-baur produk. Peralatan dirawat
sesuai jadwal untuk mencegah malfungsi atau pencemaran yang bisa
mempengaruhi identitas, mutu atau kemurnian.
2.3.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan dalam
setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi
personalia, bangunan, peralatan, perlengkapan, bahan produksi, serta wadahnya,
dan segala sesuatu yang dapat merupakan sumber pencemaran poduk. Sumber
pencemaran potensial hendaklah dihilangkan melaui suatu program sanitasi dan
higiene yang menyeluruh dan terpadu.
Untuk menjamin perlindungan produk dari pencemaran dan untuk
keamanan personil, personil mengenakan pakaian pelindung yang bersih dan
sesuai dengan tugasnya. Tersedia dalam jumlah cukup sarana toilet dengan
ventilasi yang baik, dan sarana memadai untuk penyimpanan pakaian personil.
2.3.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah
ditetapkan, dan memenuhi ketentuan CPOB yang menjamin senantiasa
menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi
ketentuan izin pembuatan dan izin edar (registrasi). Produksi hendaklah dilakukan
dan diawasi oleh personil yang kompeten.
Aspek produksi mencakup perlakuan terhadap bahan awal; validasi proses;
pencegahan pencemaran silang; sistem penomoran bets atau lot; penimbangan dan
penyerahan serta pengembalian; pengolahan; bahan dan produk kering; bahan
pengemas; kegiatan pengemasan; pengawasan selama proses; bahan dan produk
yang ditolak, dipulihkan dan dikembalikan; karantina dan penyerahan produk jadi;
penyimpanan bahan awal; bahan pengemas, produk antara, produk ruahan dan
produk jadi; pengiriman dan pengangkutan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
14
Ketentuan pada bahan awal antara lain pengadaan bahan awal hendaknya
dari pemasok yang telah disetujui dan memenuhi spesifikasi yang relevan. Semua
penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan
tersebut meliputi keterangan mengenai persediaan, nomor bets atau lot, tanggal
penerimaan dan pengeluaran, tanggal diluluskan dan tanggal daluawarsa. Setiap
bahan awal, sebelum dinyatakan lulus untuk digunakan hendaknya memenuhi
spesifikasi bahan awal yang sudah ditetapkan dan diberi label dengan nama yang
dinyatakan dalam spesifikasi. Pada saat penerimaan terhadap setiap kiriman
dilakukan pemeriksaan secara visual tentang kondisi umum, keutuhan wadah dan
segelnya, kebocoran dan kemungkinan adanya kerusakan bahan. Bahan awal yang
diterima hendaklah dikarantina sampai disetujui dan diluluskan untuk pemakaian.
Pada validasi proses, prosedur produksi hendaknya divalidasi dengan
tepat. Validasi hendaknya dilaksanakan menurut prosedur yang telah ditentukan
dan catatan hasilnya disimpan. Luas serta tingkat validasi yang dilakukan
tergantung dari sifat dan kerumitan produk dan proses yang bersangkutan.
Perubahan yang berarti dalam proses, peralatan, atau bahan hendaknya disertai
dengan tindakan ulang, untuk menjamin bahwa perubahan tersebut akan tetap
menghasilkan produk yang memenuhi spesifikasi yang telah ditetapkan.
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap
pencemaran mikroba dan pencemaran lain. Perhatian khusus diberikan pada
masalah pencemaran silang. Pencemaran silang dihindari dengan tindakan teknis
atau pengeturan yang tepat, misalnya dengan tersedianya ruang penyangga udara
dan penghisap udara.
Sistem yang menjabarkan penomoran bets dan lot secara rinci diperlukan
untuk memastikan bahwa produk antara, produk ruahan atau produk jadi suatu
bets atau lot dapat dikenali dengan nomor bets dan lots tertentu. Penomoran bets
dan lot yang digunakan pada tingkat pengolahan dan pengemasan selanjutnya
hendaknya saling berkaitan. Pemberian nomor bets atau lot yang dialokasikan
segera di catat dalam suatu buku catatan harian.
Penimbangan dan penyerahan bahan baku, bahan pengemas, produk antara
dan produk ruahan dianggap suatu bagian dari siklus produksi dan memerlukan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
15
dokumentasi dan rekonsiliasi yang lengkap. Sebelum melakukan penimbangan
dilakukan pemeriksaan kebenaran penandaan bahan baku termasuk label
pelulusan. Kapasitas, ketepatan dan ketelitian alat timbangan dan alat ukur yang
digunakan harus sesuai dengan jumlah bahan yang ditimbang.
Semua bahan yang dipakai dalam pengolahan diperiksa lebih dahulu
sebelum digunakan. Kondisi daerah pengolahan dipantau dan dikendalikan sampai
tingkat yang disyaratkan. Sebelum pengolahan dimulai ditempuh langkah yang
menjamin bahwa daerah pengolahan dan peralatan bebas dari bahan, produk yang
tidak diperlukan.
2.3.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari Cara Pembuaatan
Obat yang Baik untuk memberikan kepastian mutu bahwa produk secara
konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya.
Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap
merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan
sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada
kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait
dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi
dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan
dengan memuaskan.
Pengawasan mutu mencakup semua kegiatan analitis yang dilakukan di
laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan
awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini mencakup juga
uji stabilitas, penanganan sampel pertinggal, menyusun dan memperbaharui
spesifikasi bahan dan produk serta metode pengujianya.
Mengenai pengawasan mutu mencakup ketentuan cara berlaboratorium
pengawasan mutu yang baik; pengawasan bahan awal, produk antara, produk
ruahan dan produk jadi; dokumentasi; pengambilan sampel, dan persyaratan
pengujian.
2.3.8 Inspeksi Diri dan Audit Mutu
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
16
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek
produksi dan pengawasan mutu industri farmasi memenuhi kriteria Cara
Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang
untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan
tindakan perbaikan yang diperlukan. Tim inspeksi ditunjuk oleh manajemen
perusahaan terdiri dari sekurang-kurangnya 3 orang yang ahli dibidang
pekerjaannya dan paham mengenai CPOB. Inspeksi diri hendaklah dilakukan
secara independen dan rinci oleh petugas yang kompeten dari perusahaan.
Inspeksi diri hendaklah dilakukan secara rutin, di samping itu, pada situasi
khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi
penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya
dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan
dibuat program tindak lanjut yang efektif.
2.3.9 Penanganan Keluhan terhadap Obat, Penarikan Kembali Obat dan Obat
Kembalian.
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan
terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur
tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu
sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga
cacat dari peredaran secara cepat dan efektif. Penarikan kembali produk adalah
suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets
produk tertentu dari peredaran dilakukan. Penarikan kembali produk dilakukan
apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi
yang merugikan yang serius serta beresiko terhadap kesehatan. Penarikan kembali
produk dari peredaran dan dapat mengakibatkan penundaan atau penghentian
pembuatan obat tersebut. Produk kembalian adalah obat jadi yang telah beredar,
yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai
kerusakan, kadaluarsa, atau alasan lain misalnya kondisi wadah atau kemasan
yang menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat
yang bersangkutan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
17
Keluhan terhadap obat mencakup keluhan terhadap mutu (keadaan fisik,
kimia dan biologi), reaksi yang merugikan atau masalah efek terapetik (tidak
berkhasiat). Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi
dengan cermat, kemudian diambil tindak lanjut yang sesuai dan dibuatkan
laporan. Tindakan penarikan kembali dilakukan segera setelah diketahui ada
produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan.
Produk kembalian adalah obat jadi yang telah beredar, yang kemudian
dikembalikan ke pabrik karena adanya keluhan, kerusakan, kadaluarsa, masalah
keabsahan, atau sebab lain mengenai kondisi obat, wadah atau kemasan sehingga
menimbulkan keraguan akan keamanan, identitas, mutu dan jumlah obat yang
bersangkutan. Pabrik hendaklah membuat prosedur untuk menahan, menyelidiki
dan menganalisis obat yang dikembalikan serta menetapkan apakah obat tersebut
dapat diproses kembali atau harus dimusnahkan.
2.3.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan
dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu.
Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap
personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga
memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul
karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi
induk/formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan
harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen
adalah sangat penting.
2.3.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar,
disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara
jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak
harus menyatakan secara jelas prosedur pelulusan setiap bets produk untuk
diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
18
(pemastian mutu). Pada bab ini meliputi tanggung jawab industri farmasi terhadap
Otoritas Pengawasan Obat (OPO) dalam hal pemberian izin edar dan pembuatan
obat.
2.3.12 Kualifikasi dan Validasi
Pada bab ini menguraikan prinsip kualifikasi dan validasi yang dilakukan
di industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi
validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis
dan kegiatan yang dilakukan. Perubahan signifikasi terhadap fasilitas, peralatan,
dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi.
Pendekatan dengan kajian resiko hendaklah digunakan untuk menentukan ruang
lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program
validasi hendaklah dirinci dengan jelas dan didokumentasi di dalam Rencana
Induk Validasi (RIV) atau dokumen setara.
Kualifikasi mencakup kualifikasi desain; kualifikasi instalasi; kualifikasi
operasional; kualifikasi kinerja; kualifikasi fasilitas, peralatan dan sistem
terpasang yang telah operasional. Pada validasi proses dapat berupa validasi
prospektif, validasi konkuren, validasi retrospektif, selain validasi proses ada pula
validasi pembersihan, validasi ulang, validasi metode analisis.
2.4 Bagian Human Resource Organization (HRO)
Sumber daya manusia sangat penting dalam pembentukan dan penerapan
sisten pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh
sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang
terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap
personil hendaklah memahami tanggung jawab masing-masing dan dicatat.
Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan
awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan
dengan pekerjaan.
Divisi yang menangani personalia (SDM) di PT.KONIMEXadalah Human
Resources and Organization (HRO). Struktur organisasi HRO adalah sebagai
berikut :
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
19
GM HRO
HRD Personnel Recruitment General Service
Manager Manager Manager Manager
Gambar 2.1 Struktur organisasi bagian HRO
HRO (Human Resources Organization) membawahi fungsi Human
Resources yang dibagi menjadi 4 yaitu Human Resources Development (HRD),
Recruitment, Personnel, dan General Sevice.
Tugas pokok rutin yang dilaksanakan oleh divisi HRO antara lain adalah:
a. Pengendalian/pengontrolan pusat, dalam menumbuhkan hubungan yang baik
antara karyawan dan perusahaan. Oleh karena itu, divisi HRO perlu
bekerjasama dengan semua manajer dari tiap unit yang ada untuk menjamin
terciptanya hubungan baik tersebut.
b. Melakukan riset/penelitian terhadap validitas alat tes kepribadian yang
dipakai, serta kepuasan pekerja.
Bagian Human Resources Development (HRD) memiliki tanggung jawab
sebagai berikut :
a. Menjamin terselenggaranya pengembangan SDM yang efektif dan efisien
melalui pelatihan dan pengembangan SDM
b. Menjamin terpimpinnya penyediaan informasi yang berkaitan dengan SDM
dan pengembangannya serta dokumentasinya seperti tanggung jawab
kerja/daftar pekerjaan, spesifikasi pekerjaan, penghargaan terhadap unjuk
kerja, dan sebagainya.
c. Menjamin terselenggaranya program-program komunikasi yang sehat untuk
pembinaan SDM melalui forum diskusi, majalah internal PT. Konimex
(KONTEX), website HRD-Knowledge Management, dan lain-lain.
d. Menjamin berkembangnya program perbaikan di PT. Konimex
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
20
e. Menjamin terselenggaranya kegiatan pemeliharaan terhadap SDM melalui
riset-riset SDM seperti Riset Kepuasan Karyawan, Budaya Perusahaan
f. Kegiatan Tim Pembina Personalia (TPP) yang kegiatannya meliputi Paguyuban
Keluarga Sehat (PKS), Serikat Pekerja Farmasi dan Kesehatan (SP FARKES),
Koperasi Karyawan Mandiri “SEHAT”. TPP secara berkala mengadakan acara
bersama bagi seluruh karyawan, misalnya gerak jalan bersama, musik dan
hiburan, outbond, dan sebagainya. Hal tersebut bertujuan untuk mengakrabkan
seluruh karyawan beserta dengan keluarga. Selain itu, juga diadakan acara
siraman rohani bersama untuk meningkatkan kerohanian karyawan.
Bagian Personel memiliki tugas dan peran antara lain adalah :
a. Memimpin terlaksananya administrasi personalia seperti asuransi karyawan
(asuransi rumah sakit dan bersalin, dana pensiun, kecelakaan), data pribadi
karyawan, gaji, tunjangan pengobatan, tunjangan lainnya, serta indeks
kedisiplinan.
b. Memimpin pelaksanaan penyediaan sarana dan hal-hal lain yang terkait dengan
kesejahteraan karyawan seperti antara lain: pakaian seragam karyawan,
poliklinik sesuai dengan kebijakan yang berlaku, dan sebagainya.
c. Menggali, menampung, dan mencarikan solusi terhadap semua pemasalah
personnel serta mengusulkan perbaikan Perjanjian Kerja Bersama, sistem,
prosedur, dan peraturan yang terkait
d. Menterjemahkan/menafsirkan arti pasal-pasal pada Perjanjian Kerja Bersama
(PKB) yang berlaku pada saat pelatihan ataupun ketika menerima pertanyaan
dari karyawan/kepala bagian/supervisor di lingkungan non–operation
e. Memimpin pelaksanaan/melaksanakan tugas-tugas terkait dengan pelatihan-
pelatihan dan pengembangan SDM terkait antara lain induction training untuk
karyawan tingkat pelaksana, pembinaan sikap/mental dengan input tingkat
kedisiplinan dan penilaian prestasi kerja
Untuk menjamin kesejahteraan karyawan, PT. Konimex juga memberikan
fasilitas dan jaminan kesehatan karyawan yaitu:
a. Kendaraan dinas, tunjangan makan siang, tunjangan perumahan, perjalanan
dinas
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
21
b. Asuransi kesehatan, tunjangan pengobatan, jamsostek dan dana pensiun
c. Poliklinik PT. Konimex dan tempat ibadah (seperti mushola) dan perpustakaan
d. Pinjaman pembelian kendaraan dan rumah bagi karyawan yang memenuhi
persyaratan
e. Wadah kegiatan di PT Konimex: Paguyuban Keluarga Sehat (PKS), Serikat
Pekerja Farmasi dan Kesehatan (SP FARKES), Koperasi Karyawan Mandiri
“SEHAT”
Bagian industrial relation terdapat pada divisi operation. Bagian industrial
relation memiliki peran yaitu:
a. Memastikan perjanjian kerja bersama (PKB) PT. Konimex memenuhi
ketentuan hukum/perundangan yang berlaku dan ditaati oleh pihak terkait.
b. Memastikan situasi kerja yag berlandaskan hubungan industrial berjalan baik
dan benar yaitu: berperan sebagai mediator apabila terjadi kasus penyimpangan
terhadap PKB, membuat jadwal bipartit secara berkala/insidentil, melakukan
sarasehan/diskusi dengan level pimpinan secara berkala/insidensil.
c. Menyediakan informasi tentang perkembangan hukum/perundangan yang
terkait dengan ketenagakerjaan dan K3 melalui artikel-artikel/knowledge
management.
d. Mewujudkan kondisi kerja tanpa kecelakaan kerja: melalui inspeksi terstruktur
ke tempat yang yang potensial terjadi kecelakaan kerja dan memimpin
terlaksananya program-program K3.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 3
TINJAUAN KEGIATAN DI PT. KONIMEX
3.1 Pemastian Mutu
Seluruh kegiatan yang berhubungan dengan pemastian mutu di
PT.Konimex dilakukan oleh bagian Quality Assurance (QA). Bagian ini terbagi
menjadi empat sub bagian berdasarkan fungsi dan tugasnya, diantaranya
Document Control, Validation, Good Manufacturing Practice (GMP), dan
Quality Control.
3.1.1 Bagian Good Manufacturing Practice (GMP)
PT. Konimex sebagai perusahaan farmasi yang mengutamakan kualitas
produk dan keamanan konsumennya telah menerapkan GMP sesuai dengan yang
telah ditetapkan dalam regulasi. Dalam menjamin tersedianya sistem prosedur,
mekanisme dan pelaksanaan serta pengelolaan semua dokumen terkait audit
GMP, Hazard Analysis of Critical Control Point (HACCP), halal, lingkungan,
Keselamatan dan Kesehatan Kerja (K3), dan International Standard Organitation
(ISO), PT. Konimex mewadahi ini semua dalam bidang GMP yang berada di
bawah Quality Assurance. Penerapan Good Manufacturing Practice (GMP) atau
CPOB menjadi sangat penting bagi industri farmasi agar yang obat dibuat
konsisten, memenuhi spesifikasi yang sesuai, memenuhi peraturan nasional dan
internasional, dan sesuai dengan tujuan penggunaannya. CPOB mencakup seluruh
aspek produksi dan pengendalian mutu.
CPOB harus diterapkan di industri farmasi sebagai tuntutan dari berbagai
pihak yaitu :
a. Pemerintah
Pemerintah berperan dalam mencegah persaingan tidak sehat diantara industri
farmasi dan menjamin obat yang dikonsumsi bermutu tinggi dan tidak
membahayakan pemakainya
b. Konsumen
22 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
23
Konsumen menghendaki obat yang manjur, aman bermutu (isi sesuai dengan
etiket, indikasi obat sesuai dengan tujuan penggunaannya, obat tidak rusak
hingga saat pemakaiannya)
c. Perusahaan itu sendiri
Penerapan CPOB bagi perusahaan adalah untuk membangun citra dari
perusahaan, dan sebagai komitmen dari perusahaan yang bersangkutan.
Penerapan CPOB di industri farmasi sangat bermanfaat terutama dalam
hal mutu produk berupa peningkatan keamanan konsumen, peningkatan citra
perusahaan, peningkatan pangsa pasar, mengurangi risiko produk tidak memenuhi
syarat mutu, mengurangi risiko ketidaksesuaian dengan peraturan.
Guidance GMP mengatur berbagai macam aspek yang mendukung
terbangunnya kualitas produk, mulai dari manajemen mutu, personalia, bangunan
dan fasilitas, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi
diri dan audit mutu, penanganan terhadap produk jadi, dokumentasi, analisis, serta
kualifikasi dan validasi. Sesuai dengan prinsip GMP dimana mutu obat harus
dibangun sejak awal, PT. Konimex memproduksi obat dalam kondisi yang
dikendalikan dan dipantau dengan cermat. Unsur dasar manajemen mutu yang
diterapkan PT. Konimex adalah:
a. Suatu infrastruktur atau sistem mutu mencakup struktur organisasi, prosedur,
proses dan sumber daya.
b. Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat
kepercayaan yang tinggi sehingga produk yang dihasilkan selalu memenuhi
persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut
pemastian mutu (Quality Assurance).
Sistem pemastian mutu harus didukung dengan tersedianya personil yang
kompeten, bangunan dan sarana serta peralatan yang cukup dan memadai. PT.
Konimex membangun mutu pada semua aspek yang mempengaruhi hasil seperti
pada bahan awal, proses pembuatan, pengawasan mutu, bangunan, peralatan, dan
personil sehingga PT. Konimex dapat meyakinkan konsumen bahwa produk yang
dihasilkan bermutu.
Personil yang bekerja di PT. Konimex adalah personil yang sehat,
terkualifikasi, dan memiliki pengalaman praktis. Kesehatan personil diperiksa saat
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
24
perekrutan dan pemeriksaan berkala. Untuk terus meningkatkan kualitas dari
personil maka diadakan program pelatihan mengenai GMP (CPOB, CPOTB,
CPMB, CPPOB) dan pelatihan yang dilakukan oleh bagian terkait pemahaman
terhadap semua prosedur tetap, cara pengolahan dan pengemasan. Pelatihan ini
dilakukan secara berkesinambungan yang dinilai efektivitasnya secara berkala dan
terdokumentasi.
Bangunan dan fasilitas di PT. Konimex didesain dengan konstruksi dan
tata letak yang memadai untuk meminimalkan resiko kekeliruan, pencemaran
silang, dan kesalahan lain. Salah satunya adalah dengan membuat desain dimana
proses pembersihan, sanitasi, dan perawatan dapat dilakukan dengan mudah,
termasuk dalam desain dan konstruksi peralatan yang digunakan. Tata letak
ruangan produksi didesain mengikuti urutan tahap dan menurut kelas kebersihan
yang dipersyaratkan. Luas area kerja dan area penyimpanan bahan atau produk
yang sedang dalam proses memadai.
PT. Konimex memiliki fasilitas instalasi pipa, udara, lampu, dan saluran
pembuangan yang dipasang sedemikian rupa sehingga mencegah pencemaran
produk. Pada area penyimpanan atau gudang didesain khusus untuk menjamin
kondisi penyimpanan yang baik. Adanya penandaan yang jelas untuk barang yang
berstatus karantina serta adanya tempat penyimpanan yang khusus untuk bahan
yang berisiko tinggi terhadap penyalahgunaan seperti bahan prekursor. Peralatan
di PT. Konimex di desain dengan konstruksi menggunakan baja tahan karat.
Peralatan tersebut ditempatkan dan dikualifikasi dengan sesuai desain dan
seragam dari bets ke bets. Perawatan terhadap semua peralatan di PT. Konimex
secara periodik termasuk kalibrasi alat timbang dan ukur yang lain.
Salah satu upaya untuk menjamin kebersihan fasilitas dan personil maka
dibuat prosedur mengenai sanitasi dan higiene. Ruang lingkup sanitasi meliputi
personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya,
dan segala sesuatu yang dapat menjadi sumber pencemaran produk. Prosedur
pembersihan, sanitasi dan higiene divalidasi dan dievaluasi secara berkala untuk
memastikan efektivitasnya.
Produksi dijalankan dengan mengikuti prosedur yang ditetapkan dan
memenuhi ketentuan CPOB mulai dari proses penyediaan bahan baku dan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
25
kemasan, proses produksi, in process control, penanganan produk jadi (yang
ditolak, dipulihkan, dan dikembalikan), proses karantina dan hingga penyerahan
produk jadi. Untuk memastikan bahwa produk yang dihasilkan konsisten
memenuhi mutu yang sudah ditetapkan dilakukan pengawasan mutu sebagai
bagian yang esensial dari CPOB. Pengawasan mutu dilaksanakan oleh bagian
Quality Control terhadap bahan awal, produk antara, produk ruahan, dan produk
jadi (yang dilakukan dengan sistem sampling), berperan pada proses
monitoring/pengendalian terhadap lingkungan, pengelolaan rekaman hasil
pemeriksaan, penanganan sampel pertinggal, dan melakukan uji stabilitas produk.
Inspeksi diri dan audit mutu dilakukan GMP untuk mengevaluasi bahwa
semua aspek produksi dan pengawasan mutu memenuhi ketentuan CPOB.
Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan
CPOB sehingga dapat ditetapkan tindakan perbaikan. Semua prosedur dan
dokumentasi hasil serta catatan inspeksi diri didokumentasikan dan dibuat
program tindak lanjut yang efektif. Inspeksi diri dilakukan minimal 1 kali setahun
untuk setiap bagian dan dilaksanakan oleh tim auditor dengan berpedoman pada
Pedoman GMP yang berlaku.
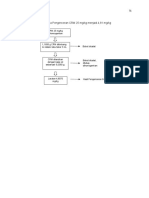
Mekanisme audit di PT.Konimex adalah sebagai berikut :
Gambar 3.1 Mekanisme audit GMP
Audit GMP dilakukan tehadap semua faktor yang terkait mutu produk dan
proses, meliputi : personil, bangunan dan fasilitas, peralatan, penyimpanan bahan
awal, pengemas dan produk (produk jadi, antara, ruahan), produksi, pengawasan
mutu, dokumentasi, sanitasi dan higiene, dan validasi. Tim auditor berpedoman
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
26
pada Pedoman GMP (CPOB, CPOTB, CPKB, CPMB, CPPOB) yang berlaku.
Setelah dilakukan audit harus ada tindakan perbaikan dan pencegahan yang harus
dilakukan oleh bagian yang di audit terhadap hasil temuan audit dan hasilnya
didokumentasikan dan tindak lanjutnya dievaluasi.
a. Perencanaan
Perencaan dibuat setiap tahun oleh GMP manager yang meliputi semua
bagian yang terkait mutu produk. Dalam perencanaan dijabarkan bagian, jadwal
periode audit, cakupan audit dan tim auditor yang bertugas, serta kegiatan lain.
Auditor juga telah membuat prosedur tetap yang sah serta alat bantu untuk
mendukung pelaksanaan audit misalnya format buku laporan, catatan audit,
cheklist audit, dan Permintaan Tindakan Korektif Pencegahan.
b. Persiapan
Persiapan umum yang dilakukan sebelum dilakukan audit yaitu membuat
detil perencanaan dan audit yang disetujui semua pihak, menentukan ketua audit
dan anggota audit serta pembagian tugas sesuai kompetensinya. Pada tahap ini tim
akan mempersiapkan riwayat audit dari bagian yang akan diaudit, checklist audit,
dan dokumen acuan lain, serta pemberitahuan waktu pelaksanaan pada pihak yang
diaudit karena audit di PT.Konimex bersifat open-audit.
c. Pelaksanaan
Pelaksanaan audit dimulai dengan pembukaan (opening meeting) dimana
auditor dan auditee diperkenalkan, membahas agenda dan waktu pelaksanaan,
serta memastikan pihak-pihak yang akan di audit berada di tempat. Lama
pelaksanaan audit tergantung pada ruang lingkup bagian yang diaudit. Semakin
besar ruang lingkup, maka audit berlangsung semakin lama. Setelah acara audit di
buka maka auditor akan melaksanakan site inspection, evaluasi dokumen yang
berkaitan, dan membuat catatan audit untuk setiap observasi. Audit ditutup
dengan memaparkan hasil temuan berupa catatan audit yang dikonfirmasi ke
pihak auditee termasuk daftar dokumen atau konfirmasi yang belum diberikan.
Pihak auditor akan berdiskusi dengan pihak auditee untuk kemungkinan CAPA (
correcttive action preventive action). Saat pelaksanaan audit, tim auditor harus
berpedoman pada pedoman GMP (CPOB, CPMB, CPOTB, CPPOB, CPKB) yang
berlaku tergantung objek bagian yang di audit.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
27
d. Pelaporan
Laporan audit dibuat segera setelah kegiatan audit selesai dan catatan audit
disetujui. Laporan audit merupakan dokumen resmi yang berisi tujuan dan
lingkup audit, penanggung jawab audit, tempat dan tanggal audit dilaksanakan,
ringkasan hasil audit, temuan audit dan kriterianya, dan kesimpulan atau saran
audit. Apabila terdapat penyimpangan pada standar audit, maka akan diterbitkan
PTKP (Permintaan Tindakan Korektif dan Pencegahan) kepada bagian yang
bersangkutan. Pelaporan audit dapat berupa dokumen rekapitulasi hasil audit dan
rekap PTKP.
e. Tindak lanjut
Tindak lanjut yang dilakukan adalah dilakukannya verifikasi terhadap
PTKP yang sudah dibuat oleh bagian, yaitu mengevaluasi apakah tindakan
korektif dan pencegahan sudah dilakukan atau belum. Bila tidak ditemukan
permasalahan yang sama, maka PTKP untuk bagian tersebut ditutup, dan bagian
GMP akan memulai tahap perencanaan untuk melakukan audit berikutnya di
bagian lainnya sesuai perencanaan yang sudah dibuat.
Meskipun PT. Konimex telah mengikuti CPOB secara ketat untuk
menghasilkan obat yang bermutu, masalah dalam produksi masih mungkin saja
terjadi sehingga obat yang dihasilkan dapat tidak sesuai dengan standar mutu yang
ditetapkan. Untuk menangani keluhan konsumen atas produk yang dihasilkan, PT.
Konimex memiliki prosedur dalam menangani keluhan terhadap produk dari
distributor maupun konsumen. Keluhan akan diperiksa dahulu apakah tergolong
pada keluhan yang justified atau unjustified. Jika memang tidak perlu dilakukan
penarikan atas keluhan tersebut maka tidak perlu dilakukan penarikan. Keputusan
penarikan kembali obat yang telah beredar dapat bersumber dari otoritas
pengawasan obat atau dari PT. Konimex sendiri. Penarikan dapat disebabkan
karena telah terjadi kerusakan, kadaluarsa, kondisi kemasan yang dapat
menimbulkan keraguan akan identitas mutu, keamanan, serta menyangkut pada
jumlah dan jenis.
3.1.2 Validasi
Validasi dan kualifikasi merupakan bagian penting dari Quality
Assurance, sehingga CPOB mempersyaratkan industri farmasi melakukan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
28
validasi. Selain itu juga, validasi merupakan bukti pengendalian terhadap aspek
kritis dari kegiatan yang dilakukan. Validasi adalah suatu tindakan pembuktian
dengan cara yang sesuai bahwa setiap bahan, proses, prosedur, kegiatan, sistem,
perlengkapan, mekanisme yang digunakan dalam produksi dan pengawasan
senantiasa mencapai hasil yang diinginkan secara konsisten (Pedoman CPOB).
Validasi sangat diperlukan oleh industri farmasi untuk memenuhi
persyaratan legal, mengenal tahapan proses dengan baik, mengetahui hal-hal kritis
yang harus dikendalikan, meningkatkan produktifitas dari mengurangi jumlah
sampling dan reject, serta meningkatkan konsistensi. Seluruh kegiatan validasi di
PT. Konimex dilakukan oleh bagian Validation yang dipimpin oleh seorang
Validation Manager yang bertanggung jawab kepada Quality Assurance (QA)
manager.
Kebijakan pelaksanaan kualifikasi dan validasi di PT. Konimex:
a. Menitikberatkan pada pemenuhan persyaratan regulasi pemerintah
b. Memprioritaskan kegiatan kualifikasi dan validasi pada produk farmasi dan
obat tradisional, baru kemudian suplemen makanan dan makanan
c. Kegiatan kualifikasi dan validasi diutamakan dengan pendekatan prospektif,
baru kemudian retrospektif dan concurrent
d. Kegiatan validasi proses diprioritaskan pada proses yang sudah mempunyai
prosedur pembuatan dan pembersihan yang mantap dan metode analisa yang
valid, serta banyak diproduksi
e. Metode analisis untuk validasi pembersihan sedapat mungkin menggunakan
metode analisis untuk mutu produk terkait, dengan ketentuan batas deteksi
tertentu
f. Kalibrasi mencakup semua alat ukur di semua bagian yang terkait dengan
mutu produk, operator dan peralatan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
29
Gambar 3.2. Konsep validasi
Objek validasi di PT. Konimex meliputi:
a. Kualifikasi bahan baku
b. Kualifikasi bahan pengemas
c. Kualifikasi bangunan
d. Kualifikasi peralatan (penunjang dan pembuatan)
e. Validasi metode analisis
f. Validasi proses
g. Validasi pembersihan
h. Pemeliharaan validasi
Pada dasarnya, inti atau objek dari validasi adalah ada pada validasi proses
dan validasi pembersihan. Tugas dan tanggung jawab secara umum dari validasi
ini yaitu membuat suatu protokol dari berbagai sumber (seperti SOP, PP, dan lain-
lain) kemudian menyusunnya dan mempublikasikan pada bagian yang terkait,
mencocokkan dan menganalisis kesesuaian antara prosedur yang ada dengan
kenyataan yang ada di lapangan, memberikan saran evaluasi dan perbaikan yang
perlu dilakukan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
30
Tabel 3.1 Manajemen validasi pada proses produksi
Input Proses Output
Protokol Kualifikasi
Bangunan
Protokol Kualitas
URS (user requirements)
Menyusun Dokumen Mesin/Peralatan proses
dan semua informasi yang Protokol Kualifikasi
protokol kualifikasi dan Mesin/Peralatan Utilitas
terkait objek kualifikasi
validasi Protokol Validasi
dan validasi software
Protokol Validasi Proses
Protokol Validasi
Pembersihan
Semua sumber daya yang - Pelaksanaan kualifikasi
dibutuhkan untuk dan validasi
Laporan Kualifikasi dan
pelaksanaan kualifikasi dan - -Menyusun dokumen
Validasi
validasi dan penyusunan laporan kualifikasi dan
laporannya validasi
Dokumen dan urutan kerja validasi yang dilakukan di PT. Konimex adalah
sebagai berikut:
a. Pembuatan rencana induk validasi (RIV)
Rencana Induk Validasi (RIV)/ Validation Master Plan merupakan gambaran
kegiatan validasi, organisasi dan rencananya yang terdiri dari cakupan
validasi, organisasi, alur proses, dokumen yang diperlukan, jadwal dan
penanggung jawab, dan status kegiatan.
b. Protokol
Protokol validasi berisi tentang rancangan tertulis validasi, kriteria
penerimaan validasi proses, peralatan, variabel dan parameter kritis, jumlah
validasi, sampling, data yang dibutuhkan dalam memvalidasi. Protokol
validasi yang dibuat harus disetujui oleh semua bagian yang terlibat terutama
bagian Quality Assurance.
c. Pelaksanaan
Tahap pelaksanaan meliputi pengumpulan dan perekaman data, verifikasi,
dan pengujian sampel.
d. Evaluasi
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
31
Data validasi yang telah diperoleh di tabulasi dan di analisis menggunakan
tool statistik, grafik, dan lain-lain.
e. Laporan validasi
Laporan validasi berupa rangkuman hasil dan evaluasi, kesimpulan dan saran.
Validasi yang dilakukan oleh bagian validasi di PT. Konimex meliputi:
3.1.2.1 Kualifikasi Bangunan
Kualifikasi bangunan di PT. Konimex dilakukan sebagai tindakan untuk
membuktikan bahwa bangunan sesuai dengan persyaratan CPOB dan memastikan
bangunan atau ruangan tidak mencemari produk. Kualifikasi bangunan meliputi
desain bangunan; konstruksi lantai, dinding, langit-langit; pengaturan sistem udara
ruangan; pengaturan perbedaan tekanan antar ruangan; pengaturan suhu dan
kelembapan ruang; dan pengaturan pencahayaan ruang.
3.1.2.2 Kualifikasi Peralatan
Kualifikasi peralatan dilakukan sebagai tindakan untuk memberikan bukti
terdokumentasi bahwa peralatan/sistem dapat berfungsi sesuai dengan spesifikasi/
kegunanannya. Kualifikasi peralatan meliputi kualifikasi desain, instalasi, operasi,
dan kinerja.
Kualifikasi dilakukan terhadap mesin baru dan mesin lama (existing).
Validasi mesin baru dilakukan untuk membuktikan / mendemonstrasikan terhadap
spesifikasi (IQ, OQ, PQ) dan mesin harus dapat memenuhi kebutuhan proses,
sedangkan validasi mesin lama (existing) dilakukan untuk mendokumentasikan
spesifikasi, pengumpulan informasi, menentukan spesifikasi dan mesin telah
memenuhi kebutuhan proses.
Tabel 3.2. Kualifikasi peralatan berdasarkan impact terhadap produk
Direct impact system Sistem mempunyai impact langsung
terhadap kualitas produk. Contoh :
mesin cetak.
Indirect impact system Sistem mempunyai impact tidak
langsung terhadap kualitas produk.
Contoh: mesin steam untuk FBD.
Non impact system Sistem tidak mempunyai impact
langsung terhadap kualitas produk.
Contoh : lift.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
32
Gambar 3.3. V-Model “Direct Impact” System
Kualifikasi peralatan dibagi menjadi tiga tahap yaitu:
1) Installation Qualification (IQ)
Installation Qualification (IQ) adalah tindakan memastikan dan
menyediakan bukti terdokumentasi bahwa peralatan/sistem penunjang telah
dipasang/di-install sesuai dengan spesifikasi yang telah ditentukan. Untuk mesin
baru, jika terjadi kesulitan/kasus/penyimpangan pada proses instalasi yang
berpengaruh pada kualitas produk dan harus dilakukan modifikasi, maka harus
melalui mekanisme management change control dan disetujui oleh QA.
Installation Qualification (IQ) terdiri dari pabrik pembuat, model/tipe, deskripsi
(uraian cara kerja), data teknis (kapasitas, kekuatan dan sebagainya), sistem
penunjang (listrik, air, dan sebagainya), instrumentasi dan kontrol (kalibrasi),
keamanan, dokumen (manual, checklist, software, training), dan verifikasi
(instalasi dan dokumen).
2) Operational Qualification (OQ)
Operational Qualification (OQ) adalah pengadaan bukti terdokumentasi
bahwa mesin/peralatan mampu beroperasi sesuai dengan fungsi yang telah
ditentukan. Misalnya: cek tombol power,atau cek charger.
3) Performance Qualification (PQ)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
33
Performance Qualification (PQ) adalah pengadaan bukti terdokumentasi
bahwa mesin/peralatan mampu secara konsisten menghasilkan output sesuai
dengan spesifikasi yang telah ditentukan. Performance Qualification (PQ)
misalnya pada sistem Heating Ventilating and Air Conditioning (temperatur,
kelembapan, partikel, mikroba, jamur), sistem air (hardness, TSS, konduktifitas),
dan pada proses mencakup kecepatan, jumlah tablet yang dihasilkan, tebal dan
kekerasan tablet, serta keseragaman kadar.
Tabel 3.3. Pendekatan kualifikasi peralatan
Perbandingan Pendekatan Validasi
Prospektif Concurrent Retrospektif
Data:
- dokumen - Ada - bisa ada, bisa tidak - tidak ada
pembelian - Ada - bisa ada, bisa tidak - tidak ada
- buku manual - Disusun dalam - sudah ada - sudah ada
- SOP rancangan SOP
Cara pelaksanaan Pengujian dan Pengujian dan Pengumpulan
verifikasi verifikasi data dari bahan
QC, bagian
produksi,
bagian teknik
Kriteria Dokumen - dokumen - apa yang
Penerimaan pembelian pembelian sudah di capai
- apa yang sudah
dicapai
Pemakaian/produk Belum (masih Sudah ada Sudah ada
baru)
3.1.2.3 Validasi Proses
Validasi proses merupakan studi pembuktian terhadap proses pembuatan
produk (existing maupun baru) dengan memakai sistem proses (mesin, SDM,
material, SOP, lingkungan / HVAC), yang telah ditetapkan dalam menghasilkan
produk yang selalu memenuhi persyaratan mutu yang telah ditetapkan.
Di PT. Konimex fasilitas, sistem, peralatan, dan proses dievaluasi secara
berkala (verifikasi berkala) untuk memastikan bahwa fasilitas, sistem, peralatan,
dan proses tersebut masih bekerja dengan baik. Validasi proses dalam pembuatan
produk diperlukan untuk menghasilkan produk yang berkualitas.
Di PT.Konimex, ada beberapa hal yang menjadi persyaratan sebelum
validasi proses dijalankan, diantaranya :
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
34
a. Fasilitas, sistem, dan peralatan harus telah terkualifikasi.
b. Metode analisa untuk produk yang akan divalidasi harus sudah tervalidasi.
c. Personil harus terkualifikasi.
d. Bahan baku dan bahan kemasan terkualifikasi
e. SOP proses pembuatan produk yang sudah handal/ robust.
Pendekatan/metoda validasi proses yang dapat dilakukan adalah:
a. Retrospektif + Concurrent : Produk existing/rutin dengan fasilitas existing.
b. Prospektif + Concurrent : Produk existing dengan fasilitas sistem/mesin baru.
c. Prospektif : Produk baru dengan fasilitas existing atau fasilitas baru.
Tahapan dalam kegiatan/studi validasi proses adalah :
a. Pengecekan dan verifikasi dokumentasi proses (Standar Kualitas Produk,
SOP pengoperasian dan pembersihan mesin, rekaman batch proses dan
pengemasan) dan pelaksanaan proses produksi (personal, deskripsi proses
aktual, area proses, mesin dan utilitas proses, masalah yang sering terjadi
(mesin, material, metode, dan man) dan lainnya.
b. Pembuatan Protokol, sirkulasi dan persetujuan bagian terkait.
c. Koordinasi pelaksanaan validasi (pengecekan jadwal proses, pemilihan
petugas sampling, pembuatan form data, persiapan perlengkapan dan
peralatan yang diperlukan, memberikan informasi ke bagian terkait (Produksi,
QC, dan RPD).
d. Pelaksanaan validasi yang sesuai dengan jadwal serta SOP proses dan
pengemasan terhadap 3 batch proses berurutan, meliputi kegiatan: sampling,
pelabelan sampel, verifikasi dan pendataan proses/dokumentasi proses sesuai
form data.
e. Pengumpulan dan pemeriksaan sampel ke laboratoium QC. Jadwal
pemeriksaan sampel (jenis dan jumlah pengujian sampel sesuai form data)
diserahkan sepenuhnya ke bagian QC.
f. Evaluasi hasil pemeriksaan dan analisis.
g. Pembuatan laporan validasi proses (kesimpulan dan saran, jadwal revalidasi
dan change control) serta persetujuan.
h. Revalidasi periodik (dan revalidasi insidentil jika terjadi perubahan signifikan
pada sistem proses).
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
35
Kriteria penerimaan dalam validasi di PT. Konimex yaitu minimal sama
dengan persyaratan yang tercantum dalam spesifikasi produk sesuai Standar
Kualitas Produk (SKP) yang berlaku pada awal validasi proses. Selain itu, pada
periode validasi proses selanjutnya (revalidasi) minimal sesuai spesifikasi produk
dan pertimbangan data validasi sebelumnya. Analisa proses dilakukan pada awal
validasi proses berupa data hasil pemeriksaan sampel validasi dibandingkan
dengan laporan Annual Review dari produk sejenis. Pada validasi selanjutnya
analisa proses dilakukan antar periode validasi dan laporan Annual review.
3.1.2.4 Validasi Pembersihan
Validasi pembersihan adalah proses/studi yang dilakukan untuk
membuktikan dengan cara yang sesuai bahwa SOP (Standard Operating
Procedure) pembersihan/sanitasi/higiene mampu menghilangkan
kontaminan/residu (bahan aktif /tambahan, detergen, mikroba) dari mesin/sistem
hingga batas level yang dapat diterima/telah ditetapkan.
Validasi pembersihan di PT. Konimex dilakukan untuk memenuhi regulasi
dan kebijakan internal PT. Konimex, sebagai pembuktian dan dokumentasi
terhadap kapabilitas SOP pembersihan mesin/sistem, serta untuk melakukan
perbaikan yang berkesinambungan. Tujuan dari pembersihan mesin/sistem adalah
untuk menghilangkan residu/kontaminan yang dapat berasal dari lingkungan,
manusia, mesin, atau produk sebelumnya yang dapat merubah kualitas (safety,
identity, strength, quality, purity) produk berikutnya yang akan dibuat.
Cakupan validasi pembersihan antara lain :
a. mesin/sistem yang digunakan untuk multiproduk yang rutin dilakukan untuk
produk sejenis dan satu macam SOP
b. mesin/sistem yang digunakan untuk multiproduk (rutin) untuk produk tidak
sejenis dan banyak SOP
c. mesin/sistem yang kritis memberikan dampak kontaminasi untuk produksi
yang non rutin dan hanya perlu di verifikasi.
Validasi pembersihan dilakukan dengan cara visual dan kuantitatif.
Pemeriksaan visual dilakukan dengan pemeriksaan permukaan alat atau mesin
dengan cara sampling atau terhadap kejernihan media sisa cuci atau bilasan.
Metode ini digunakan jika belum ditemukan metode analisa yang tepat.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
36
Pemeriksaan kuantitatif meliputi pemeriksaan kadar bahan aktif, produk, deterjen,
senyawa hasil urai/reaksi, dan kontaminan lainnya. Pemeriksaan kuantitatif
lainnya adalah pemeriksaan mikrobiologi berupa bakteri dan jamur yang paling
mewakili/kritis terhadap jenis produk, bahan dan media..
Metode sampling untuk uji validasi antara lain:
a. Rinse sampel, merupakan cara sampling di mana sampel diambil dari sisa
bilasan hasil proses pencucian mesin (CIP, WIP).
b. Swab sampel, yaitu sampel diambil dengan melakukan olesan/usapan pada
lokasi worst case mesin menggunakan peralatan (bahan, media pelarut) yang
sesuai dan cara yang benar (arah dan luas area swab).
c. Kombinasi (rinse and swab)
d. Lokasi worst case merupakan lokasi atau titik yang paling sulit untuk
dibersihkan, sehingga dijadikan sebagai tempat/titik sampling.
Yang termasuk ke dalam lokasi worst case :
a. Permukaan yang paling banyak kontak produk
b. Bagian yang terbuat dari bahan yang sulit dibersihkan
c. Lokasi terjauh dan tersulit dari jangkauan
3.1.2.5 Pemeliharaan Validasi
Revalidasi (validasi ulang) dilakukan jika terdapat prosedur P2
(Permintaan Perubahan) karena perubahan formula, proses, kondisi operasi, mesin
(ganti atau tambah), pindah, dan keperluan install ulang. Bagian-bagian yang
terlibat yaitu :
a. Teknik: peralatan dan penunjang
b. RPPD : proses dan peralatan, pembersihan, kemasan, dokumen mesin
c. Standardisasi: metode analisis, proses, pembersihan
d. QC: metode analisis, proses, pembersihan
e. Produksi: peralatan, proses, pembersihan
3.1.2.6 Kalibrasi
Kalibrasi adalah kegiatan (pada kondisi tertentu) untuk memastikan
tingkat kesamaan nilai yang ditunjukkan oleh alat, sistem ukur yang
dipresentasikan dari pengukuran bahan dan membandingkannya dengan nilai yang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
37
sudah diketahui dari acuan standar (Pedoman CPOB 2006). Jadi, yang dapat
dikalibrasi adalah yang memiliki kriteria :
a. Mempunyai satuan.
b. Kritis untuk: mutu produk, keamanan manusia, operasi mesin.
c. Akurasi tinggi.
d. Disebut dalam dokumentasi (SOP dan catatan).
e. Kesepakatan dengan pemilik.
3.1.3 Pengawasan Mutu
Kegiatan pengawasan mutu di PT.Konimex dilakukan oleh bagian Quality
Control. Bagian Quality Control (QC) di PT. Konimex berperan dalam menjamin
kualitas bahan mentah dan produk yang dihasilkan, sehingga memenuhi
spesifikasi secara konsisten, seperti identitas, kemurnian, potensi dan karakteristik
lainnya. Tanggung jawab bagian Quality Control di PT. Konimex selengkapnya
antara lain :
a. Memastikan semua material (bahan baku) dan packaging material
memenuhi standar kualitas perusahaan dan spesifikasi.
b. Melakukan inspeksi, testing (pengujian), dan identifikasi untuk memastikan
bahwa produk PT. Konimex yang diproduksi memenuhi standar.
c. Memberikan informasi monthly review dan annual review.
d. Melakukan investigasi terhadap temuan-temuan bermasalah ketika
dilakukan testing dan inspeksi.
e. Melakukan studi “on going stability” untuk semua produk jadi.
f. Melakukan review terhadap komplain, saran terkait kualitas serta melakukan
pengawasan terhadap tindakan perbaikan jika diperlukan.
g. Mengambil bagian dalam studi validasi dan audit vendor.
Adapun peran masing-masing bagian antara lain:
a. IMI & Mikrobiologi : melakukan inspeksi terhadap barang datang
(incoming material) serta pengujian mikrobiologis, mengontrol HVAC,
purified water di line produksi I, dan penanganan limbah cair.
b. IPC I: Menangani line Produksi I dan menangani komplain kualitas serta
studi “on going stability”.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
38
c. IPC II: Menangani line Produksi II dan mengontrol HVAC serta purified
water di line Produksi II.
3.1.4 Pengendalian Dokumen
Dokumentasi merupakan proses mendokumenkan prosedur, instruksi, dan
catatan yang berkaitan langsung maupun tidak langsung dengan pembuatan obat
(produk) (CPOB, 2006). Dokumen didesain, dikaji, disetujui, di tandatangani dan
diberi tanggal oleh personil berwenang, didistribusikan dengan cermat dan di
review secara berkala. Pengelolaan dokumentasi sistem mutu di PT. Konimex
dilakukan oleh bagian document control (di bawah divisi Quality Assurance)
sebagai central document control. Namun beberapa bagian mengakomodasi juga
sistem decentral document control dengan sepengetahuan manajemen
representatif (manajer quality assurance dan sekretaris Board of Direction.
Dokumen yang bersifat eksternal seperti bagian RPPD (mencari informasi terkait
bahan atau formula baru, peraturan-peraturan Badan POM baru yang langsung
diakses dari internet) akan disimpan dan dikendalikan oleh bagian yang terkait.
Tugas dari bagian pengendalian dokumen di PT. Konimex yaitu
memproses draft dokumen, menerbitkan & mendistribusikan dokumen yang sah,
memantau masa berlaku dokumen, memintakan pemutakhiran dokumen secara
periodik, memusnahkan dokumen tidak berlaku, mengarsip & mengelola
dokumen asli dan hasil Rekaman Batch/Proses.
Prosedur untuk menetapkan pengendalian dokumen yang diperlukan harus
dibuat untuk beberapa hal diantaranya :
a. Menyetujui kecukupan sblm diterbitkan
b. Meninjau & memutakhirkan & menyetujui ulang
c. Memastikan perubahan & status revisi terkini
d. Memastikan versi yg relevan tersedia di tempat
e. Memastikan dpt dibaca & mudah dikenali
f. Memastikan dokumen eksternal diidentifikasi & dikendalikan
g. Mencegah pemakaian dokumen kadaluarsa.
Tujuan pengendalian dokumen di PT. Konimex adalah
a. Mempersingkat proses memahami langkah kerja yang relatif rumit dengan
melibatkan dua atau lebih petugas/alat/lokasi/tujuan. Selain itu, dengan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
39
menggunakan dua atau lebih tipe aktifitas yang berbeda (mesin, manual,
administratif, teknis, online, offline)
b. Menjaga konsistensi kualitas proses dan hasilnya sehingga jumlah barang
yang ditolak dapat ditekan.
c. Membantu penelusuran (audit trail) atas penyimpangan
d. Mengurangi ketergantungan sistem pada perseorangan
Tabel 3.4. Jenis dokumen dan bagian pengendali teknis di PT. Konimex
Jenis Dokumen Pengendali
Dokumen eksternal Bagian yang bersangkutan
Dokumen internal Document control
Rekaman elektronik Sistem informasi manajemen
Surat keputusan direksi Sekretaris direktur
Business Process Mapping Document control
Makalah, Buku, CD proyek Document control
Jenis dokumen yang dikendalikan oleh bagian dokumen kontrol adalah :
a. Pedoman : panduan bersama menyangkut sistem dan prosedur, yang
menjelaskan tentang sekelompok fungsi/bagian yang terlibat dan tahapanan
pekerjaan yang harus dijalankan.
b. Prosedur : uraian kegiatan yang harus dilakukan serta peringatan yang harus
diperhatikan berkaitan dengan pekerjaan tertentu.
c. Rekaman : formulir isian atau catatan hasil dari pelaksanaan suatu prosedur
d. Protokol : uraian langkah/tahap berkaitan dengan penelitian/pengawasan/
validasi/verifikasi yang akan dilakukan
e. Standar : uraian spesifikasi fisik/ kimia/teknis menyangkut bahan/produk/
alat
f. Metode : uraian langkah/tahap berkaitan dengan pengujian di laboratorium
g. Kualifikasi/Standar Kualifikasi Personel : uraian persyaratan personel
berkaitan dengan jabatan tertentu
Dalam dokumentasi, setiap bagian yang membuat dokumen bertanggung
jawab terhadap kelengkapan, kebenaran, dan kemutakhiran dokumen yang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
40
dibuatnya. Setiap bagian juga harus melakukan peninjauan kembali dokumen
secara periodik untuk menilai apakah dokumen masih mutakhir, dan jika
dokumen sudah dinyatakan tidak berlaku maka dokumen tersebut harus
dimusnahkan.
Review dokumen dilakukan secara periodik perlu dilakukan dimana untuk
dokumen tingkat 1 dan 2 dilakukan setelah 3 tahun. Dokumen tingkat 3 dan 4
dilakukan review setelah 5 tahun. Sedangkan rekaman disimpan selama umur
produk ditambah 1 tahun untuk Rekaman Batch/Rekaman Proses. Rekaman non
Rekaman Batch/Rekaman Proses disimpan selama 5 tahun.
Dokumen dan rekaman jumlahnya ribuan sehingga jika adanya recall data
manual membutuhkan waktu yang lama. Selain itu, permintaan informasi
dokumen banyak dan sering maka pemenuhan permintaan secara manual
membutuhkan waktu yang lama. Untuk mempermudah recall data maka
dibutuhkan program aplikasi komputer yang dapat dioperasikan secara online agar
bagian dapat mengakses sendiri. Dengan bantuan program aplikasi komputer
maka akan diperoleh kepraktisan dan kecepatan dalam mengetahui; Nomor,
judul, tanggal terbit, dan status suatu dokumen; isi dokumen; rekaman yang
menyertai suatu dokumen; distribusi suatu dokumen; dokumen yang diterima
suatu bagian; daftar semua dokumen/rekaman; sosialisasi dokumen.
Peluang dari sistem ini adalah desentralisasi akses informasi tentang
dokumen dan penghematan terhadap kertas. Namun, sistem ini memiliki
kekurangan, data yang banyak dimana proses input data memakan waktu dan
membutuhkan ketelitian petugas. Selain itu juga, tingkat keamanan data belum
optimal, data masih dapat disalin meskipun tidak bisa diubah dan dicetak. Pada
kenyataannya bagian Dokumen Kontrol mengalami kesulitan dalam hal waktu
evaluasi draft dan persetujuan belum dapat di batasi dua hari per orang, dokumen
tidak berlaku belum dapat sepenuhnya terambil dari dokumen kadaluarsa belum
dapat sepenuhnya di review tepat waktu.
3.2 Penelitian Produk dan Pengembangan Proses
Penelitian dan pengembangan produk dapat dilakukan pada produk baru
atau pada produk yang sudah ada. Dalam rangka perbaikan produk yang sudah
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
41
ada dapat dilakukan dengan penambahan variasi rasa, penambahan zat aktif pada
formula yang sudah ada, perubahan eksipien dan lain-lain. Di PT. Konimex,
bagian Penelitian Produk dan Pengembangan Proses memiliki tanggung jawab,
antara lain:
a. Membuat formula dalam rangka pengembangan produk baru atau perbaikan
produk yang sudah ada
b. Membuat prosedur pengolahan
c. Melakukan uji stabilitas
d. Membuat desain kemasan produk
e. Melakukan registrasi produk ke BPOM.
Untuk memenuhi tanggung jawab tersebut dilakukan pengembangan
produk yang digambarkan melalui skema berikut ini:
Ide Review
Skrining Rancangan Produk Komersial
Konsep Produk Prototipe Skala Produksi
Produksi Komersialisasi
Analisa
Informasi Produk
Bisnis Pendaftaran Produk Otorisasi
Formulasi
Studi Stabilitas
Pengemasan
Pengembangan
Gambar 3.4. Skema pengembangan produk
Ide pengembangan produk, misalnya dalam pemilihan bahan dapat
melibatkan semua bagian, antara lain bagian penelitian produk dan pengembangan
proses, bagian pemasaran, bagian produksi, bagian pembelian dan bagian lainnya.
Ide tersebut kemudian di skrinning oleh bagian penelitian produk dan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
42
pengembangan proses menjadi suatu rancangan produk yang kemudian akan
dikembangkan menjadi produk prototipe yang sesuai dengan konsep produksi.
Sebelum proses pengembangan formulasi perlu dilakukan pengumpulan informasi
produk berdasarkan analisa bisnis (harga, besaran bets, struktur kemasan, dan
waktu kadaluarsa). Dimulai dari skala lab kemudian produk dikembangkan
menjadi skala produksi setelah produk diregistrasi ke BPOM. Setelah itu, produk
dipasarkan dan dikomersialisasi kepada konsumen, kemudian dilakukan review
untuk mengevaluasi produk yang akan digunakan sebagai bahan untuk melakukan
pengembangan dan modifikasi produk berikutnya.
FRPB (Formulir Rancangan Produk Baru)
FIP (Formulir Informasi Produk)
NIE (Nomor Izin Edar)
PSP (Petunjuk Skala Produksi)
HSP (Hasil Skala Produksi)
PP (Prosedur Pengolahan) + RB (Rekaman Batch)
Gambar 3.5. Dokumentasi skema pengembangan produk
Bagian Penelitian Produk dan Pengembangan Proses membawahi empat
bagian yaitu bagian pengembangan formulasi, pengembangan kemasan, registrasi
produk dan standarisasi.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
43
3.2.1 Pengembangan Formulasi
Bagian pengembangan formulasi merupakan bagian di PT. Konimex yang
bertanggung jawab dalam membuat ide menjadi produk dalam formulasi produk
baru, melakukan perbaikan formula dan perbaikan proses dalam perbaikan produk
yang sudah ada. Strategi pengembangan produk yang sudah ada dilakukan dengan
meningkatkan produktivitas dengan cara mengurangi kemungkinan terjadinya
penyusutan pada proses produksi dan menyederhanakan proses produksi.
Tahapan pengembangan produk yang dilakukan di PT. Konimex, antara
lain:
a. Tahap preformulasi
1. Studi literatur mengenai zat aktif dan efek farmakologi dari zat aktif.
Jangka waktu mulai dari studi literatur hingga pembuatan produk prototipe
biasanya memakan waktu tiga bulan.
2. Studi formulasi untuk menentukan bahan tambahan yang memiliki
kompatibilitas terhadap zat aktif, murah dan mudah diperoleh, berkualitas
dengan proses yang mudah
b. Tahap formulasi
1. Tahap awal dilakukan dengan membuat produk prototipe, spesifikasi
sementara, dan uji panel yang meliputi rasa, aroma, dan warna.
2. Tahap menengah dilakukan dengan melakukan uji stabilitas fisik jangka
pendek, kompatibilitas produk dan kemasan, dan persiapan metode
analisa.
3. Tahap akhir dilakukan dengan memperhitungkan fasilitas mesin produksi
yang diperlukan, menentukan parameter proses, melakukan uji stabilitas
fisik jangka panjang, dan stabilitas kimiawi-mikrobiologi.
4. Tahap transfer yang merupakan tahap pemindahan proses dari skala lab ke
skala produksi yang memerlukan kerja sama antara bagian penelitian
produk dan pengembangan proses. Pada tahap ini dapat dilakukan optimasi
proses produksi. Untuk melakukan transfer diperlukan dokumen petunjuk
skala produksi dan standard kualitas produk. Hasil dari tahap transfer
diperlukan untuk melakukan uji stabilitas.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
44
Uji stabilitas obat dilakukan untuk mengetahui sampai sejauh mana obat
masih memenuhi persyaratan kadar, untuk memprediksi dan menentukan masa
kadaluarsa produk. Dalam melakukan uji stabilitas, bagian pengembangan
formulasi mengacu pada prosedur yang ditetapkan pada Asean Guideline on
Stability Study of Drug Product. Uji stabilitas dilakukan dalam dua kondisi, yaitu:
1. Kondisi umum
30 oC ± 2 oC/RH ambient atau 75% ± 5%
40 oC ± 2 oC/RH ambient atau 75% ± 5%
2. Kondisi khusus
Sinar matahari/ RH ambient
50 oC ± 2 oC/RH ambient
60 oC ± 2 oC/RH ambient
70 oC ± 2 oC/RH ambient
Almari pendingin
Jenis pengemas primer akan mempengaruhi kondisi uji stabilitas seperti
pada produk yang mempunyai kemasan primer yang impermeabel (HDPE,
Alufoil), kondisi umum pada saat pengujian adalah 30 oC ± 2 oC/RH ambient dan
40 oC ± 2 oC/RH ambient. Sedangkan pada produk yang mempunyai kemasan
primer yang permeabel (PVC, LDPE, PP), kondisi umum pada saat pengujian
adalah 30 oC ± 2 oC/RH 75% ± 5% dan 40 oC ± 2 oC/RH 75% ± 5%.
Uji stabilitas terdiri dari 4 tahap, yaitu:
1. Tahap awal yang dilakukan harian sampai maksimal 3 bulan.
2. Tahap menengah dilakukan bulanan sampai maksimal 6 bulan.
3. Tahap akhir dilakukan tiap 3 bulan sampai ED + 2 tahun (maksimal 5 tahun).
4. Skala transfer dilakukan tiap 3 bulan sampai ED + 2 tahun (maksimal 5
tahun).
3.2.2 Pengembangan Kemasan
Kemasan merupakan gabungan dari seni, ilmu pengetahuan, dan teknologi
dalam mengemas dan melindungi suatu produk untuk didistribusikan dan dijual.
Desain kemasan pada produk dapat berkaitan dengan aturan dan berkaitan dengan
seni. Bagian pengembangan kemasan di PT. Konimex memiliki tanggung jawab
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
45
untuk melakukan penelitian dan pengembangan kemasan, melakukan pengadaan
spesifikasi dan formula bahan kemasan, melakukan perbaikan pada bahan dan
proses pengemasan, dan membuat dokumen pengemasan (formula, petunjuk skala
produksi, hasil skala peoduksi, rekaman batch, prosedur pengolahan). Output dari
bagian ini, antara lain tata cara pemeriksaan bahan dan kemasan, spesifikasi bahan
kemasan dan formula, dokumen proses pengemasan, informasi bahan kemasan.
Kemasan yang baik harus dapat melindungi produk dari kelembaban,
udara, cahaya, benturan fisik, benda asing, mikroba, serta kemasan harus
kompatibel dengan produknya. Kemasan digolongkan menjadi dua golongan,
yaitu :
1. Kemasan primer
Kemasan primer merupakan kemasan yang kontak langsung dengan produk.
Contoh dari kemasan primer adalah rigid packaging (botol kaca, botol
plastik), collapsible packaging (tube logam dan tube plastik), dan flexible
packaging (strip, sachet).
2. Kemasan sekunder merupakan kemasan yang tidak kontak langsung dengan
produk. Contoh dari kemasan sekunder adalah paper box dan corrugated box.
Setiap jenis kemasan memiliki keuntungan dan kekurangan seperti
kemasan dalam bentuk gelas mempunyai keuntungan inert, higienis, mudah
disterilisasi dan jernih tetapi di sisi lain juga mempunyai kerugian berupa berat,
mudah pecah dan warna yang tersedia terbatas. Sedangkan untuk kemasan yang
berbahan dasar plastik memiliki keuntungan ringan dan menarik tetapi memiliki
kerugian tidak tahan panas pada suhu lebih dari 25°C. Berikut ini digambarkan
skema pengembangan kemasan.
3.2.3 Registrasi Produk
Registrasi merupakan prosedur pendaftaran dan evaluasi obat untuk
mendapatkan ijin edar dengan tujuan untuk melinduungi masyarakat dari
peredaran obat yang tidak memenuhi persyaratan efikasi, keamanan, mutu dan
manfaatnya. Oleh karena itu personil bagian registrasi yang akan melakukan
registrasi produk harus memiliki pengetahuan regulasi, pengetahuan teknis
tentang product knowledge dan technology knowledge, serta harus dapat
berkomunikasi di dalam perusahaan dan di luar perusahaan. Bagian registrasi
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
46
produk memiliki tanggung jawab untuk membuat tata cara pendaftaran produk,
mengkoordinir pendaftaran (izin edar produk), dan mendaftarkan perlindungan
HAKI (Hak Kekayaan Intelijen) atas produk. Output dari bagian ini yaitu tata cara
pendaftaran, nomor izin edar produk, perlindungan HKI. Untuk mendapatkan
nomor izin edar, produk didaftarkan ke Badan POM/KemenKes. Untuk
mendapatkan perlindungan produk (HAKI) produk didaftarkan ke Dirjen HKI.
Efikasi dan Mutu Penandaan
Keamanan
Uji klinik untuk Proses produksi, CPOB, Informasi lengkap,
obat baru baha baku, bahan objektif, menjamin
kemasan, produk jadi penggunaan obat secara
tepat, rasional dan aman
Gambar 3.6. Skema proses evaluasi
Registrasi obat dilakukan melalui dua tahap yaitu, pra-registrasi dan
registrasi dan kedua tahap ini diajukan secara tertulis. Sistem registrasi obat harus
dilakukan dengan tatap langsung dan bukan dengan sistem online. Keuntungan
dengan adanya tahap pra registrasi yaitu dapat berkonsultasi masalah kelengkapan
dokumen.
Dokumen pra registrasi diserahkan kepada Badan POM, KemenKes, atau
dirjen HKI untuk dievaluasi dan diperiksa kelengkapannya, jika sudah lengkap
dan disetujui maka akan diperoleh hasil pra registrasi secara tertulis. Tujuan pra
registrasi adalah untuk menentukan jalur evaluasi dan kelengkapan dokumen
registrasi obat jadi untuk kategori: 1, 2, 3, 4, 5, 6, atau 7. Untuk registrasi obat
dibedakan menjadi dua macam yaitu registrasi baru (untuk kategori 1, 2, 3, 4, dan
5) dan registrasi variasi (untuk kategori 6, 7, 8, 9, dan 10). Penjelasan dari
kategori-kategori tersebut:
a. Kategori 1
Obat baru atau produk biologi. Zat aktif baru, derivat baru, kombinasi baru,
atau bentuk sediaan baru.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
47
b. Kategori 2
obat baru dengan komposisi lama, bentuk sediaan baru, atau kekuatan baru.
c. Kategori 3
Obat atau produk biologi, dengan komposisi lama, indikasi baru, atau
posologi baru
d. Kategori 4
obat copy dengan nama dagang atau nama generik
e. Kategori 5
Sediaan lain yang mengandung obat
f. Kategori 6
g. Perubahan obat copy yaitu perubahan komposisi dan bentuk sediaan dengan
posologi yang berbeda, dan perubahan nama dagang menjadi nama generik
atau sebaliknya.
h. Kategori 7
Perubahan klaim penandaan
i. Kategori 8
Perubahan zat tambahan, spesifikasi, dan/atau metode analisa, stabilitas,
teknologi, dan/atau tempat produksi.
j. Kategori 9
Perubahan atau penambahan jenis kemasan
k. Kategori 10
Perubahan klaim penandaan, desain kemasan, nama dagang, nama
pabrik/pemberi lisensi, importir, dan besar kemasan.
Tabel 3.5. Kelengkapan Dokumen Pra-registrasi
Ringkasan Informasi
Mutu dan Teknologi Administratif
Produk (RIP)
Spesifikasi, (CA) Certificate of
Nama obat Analysis bahan baku CPOB
Bentuk sediaan Spesifikasi produk jadi Izin industri
Kekuatan sediaan
Protokol validasi metolisa dan proses
Kemasan
Protokol uji stabilitas obat jadi
Formula
Indikasi
Produsen
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
48
Gambar 3.7. Alur Pra registrasi Obat
Gambar 3.8. Alur Registrasi Obat
Dokumen registrasi yang akan diserahkan ke BPOM terdiri dari empat
bagian, yaitu:
Bagian I : Tabel yang berisi data administrasi dan informasi produk
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
49
Bagian II : Dokumen Quality (Quality Document, Overall Summary & Report)
Bagian III : Dokumen Non Klinik (Nonclinical, Overview, Summary & Study
Report)
Bagian IV : Dokumen Klinik (Clinical, Overview, Summary & Study Report)
Setelah penyerahan dokumen tersebut, BPOM mengkaji data-data
tersebut, maka dikeluarkan surat persetujuan untuk dilakukan registrasi. Registrasi
dilakukan bila hasil uji stabilitas telah diketahui. Data stabilitas yang digunakan
berdasarkan uji stabilitas dipercepat ditambah data real time minimal 1 tahun.
Produk yang diproduksi oleh PT. Konimex, yaitu obat, makanan,
suplemen makanan, kosmetika, produk bahan alam. Setelah melakukan registrasi,
akan didapat no ijin. Untuk produk obat akan diberi kode DBL (Obat Bebas),
DTL (Obat Bebas Terbatas), dan DKL (obat Keras).
3.2.4 Standarisasi
Fungsi dan tugas pokok Bagian Standarisasi, atara lain :
a. Memeriksa sampel bahan baku dan produk
Sampel bahan baku yang baru dikirim oleh pemasok atau bahan baku yang
belum pernah digunakan karena beda pemasok (multisourcing), produk baru yang
dibuat bagian penelitian produk dan pengembangan proses diperiksa oleh bagian
standarisasi dengan tujuan untuk memastikan bahwa bahan baku dan produk
sesuai dengan standard kualitas yang diinginkan.
b. Membuat metode analisa/ standar kualitas produk
Bagian Standarisasi membuat metode analisa dan standar kualitas produk
yang akan dihasilkan dengan tujuan agar menghasilkan suatu produk sesuai
dengan standard kualitas yang diinginkan. Semua metode analisa harus divalidasi
terlebih dahulu dan disahkan oleh bagian standarisasi kemudian diserahkan
kepada bagian pengawasan mutu untuk pemeriksaan rutin. Metode analisa dari
bagian standarisasi juga harus dapat diterapkan oleh bagian QC dengan peralatan
yang terdapat di bagian QC.
c. Membuat spesifikasi bahan baku
Spesifikasi bahan baku ditetapkan oleh Bagian Standarisasi dan mengacu
pada literatur resmi yang diakui KemenKes dan BPOM, seperti farmakope,
kompendia, atau materia medika.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
50
d. Membuat baku pembanding laboratorium
Bagian Standarisasi membuat baku pembanding yang digunakan untuk
analisis di laboratorium dengan tujuan supaya tingkat kepercayaan dari metode
analisa baik dan lebih ekonomis dibandingkan dengan penggunaan primary
standard.
e. Mengelola laboratorium hewan
Bagian standarisasi memiliki laboratorium hewan yang akan digunakan
untuk uji potensi dari obat. Hewan coba yang digunakan, yaitu tikus, mencit,
marmut dan kelinci.
Metode analisis adalah cara untuk melaksanakan analisa, menggambarkan
secara detail tahapan yang diperlukan untuk melaksanakan tiap uji analisis,
termasuk di dalamnya : sampel, baku pembanding, persiapan reagen, pengguna
peralatan, kurva kalibrasi, rumus perhitungan, dan lain-lain. Sedangkan validasi
metode analisis adalah proses studi laboratorium untuk mendapatkan bukti yang
terdokumentasi, bahwa metode analisis yang digunakan telah memenuhi
persyaratan yang diperlukan.
3.3 Product Planning Inventory Control (PPIC)
Pada awal tahun 2011, bagian IPC (inventory planning control) dan PPC
(Plant planning control) digabung dalam satu bagian yaitu bagian PPIC
(Production Planning and Inventory Control). PPIC memiliki fungsi yaitu :
a. Menyelaraskan kebutuhan antara bagian pemasaran, produksi, pembelian dan
bagian lain yang terkait lainnya dalam membuat suatu produk jadi agar
diperoleh efisiensi, peningkatan kualitas dan produktivitas
b. Mengelola persediaan bahan baku dan pengemas sebaik mungkin, baik dalam
hal biaya maupun dalam pemenuhan kebutuhan.
PPIC memegang peran dalam menyelaraskan kebutuhan bagian-bagian
yang terkait dalam membuat suatu produk. Dimana masing-masing bagian
mempunyai pendapat yang berbeda dalam hal persediaan. Pada umumnya bagian
pemasaran lebih menginginkan persediaan yang besar untuk memenuhi
permintaan pelanggan sebaik mungkin (tidak terjadi stock out), karena pada
umumnya ada ketidak-pastian permintaan. Bagian produksi lebih menginginkan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
51
persediaan bahan baku dan pengemas yang tinggi untuk kelancaran produksinya.
Sedangkan bagian keuangan menghendaki biaya persediaan sekecil mungkin
karena persediaan adalah uang (modal) yang berhenti, sehingga harus dijaga agar
nilai persediaan sekecil mungkin. Sehingga PPIC bertugas bagaimana mengelola
persediaan sebaik mungkin ditinjau dari kepentingan perusahaan secara
keseluruhan.
PPIC dalam penyediaan bahan baku dan bahan pengemas melakukan
perhitungan sehingga tingkat persediaan yang optimum dapat tercapai. Beberapa
hal yang harus diperhatikan untuk mencapai tingkat persediaan yang optimum di
antaranya barang-barang apa saja yang harus diadakan persediaan, kapan pesanan
harus dilakukan, berapa jumlah pesanan yang dibuat, sistem pengendalian
persediaan apa yang dipakai.
Langkah-langkah yang dilakukan bagian PPIC dalam perencanaan
persediaan bahan baku dan bahan pengemas yaitu:
a. Menghitung kebutuhan Bahan Baku dan Pengemas atas dasar Rencana
Produksi (RP) dan Formula
b. Membuat Proyeksi Persediaan Bahan Baku dan Pengemas
c. Mengatur saldo minimum dan pengadaannya untuk menunjang
kelangsungan produksi
d. Menerima, menyimpan, dan mengirim Bahan Baku dan Pengemas
PPIC dalam penyediaan bahan baku melakukan perhitungan kebutuhan
bahan baku dengan mempertimbangan berbagai faktor yaitu:
a. Saldo awal (persediaan awal)
b. Oustanding order (barang yang terlambat datang)
c. Schedule receipt (permintaan pembelian yang sudah ditempatkan)
d. Rencana kebutuhan (hasil perhitungan antara rencana produksi dan formula)
e. Buffer stock (untuk mengatasi delivery time yang lama dan permintaan
tambahan)
f. Delivery time (waktu yang dibutuhkan dari pemesanan sampai barang
sampai di gudang)
g. Minimum order (jumlah pemesanan paling sedikit yang dapat dipesan)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
52
Bahan baku/emballage disimpan di gudang. Jenis gudang yang digunakan
untuk menyimpan bahan baku/emballage yaitu:
a. Gudang biasa
Gudang biasa adalah gudang yang dipakai untuk menyimpan bahan
baku/emballage yang tidak memerlukan suhu khusus.
b. Gudang dingin
Gudang dingin adalah gudang yang dipakai untuk menyimpan bahan
baku/emballage yang memerlukan suhu khusus (maksimal 250C). Misalnya roll.
c. Gudang api
Gudang api adalah gudang yang dipakai untuk menyimpan bahan baku yang
mudah terbakar. Misalnya alkohol.
PPIC mempunyai hubungan yang terkait dengan bagian lain yang terkait
dengan proses produksi. Hubungan antar bagian tersebut yaitu:
a. RPD (Research and Product Development)
RPD adalah bagian yang mengeluarkan formula (pengemas dan bahan baku
produk).
b. QC (Quality Control)
QC adalah bagian yang melakukan pemeriksaan kualitas bahan
baku/emballage.
c. Purchasing
Purchasing adalah bagian yang melaksanakan pembelian bahan
baku/emballage sesuai dengan Permintaan Pembelian yang dibuat.
d. Produksi
Produksi adalah bagian yang menggunakan bahan baku/emballage untuk
diproses menjadi suatu produk.
e. MIS (Management Information System)
MIS adalah bagian yang mengelola sistem informasi secara on-line.
3.4 Bagian Produksi
Proses produksi di industri farmasi hendaklah dilaksanakan dengan
mengikuti prosedur yang telah ditetapkan untuk menjamin mutu obat sesuai
dengan persyaratan spesifikasi. Mutu obat tidak hanya ditentukan oleh hasil
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
53
analisa produk obat akhir, tetapi oleh seluruh tahapan produk selama proses
produksi. Prosedur produksi hendaklah dibuat oleh penanggung jawab produksi
bersama-sama dengan penanggung jawab pengawasan mutu.
Proses produksi mencakup beberapa tahapan seperti input, proses dan
output. Input yang dimaksud adalah informasi, tenaga kerja, mesin/peralatan,
material, energi. Proses meliputi proses kerja, sistem mutu, persediaan, kapasitas.
Output meliputi kualitas, harga, penyerahan, keamanan, moral, fleksibilitas.
Bagian produksi PT. Konimex berada di bawah Sub divisi Plant. Bagian
produksi farmasi dibagi menjadi empat jalur yaitu bagian produksi farmasi 1
(Paramex Line), bagian produksi farmasi 2 (tablet dan solid), bagian produksi
farmasi 3 (cair dan semisolid termasuk kosmetik), serta bagian produksi farmasi 4
(Natural Product). Produksi makanan dibagi menjadi tiga yaitu Bagian produksi
makanan 1 (permen), Bagian produksi makanan 2 (biskuit), Bagian produksi
makanan 3 (suplemen makanan).
Tugas pokok bagian produksi:
1) Melaksanakan kegiatan produksi sesuai dengan Rencana Produksi (RP)
dengan kualitas, jumlah, jenis, dan waktu yang sesuai dengan biaya
seminimal mungkin.
2) Melaksanakan kegiatan produksi sesuai dengan peraturan yang
berlakusehingga mampu :
a) menghasilkan produk sesuai spesifikasi secara konsisten (reproducibility
dan consistency) → mutu
b) menghasilkan produk sesuai persyaratan mutu dan biaya serendah
mungkin artinya efisiensi dalam penggunaan bahan baku, kemasan,
mesin, tenaga kerja, energi, dan biaya umum pabrik lainnya → biaya
(efisiensi biaya)
c) menjamin ketersediaan produk pada saat pelanggan membutuhkan
artinya menghasilkan produk sesuai spesifikasi dalam jenis, jumlah, dan
waktu yang telah disepakati → ketersediaan (delivery/availability)
d) menyesuaikan diri terhadap tuntutan perubahan spesifikasi produk,
perubahan volume produk,perubahan waktu penyerahan, maupun
perubahan “product mix” → kelenturan (flexibility)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
54
3.4.1 Produksi Farmasi 1 (Paramex Line)
Bagian produksi farmasi I di PT. Konimex di khususkan untuk menangani
produksi tablet Paramex. Paramex merupakan produk unggulan di PT. Konimex
sehingga diperlukan fasilitas khusus agar dapat memproduksi dalam jumlah yang
banyak. Proses produksi paramex bersifat in-line dan dilakukan dalam sistem
tertutup dimana semua bahan baku baik zat aktif maupun eksipien dilewatkan
melalui sistem tertutup seperti pipa. Produksi Paramex menggunakan prinsip
make to stock yang berarti Paramex di produksi untuk memenuhi stok di gudang
bukan berdasarkan make to order yakni di produksi sesuai dengan permintaan.
Proses produksi Paramex di bangun dengan desain yang menjaga kualitas
produk. Hal ini dibuktikan dengan penggunaan teknologi SCADA system
(Supervisory Control And Data Acquisition) dimana seluruh sistem di kontrol
dengan komputer yang terintegrasi dan data-data yang ada dikontrol dan dibaca
secara real time sehingga pengawasan dapat dilakukan di tempat terpisah (Control
room), selain di area produksi itu sendiri. Dengan sistem SCADA, SOP
pengolahan yang dalam sistem konvensional berupa hardcopy telah dimasukkan
ke sistem komputer. Parameter-parameter proses juga dapat dimasukkan sehingga
konsistensi proses produksi dapat dikontrol. Personel yang menjalankan proses
juga tidak dapat sembarangan karena setiap kali melakukan proses diawali dengan
memasukkan password and user identification. Analisa terhadap kualitas proses
dan hasil produksi juga mudah dilakukan karena semua sudah terekam dalam
database yang ada. Personel yang menjalankan proses juga tidak bisa
sembarangan karena setiap kali menjalankan prosedur tersebut pasti akan diawali
dengan memasukkan password atau user identification dengan level atau batasan
kewenangan masing-masing yang sudah sudah ditetapkan dalam password
management.
Berikut beberapa fungsi yang dapat dijalankan oleh sistem SCADA:
a. Perencanaan produksi
Perencanaan di sini meliputi perencanaan bahan baku, formulasi, tahapan
proses, parameter proses, sistem dan prosedur pengoperasian mesin, operator, dsb.
Semua proses perencanaan ini telah diprogram sehingga dapat dipastikan proses
selalu terjadi dengan konsisten dari waktu ke waktu.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
55
b. Pengaturan permintaan
Semua SOP yang terkait perintah kerja alur proses sudah tersusun dalam
komputer sehingga setiap urutannya dapat terukur dan terpantau dengan jelas.
c. Pencatatan elektronik
Semua tahapan kegiatan, parameter proses, dan output dalam proses produksi
terekam dalam bentuk elektronik secara real-time.
d. Tanda tangan elektronik
Berita acara tertulis yang perlu ditanda tangani oleh penanggung jawab telah
terwakili dengan sistem user management. Jadi, siapa pun orang mengakses dan
melakukan sesuatu terhadap sistem, harus mengisi identitas dan memasukkan
password.
e. Audit
Audit yang efektif dipengaruhi oleh suatu sistem yang traceability (setiap
kejadian dapat tertelusur) dan accountability (setiap kegiatan secara kronologis
bisa dipertanggung jawabkan). Sistem SCADA teah mengakomodasi hal ini.
f. Pencatatan nomor rekaman produksi elektronik
Sistem SCADA telah mengakomodasi rekaman proses produksi secara
elektronik dalam bentuk softcopy yang setiap saat bisa dicetak untuk bukti
tertulis.
Tahapan kegiatan di Paramex line yaitu predispensing, dilakukan di lantai
teratas yaitu lantai 5, sedangkan tahap terakhir yaitu pengemasan dilakukan di
lantai dasar. Berikut urutan kegiatan Paramex line.
a. Pre Dispensing (Lantai 5)
Pre proses dilakukan di area pre dispensing yang berada di lantai lima dimana
bahan baku dibawa dari lantai satu ke lantai lima menggunakan lift. Sebelum
dilakukan penimbangan, bahan baku diindentifikasi kebenaran jenisnya
menggunakan barcode system. Penimbangan secara manual (manual dossing)
dilakukan untuk bahan yang jumlahnya relatif kecil, seperti lubrikan, bahan
pengikat, bahan penghancur.
Pada pre dispensing area dilakukan penyesuaian ukuran partikel (sizing) dan
pengayakan (milling) kemudian masuk ke dalam target bin di lantai empat. Di
tahap ni terdapat tiga station (station A didedikasikan untuk parasetamol, station
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
56
B dan C untuk masing-masing dua bahan baku lainnya). Proses pre dispensing
dilengkapi dengan metal detector untuk mendeteksi adanya logam dalam bahan
baku. Bila terdapat logam, muncul metal alarm, dan aliran bahan baku dari lantai
lima berhenti. Klep/valve pada saluran tersebut menutup secara otomatis. Hasil
pre dispensing ditampung pada bin di lantai empat.
b. Lantai empat
Lantai empat merupakan dispensing area dan pada lantai tersebut hasil
penimbangan otomatis sesuai formula disatukan dalam sebuah target bin yang
diletakkan di atas moving scale. Dispensing bin berjalan sepanjang moving scale
untuk mengambil bahan baku dari lantai lima secara gravitasi. Beberapa bahan
baku untuk satu batch akan langsung ditampung dalam satu IBC. Pendosisan
diatur dengan screw feeder dan penimbangan dilakukan secara otomatis sesuai
formula. Setelah semua komponen bahan baku masuk dalam dispensing bin, maka
campuran serbuk dialirkan menuju granulator di lantai tiga.
c. Lantai tiga
Metode granulasi yang digunakan dalam pembuatan tablet paramex adalah
granulasi basah, sehingga perlu dilakukan pembuatan secara terpisah terlebih
dahulu terhadap larutan pengikat. Campuran serbuk yang ada di lantai empat
mengalir turun ke lantai tiga menuju granulator. Larutan pengikat yang telah
disiapkan dimasukkan ke dalam granulator jenis high shear granulation mixer.
Mixer ini terdiri tiga bagian utama yaitu bowl sebagai tempat serbuk, pengaduk
(blade mixer/impeller), dan pemotong massa granul menjadi bentuk pratikel
granul (chopper). High shear mixer dipilih karena dari segi waktu tentu lebih
cepat, jumlah pengikat lebih sedikit, diperoleh granul yang lebih kompak dan
seragam, serta waktu akhir yang dapat lebih terprediksi. Massa granul basah yang
terbentuk diayak dengan mesh tertentu dan dialirkan menuju bin di lantai dua
untuk dikeringkan.
d. Lantai dua
Di lantai ini dilakukan pengeringan granul basah dengan fluid bed dryer
(FBD). Prinsip dari alat ini adalah membuat udara di dalam menjadi vakum
sehingga granul akan naik ke atas, seketika itu juga udara kering dan panas akan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
57
masuk dari bawah untuk melakukan proses pengeringan. Setelah selesai, granul
kering tersebut akan dialirkan ke lantai satu.
e. Lantai satu
Di lantai ini terjadi proses lubrikasi, pencetakan tablet, dan pengemasan.
Setelah melalui proses pengeringan di FBD, granul yang telah kering mengalir ke
bin lantai satu lalu dicampur dengan lubrikan. Pencampuran dengan lubrikan
disertai dengan proses weighing secara otomatis, selanjutnya dilakukan
pencampuran dimana bagian yang berputar adalah bin. Perputaran yang dilakukan
secara asimetris untuk menghindari adanya dead leg. Setelah campuran granul
dan lubrikan homogen. Kemudian produk antara tersebut akan kembali dinaikkan
ke lantai atas sebagai WIP (work in process) sebelum dilakukan proses
pencetakan tablet. Produk antara tersebut dialirkan kembali dari lantai dua menuju
ke mesin tabletting di lantai satu. Mesin yang digunakan untuk pentabletan adalah
mesin rotary (180.000 tablet/ jam) yang diatur secara terkomputerisasi. Parameter
keseragaman bobot tablet yang digunakan adalah ketebalan, kekerasan, dan berat
tablet. Ketebalan tablet tergantung volum pengisian dan bulk density. Pada mesin
pencetak tablet juga dilengkapi dengan metal detector untuk memastikan tablet
bebas dari logam. Tablet akan dikemas primer dengan strip dimana masing-
masing kemasan terdiri dari empat tablet. Kemudian dikemas sekunder dengan
pemberian catch cover disertai dengan penulisan tanggal kadaluarsa.
Sistem khusus yang digunakan dalam proses produksi Paramex ini disebut
sebagai sistem SCADA. Sistem tersebut bisa mengetahui ontime record maupun
history record dari proses yang dilakukan.
3.4.2 Produksi Farmasi 2
Jalur Produksi Farmasi 2 di PT. Konimex dikhususkan untuk memproduksi
sediaan solid selain paramex. Produk yang dihasilkan antara lain Paramex Batuk
dan Flu, Inza, Inzana, Konidin, Neo Napacin.
Produksi farmasi 2 di proses secara horisontal pada satu lantai bangunan.
Bangunan untuk produksi di farmasi 2 telah memenuhi ketentuan CPOB dengan
meletakan satu alat/mesin pada satu ruang untuk menghindari kontaminasi silang.
Ruang proses juga diatur sedemikian rupa sehingga letak ruang disesuaikan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
58
dengan alur proses produksi yang dilaksanakan. Hal tersebut dilakukan untuk
meningktakan efisiensi proses produksi.
Adapun tugas dari produksi farmasi 2 adalah sebagai berikut:
a. Melaksanakan kegiatan produksi sesuai dengan Rencana Produksi (RP) dengan
kualitas, jumlah, jenis dan waktu yang sesuai dengan biaya seoptimal mungkin.
b. Melaksanakan kegiatan produksi sesuai dengan peraturan yang berlaku
(CPOB, K3, dll).
Rancangan Permintaan
Distributor Barang Jadi (RPBJ)
Logistik Rancangan Permintaan
Produksi (RPP
PPIC Rencana Produksi (RP)
Bulanan
Produksi
Rencana Produksi Logistik
Harian
Gambar 3.9. Alur permintaan barang ke bagian produksi
PT. Konimex menerapkan 3 metode tableting:
a. cetak langsung (Direct Compress) → untuk produk Konidin
b. granulasi basah (Wet Granulation) → untuk produk Inza
c. granulasi Kering (Dry Granulation)
Pemilihan terhadap metode pembuatan tablet dipengaruhi oleh berbagai hal,
antara lain faktor bahan baku obat (kompresibilitas, sifat alir, kompatibilitas,
stabilitas terhadap air maupun panas, dan lain-lain), serta faktor alat atau fasilitas
produksi. Metode cetak langsung biasanya digunakan jika bahan memiliki
kompresibiltas dan sifat alir yang baik, serta sensitif terhadap panas dan air.
Dalam metode cetak langsung, waktu proses yang diperlukan lebih cepat, serta
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
59
tenaga kerja dan peralatan kerja yang lebih sedikit. Sedangkan metode granulasi
digunakan untuk bahan yang memiliki kompresibilitas dan sifat alir yang buruk,
namun stabil terhadap panas dan tidak terurai oleh air.
Tahapan dalam memproduksi tablet di jalur produksi farmasi 2 (secara
umum) adalah :
a. Granulasi
Granulasi merupakan proses pembesaran ukuran partikel dari partikel
kecil-kecil menjadi masa granul yang permanen dan partikel asalnya masih dapat
diidentifikasi. Tujuan dilakukan granulasi untuk memperbaiki sifat alir bahan
sehingga free flowing, memperbaiki sifat kompresi bahan, memudahkan
penetapan dosis, mengurangi debu, membuat campuran homogen dan tidak
terpisah, memperbaiki tampilan tablet/kaplet.
Macam –macam mesin mixer granulator :
1) Low shear mixer
Mesin ini digunakan untuk pencampuran yang membutuhkan mechanical force
yang tinggi tetapi putarannya rendah.
2) High shear mixer
Mesin ini memiliki kecepatan putar yang tinggi sehingga dapat mencampur
dengan cepat dan efisien.
3) Continous mixer (Fluid bed granulator)
Mesin ini memiliki dua fungsi yaitu sebagai granulator dan sebagai pengering
(Fluid Bed Drying)
b. Lubrikasi
Lubrikasi merupakan proses pencampuran masa granul dengan bahan
tambahan lainnya terutama bahan pelicin atau antara semua bahan aktif dengan
bahan tambahan lainnya sehingga didapatkan campuran yang homogen Mesin
yang digunakan dalam proses lubrikasi antara lain double cone mixer, cube mixer,
v-mixer, dan IBC-blending.
c. Pencetakan tablet
Pencetakan tablet merupakan proses perubahan bahan baku atau granul
menjadi bentuk sediaan kempa cetak (tablet/kaplet) melalui proses kompresi.
Proses kompresi dapat dilakukan dengan menggunakan rotary tablet press. Mesin
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
60
ini terdiri dari upper dan lower punch, dies, cam (rel yang digunakan punch
sebagai jalur), feeder, scraper and tail over die (digunakan untuk meratakan
permukaan dies yang diisi dengan granul), weight control, precompression roll
(untuk mengurangi jumlah udara karena udara dapat menyebabkan terjadinya
capping), main compression roll, dan ejection cam.
Persyaratan umum tablet yang dihasilkan yaitu:
a. Kuat dan Tahan terhadap goncangan dan kikisan selama proses pembuatan,
pengemasan dan distribusi (hardness dan friability).
b. Memenuhi keseragaman Berat maupun keseragaman kadar zat berkhasiat
(sesuai persyaratan dalam Farmakope ).
c. Segera dapat diserap oleh tubuh (bioavailable) diukur dari uji waktu hancur
dan uji waktu larut/disolusi.
d. Memiliki penampilan yang baik dan memiliki karakteristik bentuk warna dan
atau penandaan lain yang diperlukan untuk identifikasi.
e. Stabil secara fisik dan kimia selama penyimpanan.
Beberapa masalah yang pernah dihadapi dalam proses tableting adalah
penggantian bahan baku sehingga menyulitkan proses mixing, granul memiliki
free flow yang buruk, sulit melakukan proses pencetakan, tinggi tablet tidak
seragam karena punch dan dies belum tepat pengaturannya atau karena tinggi
punch tidak sama.
d. Penyalutan
Penyalutan merupakan suatu pelapisan inti tablet sehingga menghasilkan
tablet yang lebih elegan. Penyalutan tablet memiliki beberapa alasan; proteksi
terhadap udara, cahaya, kelembaban, dan interaksi bahan yang tidak tersatukan;
menutup rasa dan bau yang tidak enak atau memudahkan pasien menelan ;
memudahkan penanganan dan pengemasan (sifat luncur tablet lebih baik dan
bebas debu), memudahkan identifikasi; meningkatkan estetika tablet.
Di PT. Konimex penyalut yang digunakan adalah film coated untuk produk
Renovit®, Ever Oxy®, Nofena®, dan lain-lain.
e. Pengemasan primer
Selain sebagai fungsi pelindung produk, kemasan primer juga terkadang
sekaligus difungsikan sebagai media informasi obat dan juga sebagai salah satu
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
61
unsur marketing produk. Di PT. Konimex, tablet di buat dalam kemasan strip isi 4
tablet. Inilah ciri khas dari produk Konimex karena pernah sebagai pelopor.
Untuk sistem ruang di bagian produksi, PT. Konimex menggunakan dua cara
yaitu koridor positif dan koridor negatif. Masing-masing sistem ruang ini
memiliki keuntungan dan kelemahan masing-masing. Koridor positif adalah
sistem dimana tekanan udara dalam koridor lebih tinggi daripada ruang produksi
sehingga udara dalam koridor akan mengalir masuk ke ruang produksi ke koridor.
Sistem ini digunakan agar debu hasil produksi tidak keluar dari ruang produksi.
Sedangkan pada koridor negatif, koridor memiliki tekanan udara yang lebih
rendah. Pada sistem ini, udara akan mengalir dari ruang produksi ke koridor
sehingga udara ruang produksi tidak tercemar udara dari koridor.
3.4.3 Produksi Farmasi 3
Jalur Produksi Farmasi 3 di PT. Konimex dikhususkan untuk memproduksi
sediaan likuid dan semisolid.
Produksi Farmasi 3 PT. Konimex dibagi menjadi sembilan jalur yaitu:
Jalur 1 : Sirup botol gelas 150 ml
Jalur 2 : Sirup botol plastik 30 ml
Jalur 3 : Sirup botol plastik 60 ml
Jalur 4 : Sirup botol plastik kotak 30 dan 60 ml, suspensi botol, sirup botol gelas,
dan sirup obat ethical
Jalur 5 : Sirup dan suspensi sachet
Jalur 6 : Salep/semi solid
Jalur 7 : Kosmetik
Jalur 8 : Powder
Jalur 9 : Steril/tetes mata
Di bagian produksi farmasi 3 kebanyakan menggunakan closed system yang
bertujuan untuk mengurangi resiko terkena kontaminan dari luar. Untuk
pengecekan dari pihak QC pun dibatasi disaat penerimaan bahan baku, filling, dan
pengemasan. Hal ini juga untuk meminimalkan kontaminasi yang terjadi. Dari
jalur 1- 9 yang membedakan adalah teknologi produksinya.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
62
3.4.4 Produksi Natural Product (Natpro)
Produksi natural product di PT. Konimex merupakan bagian yang
memproduksi produk yang berbasis dari bahan alam, yaitu Minyak Konicare,
Herbadrink, kapsul, dan tablet (granulasi basah). Produksi Natpro terletak pada
gedung dan lokasi tersendiri yang terpisah dari tempat produksi farmasi (obat) dan
makanan sehingga dapat memperkecil terjadinya kontaminasi silang dengan
produk tidak sejenis dan pengembangan produknya lebih terkonsentrasi.
Pelaksanaan produksi Natpro dipimpin oleh seorang apoteker yang menjabat
sebagai Manajer Produksi Natpro. Manajer Produksi Natpro dibantu penata
administrasi dan Kepala Seksi Proses serta Kepala Seksi Verpak. Kepala Seksi
Proses menangani proses produksi hingga pengemasan primer, sedangkan Kepala
Seksi Verpak menangani proses pengemasan sekunder.
Bahan alam yang digunakan sebagai bahan baku produk merupakan bahan
segar yang didatangkan dari supplier maupun didapatkan dari kebun PT.
Konimex. Bahan alam yang didatangkan dari supplier terdiri dari bahan mentah
maupun bahan olahan (misalnya sudah dalam bentuk ekstrak).
Bahan baku yang telah dicek oleh QC dapat digunakan untuk proses
produksi. Bahan baku diayak dengan ayakan mesh tertentu kemudian semua
bahan ditimbang sesuai formula. Masukkan bahan-bahan kedalam container Fluid
Bed Dryer, dan dispray dengan larutan slim sampai terbentuk granul, ayak dengan
mesh 12. Granul dikeringkan sampai kadar air sesuai dengan persyaratan. Granul
dikemas dengan sacheting machine dan dicek oleh QC. Kemudian diberi kemasan
sekunder (dimasukkan dus kecil dan karton box) kemudian diperiksa kembali oleh
QC. Kemasan primer dan sekunder sebelum digunakan harus telah diperiksa oleh
QC.
3.5 Bagian Logistik
Bagian logistik merupakan salah satu bagian yang terdapat di PT. Konimex
yang memiliki tanggung jawab terhadap persediaan barang jadi di PT. Konimex,
rencana permintaan produksi, proses penyimpanan dan distribusi barang jadi dan
proses penyimpanan dan distribusi barang-barang materi promosi.
Proses pemesanan dan distribusi barang di PT. Konimex bermula dari
permintaan pesanan dari pelanggan kepada distributor cabang yang berada di
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
63
masing-masing daerah. Selanjutnya, distributor cabang memberikan rekapitulasi
pesanan kepada distributor pusat (PT. Sinar Intermark dan PT. Marga Nusantara
Jaya) dan pesan tersebut diteruskan oleh distributor pusat kepada PT. Konimex
(bagian logistik). Selanjutnya bagian logistik akan melakukan pengecekan
persediaan barang jadi, jika persediaan mencukupi jumlah permintaan dari
distributor, maka bagian logistik akan membuat rencana kirim, menyiapkan
administrasi pengiriman barang jadi, dan selanjutnya melakukan pengiriman
barang jadi ke distributor cabang melalui ekspeditur. Barang jadi dikirim langsung
ke distributor cabang tanpa melalui distributor pusat dengan pertimbangan
efisiensi biaya pengiriman. Pada pengirimannya dibuat surat jalan yang terdiri
dari print out yang dibawa oleh ekspeditur dan soft copy yang dikirimkan
langsung kepada distributor pusat dan cabang.
Logistik memiliki fungsi dalam melakukan perpindahan barang dari satu
titik (pabrikan) kepada titik lain (distributor) secara tepat waktu dan dengan biaya
yang paling efisien. Selain itu, logistik juga melakukan perhitungan kebutuhan
barang jadi dan megupayakan tersedianya barang jadi dalam jumlah yang tepat
sesuai dengan kebutuhan.
Permintaan Permintaan
Distributor Logistik Bag. Produksi
Barang jadi Barang jadi
Gambar 3.10. Alur permintaan barang
3.6 Bagian Teknik
Bagian Teknik merupakan salah satu bagian di PT. Konimex yang dapat
menunjang semua kegiatan atau proses di industri farmasi terutama dalam
melakukan perawatan terhadap semua mesin di area produksi, gudang, pemastian
mutu dan penelitian produk dan pengembangan proses, serta utilitas. Perawatan
yang dilakukan dapat bersifat preventif atau pun service saat mesin breakdown.
3.6.1 Total Productive Maintenance (TPM)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
64
Salah satu tugas dari bagian teknik yaitu maintenance. Maintenance perlu
dilakukan dengan tujuan untuk mencegah terjadinya kerusakan alat,
mengupayakan kinerja alat dalam keadaan optimum, dan mendukung upaya
memuaskan pelanggan (bagian produksi).
Gambar 3.11. Ilustrasi sebuah mesin
Gambar di atas menjelaskan bahwa kegiatan perawatan merupakan suatu
hal yang penting karena kondisi alat/ mesin akan cenderung menurun dengan
bertambahnya waktu sehingga diperlukan suatu perawatan yang dapat
mempertahankan performa mesin tetap berada dalam kondisi optimum.
Berbagai bentuk perawatan yang dapat dilakukan antara lain:
a. Breakdown maintenance (BM)
Perawatan/perbaikan dilakukan setelah alat/mesin mengalami kerusakan.
BM digunakan jika kegagalan tidak mempengaruhi operasi atau produksi. Sebagai
contoh mesin stripping dianggap mesin yang tidak kritis sehingga dalam
perawatannya dipilih sistem BM.
b. Preventive Maintenance (PM)
Preventive Maintenance merupakan tindakan pencegahan sebelum
terjadinya kerusakan suatu alat/ mesin. Pemasangan mesin yang sesuai kebutuhan
dan mempertahankan fungsinya dengan baik dapat dilakukan dengan perawatan
harian, pembersihan, pemeriksaan, pelumasan & pengencangan; inspeksi berkala
dan mendiagnosis alat; restorasi periodik dan overhaul
Inspeksi periodik dilakukan untuk mendeteksi kondisi yang mungkin
menyebabkan breakdown, produksi terhenti, atau berkurangnya fungsi mesin
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
65
dikombinasikan dengan pemeliharaan untuk menghilangkan, mengendalikan
kondisi tersebut dan mengembalikan mesin ke kondisi semula.
c. Corrective Maintenance
Melaksanakan improvement pada alat agar alat tidak rusak, memudahkan
inspeksi, perbaikan dan pemakaian, memastikan keselamatan.
d. Productive Maintenance
Sasaran Productive Maintenance adalah profitable preventive
maintenance, ini mensyaratkan kita untuk tidak hanya mencegah breakdown dan
defect tapi juga bekerja dengan efisien dan ekonomis. Untuk mencapai sasaran
tersebut di atas kita perlu melakukan empat perawatan dengan baik dan tuntas.
Empat perawatan yaitu preventive maintenance, breakdown maintenance,
corrective maintenance, maintenance prevention. Tiga jenis perawatan telah
dijelaskan di bagian atas, lalu yang dimaksud maintenance preventation adalah
tindakan preventif yang dilakukan dalam tahap desain mesin, dengan harapan saat
mesin nanti terealisasi dapat meminimalkan tindakan maintenance serta
performanya selalu baik.
PT. Konimex telah menerapkan konsep Total Productive Maintenance
(TPM) ini dalam melakukan tindakan maintenance. TPM dikenal juga dengan
istilah Manajemen Kehandalan dan Perawatan Mesin Produksi. Definisi dari TPM
terdiri dari 5 pokok, yaitu
1. Bermaksud mendapatkan manfaat yang paling efektif dari peralatan
2. Membangun sistem PM yang menyeluruh
3. Mengikutsertakan semua orang yang berkaitan dengan peralatan dan mesin
4. Mempersyaratkan dukungan dan kerjasama setiap orang mulai dari manajer ke
bawah
5. Mempromosikan dan menerapkan Kegiatan PM dengan dasar Kegiatan
Kelompok kecil yang mandiri
Tiga arti Total dalam TPM adalah
1. Total efektifitas, mengejar efisiensi ekonomis atau keuntungan
2. Total Sistem Perawatan, maintenance prevention (MP) dan aktivitas untuk
meningkatkan kemampuan pelihara (MI) dan preventive maintenance (PM)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
66
3. Total Partisipasi, pemeliharaan mandiri (autonomous maintenance) oleh
operator dan aktivitas kelompok kecil di setiap departemen dan tingkat
organisasi.
Sasaran dilakukannya TPM adalah ZERO ABCD
1. Zero Accidents
Bertujuan untuk meminimalkan terjadinya kecelakaan kerja.
2. Zero Breakdowns
Bertujuan untuk meminimalkan terjadinya kerusakan pada alat.
3. Zero Crisis
Bertujuan untuk meminimalkan terjadinya tahapan krisis pada alat.
4. Zero Defects
Bertujuan untuk meminimalkan terjadinya kerusakan pada produk.
Semua kegiatan yang diarahkan untuk melakukan improvement pada kinerja
dan kapabilitas mesin dan tidak terbatas pada merawat kondisi dasar mesin saja.
Pada umumnya diarahkan untuk mencegah berulangnya masalah yang sama
dalam kaitannya dengan kinerja mesin difokuskan untuk mengeliminasi 16 major
losses, terutama yang terkait dengan mesin. Dengan kata lain, ditujukan untuk
meningkatkan Overall Equipment Effectiveness. Losses harus dapat dieliminasi
karena dapat menggerogoti profit sementara pelanggan tidak mau membayar
losses maka kepekaan merupakan langkah awal dalam memerangi losses karena
dengan membiarkan adanya losses merupakan cerminan sikap kurangnya rasa
memiliki.
Alat ukur yang dapat digunakan untuk mengetahui efektivitas TPM yang
dijalankan adalah OEE (Overall Equipment Effectiveness). Dengan OEE dapat
diketahui performa mesin kita berdasarkan waktu pemakaian. OEE dinyatakan
dalam persentase. OEE dipengaruhi oleh tiga faktor yaitu availability,
performance efficiency, dan rate of quality product. Contoh perhitungan OEE
serta losses yang mempengaruhi dapat diamati dari contoh pada gambar di atas.
Bila hasil akhir diperoleh OEE = 80%, maka loses total yang dialami sebesar
20%.
3.6.2 Sistem Air
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
67
Teknik bagian utilitas memiliki tugas untuk menangani perbaikan dan
perawatan sistem pengelolaan air. Air untuk bagian produksi sangat penting
antara lain untuk bahan baku produksi, WIP (washing in place), CIP (cleaning in
place), SIP (Sanitation in place). WIP adalah kegiatan membersihkan dimana
aktifitas pembersihan dilakukan dengan cara manual. CIP adalah kegiatan
membersihkan dimana proses pembersihannya tidak dilakukan dengan proses
manual. SIP adalah kegiatan membersihkan dimana proses pembersihan seperti
CIP tetapi dengan menggunakan air yang memiliki suhu >75°C.
Air adalah pelarut universal yang melarutkan seluruh zat seperti logam, gas,
batu, debu, dan benda asing (bakteri) yang merupakan kontaminan yang
menyebabkan terjadinya inkonsistensi kualitas air yang diperoleh.nerdasarkan
pengotornya, sebutan untuk air bermacam-macam seperti acid water, dirty water,
hard water, dll. Definisi air murni adalah air yang tidak mengandung bahan yang
lain hingga konsentrasi tertentu sesuai dengan yang dipersyaratkan. Sumber
diperolehnya air dapat dilihat pada gambar di bawah ini :
Gambar 3.12. Skema Sumber Air Baku
Proses produksi di PT. Konimex menggunakan purified water, sedangkan
untuk produksi steril tetes mata digunakan water for injection. Persyaratan
purified water, yaitu :
1. pH : 5,0 – 7,0
2. Chlorida: 0,5 mg/l
3. Sulfat: 10,0 mg/l
4. Ammonia: 0,1 mg/l
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
68
5. Kalsium: 1,0 mg/l
6. Karbondioksida: 5,0 mg/l
7. Logam Berat: 0,1 mg/l (Cu)
8. Substrat teroksidasi: lolos permanganate test
9. Total solid: 10,0 mg/l
10. Total bakteri: 100,0 cfu/ml (50 cfu/ml : WFI)
11. Pirogen: 0,0 IU/ml (WFI)
Air yang digunakan untuk plant farmasi berasal dari dua sumur air tanah
dengan kedalaman ± 120 m, dari air tanah ini kemudian dipompa dan dialirkan ke
water tower yang tingginya sekitar 24 m. Ketinggian itu dipilih agar pada titik
kaki tower diperoleh tekanan sebesar 2,4 bar, sehingga tidak diperlukan adanya
pompa untuk mendistribusikannya. Dari water tower air dialirkan ke pressure
tank agar air memiliki stabilitas tekanan yang cukup untuk mampu melewati unit
treatment selanjutnya. Air dialirkan melewati setiap unit sistem pengolahan air
untuk mendapatkan purified water sebelum digunakan untuk proses produksi.
Sistem pengolahan air untuk memperoleh purified water dapat dilakukan dalam
beberapa tahap, yaitu :
a. Multi Media Filter (MMF)
Multi media filter berfungsi untuk menghilangkan lumpur, endapan, dan
partikel-partikel yang terdapat pada raw water. Multi Media Filter merupakan
filter pertama yang terdiri dari beberapa lapis media (antrasit, pasir, granit, kerikil)
digunakan untuk menyaring suspended solid yang berukuran ≥10 µm, zat kapur,
partikel halus/koloid dan untuk menghilangkan kekeruhan. Pretreatment dari
multi media filter ini menggunakan turbiditas. Banyaknya suspended solid yang
telah terfilter akan menyebabkan filter menjadi kotor. Pembersihan filter
dilakukan dengan cara backwash dan dilakukan tiap dua hari sekali. Metode
backwash dilakukan untuk memperlama umur filter.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
69
Gambar 3.13. Proses Multimedia filter
b. Carbon Filter
Carbon Filter berfungsi untuk mengadsorpsi dissolved organic dan
mengeliminasi chlorine. Carbon filter sangat penting dilakukan karena adanya
residu chlorine dapat merusak membran Reverse Osmosis yang terbuat dari TFC
(Thin Film Composite) dan juga dapat mengoksidasi ion-exchange resin yang ada
dalam tahap penghilangan kesadahan air (softener). Selain itu, tahap ini juga akan
dapat menghilangkan bau dan rasa dari air dengan mengadsorpsi bahan-bahan
organik terlarut.
Reaksi Aktivasi Karbon dengan Chlorine:
C* + HOCl CO* + H+ + Cl-
Keterangan:
C* = Activated Carbon Surface
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
70
CO* = Surface Oxide
Karbon aktif memiliki sifat mengadsorpsi maka karbon aktif dapat jenuh
sehingga bila sudah mencapai titik jenuh harus diganti dengan karbon aktif yang
baru atau mengaktifkan kembali, yaitu dengan cara memanasi pada suhu >2000°C
atau menambah activator seperti NaOH dan dipanasi pada suhu 600°-800°C.
Gambar 3.14. Carbon Filter
c. Softener
Tahap ini bertujuan untuk menghilangkan sifat kesadahan air dengan cara
mengikat ion-ion positif seperti Ca2+ (ion kalsium) dan Mg2+ (ion magnesium)
dengan resin negatif. Semua kation-kation tersebut akan ditukar dengan Na+ pada
tahap ini. Pada prinsipnya resin suka dengan ion yang bersifat lebih positif,
sehingga pada tahap ini akan dihasilkan air dengan kandungan Na+ yang besar (air
kaya Na).
Setelah digunakan selama beberapa waktu maka filter akan jenuh dengan
ion kalsium dan magnesium sehingga filter perlu diregenerasi untuk
mengembalikkan fungsinya seperti semula. Proses regenerasi yang dilakukan
dengan menambahkan larutan garam natrium dalam jumlah banyak dengan
menggunakan brine tank sehingga resin mengikat natrium kembali dan ion
kalsium dan magnesium dilepas ke jalur reject.
d. Filter 5 µm
Untuk menyaring partikel yang berukuran ≥5 mikron. Menghilangkan
partikel-partikel zat organik/ inorganik serta mikroorganisme yang ukurannya di
atas 5µm agar air baku yang akan melalui Reverse Osmosis sudah cukup bersih
dari pengotoran mekanik & mikro.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
71
e. Reverse Osmosis
Reverse Osmosis (RO) adalah suatu teknik pembuatan air murni yang dapat
mengurangi 99% mikroorganisme, partikel dan pirogen serta senyawa organik
dengan bobot molekul lebih dari 300. Proses yang terjadi merupakan tahap filtrasi
terbaik dari teknologi membran (hingga 0,0001 mikron).
Di PT. Konimex reverse osmosis double stage digunakan agar pemurnian
air berjalan lebih efektif dan efisien. Pada proses reverse osmosis air dipompa
dengan tekanan tinggi 150-200 psi melalui membran semipermeabel dengan
menggunakan pompa bertekanan tinggi sehingga dihasilkan permeate water yang
selanjutnya akan masuk ke dalam EDI. Proses yang terjadi merupakan
penyaringan molekuler dimana hanya air murni saja yang bisa melewati membran.
Sementara kontaminan akan ditolak dan dibuang ke dalam saluran limbah.
Kontaminan yang direject oleh membran diantaranya garam terlarut senyawa
bermolekul besar >150-250 Dalton. Air yang tersisa atau dibuang disebut reject
water. Membran semipermeabel yang digunakan terbuat dari bahan TFC.
Dipilihnya bahan ini karena kemampuan rejection bahan ini yang mendekati
100%. Namun, bahan ini memiliki kelemahan yaitu tidak tahan terhadap klorin,
sehingga keberadaan klorin perlu dihilangkan sejak awal.
f. CDI (Continuous DeIonisation)/ EDI (Electro DeIonisation)
Continuous DeIonisation (CDI) / Electro DeIonisation (EDI) merupakan
perkembangan dari ion exchange system dimana sebagai pengikat ion (+) dan (-)
dipakai juga elektroda disamping resin. Continuous DeIonisation (CDI) / Electro
DeIonisation (EDI) digunakan untuk menghilangkan ion-ion yang terdapat dalam
air. Hal ini penting dilakukan terkait dengan persyaratan konduktivitas air yang
harus rendah. Semula prinsipnya adalah ion dalam air akan tertarik menuju ke
katoda dan anoda sesuai dengan konduktivitasnya. Air yang terkumpul setelah
melewati EDI ditampung dalam storage tank dan disirkulasikan dalam sistem
loop tertutup.
g. Purified Water Loop
Sirkulasi air dibuat menjadi turbulen dengan tujuan untuk mencegah
terjadinya dead lag (suatu kondisi dimana tidak terjadi aliran air pada salah satu
sisi) yang dapat mengakibatkan terjadinya akumulasi partikel pada sisi tersebut
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
72
(biofilm). Kemudian dilakukan sanitasi dengan ozon untuk menghilangkan baktei
dan ozon akan ikut disirkulasi ke dalam pipa-pipa hingga tank penampungan
maupun user point. Setelah itu pada sirkulasi berikutnya dilewatkan sinar
ultraviolet untuk mendestruksi ozon sisa yang masih aktif menjadi oksigen.
Setelah proses sanitasi maka air tesebut siap untuk digunakan dalam proses
produksi. Air yang digunakan untuk produksi tetes mata adalah Water for
Injection yang diperoleh dengan cara mendestilasi purified water menggunakan
teknologi multi effect water still, yaitu sistem destilasi bertingkat dengan efisiensi
tinggi dan penggunaan sistem panas. Hasil destilasi kemudian dikondensasi dan
disimpan dalam storage tank pada suhu 70-80°C sebelum didistribusikan untuk
produksi produk steril.
3.6.3 Sistem Pengkondisian Udara (HVAC)
Sistem pengkondisian udara ini merupakan sistem pengolahan udara
sehingga udara yang ada akan sesuai dengan keadaan yang diinginkan/ kebutuhan.
Pengkondisian udara ini perlu diperhatikan dengan tujuan untuk memperoleh
kenyamanan kerja dan untuk keperluan khusus seperti proses produksi dan
penyimpanan bahan. Pengkondisian udara yang tidak baik dapat berdampak pada
kualitas produk jadi misalnya produk menjadi terkontaminasi dengan adanya
kontaminasi silang sehingga sistem pengkondisian udara sangat dibutuhkan pada
industri farmasi.
Kondisi lingkungan yang kritis terhadap kualitas produk adalah cahaya,
suhu, kelembapan relatif, kontaminasi mikroba dan kontaminasi partikel dan
semua itu diatur dengan sistem tata udara. Pengkondisian dari sistem tata udara di
PT. Konimex, antara lain temperatur (cooling/heating), kelembaban udara
(humidifier/ dehumidifier), kebersihan (filter, HEPA filter), aliran udara dan
tekanan udara (fan, damper, diffuser).
Beberapa regulasi telah menyatakan persyaratan mengenai sistem Heating
Ventilating and Air Conditioning (HVAC) terkait dengan kelas kebersihan ruang
untuk proses produksi. Regulasi yang digunakan adalah GMP, Federal Standar
209E, ISO, komparasi standar, pedoman CPOB. Misal Federal Standar 209 E
mensyaratkan kelas kebersihan yang berbeda berdasarkan kegiatan (ruang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
73
dipersiapkan untuk proses produksi, ruang saat operasional mesin tidak berjalan,
dan ruang saat proses operasional sedang berlangsung).
Pengkondisian ruang akan menghasilkan beberapa kelas kebersihan.
Berikut adalah contoh kelas ruang kebersihan dan persyaratannya:
a. Kelas III – 100.000
Pre filter sebelum AHU (eff 20%)
Medium filter sebelum AHU (eff 95%)
HEPA filter sebelum ruangan (eff 99%)
Luas HEPA 5-10% dari luas ruangan
Air change 25 kali per jam
Pressure gradient >15 pa
b. Kelas II – 10.000
Pre filter sebelum AHU (eff 20%)
Medium filter sebelum AHU (eff 95%)
HEPA filter sebelum ruangan (eff >99%)
Luas HEPA 10-15% dari luas ruangan
Air change 40 kali per jam
Pressure gradient >15 pa
Untuk memenuhi persyaratan tersebut, beberapa parameter perlu
dikondisikan antara lain:
a. Temperatur (Cooling/Heating)
Ada beberapa sumber panas yang terdapat dalam industri antara lain lampu,
manusia, lingkungan, atap, kaca, proses pemanasan dalam produksi. Sumber–
sumber ini akan mempengaruhi temperatur ruang maka perlu pengkondisian udara
yang dilakukan dengan menggunakan ventilasi dan AC. Ruangan yang
memerlukan pengaturan suhu dikontrol dengan menggunakan AC.
Pendinginan udara dapat dilakukan dengan dua cara, yaitu cara pendinginan
langsung dan cara pendinginan tak langsung. Pendinginan langsung merupakan
cara pendinginan dimana udara yang akan disirkulasikan didinginkan secara
langsung melalui evaporator dari mesin pendingin. Sedangkan cara pendinginan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
74
tidak langsung udara didinginkan melalui AHU yang dialiri oleh air dingin
menggunakan Chiller.
b. Kelembaban udara (Humidifier/Dehumidifier)
Dehumidifier biasa digunakan untuk ruangan yang memerlukan kelembaban
relatif rendah seperti ruangan untuk produksi tablet effervescent. Penggunaan
dehumidifier ini akan membantu menciptakan kondisi ruangan dengan udara yang
dingin tetapi dengan kelembaban relatif yang rendah (kering).
c. Kebersihan (Filter, HEPA filter)
Pengaturan jumlah partikel dilakukan dengan pemasangan HEPA filter dan
untuk ruangan yang banyak menghasilkan debu dilengkapi dengan dust collector.
Udara yang dialirkan ke dalam ruangan mengalami filtrasi ssecara bertingkat
melalui prefilter, medium filter, dan HEPA filter. Tahap prefilter dan medium
filter berada pada AHU. Bagian filter yang dapat dibersihkan hanyalah prefilter,
sedangkan medium filter tidak dapat dibersihkan. Misal untuk ruangan kelas
100.000 dimana hanya boleh terdapat 100.000 partikel berukuran 0,5 mikron.
Jumlah tersebut dapat diperoleh dengan memasang HEPA filter seluas 5-10% luas
ruangan, untuk ruangan kelas 10.000 diperoleh dengan memasang HEPA seluas
10-15% luas ruangan, serta untuk memperoleh ruangan dengan kelas 100
dilakukan pemasangan HEPA dengan luas sebesar luas ruangan (Full HEPA).
d. Aliran udara dan Tekanan udara (Fan, Damper, Diffuser)
Pengaturan tekanan udara dilakukan dengan mengatur jumlah udara yang
keluar masuk ruangan, dimana jumlah udara yang masuk lebih besar dari yang
keluar dari ruangan dengan menambahkan fresh air dari luar. Pengaturan volume
tersebut dapat dilakukan dengan menggunakan damper. Misal untuk kelas
steril/100 arah aliran udara yang disirkulasikan dalam ruangan adalah laminair,
bukan turbulen. Hal ini disebabkan karena dengan aliran udara yang laminair akan
dapat mengeliminasi kemungkinan terjadinya akumulasi debu pada salah satu
sudut ruangan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
75
Gambar 3.15. Aliran udara laminair
Aliran laminair dapat diperoleh dengan menjaga kecepatan alirnya (>0,3
m/s). Kecepatan aliran ini juga akan berpengaruh terhadap banyaknya sirkulasi
dalam ruangan tersebut. Umumnya, untuk ruangan yang bersih (clean room)
jumlah sirkulasi yang dipersyaratkan adalah >20 kali. Banyaknya sirkulasi ini
akan mempengaruhi banyaknya partikel dalam suatu ruangan. Misalnya, untuk
memperoleh ruangan dengan kelas 10.000, dilakukan sirkulasi sebanyak 40 kali
atau lebih, sedangkan untuk memperoleh ruangan dengan kelas 100.000, sirkulasi
dilakukan sebanyak 25 kali.
3.6.4 Sistem Udara Bertekanan
Udara bertekanan terutama digunakan untuk menyemprotkan cairan, baik
pada proses granulasi tablet maupun proses penyalutan. Oleh karena bersentuhan
langsung dengan produk maka pada sistem udara bertekanan harus dilengkapi
dengan saringan udara yang sesuai. Pemasangan saluran (pipa) untuk udara
bertekanan harus diatur sedemikian rupa sehingga mudah untuk diakses pada tiap
tahapan proses produksi yang membutuhkannya. Saluran (pipa) tersebut juga
harus diberi penandaan yang jelas untuk menunjukkan isi dan arah aliran.
Kompresor adalah alat yang digunakan untuk menghasilkan udara bertekanan
yang akan difungsikan sebagai penggerak instrumen, servis, kebutuhan khusus,
seperti kebutuhan laboratorium. Jenis kontaminan yang mungkin ada dalam udara
tersebut antara lain debu, air, karat, mikroorganisme, dan senyawa-senyawa
hidrokarbon (oli/minyak). Syarat udara yang dapat digunakan dalam produksi
(yang kontak langsung dengan produk adalah 1-2-1 (ISO 8573-1: 2001).
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
76
Tabel 3.6. Air Quality Classes menurut ISO 8573-1
Pada aplikasi yang kontak dengan produk persyaratan udara menurut ISO
85375 – 1 adalah 1.2.1 dimana angka pertama menunjukkan kelas jumlah partikel
padat per m3, angka kedua menunjukkan kelas Pressure Dewpoint dan angka
ketiga menunjukkan kelas oli yang terkandung dalam udara. Tabel tentang
penjelasan kelas tersebut dapat di lihat dibawah ini :
Tabel 3.7. Air Quality Classes menurut ISO 8573-1
3.7 Sistem Pengelolaan Lingkungan Hidup
Falsafah pada PT. Konimex adalah “Hidup bahagia untuk Semua Orang”.
Dalam lingkup industri, falsafah tersebut bermakna tidak menyusahkan orang lain
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
77
dengan limbah yang dihasilkan. Oleh karenanya, PT. Konimex sangat peduli
terhadap pengelolaan limbah yang dihasilkan, yang secara langsung berhubungan
dengan pengelolaan lingkungan hidup.
Tujuan pengelolaan lingkungan hidup di PT. Konimex adalah :
a. Mewujudkan pembangunan yang berwawasan lingkungan
b. Meminimalkan dampak negatif terhadap lingkungan yang timbul akibat
kegiatan pabrik,
c. Tersedianya dokumentasi dan informasi pengolahan lingkungan yang
dilaksanakan terhadap kemungkinan dampak
Dasar hukum pengelolaan lingkungan hidup adalah sebagai berikut :
a. Undang-Undang Republik Indonesia No. 23 tahun 1997 tentang Pengelolaan
Lingkungan Hidup
b. Undang-Undang Republik Indonesia No. 36 tahun 2009 tentang Kesehatan
c. Peraturan Pemerintah Republik Indonesia No. 27 tahun 1999 tentang Analisis
Mengenai Dampak Lingkungan (AMDAL)
c. Peraturan Pemerintah Republik Indonesia No. 27 tahun 1999 tentang Analisis
Mengenai Dampak Lingkungan (AMDAL)
d. Keputusan Menteri Lingkungan Hidup No. 39/MENLH/8/96 tentang Jenis
Usaha yang Wajib AMDAL
e. Keputusan Menteri Lingkungan Hidup No. 12/MENLH/3/94 tentang UKL-
UPL
f. Peraturan Menteri Kesehatan No. 928/MENKES/PER/IX/1995 tentang
Penyusunan AMDAL di Bidang Kesehatan
g. Keputusan Menteri Lingkungan Hidup No. 13/MENLH/3/95 tentang Baku
Mutu Emisi
h. Keputusan Kepala BAPEDAL No. 03/BAPEDAL/09/1995 tentang Persyaratan
Teknis Pengolahan Limbah Berbahya dan Beracun
i. Peraturan Daerah Provinsi Jawa Tengah No. 10/2004 tentang Baku Mutu
Limbah Cair Industri Farmasi
Tugas dan tanggung jawab pengolahan organisasi lingkungan hidup:
a. Mempertahankan kualitas lingkungan hidup sesuai dengan kriteria baku mutu
lingkungan yang ditetapkan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
78
b. Mengikuti perkembangan peraturan serta teknologi di bidang lingkungan hidup
Kegiatan produksi dan perkantoran di industri (pabrik) dapat menghasilkan
limbah bagi lingkungan bila tidak dikelola dengan baik. Limbah yang dihasilkan
oleh PT. Konimex memiliki berbagai macam jenis, mulai dari limbah padat, cair,
dan gas. Berikut adalah contoh limbah yang dihasilkan dan sumbernya.
Tabel 3.8. Contoh limbah dan sumbernya
No. Jenis limbah Sumber limbah
1. Kertas, karton, plastic Kantor, bekas kemasan
2. Roll alufoil, cellophane Waste, susut produksi
3. Botol , kaleng, drum Bekas kemasan
4. Debu : dust collector Proses produksi
5. Bahan obat, produk Pemusnahan obat
6. Air buangan , sisa proses Kondensat steam, air cucian, air pembersihan,
toilet , wc
7. Suara , getaran Mesin produksi, boiler, chiller, fan , ac.
8. Gas-gas Asap pembakaran
3.7.1 Pengelolaan Limbah Padat
Limbah padat yang dihasilkan oleh PT. Konimex berupa debu yang berasal
dari ruang produksi, lantai, mesin; pemusnahan bahan baku/obat; sisa kemasan
berupa karton, plastik, botol, drum, kaleng, roll alufoil; kertas yang berasal dari
kantor.. Pengelolaan limbah padat di PT.Konimex dilakukan dengan dua cara
yaitu secara konvensional dan multi stage burner tergantung dari jenis limbah
yang dihasilkan. Limbah B3 dikelola menggunakan cara multi stage burner
sedangkan untuk limbah yang tidak berbahaya seperti limbah kantor dan sisa
kemasan cukup menggunakan cara konvensional.
Limbah padat berupa sisa kemasan, kertas dan lainnya dibakar dengan cara
konvensional, yaitu dibakar dalam suatu tungku api yang terbuat dari bata tahan
api dan dilengkapi dengan cerobong asap setinggi 24 meter. Sisa abu yang hasil
pembakaran dibuang ke TPA (tempat pembuangan akhir). Sedangkan sisa botol,
kaleng dan lain-lain yang masih dapat berguna dijual ke pihak lain. Sebelum
dijual, limbah harus dipastikan tidak terdapat identitas PT.Konimex tersebut untuk
menghindari salah penggunaan oleh pihak lain.
Limbah padat berupa debu dari ruang produksi dikumpulkan dengan sistem
siklon (cyclone system), dimana udara disedot dan diputar sehingga partikel debu
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
79
akan terpisah dan berada pada bagian bawah alat. Debu turun dan ditampung
dalam dust collector sehingga udara yang telah bersih dapat langsung dikeluarkan
ke lingkungan. Pada alat ini terdapat penyaring atau filter yang menahan debu
atau partikel dengan ukura penyaring tertentu sehingga udara yang dikeluarkan
benar-benar terbebas dari partikel padatan yang dikhawatirkan mengandung obat.
Padatan debu yang telah terpisah, baik debu dari ruang produksi dan mesin, sisa
bahan baku, dan obat yang kadaluarsa atau rusak dimusnahkan dengan
menggunakan multi stage burner. Hal tersebut karena limbah-limbah tersebut
tergolong ke dalam B3 (Bahan Berbahaya dan Beracun). Pembakaran dengan
multi stage burner dilakukan secara bertingkat agar lebih efektif dan
menghasilkan sisa pembakaran yang tanpa asap (smokeless) yaitu pembakaran
dengan suhu 300°C (tahap pertama) kemudian asap yang dihasilkan dibakar
dengan suhu 900-1000°C selama 6 jam sehingga tidak ada asap yang dihasilkan
dari proses pembakaran tersebut (tahap kedua). Selanjutnya abu sisa pembakaran
B3 tersebut dikumpulkan dan disimpan sementara di TPS (maksimal 90 hari)
untuk selanjutnya dikelola oleh pihak ketiga yang memiliki sertifikat untuk
mengelola limbah B3. PT. Konimex mengirimkan abu sisa pembakaran B3 ke
PPLI Cileungsi, Bogor. Adapun kapasitas dari multi stage burner ± 120 kg limbah
padat, yang kemudian akan menjadi debu ± 4 kg.
Pembakaran dengan metode multi stage burner hampir tidak menghasilkan
asap atau smoke less burner. Pembakaran dilakukan selama 12 jam yaitu 6 jam
pembakaran dan 6 jam pendinginan. Untuk meyakinkan bahwa udara hasil
pembakaran multi stage burner memenuhi baku mutu yang persyaratkan, maka
secara berkala dilakukan pemeriksaan udara hasil pembakaran multi stage burner
bekerja sama dengan BPLI Semarang. Cerobong yang digunakan memiliki
panjang sampai 14 m, hal ini bertujuan untuk menghindari pencemaran udara
hasil pembakaran ke daerah sekitar.
3.7.2 Pengelolaan Limbah Cair
Limbah cair yang dihasilkan oleh berasal dari PT. Konimex berupa air hujan
dan kondensat steam, limbah pabrik, limbah workshop, dan limbah domestik.
Limbah cair yang dihasilkan oleh PT. Konimex diolah dengan sistem multi cell
aerated lagoon kecuali air hujan dan kondensat steam. Sistem ini menggunakan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
80
sembilan cell aerated lagoon dengan tiga stage yang dilengkapi dengan aerator
untuk masing-masing cell. Sebelum masuk ke cell, limbah cair terlebih dahulu
dialirkan ke bak penampung (sumpitch). Namun pada limbah workshop dilakukan
penyaringan pasir atau oli sebelum masuk sumpicth. Hal ini dilakukan untuk
penghindari terjadinya penyumbatan pada sumpicth. Dari bak penampung, seluruh
limbah cair dipompa ke cell yang kemudian dilakukan proses aerasi yang
bertujuan untuk meningkatkan jumlah oksigen sehingga bakteri dapat
menguraikan limbah. Proses ini berlangsung sekitar 21 hari. Pada proses aerasi
akan terbentuk lumpur/endapan/sludge. Limbah yang telah diproses pada bak
aerasi kemudian dialirkan ke dalam bak sedimentasi untuk mengendapkan lumpur
yang dihasilkan. Lumpur yang mengendap secara otomatis dipompa ke bak sludge
trap dan air yang telah melewati proses sedimentasi merupakan air yang telah
bersih. Air ini dapat dilepas ke badan air dengan cara dialirkan ke kolam ikan (fish
pond) terlebih dahulu untuk memastikan keamanannya dan dapat langsung dilepas
ke badan air. Di dalam bak sludge trap lumpur dan air akan dipisahkan lagi,
lumpur akan mengendap sedangkan air akan dialirkan kembali ke sumpitch untuk
diproses lagi. Sebelum dibuang, terlebih dahulu dilakukan pemeriksaan oleh
bagian pengawasan mutu secara berkala seminggu sekali. Pemeriksaan yang
dilakukan meliputi pemeriksaan pH, TSS, kimia, Biologycal Oxygen Demand
(BOD) dan Chemical Oxygen Demand (COD). Lumpur yang mengendap akan
dikeringkan dan dikumpulkan di TPS - B3, selanjutnya akan dikirim ke PPLI,
Cileungsi, Bogor.
3.7.3 Pengelolaan limbah udara/suara
Selain limbah padat dan cair, PT. Konimex juga menghasilkan limbah
udara. Limbah udara ini antara lain suara atau kebisingan dan gas-gas dari
cerobong asap. Cerobong asap dibuat dengan ketinggian yang telah ditetapkan serta
dilakukan pengujian secara rutin untuk memeriksa apakah limbah asap memenuhi
persyaratan ambang batas emisi yang teah ditetapkan. Untuk mengatasi gangguan
lingkungan akibat suara dari mesin-mesin produksi ketika beroperasi dilakukan
dengan pemasangan peredam bunyi menggunakan silencer. Silencer merupakan
alat yang digunakan untuk meredam bunyi yang timbul dari mesin produksi.
Selain itu dapat dilakukan dengan menggunakan partial enclosure yaitu berupa
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
81
penanaman tanaman rambat pada pagar pabrik berfungsi sebagai peredam dari
kebisingan suara yang berasal dari aktivitas pabrik. Skema pengelolaan limbah
udara PT. Konimex dapat dilihat pada gambar 3.60.
Rekap Laporan Analisa Kualitas Udara Ambien
Lokasi pengambilan sampel bulan Februari 2011
Lokasi 1 : RT 05 RW XV Cemani, Grogol, Sukoharjo
Lokasi 2 : Depan masjid RT 07 RW XIII Cemani, Grogol, Sukoharjo
Lokasi 3 : RT 05 RW XIII Mantung, Sanggrahan, Sukoharjo
Lokasi pengambilan sampel bulan Mei 2011
Lokasi 1 : Ngrongah RT 03/XIII Sanggrahan, Grogol, Sukoharjo
Lokasi 2 : Ngrongah RT 01/XIII Sanggrahan, Grogol, Sukoharjo
Lokasi 3 : Depan masjid Muttaqien Cemani RT 06/XIII Grogol, Sukoharjo
Tabel 3.9 Tabel Laporan Analisa Kualitas Udara Ambien
Hasil Analisa
Baku Lokasi 1 Lokasi 2 Lokasi 3
No Parameter Satuan
mutu Peb Mei Peb Mei Peb Mei
2011 2011 2011 2011 2011 2011
1 NO2 µgr/m3 316 26.4 18.0 25.2 27.4 29.9 29.6
2 SO2 µgr/m3 632 50.3 30.8 65.3 28.6 38.3 29.0
3
3 CO µgr/m 15000 771.8 126.8 260.1 209.8 233.3 120.4
4 NH3 ppm 2 0.1 0.113 0.086 0.099 0.083 0.112
5 H2S ppm 0.02 0.014 0.007 0.007 0.006 0.022 0.006
6 Debu µgr/m3 230 41.8 18.7 26.2 31.3 92.6 94.6
3.8 Keselamatan dan Kesehatan Kerja (K3)
Keselamatan dan Kesehatan Kerja merupakan tanggung jawab perusahaan
dan karyawan yang harus dipenuhi, karena keselamatan dan kesehatan kerja
merupakan salah satu faktor yang sangat mempengaruhi produktifitas kerja.
Dimana tujuan utama dari penerapan Keselamatan dan Kesehatan Kerja di PT.
Konimex antara lain :
a. Untuk mewujudkan angka kecelakaan nihil (zero accident), artinya tidak
terjadi kecelakaan
b. Terciptanya kondisi lingkungan kerja yang aman, sehat, dan nyaman
c. Terbentuknya cara dan sikap kerja yang aman
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
82
Dalam rangka tercapainya tujuan dari bagian keselamatan dan kesehatan
kerja maka bagian ini memiliki sistem manajemen sebagai berikut :
Plan
Action Do
Check
Gambar 3.16. Sistem manajemen keselamatan dan kesehatan kerja
1. Plan bertanggung jawab untuk membuat rencana pelaksaaan K3 yang meliputi:
a. Identifikasi bahaya, penilaian resiko,dan penetapan tindakan pengendalian
terhadap semua aktifitas, produk, prosedur, pekerjaan dan sarana pendukung
yang ada di tempat kerja.
b. Penetapan peraturan perundangan dan persyaratan yang relevan untuk
dijadikan acuan pelaksanaan K3.
c. Penetapan tujuan dan sasaran K3 tahunan guna memenuhi kebijakan K3
perusahaan
d. Penyusunan rencana anggaran tahunan dalam hal pelaksanaan sasaran di
bidang K3.
2. Do merupakan pelaksanaan dari rencana yang telah dirancang sebelumya,
meliputi:
a. Penetapan bagian-bagian dan fungsi-fungsi dalam membuat sistem, manual,
prosedur K3; pelaksana sistem (semua bagian di dalam perusahaan); auditor
internal; P2K3 sebagai pendukung pelaksanaan & pengawasan sistem;
Koordinator K3; ahli K3; dll.
b. Penentuan persyaratan/ kompetensi khusus karyawan yang beraktivitas pada
lingkungan kerja yang berbahaya (penilaian kompetensi, pelatihan K3 yang
relevan, on the job training yang diperlukan untuk memenuhi persyaratan
tsb).
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
83
c. Menciptakan sistem komunikasi untuk memastikan bahwa informasi K3
kepada karyawan dan pihak luar dapat dilaksanakan dengan baik (Safety
Meeting, Kontex, Knowlegde Management).
d. Penetapan persyaratan pengendalian dokumen yang berkaitan dengan
Sistem Manajemen K3.
e. Pengendalian resiko kecelakaan dan penyakit akibat kerja (penerapan dan
evaluasi analisa bahaya pekerjaan, analisa bahaya lingkungan kerja, dll).
f. Penyusunan prosedur dalam menghadapi keadaan darurat yang dapat
mengancam keselamatan karyawan (pencegahan, penanggulangan, sarana,
pelatihan dll).
g. Penetapan kebutuhan sarana prasarana K3, meliputi preventive maintenance,
corrective maintenance dan break down maintenance.
h. Persiapan penanggulangan keadaan darurat (emergency preparedness
response)
- Identifikasi kondisi darurat & rencana penanggulangan
- Prosedur komunikasi
- Review berkala
3. Check dilakukan sebagai sistem kontrol dan evaluasi untuk melihat tingkat
keberhasilan pelaksanaan. Cek dilakukan melalui:
a. Inspeksi dan pengujian
b. Non Conformance dan incident
c. Pencatatan
d. Audit
4. Action dilakukan dengan meninjau ulang dan meningkatkan sitem manajemen
K3.
Pelaksanaan K3 merupakan tanggung jawab dari perusahaan dan karyawan
yang harus dipenuhi karena merupakan salah satu faktor yang sangat
mempengaruhi produktivitas kerja. Area kerja yang luas, pekerjaan, kondisi
lingkungan dan potensi bahaya beragam, memerlukan penanggung jawab
pelaksanaan dan pengawasan K3 di area masing-masing. Oleh karena itu, PT.
Konimex membentuk Panitia Pembina Keselamatan dan Kesehatan Kerja (P2K3)
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
84
yang bertugas mengkoordinir penanganan masalah yang terkait dengan
keselamatan dan kesehatan kerja.
Panitia Pembina Keselamatan dan Kesehatan Kerja melibatkan berbagai
bagian yang ada di PT. Konimex. P2K3 terletak di luar struktur formal perusahaan
dan terdiri dari perwakilan yang bertanggung jawab terhadap pelaksanaan Sistem
Manajemen K3, pengawasan, dan melaksanakan perbaikan terus menerus di
bidang K3. Selain P2K3, dalam penanganan K3 di PT. Konimex juga terdapat
koordinator K3, auditor kesehatan dan keselamatan kerja dan lingkungan sebagai
auditor internal K3 dan bagian Operation/ K3 yang menyusun sistem dan program
K3.
P2K3 menunjuk dan mengesahkan sejumlah karyawan yang bertanggung
jawab di bagian kerjanya masing-masing untuk membantu mengkoordinir
pelaksanaan program-program K3 di PT. Konimex. Penyelenggaraan safety
meeting (pertemuan K3 antara Kepala bagian/Kepala seksi dengan seluruh anak
buahnya) yang dilakukan setiap tanggal 12 dan merupakan media informasi K3 ke
karyawan dan forum sumbang saran masalah K3 kepada semua bagian. Dimana
tugas utama dari koordinator K3 adalah membantu P2K3 dalam melaksanakan,
mengawasi, memberi informasi, dan melakukan perbaikan-perbaikan yang
berhubungan dengan pelaksanaan program K3. Sistem dan pelaksanaan program
K3 diaudit oleh EHS auditor. Dalam rangka pelaksanaan keselamatan dan
kesehatan kerja, PT. Konimex melakukan pemeriksaan kesehatan bagi karyawan
sebelum karyawan bekerja dan pemeriksaan kesehatan berkala maupun
pemeriksaan kesehatan khusus (audiometri, spirometri). Selain pemeriksaan
keehatan bagi karyawan PT. Konimex juga menyediakan sarana kesehatan
sebagai usaha untuk menciptakan tenaga kerja yang sehat dan produktif dengan
menyediakan fasilitas poliklinik dan Rumah Sakit Rujukan, Jamsostek, tunjangan
kesehatan, asuransi, rawat inap, pos PPPK, personal accident.
Usaha lain dari perwujudan K3 di PT. Konimex adalah pengelolaan gizi
kerja dengan pengadaan fasilitas kantin dan makan siang yang memiliki nilai gizi
yang cukup.
Program K3 di PT. Konimex, yaitu :
1. Keselamatan kerja
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
85
a. analisis bahaya lingkungan
b. inspeksi dan audit K3
c. perbaikan lingkungan
d. analisis kecelakaan kerja
2. Kesehatan kerja
a. Penyediaan sarana kesehatan bagi karyawan (Jamsostek, TPO, AMAG,
kotak P3K, poliklinik, dokter perusahaan, RS rujukan)
b. Pemeriksaan kesehatan karyawan (pemeriksaan awal, berkala, atau khusus)
3. Higiene perusahaan
a. Pengukuran dan perbaikan faktor higiene di lingkungan kerja (penerangan,
kebisingan, kadar debu, suhu dan kelembaban)
b. Pemasangan alat-alat untuk perbaikan kerja (AC, dust collector)
c. Pemantauan gizi kerja (penyediaan makan siang dan pemantauan kalori)
d. Sanitasi ingkungan sesuai dengan CPOB dan CPMB
4. Lingkungan hidup
5. Sarana penanggulangan bahaya kebakaran
a. alat deteksi dini kebakaran
b. alat pemadam api ringan hidran dan rambu evakuasi
6. Pendidikan dan pelatihan K3
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 4
PEMBAHASAN
4.1 Manajemen Mutu
Prinsip dalam manajemen mutu di industri farmasi adalah industri farmasi
harus membuat obat sesuai dengan tujuan penggunaannya, memenuhi persyaratan
yang tercantum di Dokumen Izin Edar (registrasi), dan dari segi kualitas,
keamanan, manfaat tidak menimbulkan risiko pada penggunaannya. Manajemen
industri farmasi bertanggung jawab untuk mencapai tujuan tersebut melalui
kebijakan mutu perusahaan yang memerlukan dukungan dari semua departemen
dalam perusahaan tersebut termasuk pemasok dan distributor. Hal inilah yang
juga dilakukan oleh PT. Konimex dalam penerapan sistem manajemen mutu di
perusahaannya.
Dalam menjalankan sistem pemastian mutu, PT. Konimex didukung oleh
adanya korelasi yang baik antara bagian manajeman, pemastian mutu (QA),
GMP/CPOB, pengawasan mutu (QC), dan pengkajian mutu produk. Dalam
menjalankan sistem pemastian mutu PT. Konimex didukung dengan tersedianya
personil yang berkompeten, bangunan, sarana serta peralatan yang memadai. PT.
Konimex sebagai perusahaan yang mengutamakan mutu menerapkan pemastian
mutu secara konsisten. Dalam manajemen mutu PT. Konimex selain berpedoman
pada CPOB, PT. Konimex menggunakan standar dari ISO 9001:2008. Selain itu,
PT. Konimex juga memiliki sertifikat CPOB yang didapatkan dari Badan
Pengawasan Obat dan Makanan (BPOM) untuk berbagai produk. Jadi bisa
dikatakan bahwa aspek-aspek CPOB telah diimplementasikan serta
terdokumentasikan dengan baik di sini.
4.2 Personalia
Industri farmasi merupakan suatu industri yang harus memiliki personil
yang terkualifikasi dan berpengalaman dalam jumlah yang memadai sehingga
semua tugas dan tanggungjawab terutama dalam proses pembuatan obat sesuai
dengan CPOB dapat terlaksana dan mutu dari obat dapat dipertanggungjawabkan.
86 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
87
Tiap personil di industri farmasi harus memiliki deskripsi tugas yang jelas tetapi
tidak dibebani tanggungjawab yang berlebihan untuk menghindari resiko terhadap
mutu obat.
Personalia dan pengembangan sumber daya manusia sangatlah penting.
Oleh karena itu, PT. Konimex memiliki divisi Human Resources Organization
(HRO) yang berperan dalam manajemen sumber daya manusia dan
pengembangannya. Manajemen sumber daya manusia yang dilakukan oleh PT.
Konimex dimulai dari rekruitmen, pelatihan, beserta semua aspek-aspeknya yang
dapat digunakan untuk memenuhi kebutuhan personalia.
Persyaratan menurut CPOB mengenai personalia yaitu suatu industri
farmasi harus memiliki struktur organisasi yang jelas serta tugas spesfik dan
kewenangan dari personil pada posisi penanggung jawab harus dicantumkan
dalam uraian tugas tertulis dimana aspek CPOB tidak ada yang terlewatkan
ataupun tumpang tindih. Hal tersebut dipenuhi oleh PT. Konimex dengan
menyusun struktur organisasi yang jelas dan tiap bagian memiliki deskripsi tugas
yang jelas. Selain itu, CPOB juga mensyaratkan personel kunci, yaitu Kepala
Bagian Pemastian Mutu (QA), Kepala Bagian Pengawasan Mutu (QC) dan
Kepala Bagian Produksi haruslah dipegang oleh Apoteker dan oleh orang yang
berbeda-beda serta tidak saling bertanggungjawab satu terhadap yang lain. Di PT.
Konimex posisi kunci tersebut sudah dipegang oleh Apoteker dengan orang yang
berbeda-beda serta tidak saling bertanggungjawab satu terhadap yang lain dan
masing-masing personel kunci memiliki tugas dan tanggung jawab yang jelas.
PT. Konimex menerapkan prinsip-prinsip dalam proses penerimaan
(recruitment) karyawan, yang ditentukan dalam standar kualifikasi personalia
yang meliputi proses seleksi awal, pemenuhan kriteria dan pengetahuan serta
keterampilan sesuai dengan yang tercantum dalam deskripsi tugas, memiliki
kesehatan fisik dan mental, dan persyaratan lainnya. Setelah itu, PT. Konimex
juga mengadakan pelatihan-pelatihan, termasuk pelatihan CPOB dan pelatihan-
pelatihan lain yang terkait dengan tugas dan fungsinya pada tiap-tiap bagian.
Kegiatan pelatihan tidak hanya dilakukan oleh internal perusahaan, tetapi juga
dari pihak eksternal dimana hal tersebut dilakukan guna memenuhi CPOB dalam
perolehan personel yang terkualifikasi dan bertanggungjawab.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
88
Kesehatan karyawan juga merupakan salah satu hal dipersyaratkan oleh
CPOB selain pengetahuan dan ketrampilan. Oleh karena itu, PT. Konimex selalu
berusaha agar personelnya selalu dalam keadaan sehat dengan menciptakan
suasana yang kondusif dan memberikan menu makan siang yang memiliki nilai
gizi yang cukup. Dimulai dari pemeriksaan kesehatan pada saat penerimaan
karyawan, kemudian kesehatan karyawan terus dijaga melalui pemeriksaan secara
berkala. Pemeriksaan khusus dilakukan untuk personel yang bekerja di tempat-
tempat yang berisiko tinggi, misalnya di tempat yang bising karena operasi mesin
atau di tempat yang memiliki kontak dengan debu yang tinggi seperti ruang
timbang. Pemeriksaan khusus tersebut meliputi pemeriksaaan audiometri dan
spirometri.
PT. Konimex memiliki sarana kesehatan karyawan antara lain Jamsostek,
Tunjangan Kesehatan, Asuransi Rawat Inap, kotak PPPK, Poliklinik, Personal
Accident, Dokter Perusahaan, RS Rujukan poliklinik dan RS rujukan dengan
tujuan untuk menunjang kesehatan personil. Di samping itu, penerapan K3 di PT.
Konimex juga berlangsung dengan baik dengan membentuk Panitia Pembina
Keselamatan dan Kesehatan Kerja (P2K3) yang bertugas mengkoordinir
penanganan masalah yang terkait dengan keselamatan dan kesehatan kerja.
sehingga dapat menjamin keselamatan dan kesehatan kerja personel.
4.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain,
konstruksi, letak yang memadai serta disesuaikan kondisinya agar memudahkan
dalam pelaksanaan kerja, pembersihan, dan pemeliharaan. Rancang bangun dan
tata letak ruang hendaklah dapat mencegah resiko tercampurnya obat atau
komponen obat yang berbeda, kemungkinan terjadinya kontaminasi silang oleh
obat atau bahan-bahan lain, serta resiko terlewatnya salah satu langkah dalam
proses produksi. Bangunan dan fasilitas dikonstruksi, dilengkapi dan dirawat
dengan tepat agar memperoleh perlindungan maksimal dari pengaruh cuaca,
banjir, rembesan dari tanah serta masuk dan bersarangnya serangga, burung,
binatang pengerat, kutu atau hewan lain. Selain itu bangunan serta fasilitas
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
89
hendaklah dibersihkan dan jika perlu didesinfeksi sesuai prosedur tertulis yang
rinci.
4.3.1 Lokasi
Lokasi bangunan memiliki letak geografis yang baik dan bukan merupakan
daerah gempa, memiliki iklim yag tidak mempengaruhi kualitas produk serta
kegiatan produksi tidak berpengaruh terhadap lingkungan dan dampak polusi/
efluent terhadap lingkungan, tidak ada pencemaran dari lingkungan sekitarnya
serta dari kegiatan industri lain yang berdekatan. PT. Konimex terletak cukup jauh
dari kawasan industri lain sehingga resiko pencemaran dapat dihindari. Selain itu
lokasi bangunan PT. Konimex yang terletak di desa sangrahan merupakan daerah
yang bebas dari banjir dan bukan merupakan daerah gempa. PT. Konimex juga
berada di negara Republik Indonesia yang merupakan negara beriklim tropis yang
mempunyai rentang suhu yang tidak lebar setiap tahunnya sehingga tidak
mempengaruhi kualitas produk yang dihasilkan.
4.3.2 Konstruksi Bangunan
PT. Konimex merancang dan membangun gedung pabrik agar dapat
melindungi dari pengaruh cuaca, banjir dan rembesan air melalui tanah.
Permukaan lantai, dinding, langit-langit dan pintu dibuat kedap air, licin, bebas
dari keretakan sehingga mudah dibersihkan dan tidak terdapat sambungan untuk
mengurangi pelepasan atau pengumpulan partikel dan mencegah pertumbuhan
mikroba. Konstruksi lantai pada PT. Konimex telah mengikuti persyaratan yang
terdapat dalam CPOB dimana untuk gudang jenis bahan yang dipakai untuk
konstruksi lantai adalah beton padat yang bersifat menahan debu, pada ruang
produksi menggunakan beton yang dilapisi epoksi dimana permukaannya tidak
berpori dan ruang pengemasan serta laboratorium menggunakan ubin keramik
yang tahan terhadap bahan kimia dan goresan. Pada pertemuan antara dinding,
langit-langit, dan lantai tidak terdapat sambungan, tidak ada siku dan berbentuk
lengkung untuk mengurangi resiko menumpuknya partikel, mencegah
pertumbuhan mikroba, dan memudahkan pembersihan.
Lampu di pasang rata dengan langit-langit dan diberi penutup untuk
mencegah kebocoran udara. Setiap ruangan mendapatkan penerangan yang efektif
sesuai dengan kebutuhan kerja. Berdasarkan tekanan udara, sirkulasi udara, dan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
90
jumlah partikel, ruang produksi di PT. Konimex dibedakan menjadi tiga kelas
yaitu kelas 100.000, kelas 10.000 dan kelas 100. Pembagian ini dilakukan untuk
mencegah kontaminasi antar ruangan.
4.3.3 Rancang Bangun dan Tata Ruang
Rancangan bangunan PT. Konimex telah memenuhi persyaratan CPOB
melalui penerapan line (jalur produksi) untuk masing-masing produk, dimana satu
jalur mencakup semua tahap pengolahan serta pengemasan suatu produk sehingga
kontaminasi silang dapat dihindari. Sebagai penghubung antara ruang/kelas yang
berbeda disediakan ruang penyangga atau buffer, sedangkan untuk jalur masuk
barang dapat melalui pass box. Air shower terdapat pada setiap pintu masuk
menuju area produksi. Lalu lintas dalam ruang produksi di PT. Konimex
dilakukan melalui koridor agar lalu lintas barang mau pun orang tidak
mengganggu proses produksi. Pada ruang produksi multi produk menganut
prinsip koridor bersih dengan cara membuat tekanan koridor lebih besar dari
tekanan area proses produksi sehingga kontaminan yang berasal dari ruang proses
tidak akan tercampur dengan kontaminan dari ruangan lain karena aliran udara
bergerak dari koridor menuju ruang proses.
4.3.4 Sistem Tata Udara
Sistem tata udara di PT. Konimex di desain untuk memenuhi persyaratan
CPOB dimana beberapa parameter seperti cahaya, suhu, kelembapan udara,
kontaminasi mikroba, kontaminasi partikel, aliran dan tekanan udara di atur sesuai
dengan persyaratan yang telah ditetapkan. Pengaturan tata udara tersebut
menggunakan system AHU dimana parameter – parameter yang dibutuhkan untuk
setiap ruangan berbeda tergantung dari kelas kebersihan dari ruangan tersebut.
Perbedaaan tersebut terlihat dari jumlah partikel yang diizinkan dalam suatu
ruangan. Untuk mengatur perbedaan jumlah partikel, PT. Konimex
mengkondisikan pertukaran udara dari tiap ruangan per jam dan juga mengatur
filter akhir yang digunakan. Untuk mengatur pertukaran udara, digunakan control
damper yang dapat mengatur jumlah udara yang dapat masuk ke suatu ruangan
sedangkan untuk mengatur ukuran partikel digunakan berbagai macam filter akhir
sesuai dengan kebutuhan.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
91
4.3.5 Sistem pengolahan air
Sistem pengolahan air di PT. konimex telah memenuhi persyaratan CPOB
dimana air yang akan digunakan untuk keperluan produksi diolah terlebih dahulu
agar memenuhi persyaratan yang ditetapkan menjadi air murni (purified water)
dan untuk produksi steril menggunakan water for injection yang diperoleh dengan
cara mendestilasi purified water menggunakan teknologi multi effect water still,
yaitu sistem destilasi bertingkat dengan efisiensi tinggi dan penggunaan sistem
panas.
4.4 Peralatan
Menurut CPOB peralatan untuk membuat obat harus memiliki desain dan
konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi
dengan tepat. Hal ini dilakukan dengan tujuan agar mutu obat terjamin sesuai
desain serta seragam dari batch ke batch dan untuk memudahkan pembersihan
serta perawatan. Peralatan yang berhubungan dengan proses produksi atau proses
pembuatan obat di PT. Konimex menjadi tanggung jawab bagian produksi, bagian
teknik, dan validasi. Pengadaan peralatan harus lebih dahulu mempertimbangkan
kesesuaian spesifikasi dari alat yang diinginkan dengan tujuan penggunaan agar
keberadaan alat tersebut dapat menunjang proses pembuatan obat yang sesuai
dengan CPOB. Spesifikasi alat yang diinginkan harus tercantum dalam URS
(User Requirements Specification). URS ini pada awalnya dibuat oleh bagian
produksi berupa kalimat yang berisi output yang diinginkan yang kemudian akan
diterjemahkan oleh bagian teknik menjadi suatu URS yang lengkap yang akan
diberikan kepada pemasok alat yang terkait.
PT. Konimex juga sangat memperhatikan hal yang berkaitan dengan
konstruksi dan desain peralatan sebagai contoh, untuk alat produksi yang kontak
langsung dengan produk dipilih alat dengan permukaan yang inert. Kemudian
dilakukan pembersihan secara rutin dan perawatan secara berkala. Instalasi dan
lokasi perlu memperhatikan beberapa hal antara lain kesesuaian ukuran ruang dan
besar alat, kekuatan lantai, fasilitas listrik, pembumian yang baik,
mempertimbangkan area yang cukup untuk perawatan atau pembersihan,
ketersediaan utilitas penunjang, alat terpasang dengan instruksi yang jelas, ada
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
92
jarak yang cukup antar alat. Hal ini telah diterapkan oleh PT. Konimex melalui
penerapan konsep through the wall installation di Paramex line, dimana hanya
mesin yang digunakan langsung untuk proses produksi saja yang ada di area
produksi, bagian lain seperti mesin/main motor, panel elektrik, dan utilitas lainnya
terpisah dan masuk ke area teknik.
Setiap alat harus memiliki tanda dan nomor identitas yang jelas. Nomor ini
dicantumkan di dalam semua perintah untuk menunjukkan unit atau peralatan
tersebut yang digunakan. Tanda tersebut juga berlaku pada pipa, penandaan harus
jelas menandakan isi dan arah aliran. Di PT. Konimex hal ini juga telah
diterapkan dengan baik, setiap peralatan sudah memiliki label yang jelas tertempel
pada alat yang dimaksud. Penandaan terhadap pipa pun juga dilakukan sesuai
dengan persyaratan CPOB sebagai contoh pipa dari udara bertekanan diberi
penandaan yang jelas untuk menunjukkan isi dan arah aliran.
Prosedur tetap pembersha harus tersedia dalam menjaga kebersihan untuk
masing-masing peralatan dan dilakukan pencatatan setiap kegiatan pembersihan
dalam log book, serta menempelkan status kebersihan pada alat. PT. Konimex
telah menyediakan prosedur pembersihan untuk masing-masing alat dan prosedur
tersebut telah menjadi prosedur resmi yang harus dilaksanakan oleh operator dari
masing-masing alat. Secara sistem, cara membersihkan peralatan dapat dilakukan
baik secara manual atau menggunakan cip. Contoh produksi farmasi 2, 3 masih
menggunakan cara dan catatan manual. Produksi farmasi 1 sudah menggunakan
cara elektronik, yaitu sistem akan memberikan peringatan apabila tiba waktunya
untuk melakukan proses pembersihan, apabila tidak dilakukan sistem akan
berhenti. Setiap pencatatan juga telah dilakukan secara elektronik, setiap IBC
terpasang transponder yang akan terhubung dengan sistem dan secara otomatis
akan keluar dalam catatan batch.
Peralatan yang digunakan untuk proses produksi dan proses yang terkait
lainnya telah berada dalam keadaan terkualifikasi dengan kondisi yang baik.
Setiap peralatan baru perlu dilakukan kualifikasi antara lain: Instalation
Qualification (IQ), Operational Qualification (OQ), dan Performance
Qualification (PQ). Kalibrasi dilakukan terhadap peralatan yang digunakan untuk
menimbang, mengukur, menguji, dan mencatat pada periode tertentu yang sudah
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
93
ditetapkan. Begitu pula dengan mesin dan sistem-sistem penunjang seperti pure
steam, dust collector system, dan Heating Ventilating and Air Conditioning
(HVAC) telah tervalidasi untuk menjamin kualitas produk secara konsisten.
4.5 Sanitasi dan Higiene
Menurut CPOB tingkat sanitasi dan higiene yang tinggi diterapkan pada
setiap aspek pembuatan obat meliputi personil, bangunan, peralatan dan
perlengkapan, bahan produksi serta wadahnya dan segala sesuatu yang dapat
menjadi sumber pencemaran pada produk. PT. Konimex menerapkan higienitas
pada tiap personel melalui pemeriksaan kesehatan secara berkala dan pemeriksaan
secara khusus. Selain itu, personel juga dilatih untuk menerapkan higiene selama
bekerja dan memakai alat pelindung diri (APD) bersih secara benar sebelum
memasuki ruangan produksi. APD yang digunakan meliputi pakaian pelindung
yang bersih yang dilengkapi dengan pentup kepala, penutup mulut dan shoe cover
atau sepatu khusus untuk masuk ke ruang produksi. Bagi personil yang bekerja
dan kontak langsung dengan produk diwajibkan memakai sarung tangan,
sedangkan sumbat telinga dipakai untuk personil yang bekerja pada mesin yang
menghasilkan suara bising melebihi batas yang ditetapkan dan bagi personil yang
mengidap penyakit atau menderita luka terbuka yang dapat merugikan mutu
produk tidak diijinkan masuk ke dalam ruang produksi.
Aspek sanitasi pada bangunan dan fasilitas di PT. Konimex meliputi
desain gedung yang dikonstruksi dengan tepat dan ruangan produksi yang mudah
dibersihkan, tersedianya ruang ganti/ruang antara untuk masuk ke ruang produksi,
tersedianya toilet dan fasilitas cuci tangan yang dilengkapi dengan air bersih,
sabun dan pengering. Peralatan yang digunakan dalam produksi memiliki
prosedur pembersihan yang berbeda untuk masing-masing alat telah divalidasi
dan dievaluasi secara berkala untuk memastikan bahwa efektivitas prosedur telah
memenuhi persyaratan. Selain itu, untuk mencegah kontaminasi yang mungkin
terbawa dari lingkungan luar oleh bahan produksi, baik itu oleh bahan mentah
maupun bahan pengemas, sebelum memasuki ruang produksi bahan-bahan
tersebut harus melalui ruang antara yang dikhususkan untuk jalur masuknya
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
94
barang ke dalam ruang produksi dan dilakukan proses pembersihan atas wadah
atau bagian luar bahan baku atau kemasan.
4.6 Produksi
Proses produksi yang dilakukan di PT. Konimex dilaksanakan dengan
mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB. Hal
ini dilakukan untuk menjamin senantiasa menghasilkan produk yang memenuhi
persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar
(registrasi). Berdasarkan hasil audit 188 perusahaan farmasi tahun 2005, PT.
Konimex termasuk perusahaan yang mendapat kategori A dalam hal penerapan
CPOB.
Setiap produksi obat membutuhkan sarana berupa gedung produksi-
pengemasan-penyimpanan; material yang memenuhi persyaratan; peralatan yang
terkualifikasi dan terkalibrasi; personel yang terlatih dan terkualifikasi; proses
produksi yang tervalidasi; dokumen produksi yang sah dan mampu tertelusur.
Pemenuhan terhadap persyaratan tersebut akan menghasilkan obat yang
memenuhi aspek Kualitas (Quality), Keamanan (Safety), dan Efektivitas/khasiat
(Efficacy) dan aspek CPOB.
Bagian produksi mempunyai fungsi melakukan proses pembuatan obat
berdasarkan Rencana Permintaan Produksi (RPP) dari bagian logistik.
Penempatan ruang produksi antara likuid dan solid sudah dipisahkan agar tidak
saling terkontaminasi. PT. Konimex mempunyai dua tempat produksi solid, satu
yang dikhususkan untuk produksi Paramex dan satu lagi untuk produk solid
lainnya. Di PT. Konimex kelas kebersihan ruangan terbagi dua yaitu untuk produk
steril dan non steril. Produk steril seperti tetes mata steril di produksi di kelas
kebersihan A (kelas 100 dengan sistem Laminair Air Flow). Produk non steril
seperti tablet, sirup, krim, dan lain-lain di produksi di kelas kebersihan C (kelas
10.000). Pada area produksi juga di lengkapi dengan sistem air lock (sistem
penyangga udara) untuk perpindahan beda kelas kebersihan. Hal ini bertujuan
untuk membatasi pertukaran udara dan menjaga kestabilan tekanan udara, serta
untuk mencegah terjadinya kontaminasi silang. Dalam hal pencegahan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
95
kontaminasi silang, PT. Konimex juga telah mengikuti persyaratan kelas
kebersihan untuk setiap ruang sesuai dengan tujuan penggunaannya.
Dari segi personalia, ketika memasuki ruang locker maka masing-masing
personil harus mengenakan pakaian khusus (overall), sepatu khusus atau memakai
shoe cover, topi yang menutupi rambut atau memakai head cover, dan masker.
PT. Konimex sudah melakukan beberapa tindakan pencegahan kontaminasi
seperti menyediakan ruang buffer yang berbeda kelas kebersihan antara bagian
luar dan dalam; mengharuskan setiap pekerja memakai alat pelindung diri yang
bersih; melakukan pembersihan peralatan dan ruang yang benar setiap habis
pakai, beberapa jalur produksi telah menggunakan closed system, alat-alat tertentu
juga telah dibuat dedicated facility; melakukan pengawasan terhadap udara
produksi secara berkala. Secara umum semuanya itu menunjukkan bahwa dalam
bidang produksi, PT. Konimex telah memenuhi persyaratan sesuai yang
ditetapkan oleh CPOB atau c-GMP.
Segala aspek dalam memproduksi suatu obat, haruslah diperhatikan agar
menjadi produk yang bermutu, berkhasiat dan aman. Aspek tersebut meliputi
bahan baku, tahapan proses produksi, bangunan, kebersihan personel, pakaian
serta personel yang terlatih. Bahan baku yang digunakan dalam proses produksi
haruslah memenuhi spesifikasi bahan awal yang telah ditetapkan dan dinyatakan
release oleh QC. Bahan baku tersebut kemudian dipergunakan dalam proses
produksi. Setiap ruangan dan peralatan yang akan digunakan dalam proses
produksi telah dibersihkan sebelumnya dengan pemberian label pembersihan
ruangan dan peralatan. Untuk memastikan bahwa selama proses produksi dan
pengemasan diawasi dan dikendalikan sehingga produk jadi yang dibuat sesuai
dengan spesifikasi yang telah ditetapkan maka dilakukan In Process Control
(IPC). Masing-masing produk memiliki tahapan IPC yang berbeda disesuaikan
dengan bentuk sediaan. Misalnya pada waktu pencetakan tablet dilakukan
pemeriksaan berupa keseragaman bobot, diameter tablet, waktu hancur. Setelah di
kemas primer, produk juga dilakukan IPC (In Process Control) untuk memeriksa
kebocoran strip atau blister. Dengan adanya IPC mencegah sedini mungkin
produk diluar spesifikasi. Kegiatan pengawasan selama berlangsungnya proses
pengolahan bertujuan untuk mencegah terlanjur diproduksinya obat yang tidak
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
96
memenuhi spesifikasi. Pengawasan selama proses pengolahan yang dilaksanakan
oleh bagian produksi menjamin bahwa mesin dan peralatan produksi serta proses
yang digunakan akan menghasilkan produk yang memenuhi spesifikasi yang
ditetapkan. Dengan demikan mutu suatu produk tidak hanya menjadi tanggung
jawab bagian Quality Control tapi juga menjadi tanggung jawab semua pihak
yang berhubungan dengan proses produksi sediaan tersebut.
Dokumentasi yang ada untuk setiap produk sudah lengkap dan sesuai
dengan ketentuan. Setiap proses produksi suatu produk dilaksanakan berdasarkan
job sheet sediaan tersebut. Batch record adalah satu paket dokumen yang
diterbitkan untuk pembuatan suatu batch produk. Dokumen tersebut merupakan
riwayat sebuah batch produk yang berisikan komposisi bahan baku dan bahan
kemas yang dipakai, tahapan proses produksi sampai pengemasan. Dalam hal
dokumen produksi, PT. Konimex juga telah menerapkan ketentuan dalam CPOB.
Hal ini dibuktikan dengan diterbitkannya dokumen-dokumen seperti: dokumen
produksi induk, prosedur pengolahan induk, prosedur pengemasan induk, catatan
pengolahan, dan pengemasan batch.
PT. Konimex telah melakukan validasi untuk metode analisis bahan baku
dan validasi proses produksi. Validasi proses produksi dilakukan dengan tujuan
untuk membuktikan dan memastikan bahwa proses produksi dari batch ke batch
senantiasa dilaksanakan dengan konsisten sehingga menghasilkan produk yang
memenuhi ketentuan mutu yang ditetapkan.
Secara keseluruhan dapat disimpulkan bahwa proses produksi di PT.
Konimex telah dilakukan berdasarkan prosedur yang telah ditetapkan dan
memenuhi ketentuan CPOB. Proses produksi dijamin secara konsisten untuk
menghasilkan produk yang memenuhi persyaratan mutu dan memenuhi ketentuan
izin pembuatan dan izin edar/registrasi.
4.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang essensial dari CPOB untuk
memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang
sesuai dengan tujuan pemakaiannya. Dalam mencapai sasaran mutu diperlukan
komitmen dan keterlibatan semua pihak mulai dari awal pembuatan sampai
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
97
distribusi produk jadi serta buangan yang dihasilkan dari proses tersebut tidak
membahayakan lingkungan sekitar.
Sistem pengawasan mutu yang diterapkan PT.Konimex mencakup seluruh
aspek yang disyaratkan dalam CPOB untuk memastikan tiap produk yang dibuat
senantiasa memenuhi persyaratan mutu yang sesuai dengan tujuan penggunaanya.
PT. Konimex melakukan pengawasan mutu obat sejak bahan awal datang hingga
produk jadi siap dipasarkan. Tanggungjawab pengawasan mutu berada pada
bidang Quality Control yang bertanggungjawab langsung kepada manager Quality
Assurance (QA). Walau Quality control berada di bawah Quality Assurance,
namun masih bisa disebut berdiri sendiri karena terpisah dengan bidang produksi
sehingga jaminan adanya independensi yang kuat dalam pengawasan obat tetap
terjaga.
Bagian pengawasan mutu PT. Konimex antara lain memiliki wewenang
untuk meluluskan bahan awal, produk antara, produk ruahan, dan obat jadi bila
produk tersebut sesuai dengan spesifikasinya, atau menolaknya bila tidak cocok
dengan spesifikasinya atau bila tidak dibuat sesuai dengan prosedur yang disetujui
dan kondisi yang ditentukan. Bagian pengawasan mutu juga berwenang dalam
melakukan pengambilan contoh atau sampel barang yang akan diuji. Personil
yang bertugas dalam pengambilan sampel telah memperoleh pelatihan awal dan
berkelanjutan secara teratur tentang cara pengambilan sampel yang benar.
Pengendalian mutu bahan baku, bahan pengemas dan produk yang
dihasilkan PT. Konimex dengan metode analisis yang dianjurkan dalam
Farmakope Indonesia, United Stated Pharmacopeia, British Pharmacopeia, dan
lain-lain yang sesuai dengan fasilitas analisa yang ada dalam laboratorium QC PT.
Konimex. Metode analisis tersebut sebelumnya telah divalidasi oleh bagian
Standardisasi bekerja sama dengan bagian QC. Perubahan atau modifikasi pada
metode analisis yang diluar batasan yang ditetapkan maka diperlukan validasi
kembali. Alat-alat analisa pun dikalibrasi secara berkala sesuai dengan prosedur
yang telah baku.
Dengan melaksanakan hal tersebut diharapkan setiap metode dan alat
analisa memberikan hasil yang teliti dan akurat sehingga dapat memberikan data
yang sesungguhnya sehingga mutu bahan baku, bahan kemas, dan produk yang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
98
dihasilkan selalu dapat dikontrol sesuai spesifikasi yang ditentukan. Sebagai
contoh, pada produksi tablet, QC melakukan sampling pada empat titik kritis yang
menjadi perhatian saat pengolahan seperti saat granulasi, lubrikasi, tabletting dan
pengemasan primer. Sedangkan pada saat produksi sediaan liquid dan semisolid,
QC selalu melakukan pengujian pada produk setelah tahap kritis pencampuran
(mixing) dan pengisian (filling). Di samping itu QC juga melakukan pengujian
terhadap sampel selama on going stability pada bulan ke-0, 3, 6, 12, 24, ED
(expiration date) dan ED+1 dan penanganan terhadap sampel pertinggal. Hal ini
menjadi penting sebagai upaya korektif jika terjadi keluhan di masyarakat.
Dalam aspek bangunan untuk laboratorium pengawasan mutu, PT. Konimex
telah memenuhi persyaratan CPOB tentang cara berlaboratorium pengawasan
mutu yang baik. Laboratorium QC juga dibuat di dekat area masing-masing
produksi (QC satelit) mempermudah pengambilan dan pengujian. Selain di dekat
area produksi, laboratorium QC juga berpusat di satu gedung dimana laboratorium
pusat QC bergabung dengan laboratorium bagian Standardisasi. Laboratorium QC
telah dilengkapi peralatan yang memadai untuk menunjang pemeriksaan secara
fisika, kimia dan mikrobiologi terhadap produk yang diuji. PT. Konimex juga
memiliki laboratorium hewan yang khusus digunakan untuk uji pada hewan
seperti mencit, marmut, kelinci, dan nyamuk. Hewan-hewan ini dipakai pada
pengujian kosmetik respon penghilang rasa gatal, efek panas pada kulit, dan lain-
lain. Dalam aspek personil tiap karyawan berkewajiban untuk memakai pakaian
pelindung yaitu jas laboratorium dan alat pengaman seperti masker dan sarung
tangan yang sesuai untuk keperluan tugasnya .
Sesuai dengan Pedoman CPOB, pengawasan dan pengendalian mutu juga
harus mencakup aspek lingkungan. PT. Konimex dalam hal ini selalu melakukan
pemantauan kualitas air dan pemantauan lingkungan di dalam dan di luar produksi
secara berkala. Hal ini terlihat dari sampel-sampel yang diuji secara rutin oleh
bagian mikrobiologi dan lingkungan meliputi deep well water (air sumur dalam)
setiap bulan, purified water (air murni) untuk pengolahan produksi dilakukan
setiap point of use, water for injection (WFI) setiap hari selama produksi, waste
water (air limbah) setiap minggu, serta HVAC meliputi kelembaban, jumlah
partikel, mikroba, dan kapang di ruang produksi.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
99
4.8 Inspeksi Diri dan Audit Mutu
Pada CPOB dipersyaratkan untuk perusahanwajib melakukan inspeksi diri
dan audit mutu terhadap pelaksanaan CPOB di lingkungan pabrik. Secara garis
besar inspeksi diri merupakan suatu peninjauan kembali secara jujur (objektif)
atas seluruh tata kerja pabrik (manufacturing operation) dilihat dari setiap aspek
yang dapat berpengaruh pada jaminan mutu dari produk yang dihasilkan. Hal ini
sangat penting untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan dapat
diatasi dengan menetapkan tindakan perbaikan(korektif dan preventif) yang
diperlukan. Inspeksi diri bukan hanya mencari kesalahan atau kelemahan yang ada
tetapi lebih utama untuk mencari cara pencegahan dan mengatasi masalah secara
efektif.
Di PT. Konimex, inspeksi diri/audit internal dilakukan oleh bagian GMP.
Bagian GMP berada di bawah Bagian Pemastian Mutu (Quality Assurance).
Inspeksi diri yang dilakukan pada PT. Konimex dilakukan secara rutin yaitu sekali
dalam setahun untuk masing-masing bagian yang terkait dengan mutu produk dan
prosesnya. Inspeksi ini dilakukan oleh personil yang sudah berpengalaman dan
terkualifikasi di bidang CPOB terkini. Audit ini ditujukan untuk melakukan
perbaikan-perbaikan apabila terjadi penyimpangan dari ketentuan CPOB yang
berlaku. Setelah dilakukan inspeksi diri, disusun laporan hasil inspeksi diri serta
dibuat rencana tindakan perbaikan dan tindakan pencegahan. Dari inspeksi diri
yang dilakukan, dapat diketahui adanya kekurangan-kekurangan dalam
pelaksanaan CPOB dan dapat disusun tindakan perbaikan dan pencegahan. Hal
tersebut dilakukan untuk menjamin CPOB dijalankan secara konsisten di PT.
Konimex.
Program inspeksi diri ditujukan untuk memperbaiki kekurangan-kekurangan
yang ada dan meningkatkan efisiensi serta produktivitas kerja dari masing-masing
bagian. Program inspeksi diri dirancang dan dilaksanakan dengan melibatkan
semua pihak yang terkait baik proses produksi, maupun fasilitas dan
infrastrukturnya. Inspeksi diri mencakup aspek manusia, perangkat keras
(hardware) dan perangkat lunak (software) beserta sistem yang dipakai.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
100
4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat, Obat
Kembalian
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu
atau beberapa batch atau seluruh batch produk tertentu dalam peredaran.
Penarikan kembali dilakukan apabila ditemukan produk yang cacat mutu atau bila
ada laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap
kesehatan. Penarikan kembali dilakukan apabila ditemukan adanya produk yang
tidak memenuhi syarat kualitas atau atas dasar pertimbangan adanya efek samping
yang tidak diperhitungkan yang merugikan kesehatan. Penarikan kembali seluruh
obat jadi tertentu dapat merupakan tindak lanjut penghentian pembuatan satu jenis
obat jadi yang bersangkutan.
PT. Konimex menangani keluhan terhadap obat yang berasal dari dalam
maupun luar perusahaan. Keluhan terhadap obat dari luar terdiri dari keluhan
mutu teknis yang berasal dari pihak ketiga mengenai obat yang beredar di pasaran
dan keluhan medis mengenai cacat kualitas yang berhubungan dengan reaksi obat
yang tidak diinginkan. Selain itu, keluhan dari luar perusahaan dapat berasal dari
distributor, dokter, apoteker, rumah sakit/klinik, pemerintah (BPOM), pasien dan
media massa.
PT. Konimex membagi produk kembalian menjadi dua jenis yaitu obat
kadaluwarsa dan obat yang cacat atau rusak. Produk kembalian diterima PT.
Konimex melalui distributor-distributornya. Pabrik akan menerima melalui
gudang obat jadi. Obat yang diterima akan diperiksa kelengkapannya, kemudian
Bagian QC melakukan pemeriksaan sesuai prosedur yang berlaku. Barang yang
diterima diperiksa jumlahnya, nomor batch dan dibandingkan dengan retained
sample (contoh pertinggal). Penyimpanan contoh pertinggal dilakukan sesuai
dengan persyaratan penyimpanan obat yang tertera pada label atau etiket. Contoh
pertinggal disimpan selama expired + 1 tahun, setelah itu dimusnahkan.
Jika obat tersebut sudah kedaluwarsa maka akan dimusnahkan. Prosedur
pemusnahan harus dapat mencegah terjadinya pencemaran lingkungan dan
kemungkinan dimanfaatkan oleh orang yang tidak bertanggung jawab.
Secara umum penanganan keluhan terhadap produk, penarikan kembali
produk (recall), dan produk kembalian (retur) di PT. Konimex telah sesuai dengan
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
101
ketentuan yang ada dalam CPOB. Penanganan keluhan ada di bawah wewenang
QA. Jika berkaitan dengan mutu produk dan memerlukan pemeriksaan lebih
lanjut, maka QA akan dibantu oleh bagian QC. Jika diperlukan adanya penarikan
produk yang telah beredar, maka bagian marketing akan melakukan penarikan
dengan bantuan distributor-distributornya.
4.10 Dokumentasi
Dokumentasi merupakan bagian dari sistem informasi manajemen mutu dan
dokumentasi yang baik merupakan bagian yang essensial dari pemastian mutu.
Dokumen harus jelas untuk memastikan bahwa tiap personil menerima tugas dan
tanggung jawab yang jelas sehingga memperkecil resiko terjadinya kekeliruan.
Industri farmasi dalam memproduksi obat juga harus membuat dokumentasi
melalui catatan, data mentah, laporan analisa hingga laporan penyelidikan yang
berkaitan dengan proses produksi dan aspek pengendalian mutu terhadap obat
dimana dokumen tersebut harus dikaji ulang secara berkala dan dijaga agar selalu
up to date. Produsen harus dapat menunjukkan bahwa obat dirancang dan dibuat
dengan kualitas yang baik atas dasar dokumen yang jelas, bukan sekedar melalui
komunikasi lisan yang bisa berakibat salah tafsir dan kekeliruan. Berdasarkan
CPOB dokumentasi harus meliputi spesifikasi (spesifikasi bahan awal, pengemas,
produk ruahan, produk antara dan produk jadi), dokumen produksi (dokumen
produksi induk, prosedur produksi induk yang meliputi prosedur pengolahan
induk dan prosedur pengemasan induk, catatan produksi batch yang meliputi
catatan pengolahan batch dan catatan pengemasan batch), prosedur dan catatan
mengenai penerimaan, pengambilan sampel, dan pengujian.
Dalam pengontrolan dokumen, PT. Konimex membentuk suatu bagian yang
disebut Document Control (DC) untuk menangani sistem dokumentasi yang ada
pada tiap bagian sesuai dengan persyaratan CPOB. Melalui sistem komputer
terintegrasi, pendokumentasian di PT. Konimex telah dilakukan secara sistematis
untuk memudahkan pencarian dokumen. PT. Konimex menyadari bahwa aspek
dokumentasi merupakan suatu hal yang penting untuk ketelusuran suatu proses
produksi maka dibuat pembagian level dokumen dari level satu hingga empat
berdasarkan tingkat kepentingannya dan review-nya secara berkala. Pemegang
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
102
dokumen juga dibatasi untuk pihak-pihak tertentu yang memang terkait dengan
dokumen tersebut untuk menjamin aspek kerahasiaan dari dokumen. Untuk
dokumen asli, seluruhnya dipegang oleh bagian Document Control, kecuali
beberapa dokumen tertentu milik bagian penelitian produk dan pengembangan
proses yang sifat kerahasiaannya harus benar-benar terjaga mengenai keterangan
khusus suatu produk. Dokumen dalam bentuk softcopy yang bisa diakses oleh
orang yang berkepentinganpun tidak dapat dicetak dan disalin, sedangkan
dokumen salinan yang dapat dimiliki oleh pihak terkait masih tetap terjaga
kerahasiannya karena selalu dicatat, dikontrol dan harus telah mendapat cap dari
bagian document control. Semua dokumen di PT. Konimex selalu dikaji ulang
secara berkala dan dijaga agar selalu up to date sesuai dengan yang dipersyaratkan
dalam CPOB.
4.11 Kualifikasi dan Validasi
PT. Konimex telah menerapkan CPOB dalam setiap kegiatannya salah
satunya yaitu melaksanakan validasi. Validasi merupakan bagian yang penting
dari CPOB untuk menjamin bahwa produk obat yang dihasilkan mempunyai
kualitas yang konsisten. Validasi adalah suatu tindakan pembuktian yang sesuai
dengan prinsip-prinsip dari CPOB bahwa prosedur, proses, peralatan, bahan-
bahan, aktivitas atau sistem berfungsi sesuai dengan yang disyaratkan. Dengan
kata lain validasi adalah suatu uji atau membuktikan keabsahan.
Kegiatan validasi harus dilakukan oleh industri farmasi yang mencakup
aspek kritis dari suatu kegiatan produksi meliputi kualifikasi bahan baku,
kualifikasi bahan pengemas, kualifikasi peralatan (penunjang dan pembuatan),
kualifikasi bangunan, validasi metode analisis, validasi proses, validasi
pembersihan, dan pemeliharaan validasi. Revalidasi juga perlu dilakukan bila ada
perubahan pada metode, alat, fasilitas, maupun proses. Revalidasi juga dilakukan
dalam rentang waktu tertentu yang telah ditentukan oleh perusahaan. Pelaksanaan
validasi dan kualifikasi PT. Konimex membentuk bagian validasi tersendiri yang
bertanggungjawab langsung kepada QA manager. Sedangkan khusus validasi
metode analisis menjadi tanggungjawab bagian standarisasi.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
103
Setiap tahunnya bagian tim validasi menyusun Rencana Validasi Induk
(RIV) dan protokol validasi masing-masing line produksi. Rencana Induk validasi
ini mencakup informasi tentang fasilitas, peralatan atau proses yang akan
divalidasi; format dokumen berupa format protokol, laporan validasi dan jadwal
perencanaan pelaksanaan validasi; acuan dokumen yang digunakan dan struktur
organisasi yang melaksanakan kegiatan validasi tersebut. Kegiatan validasi yang
dilakukan oleh PT. Konimex telah mencakup aspek kritis yang dipersyaratkan
CPOB, yakni meliputi kualifikasi bahan baku dan bahan pengemas, peralatan
(penunjang dan pembuatan), dan bangunan serta validasi proses, pembersihan,
metode analisis dan pemeliharaan validasi.
Selain validasi proses PT. Konimex juga melaksanakan validasi terhadap
mesin atau peralatan yang dibiasa dikenal sebagai kualifikasi alat. Kualifikasi alat
di PT. Konimex dilakukan oleh masing-masing bagian atau unit. Kualifikasi yang
dilakukan antara lain kualifikasi desain, kualifikasi instalasi, kualifikasi
operasional, dan kualifikasi kinerja. Kualifikasi tersebut memastikan bahwa alat
tersebut telah dipasang dan dapat dioperasikan dengan baik serta telah mencapai
kinerjanya.
PT. Konimex juga melakukan kalibrasi alat ukur agar tidak terjadi kesalahan
pembacaan data yang dapat berakibat signifikan pada mutu produk. Kalibrasi
yang dilakukan di PT. Konimex diupayakan hingga mencapai hasil yang baik atau
baik dengan koreksi namun masih dapat digunakan. Khusus alat-alat yang sangat
mempengaruhi mutu produk, jika setelah dikalibrasi masih terdapat faktor koreksi
yang hampir tidak dapat ditoleransi maka diupayakan adanya service hingga
didapat kondisi yang baik.
Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 5
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
a. Praktek Kerja Profesi Apoteker di PT. Konimex dapat membantu
mahasiswa dalam memahami tanggung jawab profesi apoteker sesuai
dengan CPOB dan mengetahui penerapannya di setiap bagian industri
farmasi.
b. Praktek Kerja Profesi Apoteker di PT. Konimex dapat membantu
mahasiswa dalam mengetahui dan memahami peran Apoteker di industri
farmasi.
c. PT. Konimex telah menerapkan prinsip-prinsip CPOB pada seluruh kegiatan
yang terkait dengan produksi obat
5.2 SARAN
Dalam usaha mempertahankan kualitas produk dalam hal efikasi, keamanan
dan kualitas untuk menghasilkan produk-produk yang kompetitif, maka PT.
Konimex Pharmaceutical Laboratories harus selalu berusaha meningkatkan dan
mengoptimalkan fasilitas, sarana dan sumber daya yang ada sejalan dengan
perkembangan dunia industri farmasi yang makin berkembang.
104 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR REFERENSI
Badan Pengawasan Obat dan Makanan. (2006). Pedoman Cara Pembuatan Obat
yang Baik. Jakarta : Badan POM RI.
Badan Pengawas Obat dan Makanan. (2009). Petunjuk Operasional Penerapan
CPOB. Jakarta : Badan POM RI.
Badan Pengawas Obat dan Makanan. (2009). Suplemen I 2009 Pedoman CPOB
2006. Jakarta : Badan POM RI.
Harmita. (2006). Buku ajar analisis fisikokimia. Depok: Departemen Farmasi
FMIPA UI.
Joesoef, D. (1993). Konimex : Sistem Sosial Budaya dan Pengaruhnya terhadap
Bisnis Cina. Jakarta : Konimex.
Konimex Pharmaceutical Laboratories. (2002). Selayang Pandang Perjalanan
Panjang, www.konimex.com, diakses tanggal 26 Maret 2011 pkl 10.35.
Konimex Pharmaceutical Laboratories. (2002). Dari Farmasi Hingga Produk
Alami. www.konimex.com, diakses tanggal 26 Maret 2011 pkl 10.37.
Konimex Pharmaceutical Laboratories. (2002). Dari Sanggarahan Ke Konsumen,
www.konimex.com, diakses tanggal 26 Maret 2011 pkl 11.05.
Priyambodo, B. (2007). Manajemen Farmasi Industri.Yogyakarta: Global Pustaka
Utama.
Schuler, R. (1997). Manajemen SDM menghadapi abad ke-21. Jakarta : Erlangga
Sudarsana, I. Paramex Line, Sebuah Teknologi Proses Terkini ... Untuk Apa ?.
Majalah Kontex edisi no.111 th.21
105 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
UNIVERSITAS INDONESIA
PENETAPAN BAKU PEMBANDING SEKUNDER DAN
VALIDASI METODE ANALISIS BAHAN BAKU
TUGAS KHUSUS PRAKTEK KERJA PROFESI APOTEKER
SALMI HAYATI, S.Farm.
1006835500
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER-DEPARTEMEN FARMASI
DEPOK
DESEMBER 2011
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR ISI
DAFTAR ISI .........................................................................................................i
DAFTAR TABEL ................................................................................................ii
BAB 1 PENDAHULUAN.....................................................................................1
1.1 Latar belakang ....................................................................................1
1.2 Tujuan … ...........................................................................................2
BAB 2 TINJAUAN PUSTAKA ...........................................................................3
2.1 Bagian Standardisasi..........................................................................3
2.2 Validasi Metode Analisis.............................................................. 4
2.2.1 Kecermatan.......................................................................... 4
2.2.2 Keseksamaan....................................................................... 5
2.2.3 Selektivitas.......................................................................... 5
2.2.4 Linieritas dan Rentang........................................................... 6
2.2.5 Batas deteksi dan batas kuantitasi......................................... 6
2.2.6 Ketangguhan metode.............................................................. 6
2.2.7 Kekuatan................................................................................ 7
2.3 Kategori validasi metode analisis.................................................... 7
2.4 Verifikasi........................................................................................... 8
2.5 Baku pembanding.............................................................................. 9
BAB 3 METODOLOGI .......................................................................................
11
3.1 Metode dan Tahapan Pelaksanaan.................................................. 11
3.1.1 Penetapan Baku Pembanding Sekunder................................. 11
3.1.2 Validasi Metode Analisis Bahan Baku................................... 11
3.2 Waktu Pelaksanaan......................................................................... 12
3.3 Tempat Pelaksanaan....................................................................... 12
BAB 4 PEMBAHASAN .....................................................................................
13
4.1 Penetapan Baku Pembanding Sekunder........................................... 13
4.2 Validasi Metode Analisis Bahan Baku........................................... 15
BAB 5 KESIMPULAN ........................................................................................ 18
5. 1 Kesimpulan..................................................................................... 18
5. 2 Saran................................................................................................. 18
DAFTAR REFERENSI .......................................................................................
19
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
DAFTAR TABEL
Tabel 2.1 Hubungan kategori validasi metode analisa dan parameternya........... 8
Tabel 4.1 Parameter uji, metode, dan hasil analisis cyanocobalamin 0,1%...... 13
Tabel 4.2 Parameter uji, metode, dan hasil analisis d-α-tocoperolum................ 13
Tabel 4.3 Parameter uji, metode, dan hasil analisis acidum folicum.................. 14
Tabel 4.4 Parameter dan hasil validasi metode analisa bahan baku................. 15
ii
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Obat merupakan unsur penting dalam pelayanan kesehatan. Dalam upaya
menyediakan obat yang bermutu kepada masyarakat maka pemerintah
mewajibkan setiap industri farmasi mengikuti pedoman Cara Pembuatan Obat
yang Baik (CPOB). Konsep dasarnya adalah terciptanya obat dengan mutu yang
konsisten dan memenuhi persyaratan yang telah ditetapkan.
Dalam proses penjaminan mutu obat, pemastian mutu dari semua hal
penting dilakukan. Untuk itu pada setiap proses produksi juga harus memenuhi
spesifikasi yang telah ditentukan. Hal ini sesuai dengan salah satu aspek yang
tercantum dalam CPOB yaitu adanya suatu sistem pemastian mutu. Pemastian
mutu di PT. Konimex dilakukan oleh Divisi Quality Assurance. Bagian pemastian
mutu memastikan obat-obat dibuat dan dikendalikan secara konsisten untuk
mencapai standar mutu yang sesuai tujuan penggunaan dan dipersyaratkan dalam
izin edar dan spesifikasi produk.
Penentuan spesifikasi pada setiap bahan baku, produk ruahan dan produk
jadi adalah hal yang penting dalam pencapaian mutu produk secara keseluruhan.
Untuk itu perlu dibuat suatu daftar spesifikasi yang jelas untuk setiap bahan baku
ataupun produk jadi yang digunakan yang akan menjadi parameter dari mutu
bahan atau produk jadi tersebut. Spesifikasi dan metode analisis dibuat dengan
mengacu pada Farmakope Indonesia, United States Pharmacopoeia, European
Pharmacopoeia, Japanese Pharmacopoeia, maupun kompedial resmi lainnya
yang diakui oleh Kementerian Kesehatan Republik Indonesia. Untuk menjamin
bahwa metode analisis yang digunakan dalam penentuan parameter yang
berhubungan dengan kualitas bahan baku farmasi sesuai dengan penggunaannya
dan dapat memberikan hasil yang terpercaya, maka dibutuhkan suatu validasi
terhadap metode analisis yang digunakan.
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Dalam menentukan suatu bahan baku memenuhi kriteria yang ditetapkan,
perlu dilakukan pembandingan antara bahan baku tersebut dengan suatu standar
yang telah terbukti memenuhi persyaratan. Oleh karenanya, suatu standar atau
baku pembanding yang akan digunakan untuk kepentingan pemeriksaan sampel
sangat penting untuk ditetapkan. Baku pembanding kerja atau baku pembanding
sekunder yang telah ditetapkan akan mempermudah pemeriksaan bahan baku
yang digunakan. Hal tersebut merupakan beberapa cara untuk menjamin kualitas
produk farmasi yang dihasilkan, yaitu produk dengan kualitas yang pasti,
konsisten dan reprodusibel.
1.2 Tujuan
a. Melakukan validasi metode analisis bahan baku
b. Melakukan penetapan baku pembanding sekunder
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
BAB 2
TINJAUAN PUSTAKA
2.1 Bagian Standardisasi
Kegiatan standardisasi di PT. Konimex dilakukan oleh bagian Standardisasi
yang mempunyai fungsi dan tugas pokok yaitu :
a. Memeriksa sampel bahan baku dan produk.
b. Membuat baku pembanding laboratorium.
c. Membuat spesifikasi bahan baku dan standar kualitas produk.
d. Mengelola laboratorium hewan
Bagian Standardisasi di PT. Konimex dibagi menjadi dua Standardisasi
Bahan Baku dan Standardisasi Produk Jadi. Tugas dari bagian Standardisasi
Bahan Baku adalah melakukan pemeriksaan bahan baku rutin, riset dan validasi
atau verifikasi, menyediakan baku pembanding sekunder, dan menyediakan
spesifikasi bahan baku. Sedangkan bagian Standardisasi Produk Jadi yaitu
pemeriksaan produk jadi rutin yang dihasilkan oleh bagian Riset Product
Development, membuat standar kualitas produk, dan mengelola laboratorium
hewan.
Bagian Standardisasi salah satu tugasnya adalah membuat metode analisis
bahan baku dan produk jadi. Metode analisis tersebut kemudian divalidasi untuk
menjamin bahwa metode analisis yang digunakan mampu memberikan hasil yang
cermat dan handal hingga dapat dipercaya.
Beberapa kebijakan yang diterapkan terhadap metode analisis yang
digunakan oleh Quality Control adalah:
a. Metode analisis produk harus dilakukan validasi terlebih dahulu sebelum
disahkan dan diserahkan ke bagian Quality Control.
b. Metode analisis yang dikembangkan harus dapat diterapkan oleh bagian
Quality Control dengan peralatan yang terdapat di bagian Quality Control.
c. Spesifikasi bahan baku sedapat mungkin diambil dari/sesuai dengan buku
acuan resmi yang diakui oleh Kementerian Kesehatan.
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Kegiatan lain yang juga dilakukan oleh bagian standardisasi adalah validasi
dan verifikasi metode analisis. Pada validasi metode analisis, dilakukan pengujian
terhadap metode analisis yang dikembangkan oleh bagian Standardisasi untuk
membuktikan bahwa metode analisis dan standart kualitas produk yang akan
dikembangkan tersebut dapat bekerja memberikan hasil sesuai dengan yang
diharapkan, sedangkan verifikasi metode analisis dilakukan berdasarkan metode
analisis yang telah terdapat pada kompendial. Verifikasi dilakukan untuk
mengetahui apakah metode analisis yang ada pada farmakope dapat digunakan.
Berdasarkan Cara Pembuatan Obat yang Baik, bahan awal terdiri dari bahan
baku dan bahan pengemas. Bahan awal harus memenuhi spesifikasi yang relevan
serta harus berasal dari pemasok yang telah disetujui. Sebelum diluluskan untuk
digunakan, tiap bahan awal harus memenuhi spesifikasi dan diberi label dengan
nama yang dinyatakan dalam spesifikasi. Dalam keadaaan tertentu, pemenuhan
sebagian atau keseluruhan terhadap spesifikasi dapat ditunjukkan dengan sertifikat
analisis yang diperkuat dengan pemastian identitas yang dilakukan sendiri (Badan
Pengawas Obat dan Makanan Republik Indonesia, 2006).
2.2 Validasi metode analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter
tertentu, berdasarkan percobaan laboratorium, untuk menentukan bahwa
parameter tersebut memenuhi persyaratan untuk penggunaannya.
2.2.1 Kecermatan atau akurasi
Kecermatan adalah kedekatan hasil penetapan yang diperoleh dengan hasil
yang sebenarnya. Kecermatan dinyatakan sebagai hasil perolehan kembali dari
analit yang ditambahkan. Ada tigacara untuk menentukan akurasi, yaitu metode
perbandingan terhadap standar acuan, metode simulasi atau spiked placebo
recovery, dan metode penambahan bahan baku atau standard addition method.
Cara yang umum digunakan untuk menentukan kecermatan adalah berdasarkan
presentase yang didapat dari kurva linear standar. Persen perolehan kembali
dinyatakan sebagai rasio antara hasil kadar yang diperoleh dengan kadar yang
sebenarnya. Kriteria cermat diberikan jika hasil analisis memberikan rasio antara
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
80%-120%. Pada percobaan penetapan kecermatan, sedikitnya lima sampel yang
mengandung analit atau plasebo yang harus disiapkan dengan kadar antara 50%
sampai 150% dari kandungan yang diharapkan.
2.2.2 Keseksamaan (Precision)
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara
hasil uji individual, diukur melalui penebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari
campuran yang homogen. Kriteria seksama diberikan jika metode memberikan
simpangan baku relatif atau koefisien variasi 2% atau kurang.
Akan tetapi kriteria ini sangat fleksibel tergantung pada konsentrasi analit
yang diperiksa, jumlah sampel, dan kondisi laboratorium. Keseksamaan dapat
dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility).
Kriteria seksama diberikan jika metode memberikan simpangan baku relatif atau
koefisien variansi 2% atau kurang. Dari penelitian dijumpai bahwa koefisien
variansi meningkat dengan menurunnya kadar analit yang dianalisis. Percobaan
keseksamaan dilakukan terhadap paling sedikit enam replika sampel dengan
matriks yang homogen.
2.2.3 Selektivitas (Spesifitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuan yang hanya
mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen
lain yang mungkin ada dalam matriks sampel. Selektivitas seringkali dapat
dinyatakan sebagai derajat penyimpangan (degree of bias) metode yang dilakukan
terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran,
hasil urai, senyawa sejenis, senyawa asing lainnya, dan dibandingkan dengan
terhadap hasil analisis sampel yang tidak mengandung bahan lain yang
ditambahkan.
2.2.4 Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transformasi matematika yang baik,
proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah
pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
ditetapkan dengan kecermatan, keseksamaan, dan liniearitas yang diterima.
Linearitas biasanya dinyatakan dalam istilah variasi sekitar arah garis regresi yang
dihitung berdasarkan persamaan matematik data yang diperoleh dari hasil uji
analit dalam sampel dengan berbagai konsentrasi analit.
Sebagai parameter adanya hubungan linier digunakan koefisien korelasi r
pada analisis regresi linier y = a + bx. Hubungan linier yang ideal dicapai jika
nilai b = 0 dan r = +1 atau -1 bergantung pada arah garis. Sedangkan nilai a
menunjukkan kepekaan analisis terutama instrumen yang digunakan. Parameter
lain yang harus digunakan adalah simpangan baku residual (Sy). Dengan
menggunakan kalkulator atau perangkat lunak komputer, semua perhitungan
matematika tersebut dapat diukur.
2.2.5 Batas deteksi dan batas kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dideteksi
yang masih memberikan respon signifikan dibandingkan dengan blanko. Batas
deteksi merupakan parameter uji batas. Batas kuantitasi merupakan parameter
pada analisis renik dan diartikan sebagai kuantiasi terkecil analit dalam sampel
yang masih dapat memenuhi kriteria cermat dan seksama.
Batas deteksi dan kuantitasi dapat dihitung secara statistik melalui garis
regresi linier dari kurva kalibrasi.
2.2.6 Ketangguhan metode (Ruggedness)
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh dari
analisis sampel yang sama dalam berbagai kondisi uji normal, seperti
laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang berbeda, dan
lain-lain. Ketangguhan biasanya dinyatakan sebagai tidak adanya pengaruh
perbedaan operasi atau lingkungan kerja pada hasil uji. Ketangguhan metode
merupakan ukuran ketertiruan pada kondisi optimasi normal antar laboratorium
dan antar analisis.
2.2.7. Kekuatan (Robustness)
Robustness adalah kapasitas dari metode analisis untuk tetap tidak
terpengaruh oleh variasi kecil yang sengaja dilakukan pada parameter
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
pemeriksaan atau metode analisisnya. Misalnya, variasi dilakukan pada pH, suhu
kolom, flow rate, dan lain-lain.
Untuk memvalidasi kekuatan suatu metode perlu dibuat suatu perubahan
metodologi yang kecil dan terus menerus dan mengevaluasi respon analitik dan
efek pada presisi dan akurasi (Harmita, 2006).
2.3 Kategori Validasi Metode Analisis
Menurut The United States Pharmacopeia 31 The National Formulary 26
tahun 2008, metode atau prosedur analisis dapat dibedakan menjadi empat
kategori, yaitu (United States Pharmacopeial Convention, 2008):
a. Kategori I
Mencakup prosedur analisis kuantitatif, untuk menetapkan kadar komponen
utama bahan obat atau zat aktif dalam sediaan farmasi.
b. Kategori II
Mencakup prosedur analisis kualitatif dan kuantitatif yang digunakan untuk
menganalisis impurities ataupun degradation compounds dalam sediaan farmasi.
c. Kategori III
Mencakup prosedur analisis yang digunakan untuk menentukan karakteristik
penampilan suatu sediaan farmasi, misalnya disolusi dan pelepasan obat.
d. Kategori IV (tes identifikasi)
Perbedaan masing-masing kategori dapat dilihat pada Tabel 2.1
Tabel 2.1. Hubungan kategori validasi metode analisis dan parameternya
Parameter Kategori I Kategori Iia Kategori IIb Kategori III
Analisis
Akurasi + + - -
Presisi + + - -
Spesifitas + + + +
Batas deteksi - - + -
Batas - + - -
kuantitasi
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Linearitas + + - -
Range + + - -
Ruggedness * * - -
Keterangan: * dilakukan jika perlu
2.4 Verifikasi
Verifikasi suatu metode analisis merupakan pembuktian bahwa suatu
laboratorium dapat melakukan analisis secara berulang dengan memenuhi batas
penerimaan. Verifikasi pada kondisi pemakaian ditunjukkan dengan memenuhi
spesifikasi kesesuaian sistem yang terdapat pada metode analisis, seperti
pemenuhan akurasi dan presisi atau parameter metode lainnya yang sesuai dengan
jenis metode (Food and Drug Administration, 2009).
Verifikasi metode uji adalah konfirmasi ulang dengan cara menguji suatu
metode dengan melengkapi bukti-bukti yang obyektif, apakah metode tersebut
memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan. Verifikasi
metode uji ditujukan untuk metode pengujian standar seperti kompendial
Farmakope, Standar Nasional Indonesia, Association of Official Analytical
Chemists (AOAC), dan lain sebagainya. Metode baku (standar) yang sudah
divalidasi umumnya tidak perlu lagi divalidasi ulang. Namun untuk mengetahui
kinerjanya disuatu laboratorium, metode tersebut perlu dicoba dulu atau
diverifikasi keandalannya. Dalam verifikasi ini dilakukan analisis kinerja metode
berupa akurasi, presisi, dan linearitas.
Verifikasi dilakukan pemeriksaan terbatas (selektif) pada yang terpenting
saja dan relevan dengan jenis contoh yang dianalisis. Pada verifikasi tidak
selengkap validasi misalnya ketangguhan, kekuatan, batas deteksi dan batas
kuantitasi metode dan sebagainya tidak dilakukan. Verifikasi bertujuan untuk
membuktikan bahwa laboratorium mampu melakukan analisis dengan hasil yang
dapat diandalkan (valid).
2.5 Baku Pembanding
Baku pembanding dibagi menjadi dua, yaitu baku pembanding primer
biasanya tidak langsung digunakan untuk pengujian analisis rutin. Baku
pembanding primer hanya digunakan untuk tujuan seperti diuraikan dalam
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
monograf yang bersangkutan dan baku pembanding sekunder atau baku
pembanding kerja digunakan untuk analisis rutin yang disiapkan dari bahan baku
yang mempunyai kemurnian analisis atau bahan baku dengan kemurnian tinggi
dan dilakukan uji perbandingan terhadap baku pembanding primer.
Baku pembanding merupakan bahan yang terpilih berdasarkan
kemurniannya yang tinggi, karakteristik kritis, serta kesesuaian penggunaannya.
Baku pembanding diperlukan secara khusus di dalam beberapa penetapan kadar
dan pengujian dalam farmakope dan dimaksudkan hanya untuk keperluan
tersebut. Baku pembanding hanya digunakan untuk pengujian mikrobiologi,
kromatografi, spektofotometri yang pengukurannya harus dibandingkan dengan
baku pembanding hingga diperoleh hasil yang teliti dan tepat (Departemen
Kesehatan Republik Indonesia, 1995).
Baku pembanding harus disimpan, ditangani dan digunakan secara benar.
Baku pembanding hendaknya diberi label baku pembanding yang mencantumkan
kadar, tanggal pembuatan, tanggal kadaluarsa, tanggal pertama kali tutup
wadahnya dibuka dan bila perlu kondisi penyimpanannya. Biasanya baku
pembanding harus disimpan dalam wadah bersumbat asli, dijauhkan dari sumber
panas dan terlindung cahaya, khususnya harus dihindari lingkungan penyimpanan
yang lembab. Apabila diperlukan kondisi penyimpanan khusus, petunjuk
penyimpanan dicantumkan pada etiketnya (Departemen Kesehatan Republik
Indonesia, 1995).
Baku Pembanding tidak boleh digunakan sebagai obat. Beberapa cara
pengujian dan penetapan pada farmakope dilakukan dengan cara membandingkan
zat yang diuji terhadap baku pembanding (Departemen Kesehatan Indonesia,
1995).
Baku pembanding sekunder atau baku pembanding kerja dapat ditetapkan
melalui penerapan uji dan pemeriksaaan yang sesuai dengan interval waktu yang
berkala untuk memastikan standardisasi. Baku pembanding harus diberi
penandaan yang tepat, yang sedikitnya mengandung informasi seperti nama
bahan, nomor bets atau nomor lots, nomor kontrol, tanggal penyiapan, masa edar,
potensi, kondisi penyimpanan. Semua baku pembanding yang dibuat oleh pabrik
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
itu sendiri (in-house reference standard) harus distandardisasi terhadap baku
pembanding resmi, bila ada, sejak awal dan pada interval waktu berkala.
BAB 3
METODOLOGI
3.1 Metode dan Tahapan Pelaksanaan
Metode yang digunakan dalam pelaksanaan tugas khusus meliputi studi
literatur dan pengamatan serta melakukan kegiatan pemeriksaan bahan baku yang
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
akan digunakan untuk validasi metode analisis bahan baku dan penetapan baku
pembanding sekunder.
3.1.1 Penetapan Baku Pembanding Sekunder
Tahap pertama dalam penetapan baku pembanding sekunder adalah
melakukan studi terhadap spesifikasi internal yang telah tersedia. Selanjutnya
dilakukan pengujian terhadap zat yang akan ditetapkan sebagai baku pembanding
sekunder sesuai dengan parameter yang telah ditetapkan. Jika telah memenuhi
parameter, analis akan menyusun sertifikat analisis baku pembanding dan baku
pembanding sekunder tersebut dapat digunakan untuk keperluan di laboratorium.
Dalam tugas khusus kali ini, ditetapkan tiga bahan baku menjadi baku
pembanding sekunder, yaitu cyanocobalamin 0.1%, d-α-tocoperolum, acidum
folicum.
3.1.2 Validasi Metode Analisis Bahan Baku
Tahap pertama adalah pencarian literatur mengenai metode analisis kadar
secara kuantitatif terhadap bahan baku tersebut. Selanjutnya, analis akan
memeriksa ketersediaan alat dan bahan yang diperlukan dengan alat dan bahan
yang tersedia di laboratorium. Jika metode yang dimaksud tidak diketemukan di
literatur atau menggunakan alat atau bahan yang tidak tersedia, maka analis akan
melakukan riset untuk pengembangan metode analisis. Kemudian metode analisis
hasil pengembangan riset itu akan dilakukan verifikasi atau validasi. Dalam tugas
khusus kali ini, dilakukan validasi metode analisis kadar secara spektrofotometri
UV-Vis, titrasi, dan potensiometri terhadap lima bahan baku, yaitu coenzym Q10,
lactic acid, metoclopramide HCl, calcium carbonate, magnesium
glycerophosphate.
3.2 Waktu Pelaksanaan
Pelaksanaan tugas khusus dilakukan pada setiap hari kerja mulai tanggal 6
hingga 28 Oktober 2011.
3.3 Tempat Pelaksanaan
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Pelaksanaan tugas khusus dilakukan pada laboratorium bagian
Standardisasi PT. Konimex Pharmaceutical Laboratories, Sukoharjo, Solo, Jawa
Tengah.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Penetapan Baku Pembanding Sekunder
Bahan baku yang akan ditetapkan menjadi baku pembanding sekunder
adalah cyanocobalamin 0.1%, d-α-tocoperolum, acidum folicum. Parameter,
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
metode dan hasil penetapan baku pembanding sekunder dapat dilihat pada Tabel
4.1 hingga Tabel 4.3
Tabel 4.1 Baku pembanding sekunder cyanocobalamin 0,1%
Parameter
No Metode Persyaratan Hasil
Uji
1 Pemerian Organoleptis Sesuai spesifikasi internal Sesuai
Minimum 0,1% dihitung
2 Kadar Spektrofotometri UV Sesuai
terhadap zat kering
Spektrum serapan
3 Identifikasi Sesuai spesifikasi internal Sesuai
infra merah
Penetapan susut
Susut
4 pengeringan (1121) FI Sesuai spesifikasi internal Sesuai
pengeringan
IV halaman 1043
Tabel 4.2 Baku pembanding sekunder d-α-tocoperolum
Parameter
No Metode Persyaratan Hasil
Uji
1 Pemerian Organoleptis Sesuai spesifikasi internal Sesuai
2 Kadar Spektrofotometri UV 96,0 - 102,0 %, Sesuai
Spektrum serapan
3 Identifikasi Sesuai spesifikasi internal Sesuai
infra merah
Tabel 4.3 Baku pembanding sekunder acidum folicum
Parameter
No Metode Persyaratan Hasil
Uji
1 Pemerian Organoleptis Sesuai spesifikasi internal Sesuai
95,0 - 102,0 %, dihitung
2 Kadar Spektrofotometri UV Sesuai
terhadap zat kering.
Spektrum serapan
3 Identifikasi Sesuai spesifikasi internal Sesuai
infra merah
4 Susut Penetapan susut Sesuai spesifikasi internal Sesuai
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
pengeringan pengeringan (1121) FI
IV halaman 1043
Salah satu tugas bagian Standardisasi adalah menyediakan baku
pembanding sekunder untuk penelitian sehari-hari di laboratorium, pemeriksaan
rutin dan uji stabilitas. Bagian standardisasi membuat bahan baku pembanding
sekunder, hal ini dilakukan karena mahalnya bahan baku primer dan persediaan
terbatas. Pembuatan baku pembanding sekunder, dengan memilih bahan baku
yang memenuhi spesifikasi bahan baku, kemudian ditetapkan terhadap baku
primer. Penetapan ini dilakukan dengan menggunakan metode analisis tervalidasi
untuk mengetahui identitas, kemurnian, dan analisis kadar serta parameter lain
yang ditetapkan dengan dibandingkan terhadap baku primer. Data-data
pembakuan yang dilakukan dituliskan dalam Sertifikat Analisis Baku Pembanding
Sekunder. Sertifikat Analisis Baku Pembanding Sekunder yang berisi nomor
dokumen, tanggal terbit, supplier, nomor batch, tanggal datang, tanggal periksa,
tanggal kadaluarsa, tanggal uji ulang, pemerian, identifikasi, susut pengeringan,
kadar, data analisis penetapan kadar, catatan, kondisi penyimpanan, tandatangan
Manajer Standardisasi. Jika hasil pengujian memenuhi syarat, maka baku
pembanding sekunder tersebut dapat digunakan dalam pengujian.sebagai baku
kerja.
Baku pembanding sekunder ditempatkan pada wadah botol khusus yang
diberikan etiket baku pembanding sekunder yang berisi keterangan kode baku
pembanding sekunder, nama bahan, kadar, susut pengeringan/kadar air, tanggal
kadaluarsa (tanggal periksa ulang), dan keterangan. Baku pembanding sekunder
yang telah ditempatkan pada wadah dan diberi etiket selanjutnya ditempatkan
dalam lemari penyimpanan khusus baku pembanding sekunder.
Hasil penetapan baku pembanding sekunder terhadap parameter-parameter
identitas, kemurnian, dan kadar menunjukan bahwa semua bahan baku yang
diperiksa, yaitu cyanocobalamin 0.1%, d-α-tocoperolum, acidum folicum
memenuhi persyaratan. Hal tersebut karena bahan baku yang diperiksa belum
mengalami proses yang dapat menyebabkan perbedaan identitas, adanya cemaran
maupun menurunnya kadar zat. Selain itu, metode analisis pada penetapan kadar
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
baku pembanding sekunder semuanya telah divalidasi, sehingga hasil yang
diperoleh dapat terpercaya dan memberikan hasil yang baik.
4.2 Validasi Metode Analisis Bahan Baku
Beberapa bahan baku yang divalidasi metode analisisnya dengan
menggunakan metode spektrofotometri, titrimetri, dan potensiometri adalah
coenzym Q10, lactic acid, metoclopramide HCl, calcium carbonate, magnesium
glycerophosphate. Prosedur dan persyaratan serta hasil validasi dapat dilihat pada
Tabel 4.4.
Tabel 4.4 Parameter dan hasil validasi metode analisis bahan baku
No Nama Bahan Parameter Validasi Hasil Validasi
Akurasi Uji Perolehan Kembali 98,0%-102,0%
1. Coenzym Q10 Presisi Simpangan Baku Relatif: ≤ 1,3
Linearitas Regresi Linear: ≥ 0,997
Akurasi Uji Perolehan Kembali 98,0%-102,0%
2. Lactic Acid Presisi Simpangan Baku Relatif: ≤ 1,3
Linearitas Regresi Linear: ≥ 0,997
Metoclopramide Akurasi Uji Perolehan Kembali 98,0%-102,0%
3. HCl Presisi Simpangan Baku Relatif: ≤ 1,3
Linearitas Regresi Linear: ≥ 0,997
Akurasi Uji Perolehan Kembali 98,0%-102,0%
4. Calcium Carbonate Presisi Simpangan Baku Relatif: ≤ 1,3
Linearitas Regresi Linear: ≥ 0,997
Akurasi Uji Perolehan Kembali 98,0%-102,0%
Magnesium
5. Presisi Simpangan Baku Relatif: ≤ 1,3
Glycerophosphate
Linearitas Regresi Linear: ≥ 0,997
Di PT Konimex bahan baku farmasi yang digunakan untuk produksi
haruslah memenuhi spesifikasi bahan baku. Parameter yang diperiksa dalam
Spesifikasi Bahan Baku meliputi identitas, kemurnian, kadar dan parameter lain.
Proses pembuatan metode kerja penetapan parameter yang tercantum di
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Spesifikasi Bahan Baku dilakukan melalui kegiatan riset. Untuk metode analisis
kadar bahan baku perlu dilakukan verifikasi atau validasi agar metode analisis
penetapan kadar tersebut terbukti dapat bekerja dengan benar.
Verifikasi merupakan suatu uji kinerja metode standar. Verifikasi ini
dilakukan terhadap suatu metode standar sebelum diterapkan di laboratorium.
Verifikasi sebuah metode bermaksud untuk membuktikan bahwa laboratorium
yang bersangkutan mampu melakukan pengujian dengan metode tersebut dengan
hasil yang valid. Disamping itu verifikasi juga bertujuan untuk membuktikan
bahwa laboratorium memiliki data kinerja. Hal ini dikarenakan laboratorium yang
berbeda memiliki kondisi dan kompetensi personil serta kemampuan peralatan
yang berbeda. Sehingga, kinerja antara satu laboratorium dengan laboratorium
lainnya tidaklah sama. Didalam verifikasi metode, kinerja yang akan diuji adalah
keselektifan seperti uji akurasi (ketepatan) dan presisi (kecermatan). Dua hal ini
merupakan hal yang paling minimal harus dilakukan dalam verifikasi sebuah
metode.
Verifikasi dilakukan terhadap metode analisis yang diambil dari
kompedial. Kompendial yang digunakan dapat berasal dari Farmakope Indonesia
edisi IV, United States Pharmacopoeia, European Pharmacopoeia, Japanese
Pharmacopoeia, maupun kompedial resmi lainnya yang diakui oleh Kementerian
Kesehatan Republik Indonesia.
Tidak semua metode analisis yang diinginkan terdapat pada kompendial
dan tidak semua metode yg tercantum di kompedial dapat diaplikasikan di
laboratorium. Jika hal tersebut terjadi, maka bagian standardisasi akan melakukan
riset untuk mengembangkan metode analisis bahan baku yang sesuai. Referensi
dari riset metode analisis dapat berupa jurnal, dokumen yang diterbitkan oleh
manufacturer, maupun dari sumber-sumber lainnya. Selanjutnya metode analisis
yang berhasil dikembangkan melalui riset akan divalidasi.
Parameter validasi metode analisis kadar bahan baku diantaranya adalah
parameter akurasi, presisi dan linearitas. Hasil dari lima bahan baku yang
divalidasi menggunakan metode spektrofotometri, titrimetri, dan potensiometri
yaitu coenzym Q10, lactic acid, metoclopramide HCl, calcium carbonate,
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
magnesium glycerophosphate memberikan hasil bahwa semua parameter validasi
terpenuhi. Hal tersebut menyatakan bahwa metode analisis tersebut dapat
digunakan untuk keperluan pemeriksaan di laboratorium. Secara umumnya,
pemenuhan parameter validasi metode analisis ditentukan oleh tahapan kritis yang
terdapat pada prosedur metode analisis itu sendiri. Pada metode analisis secara
spektrofotometri, tahap kritisnya adalah pada prosedur melarutkan zat pada
pelarut yang sesuai sebelum dilakukan pengukuran dan pada saat melakukan
pengenceran sampel. Jika seluruh bahan telah terlarut dengan baik, maka kadar zat
yang akan terukur dapat optimal, sehingga metode analisis yang digunakan dapat
memberikan hasil yang terpercaya. Pada metode analisis secara titrimetri, tahap
kritisnya adalah pada saat melakukan titrasi menentukan titik akhir titrasi dan
pembacaan volume buret. Hal tersebut harus dilakukan dengan seksama agar
dapat memberikan hasil yang valid.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Validasi metode analisis bahan baku merupakan salah satu kegiatan yang
dilakukan untuk membuktikan bahwa metode analisis yang dilakukan untuk
menetapkan kadar bahan baku secara kuantitatif dapat memberikan hasil yang
pasti, konsisten dan dapat diulang kembali.
b. Penetapan baku pembanding sekunder dilakukan dengan menetapkan sejumlah
bahan baku dengan parameter-parameter dan kriteria yang sesuai dengan baku
primer.
5.2 Saran
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Perlunya pengayaan referensi terutama yang terkaitan dengan riset,
verifikasi dan validasi metode analisis kadar bahan baku secara kuantitatif.
DAFTAR REFERENSI
Badan Pengawasan Obat dan Makanan Republik Indonesia. 2006. Pedoman Cara
Pembuatan Obat yang Baik. Jakarta: Badan Pengawasan Obat dan
Makanan Republik Indonesia.
Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia Ed. IV.
Jakarta: Departemen Kesehatan Republik Indonesia.
Harmita. 2006. Buku Ajar Analisis Fisikokimia. Depok : Departemen Farmasi
Universitas Indonesia.
Harmita. 2004. Petunjuk Pelaksanaan Validasi Metode dan Cara Peritungannya.
Majalah Ilmu Kefarmasian 1(3):117-135
ORA Laboratories Procedure - Food and Drug Administration. 2009. Methods,
Method Verification and Validation. United States : Food and Drug
Administration.
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
The United States Pharmacopeia Convention. 2007. The U nited States
Pharmacopoeia 30 National Formulary 25. Rockville : The United
States Pharmacopeia.
3 Universitas Indonesia
Laporan praktek..., Salmi Hayati, FMIPA UI, 2011
Anda mungkin juga menyukai
- Digital - 20359619 PR Fika Enri Aprigiyonies PT KonimexDokumen254 halamanDigital - 20359619 PR Fika Enri Aprigiyonies PT KonimexSinarAbadiPonsel100% (1)
- Pembersihan PDFDokumen49 halamanPembersihan PDFmela milaniBelum ada peringkat
- File PDFDokumen122 halamanFile PDFifk burselBelum ada peringkat
- File PDFDokumen122 halamanFile PDFifk burselBelum ada peringkat
- Ui PKL KF JakartaDokumen69 halamanUi PKL KF JakartaTrisna PriyadiBelum ada peringkat
- Laporan Praktek..., Zilfia Mutia Ranny, FMIPA UI, 2011Dokumen81 halamanLaporan Praktek..., Zilfia Mutia Ranny, FMIPA UI, 2011Siti RohmatillahBelum ada peringkat
- File PDFDokumen153 halamanFile PDFMarwati MarwaBelum ada peringkat
- Universitas IndonesiaDokumen93 halamanUniversitas Indonesianita akmaliaBelum ada peringkat
- Digital - 20359121 PR Berwi Fazri Pamudi KonimexDokumen251 halamanDigital - 20359121 PR Berwi Fazri Pamudi KonimexYUNIARTOBelum ada peringkat
- Laporan Praktek..., Annisarakhma Swastiniar Kuswan, FMIPA UI, 2012Dokumen125 halamanLaporan Praktek..., Annisarakhma Swastiniar Kuswan, FMIPA UI, 2012agus sangkaBelum ada peringkat
- PortoDokumen138 halamanPortosilfhany fatokhizarBelum ada peringkat
- Digital 20359815Dokumen93 halamanDigital 20359815serubimBelum ada peringkat
- Laporan NilfaDokumen111 halamanLaporan NilfaMohammad Naufal AliefBelum ada peringkat
- Laporan Praktek..., Yenny Handojo, FMIPA UI, 2012Dokumen113 halamanLaporan Praktek..., Yenny Handojo, FMIPA UI, 2012Amalia EBelum ada peringkat
- File PDFDokumen174 halamanFile PDFRomah Cliquers LelledBelum ada peringkat
- File PDFDokumen73 halamanFile PDFNadaNursetiyantiBelum ada peringkat
- RistraDokumen106 halamanRistraAsep KurniaBelum ada peringkat
- PKPA UI CombipharDokumen20 halamanPKPA UI CombipharwandiBelum ada peringkat
- File PDFDokumen183 halamanFile PDFKartika PuspitaningrumBelum ada peringkat
- Digital 20361535 PR Lisa PT KalbeDokumen59 halamanDigital 20361535 PR Lisa PT KalbeMelisa SlametBelum ada peringkat
- Pkpa Ndustri-DikonversiDokumen71 halamanPkpa Ndustri-DikonversiGilang FarmBelum ada peringkat
- PKPA di Apotek Kimia FarmaDokumen20 halamanPKPA di Apotek Kimia FarmaMUH HAMRI RENDI PRATOPO RENGGAALABelum ada peringkat
- Laporan Akhir KF M (Repaired)Dokumen152 halamanLaporan Akhir KF M (Repaired)habibieBelum ada peringkat
- Digital - 20360833-PR-Sonya Apriani T-PT Boehringer Ingelheim PDFDokumen90 halamanDigital - 20360833-PR-Sonya Apriani T-PT Boehringer Ingelheim PDFRisky M FauziBelum ada peringkat
- Laporan Akhir Dago Husin AriDokumen51 halamanLaporan Akhir Dago Husin AriYouth BlueBelum ada peringkat
- Troli EmergencyDokumen153 halamanTroli EmergencylusiBelum ada peringkat
- File PDFDokumen149 halamanFile PDFSunaryo KRKBelum ada peringkat
- Laporan IFK Di SamarindaDokumen50 halamanLaporan IFK Di SamarindaFarida AnggraeniBelum ada peringkat
- Laporan Akhir PBFDokumen68 halamanLaporan Akhir PBFPutri Eka RahmawatiBelum ada peringkat
- Halaman DepanDokumen10 halamanHalaman DepanPria Tunas KelapaBelum ada peringkat
- JUDULDokumen142 halamanJUDULAnizzahraMulyadiBelum ada peringkat
- KDokumen8 halamanKDika Dwi IIBelum ada peringkat
- Chapter2Dokumen154 halamanChapter2Shelva Filiana SariBelum ada peringkat
- Laporan PKLDokumen82 halamanLaporan PKLTaufik FajarBelum ada peringkat
- Cover - DapusDokumen12 halamanCover - Dapusokabolton13Belum ada peringkat
- ....Dokumen41 halaman....May Atika AnsyarBelum ada peringkat
- Laporan Akhir Praktek Kerja Profesi Apoteker LafiauDokumen66 halamanLaporan Akhir Praktek Kerja Profesi Apoteker LafiauRahiswari LakasaBelum ada peringkat
- Laporan Nurfarindo FixDokumen117 halamanLaporan Nurfarindo FixanasrirahayuBelum ada peringkat
- Laporan Praktek ., Riri Yuana, FF UI, 2014Dokumen53 halamanLaporan Praktek ., Riri Yuana, FF UI, 2014Cita PrimadaBelum ada peringkat
- Digital - 20361196-PR-Wildyanti Puspitasari Kardianto-RSPAD Gatot Subroto PDFDokumen180 halamanDigital - 20361196-PR-Wildyanti Puspitasari Kardianto-RSPAD Gatot Subroto PDFIndah Nunik N100% (1)
- Kata Pengantar Laporan Lengkap MEIJIDokumen10 halamanKata Pengantar Laporan Lengkap MEIJIethaBelum ada peringkat
- Tusus KF NabilaDokumen40 halamanTusus KF NabilaAPOTEK TOYOMARTOBelum ada peringkat
- SohoDokumen107 halamanSohorachelsantoso5259Belum ada peringkat
- Lembar Laporan Praktek Kerja Profesi ApotekerDokumen82 halamanLembar Laporan Praktek Kerja Profesi ApotekerAji JakariaBelum ada peringkat
- Laporan PKPA Badan POMDokumen114 halamanLaporan PKPA Badan POMAfis LullahBelum ada peringkat
- Plaporan-Pkpa-Angkatan 4Dokumen98 halamanPlaporan-Pkpa-Angkatan 4Listia NingsihBelum ada peringkat
- Digital 20351157 PR Aulia FarkhaniDokumen123 halamanDigital 20351157 PR Aulia FarkhaniHazrati UmmiBelum ada peringkat
- Laporan Program Kerja RSUP FatmawatiDokumen102 halamanLaporan Program Kerja RSUP FatmawatiRahimah Azzahra Alfarizi100% (2)
- Laporan PKPA PKM BangkoDokumen95 halamanLaporan PKPA PKM BangkoLina Permata SariBelum ada peringkat
- Laporan Pkpa Ak 4Dokumen98 halamanLaporan Pkpa Ak 4Nilam atika sari0% (1)
- Industri Farmasi Eliksir TeofilinDokumen14 halamanIndustri Farmasi Eliksir TeofilinHarniahBelum ada peringkat
- PDF Laporan PKPA Di KemkesDokumen103 halamanPDF Laporan PKPA Di KemkesDevy FebriBelum ada peringkat
- LAPORAN PKPA SOLASDokumen105 halamanLAPORAN PKPA SOLASrizaldi rahmatullahBelum ada peringkat
- FIXLAPORAN PKL PT ProHealthDokumen55 halamanFIXLAPORAN PKL PT ProHealthAyu LestariBelum ada peringkat
- IndustriDokumen88 halamanIndustriSYARIF HIDAYATULLAHBelum ada peringkat
- LAPORANDokumen96 halamanLAPORANrizki karobyBelum ada peringkat
- Daftar IsiDokumen9 halamanDaftar IsiputriiiwulBelum ada peringkat
- PKPA UIDokumen114 halamanPKPA UICristover FernandoBelum ada peringkat
- Bahasa Inggris Sistem 52M Volume 1Dari EverandBahasa Inggris Sistem 52M Volume 1Penilaian: 3.5 dari 5 bintang3.5/5 (39)
- Bahasa Inggris Sistem 52M Volume 3Dari EverandBahasa Inggris Sistem 52M Volume 3Penilaian: 3 dari 5 bintang3/5 (3)
- Surat Rekomdasi Dari Perguruan Tinggi Ai NurjanahDokumen2 halamanSurat Rekomdasi Dari Perguruan Tinggi Ai NurjanahAi NurjanahBelum ada peringkat
- AgitasiDokumen28 halamanAgitasiMochMiftahulMasaroAdean100% (1)
- Hasil Test Ulang 2Dokumen1 halamanHasil Test Ulang 2akbarwahyud1Belum ada peringkat
- Lembar PengesahanDokumen2 halamanLembar Pengesahanakbarwahyud1Belum ada peringkat
- Makalah Proses Industri Kimia Kelompok 2 Malam (After Uts)Dokumen14 halamanMakalah Proses Industri Kimia Kelompok 2 Malam (After Uts)akbarwahyud1Belum ada peringkat
- Section I: Hubungan Kesetimbangan Cair-CairDokumen36 halamanSection I: Hubungan Kesetimbangan Cair-Cairakbarwahyud1Belum ada peringkat
- Jepretan Layar 2023-03-21 Pada 19.42.09Dokumen95 halamanJepretan Layar 2023-03-21 Pada 19.42.09akbarwahyud1Belum ada peringkat
- Ujian Komprehensif, Neraca MassaDokumen1 halamanUjian Komprehensif, Neraca Massaakbarwahyud1Belum ada peringkat
- Lembar PengesahanDokumen2 halamanLembar Pengesahanakbarwahyud1Belum ada peringkat
- PKL di NaturaDokumen31 halamanPKL di Naturaakbarwahyud1Belum ada peringkat
- Simulasi Proses Pendinginan Campuran Amoniak-Air Menggunakan HysysDokumen5 halamanSimulasi Proses Pendinginan Campuran Amoniak-Air Menggunakan Hysysakbarwahyud1Belum ada peringkat
- Resin MelaminDokumen7 halamanResin Melaminakbarwahyud1Belum ada peringkat
- Rekrutmen Bersama BUMN 2023Dokumen1 halamanRekrutmen Bersama BUMN 2023akbarwahyud1Belum ada peringkat
- Recovery Lumpur Sidoarjo Fusi AlkaliDokumen1 halamanRecovery Lumpur Sidoarjo Fusi Alkaliakbarwahyud1Belum ada peringkat
- Hidrogenasi KimiaDokumen18 halamanHidrogenasi Kimiaakbarwahyud1Belum ada peringkat
- Laporan Praktikum Titrasi Iodimetri. Yasa 62-LibreDokumen8 halamanLaporan Praktikum Titrasi Iodimetri. Yasa 62-LibreBani Hafidz NazaliBelum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- Hasil Dan Pembahasan Makalah KimpolDokumen4 halamanHasil Dan Pembahasan Makalah Kimpolakbarwahyud1Belum ada peringkat
- Buat Tinjauan PustakaDokumen1 halamanBuat Tinjauan Pustakaakbarwahyud1Belum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- Laporan Praktikum Titrasi Iodimetri. Yasa 62-LibreDokumen8 halamanLaporan Praktikum Titrasi Iodimetri. Yasa 62-LibreBani Hafidz NazaliBelum ada peringkat
- Tugas Operasi Teknik Kimia 2Dokumen4 halamanTugas Operasi Teknik Kimia 2akbarwahyud1Belum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- 2020 TRKDokumen1 halaman2020 TRKakbarwahyud1Belum ada peringkat
- BAB 1 Teknik Reaksi KimiaDokumen17 halamanBAB 1 Teknik Reaksi KimiaoktaviaBelum ada peringkat
- Introduction CER Gasal 2020-2021 ITATSDokumen8 halamanIntroduction CER Gasal 2020-2021 ITATSakbarwahyud1Belum ada peringkat
- Presentation PIK2 2007 Ke1Dokumen16 halamanPresentation PIK2 2007 Ke1Krisna CenolBelum ada peringkat
- Skema PengenceranDokumen1 halamanSkema Pengenceranakbarwahyud1Belum ada peringkat
- Hasil Dan PembahasanDokumen8 halamanHasil Dan Pembahasanakbarwahyud1Belum ada peringkat